Численное моделирование эволюции бактериальной популяции в легких человека
Автор: Пиль Н.Е., Чигвинцев В.М.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Профилактическая медицина: актуальные аспекты анализа риска здоровью
Статья в выпуске: 1 (33), 2021 года.
Бесплатный доступ
Представлена математическая модель эволюции бактериальной популяции в легких человека с учетом динамики иммунных процессов для задачи оценки функционального повреждения легких. Численное моделирование процессов, происходящих в организме человека, рассматривается как один из инструментов для анализа и прогнозирования влияния факторов риска на здоровье. Представленный подход выполнен в рамках концепции многоуровневой модели организма человека, учитывающей взаимодействия между системами, а также функциональное состояние включенных в рассмотрение органов в условиях воздействия на них неблагоприятных факторов различного генеза. Ввиду сложности прямого моделирования структуры и процессов, происходящих в легких, из-за больших вычислительных ресурсов для описания последних используется модель пористой среды. В модель введена поврежденность легких, определяемая эволюционным уравнением. Уравнение описывает зависимость поврежденности от распределения инфильтрата и действия на клетки альвеол токсических веществ, выделяемых бактериями. Представлены некоторые результаты, характеризующие пространственное распределение концентраций компонентов иммунной системы и бактериальной популяции в ходе иммунного ответа. Проведенное исследование дает качественное представление о причинах количественного изменения бактериальной популяции при иммунной реакции организма в условиях воздействия различных факторов. Данный подход может быть использован для уточнения параметров существующих популяционных моделей распространения и течения бактериальных инфекций и построения долгосрочного прогноза эпидемиологической ситуации. Получаемые результаты могут быть полезны для проведения анализа риска инфекционных заболеваний, в том числе при воздействии на организм человека неблагоприятных факторов среды обитания.
Математическое моделирование, иммунный ответ, бактериальная популяция, выделение токсинов, функциональная поврежденность, легкие человека, пористая среда, течение многокомпонентной смеси
Короткий адрес: https://sciup.org/142229573
IDR: 142229573 | УДК: 51-76 | DOI: 10.21668/health.risk/2021.1.02
Текст научной статьи Численное моделирование эволюции бактериальной популяции в легких человека
В процессе жизнедеятельности человек постоянно взаимодействует с окружающей средой, получая из нее необходимые вещества и подвергаясь неблагоприятному воздействию. Влияние негативных факторов окружающей среды на протяжении жизни человека приводит к ухудшению его здоровья, одной из причин является инфицирование бактериальной флорой.
В настоящее время существуют различные клинико-лабораторные и функциональные методы наблюдения за организмом человека, которые дают комплексное представление о текущем состоянии здоровья пациента. Однако полученные данными методами результаты отражают состояние пациента лишь на момент измерения и не позволяют осуществлять прогнозирование [1, 2]. В основе этих мето- дов лежат анализы пациента, результаты которых сопоставляются с интервалами нормы, на основании чего делаются выводы о состоянии здоровья. Кроме того, многие из методов исследования являются весьма дорогостоящими и трудоемкими.
Качественно отличным подходом для более глубокого изучения и прогнозирования процессов, протекающих в органах человека, представляется математическое моделирование. Многие труднореализуемые натурные исследования могут быть заменены вычислительными экспериментами с использованием математических моделей. Методы математического моделирования позволяют экономить ресурсы и время, изменять начальные условия, анализировать развитие болезни по различным сцена-
Пиль Никита Евгеньевич – студент (e-mail: ; тел.: 8 (919) 467-49-69; ORCID: .
Чигвинцев Владимир Михайлович – кандидат физико-математических наук, научный сотрудник отдела математического моделирования систем и процессов (e-mail: ; тел.: 8 (342) 237-18-04; ORCID: .
риям, что говорит об универсальности подхода: можно использовать одну математическую модель для разных случаев заболевания.
Создание модели эволюции бактериальной популяции в легких человека является частью более общей задачи – создания математической модели для описания человеческого организма как связной совокупности органов и систем, в которой предлагается для каждого органа ввести некоторую меру функционального повреждения, показывающую, насколько нарушена его функция [3]. Диапазон изменения поврежденности – от 0 до 1 (0 – отсутствие функциональных нарушений, 1 – полное невыполнение функций). Данная модель включает подмодели пищеварительной, иммунной и эндокринной и дыхательной систем [4–6].
Динамику роста и пространственное распределение патогенных микроорганизмов можно описать при помощи популяционных моделей. С точки зрения описания базовых принципов значительный интерес представляет модель Моно [7], в которой численность популяции зависит от наличия питательной среды, и модель Лотки – Вольтерра [8], описывающая конкуренцию популяций. Для описания распределения популяции в пространстве в ряде работ [9–12] используются клеточные автоматы. Моделируемая область дискретизируется, определенным ячейкам присваиваются значения численности популяции и задаются правила перемещения популяции. Недостаток данных моделей заключается в сложности перехода от двумерных задач к трехмерным, а также трудностях биофизической интерпретации правил, по которым работают клеточные автоматы. Среди моделей с непрерывным временем интересными представляются работы [13, 14], в которых рассматриваются процессы эволюции бактериальных популяций, используемых в нефтедобывающей отрасли. Движение бактериальной популяции обусловливается градиентом давления и наличием диффузии. Модель описывается системой дифференциальных уравнений в частных производных.
Основные принципы построения иммунологических моделей описаны в работе [15], в которой рассматривается динамика популяции патогенных микроорганизмов и компонентов иммунной системы. Взаимосвязи между элементами модели строятся по типу «хищник – жертва» и описываются системой нелинейных дифференциальных уравнений с запаздывающим аргументом. Запаздывание вводится для описания пространственных эффектов, которые явным образом в модели не учитываются. В работах [16–18] более подробно описываются механизмы иммунного ответа, однако не учитывается пространственное распределение популяции патогенных микроорганизмов и клеток иммунной системы.
Описание динамики иммунных процессов в легких человека требует учета поведения среды. Существуют различные модели, описывающие легкие человека и дыхательные процессы. В работе [19]
рассматривается реальная геометрия дыхательных путей, однако описание процессов при данном подходе требует больших вычислительных ресурсов. Перспективным направлением к моделированию нижних дыхательных путей представляется использование модели пористой среды и теории фильтрации [6, 20, 21].
Таким образом, многие иммунологические модели не описывают явным образом пространственное распределение исследуемых характеристик в конкретном органе человека. Представляется возможным использовать подходы и методы механики течения многокомпонентных смесей в пористых средах с учетом влияния иммунологических процессов.
Цель работы – построение математической модели эволюции бактериальной популяции в легких человека с учетом динамики иммунных процессов для задачи оценки функционального повреждения легких.
Материалы и методы. Инфекционные заболевания подразумевают проникновение и / или активацию в организме человека патогенных микроорганизмов. В работе рассматривается процесс эволюции бактериальной популяции локализованной в нижних дыхательных путях. Основными характеристиками, описывающими популяцию, являются скорость деления, параметры, определяющие количество питательной среды (субстрата), способность бактерий самостоятельно перемещаться в среде и вырабатывать токсические вещества.
Известно, что организму энергетически выгоднее поддерживать на постоянном уровне концентрацию патологического антигена, нежели выводить его из организма полностью [15]. Рост численности бактериальной популяции начинается в случае ослабления иммунной системы ввиду предшествующего заболевания или проникновения патогенных микроорганизмов из окружающей среды. Одновременно с этим активизируется механизм иммунного ответа. В результате образуются воспаления в местах концентрации бактериальной популяции. Выделения, связанные с реакцией иммунной системы, вызывают уменьшение пропускной способности легких, что снижает поступление кислорода и увеличивает частоту дыхания. Бактерии в ходе своей жизнедеятельности выделяют токсины, которые негативно влияют на клетки альвеол – ухудшают барьерную и транспортную функции.
Описанные процессы протекают в нижних дыхательных путях и легких человека. Легкие представляют собой совокупность воздухоносных каналов, оканчивающихся альвеолами (рис. 1) [22].
В легких взрослого человека содержится около 600–700 млн альвеол, что создает сложности при прямом моделировании всей иерархии дыхательных путей. При этом математическое описание процессов, протекающих в легких, требует больших вычислительных ресурсов. Одним из возможных вариантов преодоления указанных вычислительных сложностей представляется использование модели пористой среды. Легкие рассматриваются в качестве сплошной насыщенной упруго-деформируемой пористой среды. Деформация возникает из-за сокращения мышц диафрагмы или поднятия ребер, в результате чего объем легких уменьшается, давление увеличивается и происходит выдох. При вдохе, реализуемом при увеличении объема, давление в легких становится ниже атмосферного, поэтому воздух попадает в организм человека. Подробно данный подход описан в работе [6].
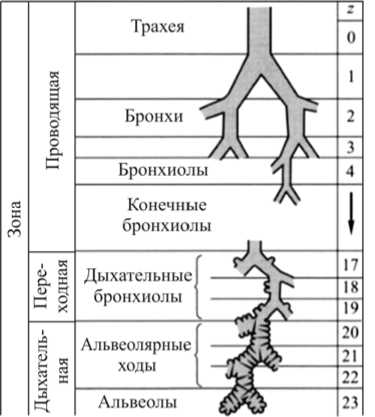
Рис. 1. Дихотомическое деление нижних воздухоносных путей согласно морфометрической модели Вейбеля [22]
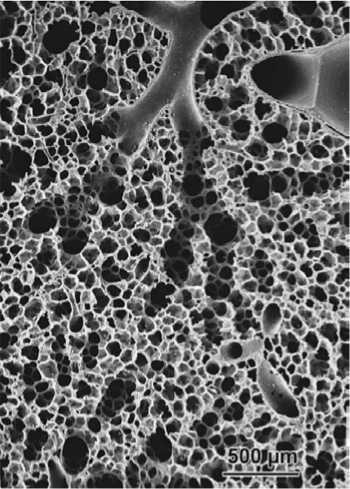
Рис. 2. Увеличенный фрагмент альвеол [23]
Модель пористой среды позволяет заменить детальную структуру альвеол и альвеолярных каналов (рис. 2) параметрами пористости и проницаемости. Пористость – это безразмерная величина, ха- рактеризующая долю пор в среде, и равная отношению объема пор к общему объему среды, состоящей из пор и деформируемых упругих перемычек. Проницаемостью называют свойство среды пропускать сквозь себя жидкости и газы.
Поврежденность легких изменяется из-за образования инфильтрата в ходе иммунного ответа и влияния токсических веществ, выделяемых бактериями, на клетки альвеол. С точки зрения модели пористой среды в ходе иммунного ответа пористость и проницаемость будут уменьшаться из-за закупорки альвеолярного пространства.
Рассмотрим математическую постановку задачи, для этого запишем уравнение баланса массы:
—+ V-(p v ) = -V- j + S , d t ( )
где p - плотность смеси, v - вектор скорости, V -оператор Гамильтона, j – вектор диффузионного потока. Переходя к концентрациям и полагая, что смесь несжимаема, получим dCi
-v'Ji’ j = -DVC,
a a где =--+ v - V - полная производная, D - коэф- at a t фициент диффузии.
Таким образом, учитывая пористость m , за пишем уравнение массопереноса в пористой среде:
д (mCA , .
(d t 7 + mv -V C = V- ( mD V C ) + S , (3)
В первом приближении будем считать, что движения рассматриваемых компонентов обусловлены диффузией за счет градиентов концентрации. Тогда общее уравнение переноса имеет вид:
d( mC ) =V- ( mD V C i ) + S i , (4)
где Сi – концентрации бактериальной популяции ( i = 1), субстрата ( i = 2), макрофагов ( i = 3), плазматических клеток ( i = 4), антител ( i = 5) и токсинов ( i = 6) соответственно; Si – массовый источник i -й компоненты смеси.
Численность бактериальной популяции увеличивается за счет деления и потребления субстрата, уменьшается из-за естественного лизиса, действия макрофагов и антител:
S 1 = Ц -2- C 1 - k 2 C 12 - Y 13 C 3 C 1 - Y 15 C 5 C 1 . (5) k + C
Концентрация субстрата уменьшается за счет потребления бактериальной популяций и восстанавливается в результате процессов регенерации:
S 2 =- k 3 Ц C +Y 2 f 1
k1 + C2
Изменение концентраций компонентов иммунной системы (макрофагов, плазматических клеток и антител):
S3 =Y31^C3
S4 =Y4^[p4 C3C4 - C3C4 H ( C4 - C4,0 ),(7)
S 5 =p 5 ^ C 4 -П 5 Y 51 c 5 C 1 -« 5 C 5 .
Концентрация токсических веществ пропорциональна концентрации бактериальной популяции и уменьшается за счет естественной нейтрализации:
S 6 =y 6 c i -a 6 C 6 .
Уравнения (4)–(8) с начальными и граничными условиями образуют систему уравнений в частных производных, описывающую эволюцию бактериальной популяции в пористой среде.
Функции ^ = ^ ( h ) описывают влияние повре-жденности h на функционирование иммунной системы. Поврежденность увеличивается за счет действия токсических веществ и закупорки альвеол и может уменьшаться за счет самовосстановления:
dh
— = aC6 + aC - акh . dt
С учетом (9) система (4)–(8) представляет собой полную математическую постановку задачи, включающую соотношения для описания изменения концентрации за счет диффузионных процессов, соотношения для массовых источников, возникающих в результате действия иммунного ответа.
Результаты и их обсуждение. Для оценки качества построенной модели проводятся численные эксперименты, которые позволяют получить пространственно-временное распределение концентраций бактериальной популяции и компонентов иммунной системы.
В начальный момент времени полагалось известным распределение и концентрация бактериальной популяции. Учитывалась локализация бактериальной популяции, начальное распределение показано на рис. 3. Рассматривается распространение концентрации бактериальной популяции в объеме пористой среды. Рассмотренный сценарий описывает гибель бактериальной популяции.
Концентрации компонентов иммунной системы распределены равномерно внутри моделируемой области. Распределение концентрации токсинов в начальный момент времени совпадает с распределением бактериальной популяции.
На рис. 4 показано пространственное распределение концентрации бактериальной популяции в ходе иммунного ответа. С течением времени бактериальная популяция распространяется в объеме, увеличивая свою численность. Затем включается механизм иммунного ответа и в момент времени (time = 9 day) можно видеть уменьшение численности популяции, обусловленное действиями макрофагов и антител.
На рис. 5, а , представлены интегральные кривые численности популяций клеток иммунной системы и бактериальной популяции. Из полученных результатов видно, что бактериальная популяция начинает интенсивный рост, что приводит к генерации и росту численности популяций клеток иммунного ответа, происходит нейтрализация патогенных микроорганизмов, и численность бактериальной популяции начинает уменьшаться.
В работе рассмотрен также сценарий выживания бактериальной популяции, что может привести к гибели органа ввиду невозможности выполнять основные функции. При этом сценарии численность бактериальной популяции начинает бесконтрольно увеличиваться, что говорит о неспособности иммунного ответа нейтрализовать патогенную флору. Интегральные кривые численности компонентов иммунной системы и бактериальной популяции представлены на рис. 5, б .
Рассмотренные сценарии отличались параметрами, характеризующими состояние иммунной системы, и параметрами, описывающими бактериальную популяцию. Текущие результаты показывают качественную картину течения иммунных процессов при бактериальном заболевании в легких человека. Стоит отметить, что разрабатываемые модели во многом индивидуальны и зависят от особенностей конкретного организма: возраста, текущего состояния иммунной системы, генетики, перенесенных заболеваний.
Полученные результаты качественно согласуются с описанными в работах [14, 18].
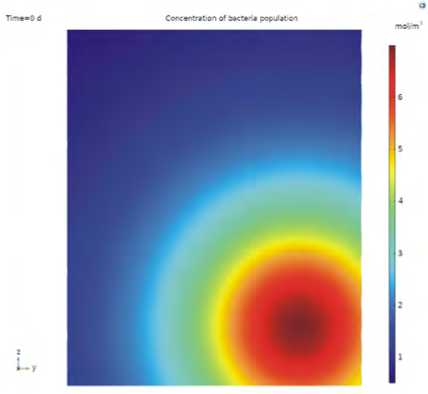
Рис. 3. Начальное распределение концентрации бактериальной популяции
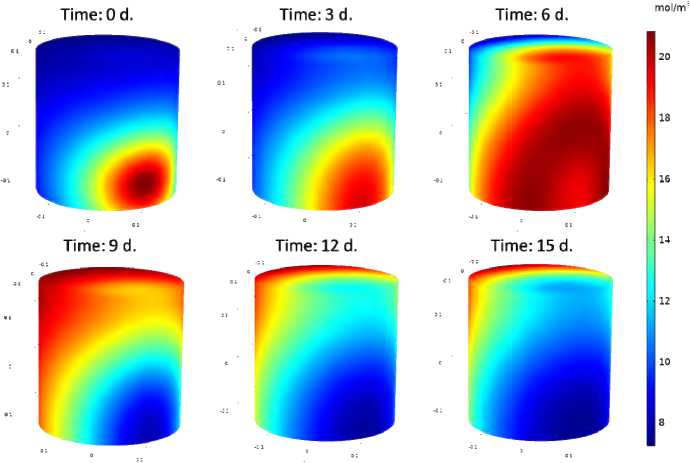
Рис. 4. Распределение концентрации бактериальной популяции в пористой среде
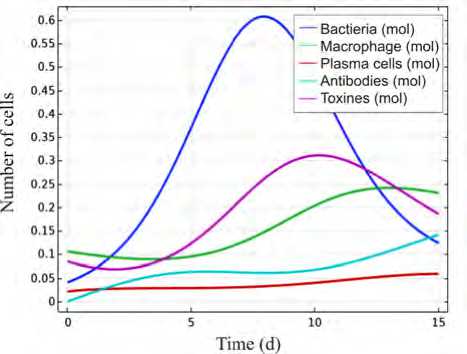
а
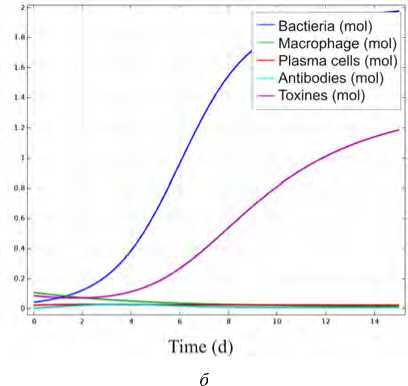
Рис. 5. Интегральные оценки концентраций компонентов иммунной системы и бактериальной популяции в рассматриваемом объеме пористой среды: а – гибель бактериальной популяции; б – выживание бактериальной популяции
Выводы. В работе рассмотрена модель для описания эволюции бактериальной популяции в легких человека. Представлены концептуальная и математическая постановки. Получены результаты численных экспериментов, описывающих сценарии гибели и выживания бактериальной популяции. Характер течения иммунных процессов определяется состоянием организма и особенностями бактериальной популяции.
В дальнейшем планируется учесть влияние процесса дыхания на перенос клеток бактериальной популяции, расширение набора элементов иммунного ответа. Планируется проведение численных исследований по влиянию поврежденности на функционирование иммунной системы в легких человека.
Представленные результаты можно считать вносящими определенный вклад в развитие методов математического моделирования для описания процессов иммунного ответа и физики течения многокомпонентных смесей в пористых средах. Для практического использования целесообразно расширить список компонентов иммунной системы и их взаимосвязей. Одним из перспективных направлений развития модели является идентификация параметров и исследование модели на предмет обнаружения новых закономерностей в иммунных процессах.
Финансирование. Исследование не имело спонсорской поддержки.
Список литературы Численное моделирование эволюции бактериальной популяции в легких человека
- Гребенев А.Л. Пропедевтика внутренних болезней. - М.: Медицина, 2001. - 592 с.
- Шкляр Б.С. Диагностика внутренних болезней. - Киев: Высшая школа, 1972. - 516 с.
- Математическая модель эволюции функциональных нарушений в организме человека с учетом внешне средо-вых факторов / П.В. Трусов, Н.В. Зайцева, Д.А. Кирьянов, М.Р. Камалтдинов, М.Ю. Цинкер, В.М. Чигвинцев, Д.В. Ла-нин // Математическая биология и биоинформатика. - 2012. - Т. 7, № 2. -С. 589-610.
- К оценке дополнительного риска заболеваний желудочно-кишечного тракта, ассоциированных с дисбиозом кишечной микрофлоры вследствие воздействия остаточных концентраций тетрациклина в пищевых продуктах / Н.В. Зайцева, П.З. Шур, А.И. Аминова, Д.А. Кирьянов // Здоровье населения и среда обитания. - 2012. - Т. 232, № 7. - С. 46-48.
- Регуляция противовирусного иммунного ответа организма: математическая модель, качественный анализ, результаты / П.В. Трусов, Н.В. Зайцева, В.М. Чигвинцев, Д.В. Ланин // Математическая биология и биоинформатика. -2018. - Т. 13, № 2. - С. 402-425.
- Трусов П.В., Зайцева Н.В., Цинкер М.Ю. О моделировании течения воздуха в легких человека: конститутивные соотношения для описания деформирования пористой среды // Вестник Пермского национального исследовательского политехнического университета. Механика. - 2020. - № 4. - С. 165-174.
- Monod J. The growth of bacterial cultures // Annual Review of Microbiology. - 1949. - Vol. 3. - P. 371-394. DOI: 10.1146/annurev.mi.03.100149.002103
- Limit cycles of Norwegian lemmings: tensions between phase-dependence and density-dependence / E. Framstad, N.C. Sten-seth, O.N. Bjornstad, W. Falck // Phil. Trans. R. Soc. Lond. B. - 1997. - Vol. 264, № 1378. - P. 31-38. DOI: 10.1098/rspb.1997.0005
- Бутов А.А., Егоров А.Г. Модель динамики численности однотипной популяции в пространстве и времени // Вестник Кемеровского государственного университета. - 2015. - Т. 64, № 4-3. - С. 121-127.
- Hong M., Xiaojuan Z. Microbial growth modeling and simulation based on cellular automata // Research Journal of Applied Sciences, Engineering and Technology. - 2013. - Vol. 6, № 11. - P. 2061-2066. DOI: 10.19026/RJASET.6.3824
- Modeling evolution of spatially distributed bacterial communities: a simulation with the haploid evolutionary constructor / A.E. Klimenko, Y.G. Matushkin, N.A. Kolchanov, S.A. Lashin // BMC Evolutionary Biology. - 2015. - Vol. 15, № 1. - P. 1-11. DOI: 10.1186/1471-2148-15-S1-S3
- 3D individual based for bacteria growth and spatial interactions: application to the case of Listeria Monocytogenes and Carnobacterium Piscola / F. Harrouet, G. Desmeulles, P. Redou, L. Guabert // Jan Van Impe. Food Sim. - 2016. - P. 6.
- Гинак А.И., Кузнецова С.Н., Милованович Е.В. Моделирование биохимических процессов в призабойной зоне скважины // Известия Санкт-Петербургского государственного технологического института. - 2012. - Т. 41, № 15. -С. 82-83.
- Холодонов В.А., Лукина М.В., Милованович Е.В. Моделирование биотехнологических и фильтрационных процессов повышения нефтеотдачи пластов // Известия Санкт-Петербургского государственного технологического института. - 2011. - Т. 37, № 11. - С. 69-71.
- Марчук Г.И. Математические модели в иммунологии. Вычислительные методы и эксперименты. - М.: Наука, 1991. - 304 с.
- Левченко О.Ю. Математическое моделирование противобактериального иммунного ответа // Политематический сетевой электронный научный журнал кубанского государственного аграрного университета. - 2011. - № 66. -С. 60-71.
- Smith A.M., McCullers J.A., Adler F.R. Mathematical model of a three-stage innate immune response to a pneumococcal lung infection // Journal of Theoretical Biology. - 2011. - Vol. 7, № 276 (1). - P. 106-116. DOI: 10.1016/j.jtbi.2011.01.052
- Кузнецов С.Р. Математическая модель иммунного ответа // Вестник Санкт-Петербургского университета. Прикладная математика. Информатика. Процессы управления. - 2015. - № 4. - С. 72-87.
- Lambert A.R. Regional deposition of particles in an imagebased airway model: CFD simulation and left-right lung ventilation asymmetry. - Iowa: University of Iowa, 2010. - P. 68.
- De Groot C.T., Straatman A.G. A conjugate fluid-porous approach for simulating airflow in realistic geometric representations of the human respiratory system // Journal of Biomechanical Engineering. - 2016. - Vol. 138, № 3. - P. 4032113. DOI: 10.1115/1.4032113
- DeGroot C.T., Straatman A.G. Towards a porous media model of the human lung // 4th International Conference on Porous Media and its Applications in Science: AIP Conference Proceedings. - 2012. - Vol. 1453, № 1. - P. 69-74. DOI: 10.1063/1.4711155
- Вейбель Э.Р. Морфометрия легких человека. - М.: Медицина, 1970. - 175 с.
- Weibel E.R. What makes a good lung? // Swiss Med. Wkly. - 2009. - Vol. 139, № 27-28. - P. 375-386.


