Чувствительность к гипотензивной терапии, уровень кортикостероидов и микросомального окисления в печени у больных артериальной гипертензией до и после устранения гиперфункции надпочечников
Автор: Непомнящих В.А., Ломиворотов В.В., Дерягин М.Н., Новиков М.А., Нигородова И.И., Коган А.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Анестезиология, реаниматология и перфузиология
Статья в выпуске: 3 т.11, 2007 года.
Бесплатный доступ
Чувствительность к гипотензивным препаратам, активность печеночных монооксигеназ и уровень кортикостероидов изучены у 28 пациентов с рефрактерной артериальной гипертензией (АГ) до и после хирургического подавления гиперфункции надпочечников. Активность микросомальных ферментов печени исследована с помощью антипиринового теста. Установлено, что эффективность антигипертензивной терапии существенно повышалась через 3 месяца - 3 года после устранения гиперфункции одного и двух надпочечников. При этом период полувыведения антипирина увеличивался на 92,2 %. Экскреция с мочой 17-КС и 17-ОКС снижалась на 30,2 и 25,8 %. На основании полученных данных сделан вывод, что уменьшение активности микросомальных монооксигеназ печени играет важную роль в снижении толерантности к гипотензивной терапии у больных с тяжелыми и злокачественными формами АГ.
Короткий адрес: https://sciup.org/142233384
IDR: 142233384
Текст научной статьи Чувствительность к гипотензивной терапии, уровень кортикостероидов и микросомального окисления в печени у больных артериальной гипертензией до и после устранения гиперфункции надпочечников
В.А. Непомнящих, В.В. Ломиворотов, М.Н. Дерягин, МА Новиков, И.И. Нигородова*,
А.С. Коган*
ФГУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина Росмедтехнологий» * Центр реконструктивной и восстановительной хирургии ВСНЦ СО РАМН, Иркутск
Чувствительность к гипотензивным препаратам, активность печеночных монооксигеназ и уровень кортикостероидов изучены у 28 пациентов с рефрактерной артериальной гипертензией (АГ) до и после хирургического подавления гиперфункции надпочечников. Активность микросомальных ферментов печени исследована с помощью антипиринового теста. Установлено, что эффективность антигипертензивной терапии существенно повышалась через 3 месяца - 3 года после устранения гиперфункции одного и двух надпочечников. При этом период полувыведения антипирина увеличивался на 92,2%. Экскреция с мочой 17-КС и 17-ОКС снижалась на 30,2 и 25,8%. На основании полученных данных сделан вывод, что уменьшение активности микросомальных монооксигеназ печени играет важную роль в снижении толерантности к гипотензивной терапии у больных с тяжелыми и злокачественными формами АГ.
В патогенезе тяжелых и злокачественных форм артериальной гипертензии ведущее место занимает повышенная секреция кортикостероидов с необратимыми морфологическими изменениями в надпочечниках [1]. Гиперальдостеронизм оказывает ренальные и экстраренальные эффекты, приводит к интенсивной ретенции натрия и задержке воды в организме [4]. Доказано, что эффективное устранение вторичного гиперальдостеронизма возможно лишь хирургическим путем. Однако известно, что эндогенные глюкокортикоиды играют ведущую роль в поддержании физиологического уровня цитохром Р-450-зависимой микросомальной монооксигеназной системы печени, ответственной за окисление многих лекарственных препаратов, в том числе гипотензивных [6, 7, 14]. Цитохромы Р-4503А4 и P-4502D6 окисляют нифедипин, бета-блокаторы и большинство ингибиторов ангиотензин-превращающего фермента [8-10]. В условиях гиперкортицизма и хирургического подавления гиперфункции надпочечников (НП) уровень кортикостероидов крови меняется, что в свою очередь может приводить к увеличению или уменьшению индуцирующего влияния глюкокортикоидов на активность системы микросомальных монооксигеназ печени [2]. Изменения печеночного микросомального окисления и особенно его замедление может сопровождаться сложными нарушениями процессов метаболизма и детоксикации, приводить к кумуляции в организме лекарственных препара тов с усилением или ослаблением их фармакологического эффекта [8, 11].
Цель настоящего исследования - изучение влияния хирургического устранения гиперкортицизма на скорость микросомального окисления в печени и лекарственную толерантность у больных рефрактерной артериальной гипертензией.
МАТЕРИАЛ И МЕТОДЫ
Чувствительность к гипотензивным препаратам изучена у 28 больных тяжелыми и злокачественными формами АГ, резистентной к многократной, комбинированной гипотензивной терапии, до и после хирургического устранения вторичного гиперальдостеронизма. У 12 больных выполнена билатеральная операция на надпочечниках, 16 пациентам подавление гиперфункции одного НП. У большинства больных АГ применяли неэкстирпационные органосохраняющие технологии, включающие эндоваскулярную «конгестию» или криодеструкцию правого НП, а также «портализацию» кровооттока от левого НП.
Монооксигеназную функцию печени (МФП) оценивали по показателям фармакокинетики антипирина (АР), отражающим суммарную активность цитохром Р-450-зависимой микросомальной монооксигеназной системы печени [5, 12, 13]. Обследуемые принимали АР внутрь, из расчета 10 мг на кг массы тела. Забор слюны или крови производили через 3, 6, 9, 12 и 24 ч после приема АР. После определения концентраций АР спектрофотометрическим методом рассчитывали его период полувыведения (Т S АР), клиренс (Cl АР) и объем распределения (VdAР). Концентрацию альдостерона (КАП) и кортизола плазмы (ККП) определяли методом радиоиммунного анализа с помощью наборов фирмы «Sorin», 17-кетостероиды (17-КС) в моче определяли по методике Н.В. Самосудовой и Ж.Ж. Басс (1967), 17-оксикортикостероиды (17-ОКС) в моче - по методу Н.А. Юдаева (1961). Центральную гемодинамику исследовали методом тетраполярной трансторакальной реографии [3]. Статистический анализ проводили с помощью программы Statistica 5.1, используя парный тест Уилкоксона и t-тест для двух зависимых выборок. Для анализа зависимости количественных признаков применяли ранговый коэффициент корреляции Спирмена (rs).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
С учетом рефрактерного характера артериальной гипертензии 22 больным до операции на НП была назначена комбинированная терапия, включающая как минимум три гипотензивных препарата с различным механизмом их действия (табл. 1). При исследовании гемодинамических показателей через 3-4 недели от начала курсового лечения установлено незначительное снижение систолического и диастолического АД (4,9 и 4,8%). Общее периферическое сосу дистое сопротивление и сердечный индекс не изменялись (табл. 2).
Низкий эффект комбинированной терапии или его отсутствие послужили одним из основных показаний к хирургическому подавлению гиперкортицизма (табл. 3). У 7 больных АГ выполнена билатеральная операция на НП, 15 пациентам подавление гиперфункции одного НП. При обследовании через 3 месяца - 3 года после операции на НП было проведено повторное изучение толерантности к гипотензивным препаратам. Однако учитывая выраженный клинический эффект хирургического вмешательства, всем больным был назначен один гипотензивный препарат, входивший ранее в комбинированное лечение (см. табл. 1). Контрольное исследование гемодинамических показателей, проведенное через 3-4 недели от начала курсовой монотерапии, позволило установить существенное снижение систолического и диастолического АД (19,5 и 15,8%) вследствие уменьшения периферического сосудистого сопротивления (табл. 2). Важно отметить, что помимо более высокой эффективности гипотензивной монотерапии (табл. 3), в 1,5-2,0 раза уменьшились суточная, разовая доза и кратность приема гипотензивного препарата по сравнению с исходным периодом (см. табл. 1).
Исследование показателей фармакокинетики АР позволило установить, что у больных АГ, получавших гипотензивную комбинированную терапию до операции, период полувыведения
Таблица 1
Суточные и разовые дозы гипотензивных препаратов до и после подавления гиперфункции НП (медиана, 25 и 75-й процентили)
|
Препарат |
Комбинированная терапия до операции |
Монотерапия после операции |
||||
|
суточная доза |
разовая доза |
кратность приема |
суточная доза |
разовая доза |
кратность приема |
|
|
Нифедипин, мг |
60 (60; 80) п=21 |
20 (20; 20) п=21 |
3-4 |
20* (20; 30) п =8 |
10* (10; 10) п =8 |
2-3 |
|
Пропранолол, мг |
80 (60; 100) п=20 |
20 (15; 25) п=20 |
4 |
35* (30; 40) п=7 |
15 (10; 20) п=7 |
2-3 |
|
Гидрохлортиазид, |
25 мг (12,5; 25) п=22 |
25 (12,5; 25) п=22 |
1 |
- |
- |
- |
|
Капотен, мг |
100 (100; 150) п=10 |
50 (50; 50) п=10 |
2-3 |
50* (25; 50) п=7 |
25* (25; 25) п=7 |
1-2 |
|
Клонидин, мг |
0,45 (0,225; 0,45) п=13 |
0,15 (0,075; 0,15) п=13 |
3 |
- |
- |
- |
* p<0,05 различия достоверны по сравнению с данными до операции
Таблица 2
Влияние гипотензивной терапии на гемодинамику до и после подавления гиперфункции надпочечников
|
Показатели |
Комбинированная терапия до операции, п=22 |
Монотерапия после операции, п=22 |
||
|
При поступлении |
3-4 недели |
При поступлении |
3-4 недели |
|
|
САД, мм рт. ст. |
224,6±10,6 |
213,8±11,3* |
195,2±9,7 |
157,4±9,2* |
|
Д% САД |
-4,9 |
-19,5 |
||
|
ДАД, мм рт.ст. |
125,1±9,0 |
119,1±8,2* |
113,6±7,3 |
95,5±7,4* |
|
Д% ДАД |
-4,8 |
-15,8 |
||
|
ОПСС, дин.с/см5 |
3325±814 |
3112±775 |
2446±512 |
2026±432* |
|
Д% ОПСС |
-6,4 |
-17,2 |
||
|
СИ, л/(мин-м2) |
2,08±0,41 |
2,07±0,47 |
2,51±0,54 |
2,55±0,49 |
|
Д% СИ |
-0,5 |
+1,6 |
||
|
ЧСС в минуту |
72,6±6,2 |
66,0±6,0* |
70,7±4,5 |
70,1±7,3 |
*р<0,05 различия достоверны по сравнению с данными при поступлении
Таблица 3
Эффективность гипотензивного лечения до и после подавления гиперфункции надпочечников
|
Эффект лечения |
Комбинированная терапия до операции, п=22 |
Монотерапия после операции, п=22 |
|
Отличный* |
- |
11 |
|
Хороший** |
3 |
9 |
|
Удовлетворительный л |
12 |
2 |
|
Неудовлетворительный лл |
7 |
- |
* достижение уровня ДАД 90 мм рт. ст. и ниже; ** снижение ДАД на 10 мм рт. ст. и ролее, но не до 90 мм рт. ст.; Л снижение ДАД на 5-9 мм рт. ст.; лл снижение ДАД менее чем на 5 мм рт. ст.
АР составлял 10,2±3,8 ч, клиренс АР - 46,9±8,1 мл/(кг • ч). Обследование этих же пациентов через 3 мес.-3 года после устранения вторичного гиперкортицизма свидетельствовало о выраженном замедлении печеночного метаболизма (табл. 4). Период полувыведения АР увеличивался на 92,2% (19,6±4,7 ч), а клиренс AP уменьшался на 45,4% (25,6±9,8 мл/(кг• ч)). При проведении корреляционного анализа установлена достоверная прямая зависимость клиренса АР с суточной, разовой дозами (rs = +0,41; rs = +0,37; р<0,05), а также кратностью приема гипотензивных препаратов (rs = +0,35; р<0,05).
Повышение чувствительности к гипотензивной терапии после подавления гиперфункции НП подтверждали и острые фармакологические пробы с коринфаром и капотеном, проведенные у 6 больных АГ. Из них у одной больной была выполнена операция на одном НП, у 5 пациентов - билатеральное устранение гиперфункции НП. Коринфар (драже) и капотен назначали однократно в дозах 10 и 25 мг. Период между исследованиями их действия составлял не менее 24 ч. Для оценки фармакодинамических эффектов препаратов каждый час (в течение полусуток) после их приема измеряли систолическое и диастолическое АД. В результате установлено, что коринфар, как и капотен до операции на НП, существенным гипотензивным эффектом не обладали (рис. 1, 2). При этом характерно, что показатели печеночного метаболизма у обследуемых больных были на достаточно высоком уровне (табл. 4). Период полувыведения АР - 11,9±4,6 ч, клиренс АР -38,9±10,7 мл/(кг • ч). Аналогичные исследования этих же больных с коринфаром и капотеном
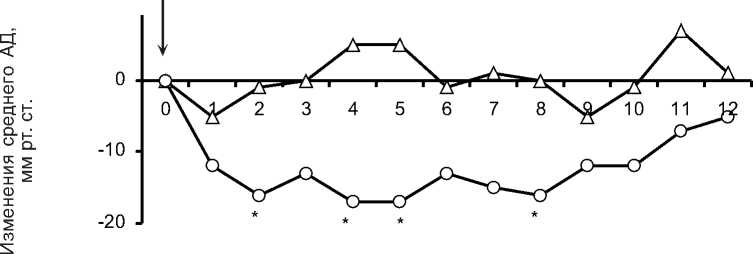
—д— до операции на НП —о— после подавления гиперфункции НП
* р<0,05 различия достоверны по сравнению с данными до операции на НП
Рис. 1. Динамика изменений среднего АД под влиянием коринфара до и после подавления гиперфункции НП. Стрелкой указан прием коринфара. По абсциссе - время в часовых интервалах.
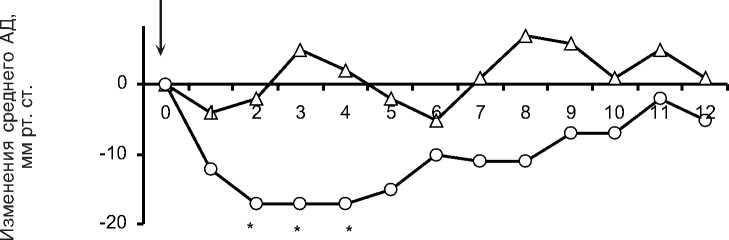
—Д— до операции на НП —о—после подавления гиперфункции НП
* р<0,05 различия достоверны по сравнению с данными до операции на НП
Рис. 2. Динамика изменений среднего АД под влиянием капотена до и после подавления гиперфункции НП. Стрелкой указан прием капотена. По абсциссе - время в часовых интервалах.
Монооксигеназная функция печени у больных АГ до и после устранения вторичного гиперкортицизма
Таблица 4
|
Показатели |
Комбинированная терапия (п=22) |
Фармапробы с коринфаром и капотеном (п=6) |
||
|
При поступлении |
3 мес. - 3 года |
При поступлении |
3 мес. - 3 года |
|
|
Т У2 АР ч |
10,2±3,8 |
19,6±4,7* |
11,9±4,6 |
20,7±5,9* |
|
Д% Т У2 АР |
- |
+92,2% |
- |
+74% |
|
CI АР мл/(кг-ч) |
46,9±8,1 |
25,6±9,8* |
38,9±10,7 |
20,1±6,4* |
|
Д% CI АР |
- |
-45,4% |
- |
-48,4% |
|
Vd АР, л/кг |
0,6±0,061 |
0,58±0,062 |
0,64±0,093 |
0,6±0,12 |
|
Д% Vd, АР |
- |
-3,3% |
- |
-6% |
* р<0,05 по сравнению с исходными данными через 3 мес.-3 года после подавления гиперфункции НП свидетельствовали о достоверном уменьшении среднего АД (рис. 1,2). При этом показатели МФП снижались почти в 2 раза по сравнению с исходными: Т S АР - 20,7±5,9 ч; Cl AP - 20,1±6,4 мл/(кг• ч).
Известно, что кортикостероиды играют важную роль в развитии рефрактерной АГ, а также в поддержании активности микросомальных монооксигеназ печени на определенном физиологическом уровне. В связи с этим значительный интерес представляли секреторно-метаболичес-
Таблица 5
Показатели кортикостероидов у больных АГ до и после подавления гиперфункции НП (медиана, 25 и 75-й процентили)
|
Показатели |
Исходно |
Через 3 мес. -3 г. |
Д% |
|
КАП, пг/мл, п=26 |
215 (123; 245) |
166 (86; 172)* |
-27,8 |
|
ККП, нмоль/л, п=27 |
523 (319; 606) |
559 (287; 564) |
+6,9 |
|
17-КС, мкмоль/с, п=25 |
26,2 (17,6; 28,1) |
18,1 (11,4; 28,6)* |
-30,2 |
|
17-ОКС, мкмоль/с, п=25 |
19,8 (11,5; 32,3) |
14,7 (9,2; 18,9)* |
-25,8 |
* р<0,05 различия достоверны по сравнению с исходными данными кие показатели кортикостероидов у обследованных больных АГ до и после устранения гиперфункции НП. Установлено, что операция на одном и двух НП через 3 мес. - 3 года приводила к снижению концентрации альдостерона плазмы на 27,8%, уменьшению суточной экскреции с мочой 17-КС и 17-ОКС на 30,2 и 25,8%. Уровень кортизола плазмы достоверно не изменялся (табл. 5).
При проведении корреляционного анализа между показателями кортикостероидов и скоростью микросомального окисления в печени установлена достоверная обратная зависимость между уровнем кортизола крови и клиренсом АР (rs = -0,32; р<0,05), а также прямая связь между клиренсом АР и экскрецией с мочой 17-ОКС (rs = +0,35; р<0,05) после операции на одном и двух НП. Это свидетельствовало, с одной стороны, о важной роли печени в метаболизме кортикостероидов, с другой -объясняло динамику изменений их показателей после подавления гиперфункции НП.
Очевидно, что подавление гиперальдостеронизма обусловлено уменьшением массы гормонопродуцирующей паренхимы надпочечников. Отсутствие параллельного снижения уровня кортизола, вероятнее всего, связано с включением стимулирующих влияний адренокортикотропного гормона (АКТГ) на интактную железу после операции на одном НП, а также выраженным снижением активности монооксигеназ печени после билатеральной операции на НП, субстратом которых являются кортикостероиды. Следует при этом заметить, что АКТГ не играет существенной роли в регуляции биосинтеза и секреции альдостерона. Таким образом, оба приведенных выше механизма обеспечивают оптимальный гормональный фон глюкокортикоидов в организме. Уровень же снижения экскреции с мочой 17-КС и 17-ОКС свидетельствует как о степени подавления гиперфункции НП, так и уровне замедления биотрансформации кортикостероидов в печени.
Таким образом, у больных, прошедших как курсовое медикаментозное лечение, так и острые фармакологические тесты, подавление вторичного гиперкортицизма сопровождалось существенным повышением чувствительности к гипотензивным препаратам. Безусловно, что снижение толерантности к гипотензивным препаратам связано не только с замедлением их биотрансформации в печени. Подавление гиперальдостеронизма создает условия для нормализации осморегулирующих механизмов печени и восстанавливает натриуретическое действие нейрогипофизарных гормонов. Устранение патологической ретенции натрия в свою очередь снижает накопление катиона в стенках артерий и нормализует сосудистую реактивность.
К сожалению, данные исследования осморегулирующих реакций и водно-солевого обмена у больных рефрактерной АГ выходят за рамки данного сообщения. Однако отметим, что снижение толерантности к лекарственной терапии у обследованных пациентов совпадало с восстановлением натриуреза и снижением интенсивности антидиуретических реакций в послеоперационном периоде.
ВЫВОДЫ
-
1. Хирургическое устранение гиперфункции НП у больных рефрактерной артериальной гипертензией приводит к существенному замедлению микросомального окисления в печени вследствие уменьшения индуцирующего влияния глюкокортикоидов на систему цитохром Р-450-за-висимых микросомальных монооксигеназ.
-
2. Снижение скорости биотрансформации ксенобиотиков в печени сопровождается уменьшением толерантности к гипотензивным препаратам и свидетельствует о целесообразности уменьшения доз и кратности их приема в послеоперационном периоде.
Список литературы Чувствительность к гипотензивной терапии, уровень кортикостероидов и микросомального окисления в печени у больных артериальной гипертензией до и после устранения гиперфункции надпочечников
- Коган А.С., Гончар А.М., Куликов Л.К. Гиперфункция надпочечников: принципы и методы коррекции. Новосибирск: Наука, 1988. 207 с.
- EDN: QZXMTT
- Непомнящих В.А.//Бюл. СО РАМН. 2002. № 2. С. 116-121.
- Пушкарь Ю.Т., Цветков А.А., Хеймец Г.И.//Бюл. Всесоюз. Кардиол. науч. центра. 1980. № 1. С. 45-48.
- Шхвацабая И.К., Чихладзе Н.М. Гиперальдостеронизм и артериальная гипертония. М.: Медицина, 1984. 136 с.
- Engel G., Hofmann U., Heidemann H., et al.//Clin. Pharmacol. Ther. 1996. Vol. 59, N 6. P. 613-623.


