Cинтез, антиэкссудативные и противовоспалительные свойства замещенных 2-метил-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамидов
Автор: Олейник И.С., Бибик Е.Ю., Доценко В.В., Стрелков В.Д., Лукина Д.Ю., Фролов К.А., Кривоколыско С.Г., Василин В.К.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.15, 2023 года.
Бесплатный доступ
Однореакторное взаимодействие цианотиоацетамида, N-(2,4-дихлорфенил)ацетоацетамида и фурфурола в присутствии избытка N-метилморфолина в этаноле при 25 °С приводит к образованию 6-метил-4-(2-фурил)-5-[(2,4-дихлорфенил)карбамоил]-3-циано-1,4-дигидропири-дин-2-тиолата N-метилморфолиния с выходом 82 %. Последующее алкилирование полученного тиолата N-замещенными α-хлорацетамидами протекает региоспецифично по атому серы и приводит к образованию 2-метил-6-[(2-оксо-2-{[замещенный арил]амино}этил)сульфанил]-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамидов 10-17. Соединения 10-17 идентифицированы методами ИК- и ЯМР-спектроскопии, а также элементного анализа. Синтезированные соединения 10-17 были исследованы на наличие антиэкссудативной и противовоспалительной активности. Белые лабораторные крысы в количестве 112 особей были поделены на контрольную («острый формалиновый отек лапы») и интактную группы, 4 группы сравнения (ацетилсалициловая кислота, индометацин, нимесулид и парацетамол) и 8 опытных групп, по количеству исследуемых производных 1,4-дигидропиридина. Эффективность противовоспалительной активности образцов оценивалась на модели «острого формалинового отека лапы» крыс, которую смоделировали введением в апоневроз правой задней конечности 0,1 мл 2%-ного раствора формалина. Исследуемые вещества вводили внутригастрально в дозе 5 мг/кг за 1,5 часа до индукции воспалительного процесса. Онкометрические изменения оценивались количественно по обхвату конечностей. Показано, что максимально выраженной противовоспалительной активностью обладают: 2-метил-6-[(2-оксо-2-{[3-(трифторметил)-фенил]амино}этил)сульфанил]-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3 -карбоксамид 12 (эффективнее препаратов сравнения в 1,09-1,81 раза); 6-[(2-анилино-2-оксоэтил)сульфанил]-2-метил-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид 16, уменьшающий отек индуцированной лапы на 42,91 % в сравнении с контролем; 2-метил-6-({2-[(3-метилфенил)амино]-2-оксоэтил}сульфанил)-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид 14 (обнаруживает противовоспалительную активность на 18-часовом интервале эксперимента в 1,65-2,85 раз выше, чем у препаратов сравнения). Наиболее активным оказался 2-метил-6-({2-[(3,5-диметилфенил)амино]-2-оксоэтил}сульфанил)-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид 11, уменьшающий отек лапы в 2,9 раза эффективнее нимесулида.
Цианотиоацетамид, присоединение по михаэлю, 1, 4-дигидроникотинамиды, виртуальный биоскрининг, антиэкссудативная активность, формалиновый отек, противовоспалительное действие
Короткий адрес: https://sciup.org/147241843
IDR: 147241843 | УДК: 547.822.1+547.825+547.826.2 | DOI: 10.14529/chem230306
Текст научной статьи Cинтез, антиэкссудативные и противовоспалительные свойства замещенных 2-метил-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамидов
Цианотиоацетамид 1 является доступным реагентом, зарекомендовавшим себя в качестве незаменимого строительного блока при получении широкого круга серо- и азотсодержащих гетероциклических соединений [1–4]. В первую очередь цианотиоацетамид 1 нашел применение в синтезе важных полупродуктов тонкого органического синтеза – 2-меркапто(2-тиоксо)никотинонитрилов и родственных им 3-цианопиридин-2-тиолатов [5–12]. Такие соединения, в свою очередь, активно используются в дальнейших гетероциклизациях в производные тиено[2,3-b]пиридина [13–21], тиазоло[3,2-а]пиридина [22–30], изотиазоло[5,4-b]пиридина [31– 34], пиридо[2,1-b][1,3,5]тиадиазина [35–39] и ряда других гетероциклических структур.
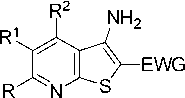

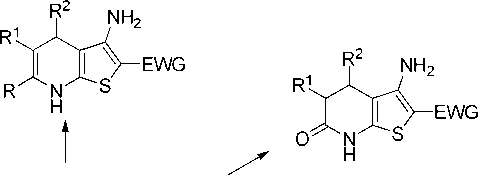
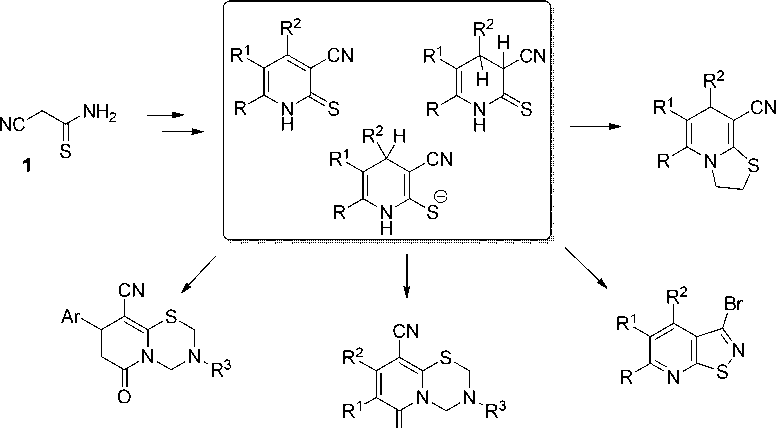
о
Из литературных данных следует, что частично насыщенные производные никотинонитрила обладают разнообразным биологическим действием. Например, 1,4-дигидропиридин-3-карбонитрилы 2 , 3 являются гепатопротекторами [40], пиридо-1,3,5-тиадиазины 4 обладают противовирусным действием в отношении вируса Повассан и вируса клещевого энцефалита [41], а также демонстрируют аналептический эффект [42], противовоспалительное [43] и адаптогенное действие [44]. 1,4-Дигидропиридин-3-карбонитрилы 5 активны в отношении вируса клещевого энцефалита [41]:
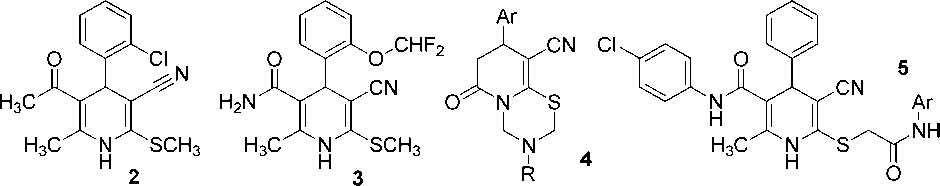
Известно, что производные гексагидрохинолина 6 активны в отношении ВИЧ [45]. По данным работы [46], насыщенные никотинонитрилы 7 и 8 обнаруживают ингибирующее действие в отношении аутотаксина. Гибридная молекула 9 , сочетающая тиофеновый и гексагидрохинолиновый фрагменты, ингибирует образование β-амилоидного пептида, и таким образом препятствует образованию амилоидных бляшек – фактору, сопутствующему ряду тяжелых заболеваний, таких как болезнь Альцгеймера, гемодиализный амилоидоз, лизоцимовый амилоидоз [47].
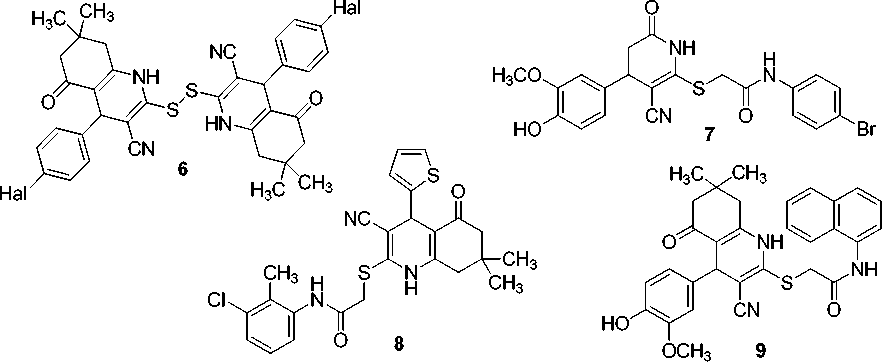
В последнее время в фокусе интересов нашей исследовательской группы находятся гибридные молекулы (молекулярные гибриды), сочетающие фармакофорные фурановый и частично насыщенный никотинонитрильный фрагменты [48–51]. Молекулярные гибриды – это относительно новая концепция в дизайне лекарственных средств. Гибридные (иначе мультимодальные) молекулы содержат два или более ковалентно связанных остатка фармакофорных субъединиц. Принято считать, что при этом достигается синергия в действии через возможность взаимодействовать (одновременно или последовательно) с несколькими протеиновыми мишенями. Такая комбинированная терапия позволяет обойтись использованием единственного гибридного препарата вместо нескольких (недавние обзорные работы по химии молекулярных гибридов и их применении в терапии [52–62]). Следует отметить, что в медицинской практике уже используется ряд молекулярных гибридов – производных фурана: анальгетик мирфентанил, антиаритмический препарат азимилид, противомикробные препараты фуразолин, фурадонин, нифуртимокс, противоязвенный агент лупитидин, гипотензивный α-адреноблокатор празозин и ряд других. 2-Фурильный фрагмент является известным фармакофорным остатком, для многих производных фурана задокументирована биологическая активность [63, 64].
Таким образом, создание гибридных молекул, сочетающих в себе остатки фуранового цикла и 1,4-дигидроникотинонитрила, представляется перспективным направлением поиска новых биологически активных соединений. Целью настоящего исследования работы являлся поиск и синтез новых гибридных молекул и изучение их антиэкссудативной и противовоспалительной активности in vivo на модели «острого формалинового отека лапы».
Экспериментальная часть
N -(2,4-Дихлорфенил)ацетоацетамид и 6-метил-4-(2-фурил)-5-((2,4-дихлорфенил)карбамоил)-3-циано-1,4-дигидропиридин-2-тиолат N -метилморфолиния синтезировали по методикам, описанным в работе [49]. N-Арил-α-хлорацетамиды синтезировали взаимодействием 1,05 экв. хлор-ацетилхлорида с первичными ароматическими аминами (1,0 экв) в абсолютном толуоле при кипячении до прекращения выделения HCl с последующим удалением растворителя на ротационном испарителе. Выходы количественные.
2-Метил-6-[(2-оксо-2-{[2-(трифторметил)фенил]амино}этил)сульфанил]-4-(2-фурил)- N -(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид (10).
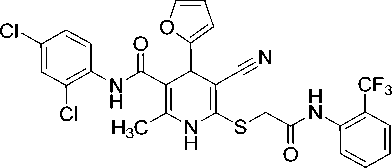
Исходный 6-метил-4-(2-фурил)-5-((2,4-дихлорфенил)карбамоил)-3-циано-1,4-дигидро-пиридин-2-тиолат N-метилморфолиния (1,2 г, 2,36 ммоль) суспендируют в 10 мл EtOH, добавляют при перемешивании 1,3 мл (2,5 ммоль) 10%-ного водного КОН. Полученный раствор через бумажный фильтр прикапывают к теплому (50 °С) раствору N-[(2-трифторметил)фенил]-α-хлорацетамида (0,56 г, 2,36 ммоль) в 7 мл EtOH. Перемешивание смеси в течение 30 мин приводит к образованию осадка, который через 24 ч отфильтровывают, промывают водным EtOH и высушивают при 60 °С. Белый мелкокристаллический порошок, выход 73 %. Для получения аналитически чистого образца продукт перекристаллизовывают из большого объема ацетона и высушивают при 60 °С. ИК-спектр, ν, см-1: 3298, 3219, 3147 (N–H), 2201 (C≡N), 1674 (C=O).
Спектр ЯМР 1Н (400 МГц, DMSO-d 6 ), δ , м. д.: 2,16 c (3Н, CH 3 ), 4,03 уш.с (SCH 2 ), 4,93 c (1H, С4H Py), 6,19 д (1H, H3 фурил, 3 J 3,2 Гц), 6,37 дд (1H, H4 фурил, 3 J 3,1 Гц, 3 J 3,2 Гц), 7,37 дд (1H, H5 2,4-Cl 2 C 6 H 3 , 3 J 8,6 Гц, 4 J 2,3 Гц), 7,47–7,52 м (3H, H-Ar, H5 фурил), 7,57–7,58 м (1H, H-Ar), 7,61 д (1H, H3 2,4-Cl 2 C 6 H 3 , 4 J 2,3 Гц), 7,68–7,72 м (1H, H-Ar), 7,76 д (1H, H-Ar, 3 J 7,8 Гц), 9,35 с (1Н, NHCO), 9,66 с (1Н, NH эндоцикл ), 10,14 (1Н, CH 2 C(O)N H ).
Спектр ЯМР 13С DEPTQ (101 МГц, DMSO-d 6 ), δ C , м. д.: 17,5* (CH 3 -Py), 35,5 (SCH 2 ), 36,4* (C4Н Py), 82,9 (C5 Py), 103,1 (C3 Py), 106,1* (C3 фурил), 110,5* (C4 фурил), 119,2 (C≡N), 123,4 кв (СF 3 , 1 J C–F 273,3 Гц), 124,9 кв (C–СF 3 , 2 J C–F 29,3 Гц), 126,4* кв (СН Ar, 3 J C–F 5,0 Гц), 127,3* (CH Ar), 127,4* (CH Ar), 128,1* (CH Ar), 128,8* (СH Ar), 129,7 (С Ar), 130,0* (CH Ar), 133,2* (CH Ar), 134,3 (С1 Ar), 134,6 кв (С Ar, 3 J C–F 1,8 Гц), 139,7 (С2 Py), 142,8* (C5 фурил), 144,8 (С6 Py), 155,5 (С2 фурил), 166,0 ( С (O)NHAr), 168,3 (SCH 2 C (O)NH). *Сигналы в противофазе.
Найдено, %: C 53,26; H 3,26; N 9,18. C 27 H 19 Cl 2 F 3 N 4 O 3 S (M 607,43). Вычислено, %: C 53,39; H 3,15; N 9,22.
Аналогично синтезировали соединения 11 - 17 .
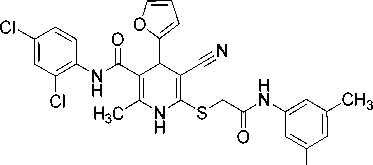
2-Метил-6-({2-[(3,5-диметилфенил)амино]-2-оксоэтил}сульфанил)-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид (11).
CHg
Белый мелкокристаллический порошок,
выход 83 %. ИК-спектр, ν , см - 1: 3298, 3215 (N–H),
2204 (C≡N), 1651 (C=O).
Спектр ЯМР 1Н (400 МГц, DMSO-d 6 ), δ , м. д.: 2,19 c (3Н, CH 3 Py), 2,23 c (6Н, 2 CH 3 ), 3,97 уш.с (2Н, SCH 2 ), 4,92 c (1H, С4H Py), 6,19 д (1H, H3 фурил, 3 J 3,2 Гц), 6,35 дд (1H, H4 фурил, 3 J 1,8 Гц, 3 J 3,2 Гц), 6,73 уш.с (1H, С4Н 3,5-C 6 H 3 NH), 7,21 уш.с (2H, С2Н С6Н 3,5-C 6 H 3 NH), 7,38 дд (1H, H5 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц, 4 J 2,4 Гц), 7,52 д (1H, H6 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц), 7,57 дд (1H, H5 фурил, 3 J 1,8 Гц, 4 J 0.8 Гц), 7,62 д (1H, H3 2,4-Cl 2 C 6 H 3 , 4 J 2.4 Гц), 9,35 с (1Н, NHCO), 9,75 с (1Н, NH эндоцикл ), 10,37 (1Н, CH 2 C(O)N H ).
Спектр ЯМР 13С DEPTQ (101 МГц, DMSO-d 6 ), δ C , м. д.: 17,6* (CH 3 -Py), 21,1* (2 CH 3 -Ar), 35,2 (SCH 2 ), 36,4* (C4Н Py), 82,4 (C5 Py), 103,1 (C3 Py), 106,1* (C3 фурил), 110,5* (C4 фурил), 117,2* (2 CH Ar), 119,3 (C≡N), 125,5* (СН Ar), 127,4* (CH Ar), 128,0* (CH Ar), 128,81 (С Ar), 128,83* (CH Ar), 129,7 (С Ar), 134,4 (С1 Ar), 137,8 (С Ar), 138,3 (C1 Ar), 139,8 (С2 Py), 142,7* (C5 фурил), 145,1 (С6 Py), 155,6 (С2 фурил), 166,0 ( С (O)NHAr), 167,0 (SCH 2 C (O)NH). *Сигналы в противофазе.
Найдено, %: C 59,11; H 4,35; N 9,78. C 28 H 24 Cl 2 N 4 O 3 S (M 567,49). Вычислено, %: C, 59,26; H, 4,26; N, 9,87.
2-Метил-6-[(2-оксо-2-{[3-(трифторметил)фенил]амино}этил)сульфанил]-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид (12).
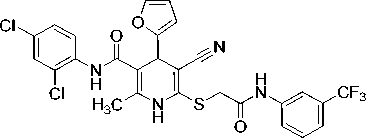
Белый мелкокристаллический порошок, выход 81 %. ИК-спектр, ν , см - 1: 3292, 3267, 3217, 3146 (N–H), 2202 (C≡N), 1662 (C=O).
Спектр ЯМР 1Н (400 МГц, DMSO-d 6 ), δ , м. д.: 2,18 c (3Н, CH 3 ), 4,04 АВ- кв (2Н, SCH 2 , 2 J 15,3 Гц), 4,91 c (1H, С4H Py), 6,18 д (1H, H3 фурил, 3 J 2,9 Гц), 6,34 дд (1H, H4 фурил, 3 J 2,9 Гц, 3 J 2,0 Гц), 7,38 дд (1H, H5 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц, 4 J 2,3 Гц), 7,44 д (1H, H Ar, 3 J 7,6 Гц), 7,51 д (1H, H6 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц), 7,55–7,59 м (2Н, наложение сигналов H5 фурил и H Ar), 7,62 д (1H, H3 2,4-Cl 2 C 6 H 3 , 4 J 2,3 Гц), 7,81 д (1H, H Ar, 3 J 8,2 Гц), 8,07 уш.с (1Н, Н2 3-СF 3 C 6 H 4 NH), 9,38 с (1Н, NHCO), 9,65 с (1Н, NH эндоцикл ), 10,98 (1Н, CH 2 C(O)N H ).
Спектр ЯМР 13С (101 МГц, DMSO-d 6 ), δ C , м. д.: 17,6 (CH 3 -Py), 36,5 (SCH 2 ), 36,7 (C4Н Py), 83,3 (C5 Py), 103,1 (C3 Py), 106,1 (C3 фурил), 110,5 (C4 фурил), 115,4 кв (С2Н 3-СF 3 C 6 H 4 NH, 3 J С–F 3,6 Гц), 119,3 (C≡N), 120,2 кв (С4Н 3-СF 3 C 6 H 4 NH, 3 J С–F 3,6 Гц), 123,0 (С6Н 3-СF 3 C 6 H 4 NH), 124,1 кв (СF 3 , 1 J С–F 272,5 Гц), 127,5 (C5H 2,4-Cl 2 C 6 H 3 ), 128,1 (C6H 2,4-Cl 2 C 6 H 3 ), 128,9 (C3H 2,4-Cl 2 C 6 H 3 ), 129,5 кв (С3Н 3-СF 3 C 6 H 4 NH, 2 J С–F 31.7 Гц), 129,7 (С5Н 3-СF 3 C 6 H 4 NH), 130,2 (C–Cl), 134,4 (2С, C1 С2 2,4-Cl 2 C 6 H 3 ), 139,4 (С2 Py), 139,8 (С1 3-СF 3 C 6 H 4 NH), 142,8 (C5 фурил), 144,7 (С6 Py), 155,6 (С2 фурил), 166,1 ( С (O)NHAr), 167,3 (SCH 2 C (O)NH).
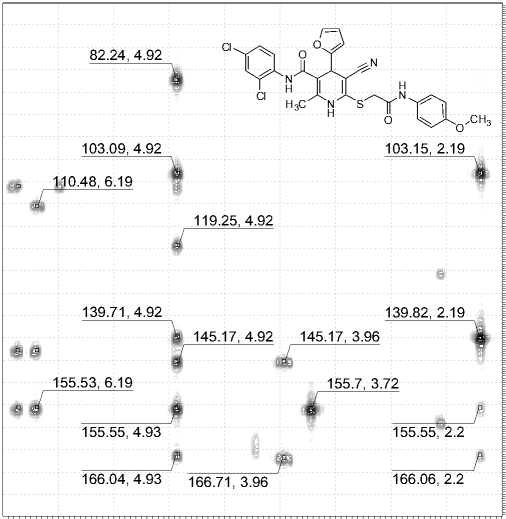
Найдено, %: C 53,29; H 3,22; N 9,14. C 27 H 19 Cl 2 F 3 N 4 O 3 S (M 607,43). Вычислено, %: C, 53,39; H, 3,15; N, 9,22. Основные корреляции в спектрах ЯМР 1H-13C HSQC и 1H-13C HMBC соединения 12 приведены в табл. 1. Химические сдвиги ядер 1Н показаны на рис. 1а, ядер 13С – на рис. 1б.
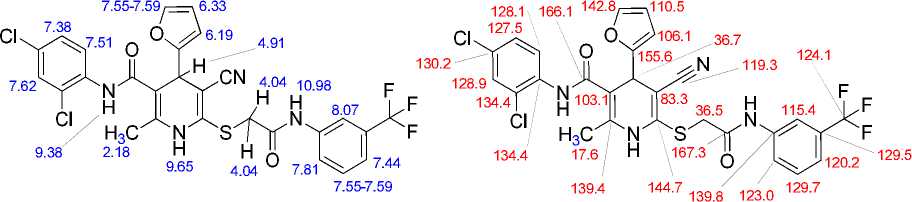
а) б)
Рис. 1. Химические сдвиги в спектрах ЯМР соединения 12: ядер 1Н (а) и ядер 13С (б)
Основные корреляции в спектрах ЯМР 1H-13C HSQC и 1H-13C HMBC соединения 12
Таблица 1
|
δН, м. д. |
Корреляции в HSQC спектре, δ, м. д. |
Корреляции в HMBC спектре, δ, м. д. |
|
2,18 c (3Н, CH 3 ) |
17,6 (CH 3 -Py) |
83,3 (C5 Py), 103,1 (C3 Py), 139,4 (С2 Py) |
|
4,04 АВ- кв (2Н, SCH 2 , 2 J 15,3 Гц) |
36,5 (SCH 2 ) |
144,7 (С6 Py), 167,3 (SCH 2 C (O)NH) |
|
4,91 c (1H, С4H Py) |
36,7 (C4Н Py) |
83,3 (C5 Py), 103,1 (C3 Py), 106,1 (C3 фурил), 119,3 слаб. (C≡N), 139,4 (С2 Py), 144,7 (С6 Py), 155,6 (С2 фурил), 166,1 ( С (O)NHAr) |
|
6,18 д (1H, H3 фурил, 3 J 2,9 Гц) |
106,1 (C3 фурил) |
110,5 (C4 фурил), 142,8 (C5 фурил), 155,6 (С2 фурил) |
|
6,34 дд (1H, H4 фурил, 3 J 2,9 Гц, 3 J 2,0 Гц) |
110,5 (C4 фурил) |
106,1 (C3 фурил), 142,8 (C5 фурил), 155,6 (С2 фурил) |
|
7,38 дд (1H, H5 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц, 4 J 2,3 Гц) |
127,5 (C5H 2,4-Cl 2 C 6 H 3 ) |
128,9 (C3H 2,4-Cl 2 C 6 H 3 ), 134,4 (2С, C1 С2 2,4-Cl 2 C 6 H 3 ) |
|
7,44 д (1H, H Ar, 3 J 7,6 Гц) |
120.2 кв (С4Н 3-СF 3 C 6 H 4 NH, 3 J С–F 3,6 Гц) |
115,4 кв (С2Н 3-СF 3 C 6 H 4 NH, 3 J С–F 3,6 Гц), 123,0 (С6Н 3-СF 3 C 6 H 4 NH), 129,5 кв (С3Н 3-СF 3 C 6 H 4 NH, 2 J С–F 31,7 Гц) |
|
7,51 д (1H, H6 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц) |
128,1 (C6H 2,4-Cl 2 C 6 H 3 ) |
128,9 слаб. (C3H 2,4-Cl 2 C 6 H 3 ) |
|
7,55–7,59 м (2Н, наложение сигналов H5 фурил и H Ar) |
129,7 (С5Н 3-СF 3 C 6 H 4 NH) 142,8 (C5 фурил) |
106,1 (C3 фурил), 123,0 (С6Н 3-СF 3 C 6 H 4 NH), 129,5 кв (С3Н 3-СF 3 C 6 H 4 NH, 2 J С–F 31,7 Гц), 139,8 (С1 3-СF 3 C 6 H 4 NH), 155,6 (С2 фурил) |
|
7,62 д (1H, H3 2,4-Cl 2 C 6 H 3 , 4 J 2,3 Гц) |
128,9 (C3H 2,4-Cl 2 C 6 H 3 ) |
127,5 (C5H 2,4-Cl 2 C 6 H 3 ), 130,2 (C–Cl), 134,4 (2С, C1 С2 2,4-Cl 2 C 6 H 3 ), |
Окончание табл. 1
|
δ Н , м. д. |
Корреляции в HSQC спектре, δ, м. д. |
Корреляции в HMBC спектре, δ, м. д. |
|
7,81 д (1H, H Ar, 3 J 8, 2 Гц) |
123,0 (С6Н 3-СF 3 C 6 H 4 NH) |
115,4 кв (С2Н 3-СF 3 C 6 H 4 NH, 3 J С–F 3,6 Гц), 120,2 кв (С4Н 3-СF 3 C 6 H 4 NH, 3 J С–F 3,6 Гц), 129,5 слаб., кв (С3Н 3-СF 3 C 6 H 4 NH, 2 J С–F 31,7 Гц), 139,8 (С1 3-СF 3 C 6 H 4 NH) |
|
8,07 уш.с (1Н, Н2 3-СF 3 C 6 H 4 NH) |
115,4 кв (С2Н 3-СF 3 C 6 H 4 NH, 3 J С–F 3,6 Гц) |
120,2 кв (С4Н 3-СF 3 C 6 H 4 NH, 3 J С–F 3,6 Гц), 123,0 (С6Н 3-СF 3 C 6 H 4 NH), 139,8 (С1 3-СF 3 C 6 H 4 NH) |
|
9,38 с (1Н, NHCO) |
– |
128,1 (C6H 2,4-Cl 2 C 6 H 3 ), 134,4 (2С, C1 С2 2,4-Cl 2 C 6 H 3 ), 166,1 ( С (O)NHAr) |
|
9,65 с (1Н, NH эндоцикл ) |
– |
17,6 (CH 3 -Py), 83,3 (C5 Py), 103,1 (C3 Py), 119,3 слаб. (C≡N), 139,4 (С2 Py) |
|
10,98 (1Н, CH 2 C(O)N H ) |
– |
115,4 кв (С2Н 3-СF 3 C 6 H 4 NH, 3 J С–F 3,6 Гц), 123,0 (С6Н 3-СF 3 C 6 H 4 NH), 167,3 (SCH 2 C (O)NH) |
2-Метил-6-({2-[(4-метоксифенил)амино]-2-оксоэтил}сульфанил)-4-(2-фурил)-N-(2,4- дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид (13).
Белый мелкокристаллический порошок, выход 90 %. ИК-спектр, ν , см - 1: 3369, 3303, 3146 (N–
H), 2195 (C≡N), 1680, 1655 (C=O).
Спектр ЯМР 1Н (400 МГц, DMSO-d 6 ), δ , м. д.: 2,19 c (3Н, CH 3 Py), 3,72 c (3Н, ОCH 3 ), 3,96 АВ- кв (2Н, SCH 2 , 2 J 14,8 Гц), 4,92 c (1H, С4H Py), 6,19 д (1H, H3 фурил, 3 J 3,2 Гц), 6,36 дд (1H, H4 фурил, 3 J 1,8 Гц, 3 J 3,2 Гц), 6,91 д (2H, С3Н С5Н 4-MeOC 6 H 4 NH, 3 J 9,1 Гц), 7,38 дд (1H, H5 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц, 4 J 2,3 Гц), 7,49–7,53 м (3H, С2Н С6Н 4-MeOC 6 H 4 NH и H6 2,4-Cl 2 C 6 H 3 ), 7,56– 7,57 м (1H, H5 фурил), 7,62 д (1H, H3 2,4-Cl 2 C 6 H 3 , 4 J 2,3 Гц), 9,35 с (1Н, C(O)NH), 9,87 с (1Н, NH эндоцикл ), 10,47 (1Н, CH 2 C(O)N H ).
Спектр ЯМР 13С DEPTQ (101 МГц, DMSO-d 6 ), δ C , м. д.: 17,6* (CH 3 -Py), 36,3 (SCH 2 ), 36,4* (C4Н Py), 55,2* (OCH 3 ), 82,2 (C5 Py), 103,1 (C3 Py), 106,1* (C3 фурил), 110,5* (C4 фурил), 114,0* (2С, C3Н C5Н 4-MeOC 6 H 4 NH), 119,3 (C≡N), 121,1* (2С, C2Н C6Н 4-MeOC 6 H 4 ), 127,4* (C5H 2,4-Cl 2 C 6 H 3 ), 128,0* (C6H 2,4-Cl 2 C 6 H 3 ), 128,8* (C3H 2,4-Cl 2 C 6 H 3 ), 129,7 (C4 2,4-Cl 2 C 6 H 3 ), 131,4 (С1 4-MeOC 6 H 4 ), 134,3 (2С, C1 С2 2,4-Cl 2 C 6 H 3 ), 139,8 (С2 Py), 142,7* (C5 фурил), 145,2 (С6 Py), 155,6 (С2 фурил), 155,7 (С4 4-MeOC 6 H 4 ), 166,0 ( С (O)NHAr), 166,8 (SCH 2 C (O)NH). *Сигналы в противофазе.
Найдено, %: C 56,89; H 4,02; N 9,77. C 27 H 22 Cl 2 N 4 O 4 S (M 569,46). Вычислено, %: C 56,95; H 3,89; N 9,84.
Основные корреляции в спектрах ЯМР 1H-13C HSQC и 1H-13C HMBC соединения 13 приведены в табл. 2. Химические сдвиги ядер 1Н показаны на рис. 2а, ядер 13С – на рис. 2б. Двумерные спектры соединения 13 показаны на рис. 3–5.
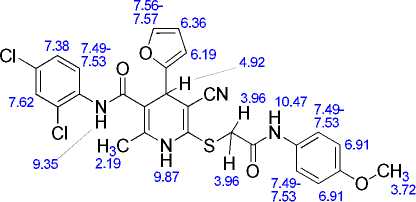
а)
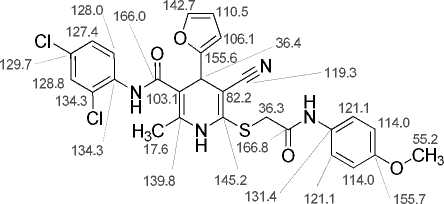
б)
Рис. 2. Химические сдвиги в спектрах ЯМР соединения 13: ядер 1Н (а) и ядер 13С (б)
Таблица 2
|
δ Н , м. д. |
Корреляции в HSQC спектре, δ, м. д. |
Корреляции в HMBC спектре, δ, м. д. |
|
2,19 c (3Н, CH 3 Py) |
17,6* (CH 3 -Py) |
103,1 (C3 Py), 139,8 (С2 Py), 155,6 слаб. (С2 фурил), 166,0 слаб. (C=O) |
|
3,72 c (3Н, ОCH 3 ) |
55,2* (OCH 3 ) |
155,7 (С4 4-MeOC 6 H 4 ) |
|
3,96 АВ- кв (2Н, SCH 2 , 2 J 14,.8 Гц) |
36,3 (SCH 2 ) |
145,2 (С6 Py), 166,8 (C=O). |
|
4,92 c (1H, С4H Py) |
36,4* (C4Н Py) |
82,2 (C5 Py), 103,1 (C3 Py), 119,3 (C≡N), 139,8 (С2 Py), 145,2 (С6 Py), 155,6 (С2 фурил), 166,0 (C=O) |
|
6,19 д (1H, H3 фурил, 3 J 3,2 Гц) |
106,1* (C3 фурил) |
110,5* (C4 фурил), 142,7* (C5 фурил), 155,6 (С2 фурил) |
|
6,36 дд (1H, H4 фурил, 3 J 1,8 Гц, 3 J 3,2 Гц) |
110,5* (C4 фурил) |
106,1* (C3 фурил), 142,7* (C5 фурил), 155,6 (С2 фурил) |
|
6,91 д (2H, С3Н С5Н 4-MeOC 6 H 4 NH, 3 J 9,1 Гц) |
114,0* (2С, C3Н C5Н 4-MeOC 6 H 4 NH) |
114,0* (2С, C3Н C5Н 4-MeOC 6 H 4 NH), 121,1* (2С, C2Н C6Н 4-MeOC 6 H 4 ), 131,4 (С1 4-MeOC 6 H 4 ), 155,7 (С4 4-MeOC 6 H 4 ) |
|
7,38 дд (1H, H5 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц, 4 J 2,3 Гц) |
127,4* (C5H 2,4-Cl 2 C 6 H 3 ) |
128,8* (C3H 2,4-Cl 2 C 6 H 3 ), 134,3 (2С, C1 С2 2,4-Cl 2 C 6 H 3 ) |
|
7,49–7,53 м (3H, С2Н С6Н 4-MeOC 6 H 4 NH иH6 2,4- Cl 2 C 6 H 3 ) |
121,1* (2С, C2Н C6Н 4-MeOC 6 H 4 ), 128,0* (C6H 2,4-Cl 2 C 6 H 3 ) |
114,0* (2С, C3Н C5Н 4-MeOC 6 H 4 NH), 121,1* (2С, C2Н C6Н 4-MeOC 6 H 4 ), 129,7 (C4 2,4-Cl 2 C 6 H 3 ), 134,3 (2С, C1 С2 2,4-Cl 2 C 6 H 3 ), 155,7 (С4 4-MeOC 6 H 4 ) |
|
7,56–7,57 м (1H, H5 фурил) |
142,7* (C5 фурил) |
106,1* (C3 фурил), 110,5* (C4 фурил), 155,6 (С2 фурил) |
|
7,62 д (1H, H3 2,4-Cl 2 C 6 H 3 , 4 J 2,3 Гц) |
128,8* (C3H 2,4-Cl 2 C 6 H 3 ) |
127,4* (C5H 2,4-Cl 2 C 6 H 3 ), 129,7 (C4 2,4-Cl 2 C 6 H 3 ), 134,3 (2С, C1 С2 2,4-Cl 2 C 6 H 3 ) |
|
9,35 с (1Н, C(O)NH) |
– |
127,4* (C5H 2,4-Cl 2 C 6 H 3 ), 128,8* (C3H 2,4-Cl 2 C 6 H 3 ), 134,3 (2С, C1 С2 2,4-Cl 2 C 6 H 3 ) |
|
9,87 с (1Н, NH эндоцикл ) |
– |
17,6* (CH 3 -Py), 82,2 (C5 Py), 103,1 (C3 Py), 119,3 слаб. (C≡N), 139,8 (С2 Py), 166,0 (C=O) |
|
10,47 (1Н, CH 2 C(O)N H ) |
– |
121,1* (2С, C2Н C6Н 4-MeOC 6 H 4 ), 131,4 слаб. (С1 4-MeOC 6 H 4 ), 166,8 (C=O) |
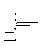
6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0
ppm
Рис. 4. Фрагмент № 1 спектра ЯМР 1Н-13С HMBC соединения 13
17.64, 9.87
82.16, 9.87
102.98, 9.87
120.91, 10.47
р
139.89, 9.87

166.09, 9.87
Е
106.06, 7.56
110.51, 7.57

134.34, 7.38
128.8, 9.36 129.55, 7.5
121.12 , 7.51
128.82, 7.38
О
131.42, 6.9
6 *
155.73, 6.91
я
155.73, 7.51
а а а
155.53, 6.19
166.75, 10.47 166.09, 9.36
10.5 10.0 9.5 9.0 8.5 8.0 7.5 7.0
ppm
6.5
Рис. 5. Фрагмент № 2 спектра ЯМР 1Н-13С HMBC соединения 13
2-Метил-6-({2-[(3-метилфенил)амино]-2-оксоэтил}сульфанил)-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид (14).
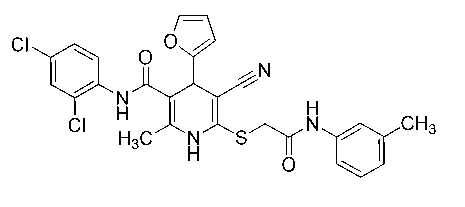
Белый мелкокристаллический порошок, выход 83 %. ИК-спектр, ν , см - 1: 3300, 3213, 3155 (N– H), 2204 (C≡N), 1651 (C=O).
Спектр ЯМР 1Н (400 МГц, DMSO-d 6 ), δ , м. д.: 2,19 c (3Н, CH 3 Py), 2,28 c (3Н, ArCH 3 ), 3,97 АВ- кв (2Н, SCH 2 , 2 J 15,1 Гц), 4,92 c (1H, С4H Py), 6,19 д (1H, H3 фурил, 3 J 2,9 Гц), 6,35–6,36 м (1H, H4 фурил), 6,91 д (1H, Н6 3-MeC 6 H 4 NH, 3 J 7,5 Гц), 7,19–7,23 м (1H, Н5 3-MeC 6 H 4 NH), 7,35–7,42 м (3H, 3-МеC 6 H 4 NH иH5 2,4-Cl 2 C 6 H 3 ), 7,53 д (1H, H6 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц), 7,55–7,57 м (1H, H5 фурил), 7,62 д (1H, H3 2,4-Cl 2 C 6 H 3 , 4 J 2,2 Гц), 9,35 с (1Н, C(O)NH), 9,74 с (1Н, NH эндоцикл ), 10,42 (1Н, CH 2 C(O)N H ).
Спектр ЯМР 13С DEPTQ (101 МГц, DMSO-d 6 ), δ C , м. д.: 17,6* (CH 3 -Py), 21,2* (CH 3 -Ar), 36,4* (C4Н Py), 36,5 (SCH 2 ), 82,5 (C5 Py), 103,1 (C3 Py), 106,1* (C3 фурил), 110,5* (C4 фурил), 116,7* (СH 3-MeC 6 H 4 NH), 119,2 (C≡N), 120,0* (СH 3-MeC 6 H 4 NH), 124,7* (СH 3-MeC 6 H 4 NH), 127,4* (C5H 2,4-Cl 2 C 6 H 3 ), 128,0* (C6H 2,4-Cl 2 C 6 H 3 ), 128,7* (СH 3-MeC 6 H 4 NH), 128,80 (C Ar), 128,83* (C3H 2,4-Cl 2 C 6 H 3 ), 129,7 (C4 2,4-Cl 2 C 6 H 3 ), 134,3 (C 2,4-Cl 2 C 6 H 3 ), 138,1 (С Ar), 138,3 (С Ar), 139,8 (С2 Py), 142,7* (C5 фурил), 145,0 (С6 Py), 155,5 (С2 фурил), 166,0 ( С (O)NHAr), 167,0 (SCH 2 C (O)NH). *Сигналы в противофазе. Найдено, %: C 58,49; H 4,13; N 10,07. C 27 H 22 Cl 2 N 4 O 3 S (M 553,46). Вычислено, %: C, 58,59; H, 4,01; N, 10,12.
2-Метил-6-({2-оксо-[(4-фторфенил)амино]этил}сульфанил)-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид (15).
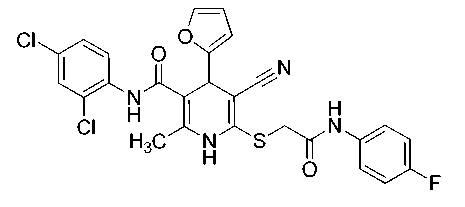
Белый мелкокристаллический порошок, выход 86 %. ИК-спектр, ν , см - 1: 3288, 3207, 3159 (N– H), 2201 (C≡N), 1659 (C=O).
Спектр ЯМР 1Н (400 МГц, DMSO-d 6 ), δ , м. д.: 2,19 c (3Н, CH 3 Py), 4,01 уш.с (SCH 2 ), 4,92 c (1H, С4H Py), 6,19 д (1H, H3 фурил, 3 J 2,9 Гц), 6,35–6,36 м (1H, H4 фурил), 7,15–7,19 м (2H, H3 H5 4-FC 6 H 4 NH), 7,38 дд (1H, H5 2,4-Cl 2 C 6 H 3 , 3 J 8,5 Гц, 4 J 2,2 Гц), 7,52 д (1H, H6 2,4-Cl 2 C 6 H 3 , 3 J 8,5 Гц), 7,55–7,57 м (1H, H5 фурил), 7,61–7,64 м (3H, наложение сигналов H3 2,4-Cl 2 C 6 H 3 и H2 H6 4-FC 6 H 4 NH), 9,37 с (1Н, C(O)NH), 9,77 с (1Н, NH эндоцикл ), 10,71 (1Н, CH 2 C(O)N H ).
Спектр ЯМР 13С (101 МГц, DMSO-d 6 ), δ C , м. д.: 17,6 (CH 3 -Py), 36,4 (C4Н Py), 36,5 (SCH 2 ), 82,7 (C5 Py), 103,1 (C3 Py), 106,1 (C3 фурил), 110,5 (C4 фурил), 115,4 д (С3H С5H 4-FC 6 H 4 NH, 2 J 22,3 Гц), 119,2 (C≡N), 121,3 д (С2H С6H 4-FC 6 H 4 NH, 3 J 7,9 Гц), 127,4 (C5H 2,4-Cl 2 C 6 H 3 ), 128,0 (C6H 2,4-Cl 2 C 6 H 3 ), 128,81 (С–Сl), 128,83 (C3H 2,4-Cl 2 C 6 H 3 ), 129,7 (C4 2,4-Cl 2 C 6 H 3 ), 134,3 (C 2,4-Cl 2 C 6 H 3 ), 134,8 д (С1 4-FC 6 H 4 NH, 4 J 2,2 Гц), 139,8 (С2 Py), 142,7 (C5 фурил), 144,9 (С6 Py), 155,5 (С2 фурил), 158,3 д (С4 4-FC 6 H 4 NH, 1 J -241,1 Гц), 166,0 ( С (O)NHAr), 167,0 (SCH 2 C (O)NH).
Найдено, %: C 55,94; H 3,57; N 10,01. C 26 H 19 Cl 2 FN 4 O 3 S (M 557,42). Вычислено, %: C 56,02; H 3,44; N 10,05.
2-Метил-6-({2-[фениламино]-2-оксоэтил}сульфанил)-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамид (16).
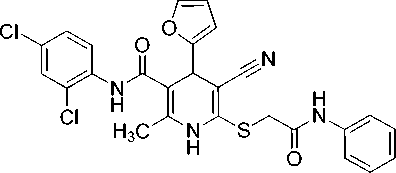
Белый мелкокристаллический порошок, выход 82 %. ИК-спектр, ν , см - 1: 3298, 3219, 3147 (N– H), 2197 (C≡N), 1678, 1657 (C=O).
Спектр ЯМР 1Н (400 МГц, DMSO-d 6 ), δ , м. д.: 2,20 c (3Н, CH 3 Py), 4,02 уш.с (2Н, SCH 2 ), 4,92 c (1H, С4H Py), 6,19 д (1H, H3 фурил, 3 J 3,2 Гц), 6,35 дд (1H, H4 фурил, 3 J 1,8 Гц, 3 J 3,2 Гц), 7,07– 7,11 м (1H, Н4 PhNH), 7,31–7,35 м (1H, Н3 H5 PhNH), 7,38 дд (1H, H5 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц, 4 J 2,4 Гц), 7,52 д (1H, H6 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц), 7,56–7,57 м (1H, H5 фурил), 7,59–7,62 м (3H, H Ar), 9,36 с (1Н, C(O)NH), 9,78 с (1Н, NH эндоцикл ), 10,61 (1Н, CH 2 C(O)N H ).
Спектр ЯМР 13С DEPTQ (101 МГц, DMSO-d 6 ), δ C , м. д.: 17,6* (CH 3 -Py), 36,4* (C4Н Py), 36,5 (SCH 2 ), 82,5 (C5 Py), 103,1 (C3 Py), 106,1* (C3 фурил), 110,5* (C4 фурил), 119,3 (C≡N), 119,5* (2С, C2Н C6Н PhNH), 123,9* (C4Н PhNH), 127,4* (C5H 2,4-Cl 2 C 6 H 3 ), 128,0* (C6H 2,4-Cl 2 C 6 H 3 ), 128,8* (3C, C3H 2,4-Cl 2 C 6 H 3 и C3Н C5Н PhNH), 129,7 (C4 2,4-Cl 2 C 6 H 3 ), 134,3 (С Ar), 138,4 (С Ar), 139,8 (С2 Py), 142,7* (C5 фурил), 145,0 (С6 Py), 155,5 (С2 фурил), 166,0 ( С (O)NHAr), 167,1 (SCH 2 C (O)NH). *Сигналы в противофазе.
Найдено, %: C 57,78; H 3,87; N 10,35. C 26 H 20 Cl 2 N 4 O 3 S (M 539,43). Вычислено, %: C 57,89; H 3,74; N 10,39.
Этиловый эфир 2-(2-{[6-метил-5-((2,4-дихлорфенил)карбамоил)-4-(2-фурил)-3-циано-1,4-дигидропиридин-2-ил]сульфанил}ацетамидо)-4,5,6,7-тетрагидробензо[b]тиофен-3-карбоновой кислоты (17).
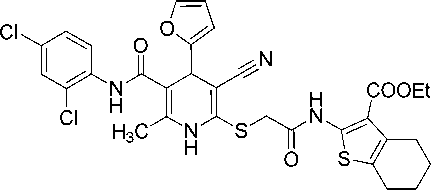
Бежевый мелкокристаллический порошок, выход 76 %. ИК-спектр, ν , см - 1: 3369, 3225 (N–H), 2199 (C≡N), 1686, 1664, 1653 (C=O).
Спектр ЯМР 1Н (400 МГц, DMSO-d 6 ), δ , м. д.: 1,30 т (3Н, OCH 2 C H 3 , 3 J 7,1 Гц), 1,70–1,75 м (4Н, СН 2 СН 2 ), 2,16 c (3Н, CH 3 Py), 2,58–2,62 м (2Н, СН 2 ), 2,67–2,72 м (2Н, СН 2 ), 4,20 АВ -кв (2Н, SCH 2 , 2 J 15,2 Гц), 4,27 кв (2Н, OC H 2 CH 3 , 3 J 7,1 Гц), 4,89 c (1H, С4H Py), 6,15 д (1H, H3 фурил, 3 J 3,2 Гц), 6,33 дд (1H, H4 фурил, 3 J 1,8 Гц, 3 J 3,2 Гц), 7,37 дд (1H, H5 2,4-Cl 2 C 6 H 3 , 3 J 8,7 Гц, 4 J 2,4 Гц), 7,49–7,52 м (2H, H5 фурил, H6 2,4-Cl 2 C 6 H 3 ), 7,61 д (1H, H3 2,4-Cl 2 C 6 H 3 , 4 J 2,4 Гц), 9,33 с (1Н, C(O)NH), 9,49 с (1Н, NH эндоцикл ), 11,30 (1Н, CH 2 C(O)N H ).
Спектр ЯМР 13С DEPTQ (101 МГц, DMSO-d 6 ), δ C , м. д.: 14,1* (OCH 2 C H 3 ), 17,4* (CH 3 -Py), 22,3 (CH 2 ), 22,4 (CH 2 ), 23,7 (CH 2 ), 25,8 (CH 2 ), 35,6 (SCH 2 ), 36,5* (C4Н Py), 60,4 (O C H 2 CH 3 ), 84,0 (C5 Py), 103,2 (C3 Py), 106,1* (C3 фурил), 110,4* (C4 фурил), 112,2 (С тиофен), 118,9 (C≡N), 126,7 (С тиофен), 127,4* (C5H 2,4-Cl 2 C 6 H 3 ), 128,0* (C6H 2,4-Cl 2 C 6 H 3 ), 128,76 (С тиофен), 128,8* (C3H 2,4-Cl 2 C 6 H 3 ), 129,7 (C4 2,4-Cl 2 C 6 H 3 ), 130,6 (С тиофен), 134,3 (С 2,4-Cl 2 C 6 H 3 ), 139,8 (С2 Py), 142,7* (C5 фурил), 143,6 (С Ar), 145,2 (С6 Py), 155,4 (С2 фурил), 164,7 (COOEt), 165,3 ( С (O)NHAr), 166,0 (SCH 2 C (O)NH). *Сигналы в противофазе.
Найдено, %: C 55,28; H 4,32; N 8,35. C 31 H 28 Cl 2 N 4 O 5 S 2 (M 671,61). Вычислено, %: C, 55,44; H, 4,20; N, 8,34.
ИК-спектры соединений 10 - 17 записывали на ИК-спектрометре Bruker Vertex 70 в режиме НПВО на кристалле алмаза в области 4000–400 см–1.
Элементный анализ на С, Н, N проведен на анализаторе Carlo-Erba Strumentazione 1106.
ЯМР-спектры соединений 10, 11, 13, 14, 16, 17 записывали на приборе Bruker Avance III HD 400MHz (400 МГц на ядрах 1Н, 101 МГц на ядрах 13С) в растворе ДМСО-d 6 , внутренний стандарт – остаточные сигналы растворителя; спектры соединений 12, 15 – на приборе Agilent 400/MR (400 МГц на ядрах 1Н, 101 МГц на ядрах 13С) в растворе ДМСО-d 6 , внутренний стандарт – остаточные сигналы растворителя.
Исследования антиэкссудативного и противовоспалительного действия. Эксперимент реализован на 112 белых беспородных крысах-самцах массой 250–270 г. Лабораторные животные были получены из вивария Луганского государственного медицинского университета имени Святителя Луки в осенний период для лаборатории кафедры фундаментальной и клинической фармакологии ЛГМУ. В течение всего периода исследований животные находились под наблюдением со свободным доступом к воде и пище (соответствие ГОСТ 33044–2014 «Принципы надлежащей лабораторной практики», утвержден приказом Федерального агентства по техрегу-лированию и метрологии № 1700-ст, от 20 ноября 2014 г.). Эксперимент одобрен комиссией по биоэтике Луганского государственного медицинского университета имени Святителя Луки Министерства здравоохранения Луганской Народной Республики (г. Луганск, кв. 50-летия Обороны Луганска, 1-Г), протокол № 6 от 1.11.2021 г.
Исследование проведено в соответствии с правилами качественной лабораторной практики при проведении доклинических исследований в Российской Федерации (Приказ Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. № 708н), а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997).
Условия содержания крыс были одинаковыми для всех экспериментальных групп: температура окружающей среды – 22–24 °С, режим освещения – естественный, относительная влажность воздуха – 40–50 %.
Экспериментальные группы формировались с помощью метода случайной выборки. Перед началом эксперимента все лабораторные животные были тщательно осмотрены, учитывались их масса, возраст, двигательная активность, состояние шерстяного покрова.
Лабораторные животные были поделены на группы в количестве по 8 животных: интактную, контрольную («острый формалиновый отек» без фармакокоррекции), четыре группы сравнения (ацетилсалициловая кислота ОАО «Уралбиофарм», парацетамол ЗАО «Медисорб», нимесулид ЗАО «Березовский фармацевтический завод», индометацин ПАО «Биосинтез») и восемь опытных групп соответственно числу исследуемых производных 1,4-дигидропиридин-3-карбонитрила 10–17 .
Антиэкссудативная активность исследуемых образцов оценивалась на модели «острого формалинового отека» лапы крыс. Модель исследования основана на воспроизведении острой воспалительной реакции субплантарным введением в правую заднюю конечность 0,1 мл 2%-ного раствора формалина. За 1,5 часа до индукции отека вводили внутрижелудочно препараты в дозах: ацетилсалициловая кислота и парацетамол по 50 мг/кг, индометацин 7 мг/кг, нимесулид 5 мг/кг. Исследуемые образцы 10–17 вводили в дозе 5 мг/кг.
Антиэкссудативный и противовоспалительный эффект оценивался онкометрически по изменению обхвата инъецированной конечности через 18 и 36 часов после индукции воспаления. Статистическая обработка полученных нами результатов производилась по известным формулам и методам математической статистики, характеризующим количественную изменчивость. При обработке экспериментальных данных определялись: среднее арифметическое обхвата конечности аср; дисперсия значений σ2 вокруг среднего арифметического и среднеквадратическое (стандартное) отклонение σ в онлайн-ресурсе [Среднее арифметическое, дисперсия, вариация – Режим доступа: ]; разность, δ (в см и %) отдельных групп, а также средние значения разности групп сравнения и исследуемых образцов. В связи с индивидуальными характеристиками экспериментальных животных, однородность полученных экспериментальных данных оценивалась коэффициентом вариации V в указанном онлайн-ресурсе. Чем больше значение коэффициента вариации, тем больший разброс и меньшая выравненность исследуемых значений. Если коэффициент вариации составляет менее 10 %, то изменчивость ряда данных принято считать незначительной, от 10 до 20 % относится к средней, более 20 % и менее 33 % – к значительной изменчивости.
Обсуждение результатов
Изначально нами была синтезирована библиотека из 115 новых производных 1,4-дигидропиридин-3-карбонитрила. Путем оценки in silico параметров биодоступности и потенциальных мишеней с использованием открытых программных пакетов OSIRIS Property Explorer [65], SwissADME [66], SwissTargetPrediction [67] и admetSAR [68] отобрано 8 соединений ( 10 – 17 ) для определения наиболее перспективных производных с учетом предполагаемых биомишеней для фармакокоррекции воспалительных реакций (структуры соединений 10 – 17 представлены на рис. 6).
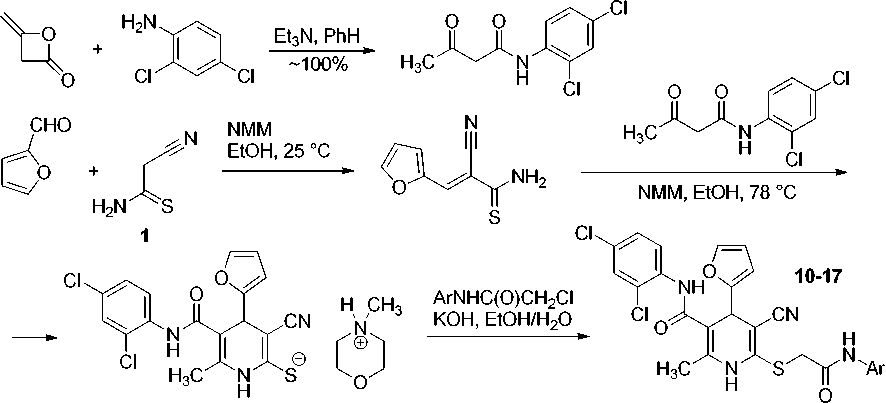
Синтез соединений 10–17 представлен ниже. Изначально дикетен вводился в реакцию с 2,4-дихлоранилином, при этом с количественным выходом получен N-(2,4-дихлорфенил)-ацетоацетамид. Последовательное взаимодействие цианотиоацетамида 1 [69] с фурфуролом и N-(2,4-дихлорфенил)ацетоацетамидом в присутствии избытка N-метилморфолина приводит к 6-метил-4-(2-фурил)-5-[(2,4-дихлорфенил)карбамоил]-3-циано-1,4-дигидропиридин-2-тиолату N-метилморфолиния. Реакция протекает как каскад процессов конденсации по Кнёвенагелю, присоединения по Михаэлю с последующей гетероциклизацией.
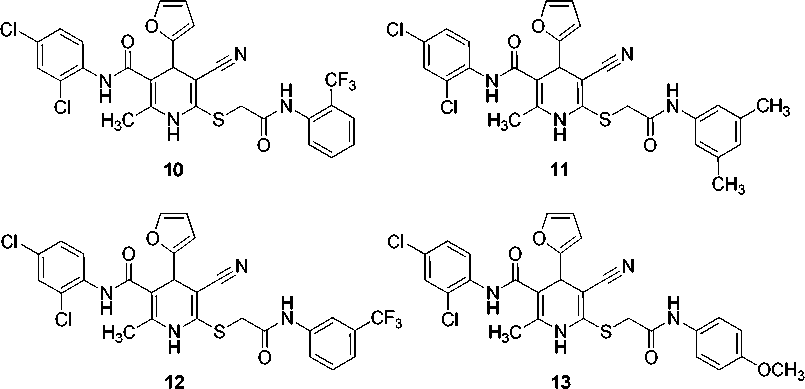
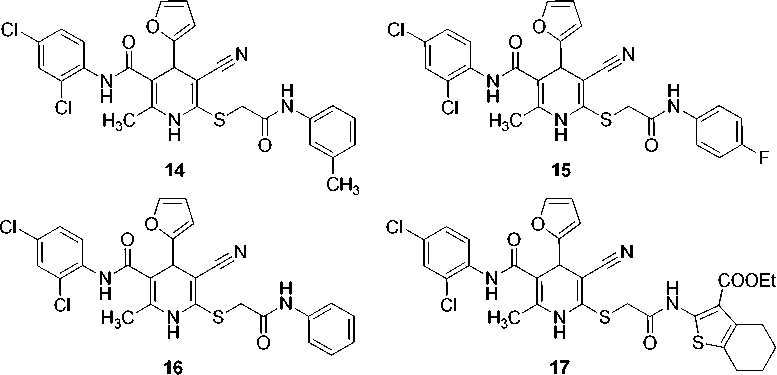
Рис. 6. Структуры соединений 10–17
S-Алкилирование полученного 3-циано-1,4-дигидропиридин-2-тиолата продуктами хлораце-тилирования первичных ароматических аминов, N-замещенными α-хлорацетамидами, протекает по обычному механизму нуклеофильного замещения S N 2 и дает ожидаемые целевые продукты, 2-метил-6-[(2-оксо-2-{ариламино}этил)сульфанил]-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамиды 10–17 :
Соединения 10–17 представляют собой мелкокристаллические вещества белого или бежевого цвета, стабильные при хранении на воздухе в сухом виде, нерастворимые в EtOH, умеренно растворимые в ацетоне и этилацетате, хорошо растворимые в ДМФА и ДМСО при нагревании. Строение соединений 10–17 подтверждено комплексом спектральных данных ЯМР 1Н, 13С и Фу-рье-ИК-спектрофотометрии.
В ИК-спектрах наблюдается узкая и интенсивная полоса поглощения, соответствующая валентным колебаниям сопряженной цианогруппы (ν 2195–2204 см–1) и полосы поглощения С=О амидных фрагментов (ν 1651–1680 см–1). В 1Н ЯМР спектрах соединений 10–17 обнаруживаются характерные сигналы протонов СН3 в виде синглета при δ 2,16–2,20 м. д., уширенный синглет (либо АВ -квартет) протонов SCH 2 (δ 3,96–4,20 м. д.), синглет протона Н4 (δ 4,89–4,93 м. д.), сигналы 2-фурильного заместителя (дублет Н3 при δ 6,15–6,19 м. д. (3 J = 2,9–3,2 Гц), дд или мультиплет Н4 при δ 6,33–6,37 м. д., дублет Н5 при δ 7,49–7,59 м. д.), характерные наборы сигналов ароматических заместителей. Протоны CON H Ar резонируют при δ 9,33–9,38 м. д., эндоциклическо-го NH – при δ 9,49–9,87 м. д., SCH 2 C(O)N H – при δ 10,14–11,30 м. д. В 13С ЯМР спектре наблюдаются сигналы углеродов СН 3 (δ 17,4–17,6 м. д.), SCH 2 (δ 35,2–36,5 м. д.), C≡N (δ 118,9– 119,3 м. д.), карбонильных атомов углерода CONHAr (δ 165,3–166,1 м. д.) и CH 2 C (O)NH (δ 166,0– 168,3 м. д.). Сигналы углеродов 2-фурильного заместителя имеют характерные значения (С2 δ 155,4–155,6 м. д., С3 δ 106,1 м. д., С4 δ 110,4–110,5 м. д., С5 δ 142,7–142,8 м. д.). Сигналы углеродов 1,4-дигидропиридиновой системы наблюдаются в следующих интервалах: С2 δ 139,4–139,8 м. д., С3 δ 103,1–103,2 м. д., С4Нδ 36,4–36,7 м. д., С 5(СN) δ 82,2–84,0 м. д., С6δ 144,7–145,2 м. д.).
Образцы 10–17 были исследованы на наличие антиэкссудативного и противовоспалительного действия. Известно, что частота встречаемости нозологий, которые сопровождаются воспалительными реакциями и требуют применения противовоспалительных лекарственных средств, в современном мире постоянно возрастает. В настоящее время одним из важнейших направлений медицины в целом и экспериментальной фармакологии в частности является поиск новых высокоэффективных и безопасных лекарственных препаратов, обладающих антиэкссудативной активностью и имеющих низкий уровень токсичности [70, 71]. Входящие в состав нестероидных противовоспалительных средств компоненты относятся к различным химическим классам, что характеризует их главнейшие фармакокинетические и фармакодинамические отличия. Наиболее часто назначаемыми лекарственными препаратами, обладающими антиэкссудативной активностью, являются ацетилсалициловая кислота, нимесулид и индометацин. Однако на фоне их длительного применения возникает ряд побочных эффектов, обусловленных их нефротоксичностью, гастротоксичностью, а также гепатотоксичностью [72, 73]. Поэтому актуальной темой на сегодняшний день является поиск, разработка, фармакологические исследования и внедрение новых более высокоэффективных антиэкссудативных средств с минимальным спектром неблагоприятных действий.
Результаты статистической обработки полученных нами данных для препаратов сравнения и исследуемых новых образцов через 18 и 36 часов после индукции воспалительного процесса представлены в табл. 3 и 4 соответственно. После введения альгогена (2%-ного раствора формалина) наблюдалась воспалительная реакция, характеризующаяся отеком, выраженной гиперемией, болезненностью и дисфункцией инъецированной лапки. Итоги эксперимента по показателям в интактной группе отражают практически полное отсутствие разницы в размере левой и правой задних конечностей.
В ходе исследования нами наблюдался выраженный отек правых задних конечностей контрольной группы. Обхват правой задней лапки через 18 часов после введения альгогена был больше обхвата левой на 162 %. Спустя 36 часов после индукции воспаления обхват правой конечности крыс контрольной группы был больше, чем таковые значения левой конечности на 154 %.
Исследуемые препараты сравнения и новые производные 1,4-дигидропиридина в различной степени проявили антиэкссудативную активность. Из препаратов сравнения наименее выраженными противовоспалительными свойствами обладает ацетилсалициловая кислота. В данном случае через 18 часов после индукции воспаления обхват правой задней конечности увеличился на 123 %. Спустя 36 часов объем правой лапки уменьшился всего на 3 %.
Таблица 3 Изменение обхвата конечностей крыс после формалинового отека через 18 часов после индукции воспаления
|
Группа животных |
Обхват конечности, см |
Разность, δ |
||
|
левой |
правой |
см |
% |
|
|
Интактная |
a= 2,84; σ 2 = 0,0055; σ = 0,0744; V = 2,62 % |
a= 2,85; σ 2 = 0,0085; σ = 0,0925; V = 3,25 % |
– |
– |
|
Контрольная (формалиновый отек) |
a= 2,65; σ 2 = 0,06; σ = 0,244; V = 9,24 % |
a= 4,28; σ 2 = 0,132; σ = 0,364; V = 11,08 % |
1,63 |
61,5 |
|
Препараты сравнения |
||||
|
Ацетилсалициловая кислота |
a= 2,45; σ 2 = 0,117; σ = 0,342; V = 13,97 % |
a= 3,02; σ 2 = 0,153; σ = 0,391; V = 12,95 % |
0,57 |
23,2 |
|
Индометацин |
a= 3,07; σ 2 = 0,053; σ = 0,231; V = 7,53 % |
a= 3,55; σ 2 = 0,102; σ = 0,32; V = 9,03 % |
0,47 |
15,25 |
|
Нимесулид |
a= 2,55; σ 2 = 0,122; σ = 0,35; V = 13,75 % |
a= 2,88; σ 2 = 0,135; σ = 0,368; V = 12,75 % |
0,33 |
12,94 |
|
Парацетамол |
a= 2,57; σ 2 = 0,093; σ = 0,305; V = 11,88 % |
a= 3,06; σ 2 = 0,079; σ = 0,282; V = 9,23 % |
0,49 |
19,06 |
|
Среднее значение |
0,46 |
17,61 |
||
|
Исследуемые синтезированные соединения |
||||
|
11 |
a= 2,92; σ 2 = 0,01; σ = 0,103; V = 3,54 % |
a= 3,12; σ 2 = 0,039; σ = 0,198; V = 6,34 % |
0,2 |
6,84 |
|
13 |
a= 2,62; σ 2 = 0,093; σ = 0,305; V = 11,65 % |
a= 3,06; σ 2 = 0,334; σ = 0,578; V = 18,87 % |
0,44 |
16,79 |
|
17 |
a= 2,58; σ 2 = 0,089; σ = 0,299; V = 11,58 % |
a= 3,26; σ 2 = 0,282; σ = 0,531; V = 16,3 % |
0,68 |
26,35 |
|
15 |
a= 3,01; σ 2 = 0,049; σ = 0,223; V = 7,41 % |
a= 3,37; σ 2 = 0,242; σ = 0,492; V = 14,58 % |
0,36 |
11,96 |
|
12 |
a= 2,72; σ 2 = 0,187; σ = 0,433; V = 15,91 % |
a= 3,11; σ 2 = 0,324; σ = 0,569; V = 18,29 % |
0,39 |
14,33 |
|
10 |
a= 2,47; σ 2 = 0,027; σ = 0,166; V = 6,74 % |
a= 3,03; σ 2 = 0,216; σ = 0,465; V = 15,33 % |
0,56 |
22,67 |
|
16 |
a= 2,53; σ 2 = 0,051; σ = 0,226; V = 8,92 % |
a= 2,86; σ 2 = 0,139; σ = 0,373; V = 13,06 % |
0,33 |
13,04 |
|
14 |
a= 2,85; σ 2 = 0,128; σ = 0,358; V = 12,58 % |
a= 3,05; σ 2 = 0,237; σ = 0,486; V = 15,97 % |
0,2 |
7,01 |
|
Среднее значение |
0,39 |
14,87 |
||
Вводимый с профилактической целью парацетамол показал умеренную антиэкссудативную активность. Так, через 18 часов после введения альгогена обхват правой конечности увеличился на 119 %. Через 36 часов отечность уменьшается, на что указывает разность в обхвате лапок крыс данной группы, которая равняется 16,73 %. Лидерами среди препаратов сравнения являются ни-месулид и индометацин. Через 18 часов разность в обхвате конечностей составляла 12,94 и 15,25 %, а спустя 36 часов эксперимента после их разового введения – 12,54 и 12,05 %. Стоит отметить, что противовоспалительная активность индометацина спустя 36 часов увеличилась на 27 %.
Восемь новых 2-метил-6-[(2-оксо-2-{[замещенный арил]амино}этил)сульфанил]-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамидов 10–17 могут приводить в разной степени к уменьшению формалинового отека, проявляя тем самым антиэкссудативные свойства. При этом семь из восьми образцов, кроме 17 , были более эффективными на 18 и 36 часах эксперимента в сравнении с ацетилсалициловой кислотой. В результате внутригастрального введения за 1,5 часа производных дигидропиридина 10 и 13 до инъекции формалина установлено, что спустя 18 часов наблюдается уменьшение отечности конечности в сравнении с аналогичным показателем крыс контрольной группы на 38,83–44,71 %. Однако через 36 часов их активность снижается на 4,68–13,64 % соответственно.
Таблица 4 Изменение обхвата конечностей крыс после формалинового отека через 36 часов после индукции воспаления
|
Группа животных |
Обхват конечности, см |
Разность, δ |
||
|
левой |
правой |
см |
% |
|
|
Интактная |
a = 2,84; σ 2 = 0,0055; σ = 0,0744; V = 2,62% |
a= 2,85; σ 2 = 0,0085; σ = 0,0925; V = 3,25 % |
– |
– |
|
Контрольная (формалиновый отек) |
a = 2,65; σ 2 = 0,06; σ = 0,244; V = 9,24 % |
a= 4,07; σ 2 = 0,053; σ = 0,231; V = 5,68 % |
1,42 |
53,58 |
|
Препараты сравнения |
||||
|
Ацетилсалициловая кислота |
a = 2,45; σ 2 = 0,117; σ = 0,342; V = 13,97 % |
a= 2,94; σ 2 = 0,153; σ = 0,391; V = 12,95 % |
0,49 |
20,0 |
|
Индометацин |
a = 3,07; σ 2 = 0,053; σ = 0,231; V = 7,53 % |
a= 3,44; σ 2 = 0,039; σ = 0,199; V = 5,81 % |
0,37 |
12,05 |
|
Нимесулид |
a = 2,55; σ 2 = 0,122; σ = 0,35; V = 13,75 % |
a= 2,87; σ 2 = 0,093; σ = 0,305; V = 10,64 % |
0,32 |
12,54 |
|
Парацетамол |
a= 2,57; σ 2 = 0,093; σ = 0,305; V = 11,88 % |
a= 3,00; σ 2 = 0,014; σ = 0,119; V = 3,98 % |
0,43 |
16,73 |
|
Среднее значение |
0,40 |
15,33 |
||
|
Исследуемые синтезированные соединения |
||||
|
11 |
a = 2,92; σ 2 = 0,01; σ = 0,103; V = 3,54 % |
a= 3,03; σ 2 = 0,022; σ = 0,15; V = 4,96 % |
0,11 |
3,76 |
|
13 |
a = 2,62; σ 2 = 0,093; σ = 0,305; V = 11,65 % |
a= 3,21; σ 2 = 0,032; σ = 0,18; V = 5,63 % |
0,59 |
22,51 |
|
17 |
a = 2,58; σ 2 = 0,089; σ = 0,299; V = 11,58 % |
a= 3,28; σ 2 = 0,058; σ = 0,241; V = 7,35 % |
0,7 |
27,13 |
|
15 |
a = 3,01; σ 2 = 0,049; σ = 0,223; V = 7,41 % |
a= 3,57; σ 2 = 0,113; σ = 0,337; V = 9,43 % |
0,56 |
18,6 |
|
12 |
a = 2,72; σ 2 = 0,187; σ = 0,433; V = 15,91 % |
a= 3,02; σ 2 = 0,142; σ = 0,377; V = 12,46 % |
0,3 |
11,02 |
|
10 |
a= 2,47; σ 2 = 0,027; σ = 0,166; V = 6,74 % |
a= 2,95; σ 2 = 0,105; σ = 0,325; V = 11,02 % |
0,48 |
19,43 |
|
16 |
a = 2,53; σ 2 = 0,051; σ = 0,226;V = 8,92 % |
a= 2,8; σ 2 = 0,062; σ = 0,25; V = 8,95 % |
0,27 |
10,67 |
|
14 |
a = 2,85; σ 2 = 0,128; σ = 0,358; V = 12,58 % |
a= 3,18; σ 2 = 0,126; σ = 0,356; V = 11,18 % |
0,33 |
11,57 |
|
Среднее значение |
0,41 |
15,58 |
||
Антиэкссудативными свойствами также обладает соединение 15 . На 18-часовой отметке исследования разность в обхвате конечностей для этого образца составляет 11,96 %, однако на 36часовой отметке данный показатель увеличивается до 18,6 %, что отражает снижение противовоспалительной активности.
Схожие по активности с индометацином и нимесулидом антиэкссудативные свойства нами выявлены у новых 1,4-дигидропиридин-3-карбонитрилов 12 и 16 . Так, введенные внутригастрально в дозе 5 мг/кг веса крысы соединения 12 и 16 способствовали снижению разницы в обхвате конечностей крыс по сравнению с показателями контрольной группы на 47,17–58,46 % на 18-часовой срок эксперимента. Через 36 часов после начала проведения эксперимента наблюдается повышение эффективности данных образцов: соединение 12 эффективнее индометацина и нимесулида на 1,03 и 1,52 %, а дигидропиридин 16 на 1,38 и 1,87 % соответственно.
При сравнении полученных данных относительно образца 14 , выявлено, что спустя 18 часов соединение 14 эффективнее препаратов групп сравнения в 1,65–2,85 раза. Однако на 36-часовом интервале антиэкссудативная активность снижается в 1,48–1,12 раза в сравнении с ацетилсалициловой кислотой, парацетамолом и индометацином. Эффективность нимесулида на данном этапе выше, чем у 14 всего в 1,03 раза, поэтому можно судить о схожей противовоспалительной активности с данным препаратом.
Наилучший результат в нашем исследовании показал образец 11 . Его однократное введение через желудочный зонд привело к появлению разности в обхвате инъецированной и неинъециро-ванной лапок крыс через 18 часов всего на 6,84 %, что превосходит полученные данные по анти-экссудативной активности ацетилсалициловой кислоты в 3,39 раза, парацетамолу в 2,79 раза, индометацину в 2,23 раза и нимесулиду в 1,89 раза. Спустя 36 часов противовоспалительная эффективность образца 11 увеличивается в 3,2–5,32 раза в сравнении с препаратами референтных групп. Исходя из данных виртуального биоскрининга, наиболее вероятными потенциальными мишенями для всех новых производных 1,4-дигидропиридин-3-карбонитрила являются аденозиновые и каннабиноидные рецепторы, коагуляционный фактор Х, простаноидные рецепторы, циклооксигеназа-2 (ЦОГ-2).
Выводы
Таким образом, реакцией 6-метил-4-(2-фурил)-5-[(2,4-дихлорфенил)карбамоил]-3-циано-1,4-дигидропиридин-2-тиолата N-метилморфолиния с выходом 82 % с N-замещенными α-хлорацетамидами были синтезированы новые гибридные молекулы, сочетающие в своей структуре 2-фурильный и 1,4-дигидропиридин-3-карбонитрильный фрагменты. Полученные соединения имеют строение 2-метил-6-[(2-оксо-2-{[замещенный арил]амино}этил)сульфанил]-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамидов. Новые соединения идентифицированы методами ИК- и ЯМР-спектроскопии (включая методы двумерной ЯМР спектроскопии), а также элементного анализа. Исходя из результатов скрининговых исследований, проведенных нами in vivo для восьми новых производных 1,4-дигидропиридин-3-карбонитрила 10–17, установлено наличие максимально выраженной антиэкссудативной активности в дозе 5 мг/кг у четырех соединений (перечислены в порядке усиления биологической активности): 2-метил-6-[(2-оксо-2-{[3-(трифторметил)фенил]амино}этил)сульфанил]-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамида 12; 2-метил-6-({2-[фениламино]-2-оксоэтил}сульфанил)-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамида 16; 2-метил-6-({2-[(3-метилфенил)амино]-2-оксоэтил}сульфанил)-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамида 14; 2-метил-6-({2-[(3,5-диметилфенил)амино]-2- оксоэтил}сульфанил)-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамида 11.
Перспективами наших дальнейших исследований является реализация экспериментов по подтверждению антиэкссудативной и противовоспалительной активности других производных цианотиоацетамида, 1,4-дигидропиридин-3-карбонитрила и родственных гибридных молекул в других классических тестах, а также выявление антиноцицептивных свойств у соединений 10–17 , а также изучение их острой пероральной токсичности.
Исследование выполнено при финансовой поддержке Кубанского научного фонда в рамках научного проекта МФИ-20.1-26/20 (заявка № МФИ-20.1/45) .
Список литературы Cинтез, антиэкссудативные и противовоспалительные свойства замещенных 2-метил-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамидов
- Abdel-Galil F.M., Sherif S.M., Elnagdi M.H. // Heterocycles. 1986. V. 24, No. 7. P. 2023. DOI: 10.3987/R-1986-07-2023.
- Дяченко В.Д., Дяченко И.В., Ненайденко В.Г. // Успехи химии. 2018. Т. 87, № 9. С. 1. DOI: 10.1070/RCR4760?locatt=label:RUSSIAN.
- Литвинов В.П. // Успехи химии. 1999. Т. 68, № 9. С. 817; Litvinov V.P. // Russ. Chem. Rev. 1999. V. 68. No. 9. P. 737. DOI: 10.1070/RC1999v068n09ABEH000533.
- Магеррамов А.М., Шихалиев Н.Г., Дяченко В.Д. и др. α-Цианотиоацетамид. М.: Техносфера, 2018. 224 с.
- Litvinov V.P., Rodinovskaya L.A., Sharanin Yu.A. et al. // J. Sulfur Chem. 1992. V. 13, No. 1. P. 1. DOI: 10.1080/01961779208048951.
- Litvinov V.P. // Phosphorus, Sulfur, Silicon Relat. Elem. 1993. V. 74, No 1. P. 139. DOI: 10.1080/10426509308038105.
- Литвинов В.П. // Изв. АН. Сер. Хим. 1998. № 11. С. 2123; Litvinov V.P. // Russ. Chem. Bull. 1998. V. 47. No. 11. P. 2053. DOI: 10.1007/BF02494257.
- Литвинов В.П. // Успехи химии. 2006. Т. 75, № 7. С. 645; Litvinov V.P. // Russ. Chem. Rev. 2006. V. 75. No. 7. P. 577. DOI: 10.1070/RC2006v075n07ABEH003619.
- Литвинов В.П., Промоненков В.К., Шаранин Ю.А. и др. 3-Циано-2(1Н)-пиридинтионы и - селеноны. В кн. Итоги науки и техники. Серия Органическая химия / под ред. М.И. Кабачника. М.: ВИНИТИ, 1989. Т. 17. С. 72.
- El-Sayed H.A., Moustafa A.H., Said S.A. et al. // Synth. Commun. 2018. V. 48, No. 20. P. 2615. DOI: 10.1080/00397911.2018.1496262.
- Salem M.A., Helel M.H., Gouda M.A. et al. // Synth. Commun. 2018. V. 48, No. 4. P. 345. DOI: 10.1080/00397911.2017.1394468.
- Литвинов В.П., Кривоколыско С.Г., Дяченко В.Д. // ХГС. 1999. № 5. С. 579.
- Dotsenko V.V., Buryi D.S., Lukina D.Yu. et al. // Russ. Chem. Bull. 2020. V. 69, No. 10. P. 1829. DOI: 10.1007/s11172-020-2969-2.
- Dotsenko V.V., Krivokolysko S.G., Krivokolysko B.S. et al. // Russ. J. Gen. Chem. 2018. V. 88, No. 4. P. 682. DOI: 10.1134/S1070363218040114.
- Dotsenko V.V., Aksenov N.A., Aksenova I.V. // Russ. J. Gen. Chem. 2019. V. 89, No. 9. P. 1744. DOI: 10.1134/S1070363219090032.
- Buryi D.S., Dotsenko V.V., Aksenov N.A. et al. // Russ. J. Gen. Chem. 2019. V. 89, No. 8. P. 1575. DOI: 10.1134/S1070363219080061.
- Chigorina E.A., Bespalov A.V., Dotsenko V.V. // Russ. J. Gen. Chem. 2019. V. 89, N 10. P. 2018. DOI: 10.1134/S1070363219100062.
- Buryi D.S., Dotsenko V.V., Levashov A.S. et al. // Russ. J. Gen. Chem. 2019. V. 89, No. 5. P. 886. DOI: 10.1134/S1070363219050050.
- Dotsenko V.V., Buryi D.S., Lukina D.Yu. et al. // Monatsh. Chem. 2019. V. 150, No. 11. P. 1973. DOI: 10.1007/s00706-019-02505-4.
- Stroganova T.A., Vasilin V.K., Dotsenko V.V. et al. // Tetrahedron Lett. 2019. V. 60. P. 997. DOI: 10.1016/j.tetlet.2019.03.012.
- Dotsenko V.V., Muraviev V.S., Lukina D.Yu. et al. // Russ. J. Gen. Chem. 2020. V. 90, No. 6. P. 948. DOI: 10.1134/S1070363220060043.
- Kažoka H., Krauze A., Viļums M. et al. // Chem. Heterocycl. Compds. 2007. V. 43, No. 1. P. 50. DOI: 10.1007/s10593-007-0007-z.
- Kalashnik I.N., Dyachenko V.D. // Russ. J. Gen. Chem. 2020. V. 90, No. 3. P. 357. DOI: 10.1134/S1070363220030068.
- Dyachenko V.D., Matusov I.O., Dyachenko I.V. et al. // Russ. J. Org. Chem. 2018. V. 54, No. 12. P. 1777. DOI: 10.1134/S1070428018120060.
- Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. et al. // Chem. Heterocycl. Compds. 2007. V. 43, No. 5. P. 599. DOI: 10.1007/s10593-007-0094-x.
- Krauze A., Duburs G. // Chem. Heterocycl. Compds. 1996. V. 32, No. 8. P. 986. DOI: 10.1007/BF01176979.
- Dyachenko V.D. // Russ. J. Org. Chem. 2007. V. 43, No. 2. P. 271. DOI: 10.1134/S1070428007020194.
- Shestopalov A.M., Rodinovskaya L.A., Sharanin Yu.A. et al. // J. Gen. Chem. USSR. 1988. V. 58, No. 4. P. 745.
- Rodinovskaya L.A., Belukhina E.V., Shestopalov A.M. et al. // Russ. Chem. Bull. 1994. V. 43, No. 3. P. 449. DOI: 10.1007/BF01169725.
- Sharanin Yu.A., Goncharenko M.P., Shestopalov A.M. et al. // J. Org. Chem. USSR. 1991. V. 27, No. 9.2. P. 1767.
- Gewald K., Schäfer H., Schlegel U. // J. Prakt. Chem. 1976. V. 318, No. 5. P. 779. DOI: 10.1002/prac.19763180509.
- Krauze A.A., Bomika Z.A., Pelcher Y.É. et al. // Chem. Heterocycl. Compds. 1982. V. 18, No. 4. P. 385. DOI: 10.1007/BF00503559.
- Paronikyan E.G., Noravyan A.S., Dzhagatspanyan I.A. et al. // Pharm. Chem. J. 2002. V. 36, No. 9. P. 465. DOI: 10.1023/A:1021836504036.
- Moryashova S.I, Salamandra L.K., Fedorov A.E. et al. // Russ. Chem. Bull. 1998. V. 47, No. 2. P. 357. DOI: 10.1007/BF02498968.
- Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. // Russ. Chem. Bull. Int. Ed. 2012. V. 61, No. 1. P. 131. DOI: 10.1007/s11172-012-0018-5
- Frolov K.A., Dotsenko V.V., Krivokolysko S.G. et al. // Chem. Heterocycl. Compds. 2012. V. 48, No. 7. P. 1117. DOI: 10.1007/s10593-012-1109-9.
- Dotsenko V.V., Frolov K.A., Krivokolysko S.G. // Chem. Heterocycl. Compds. 2015. V. 51, No. 2. P. 109. DOI: 10.1007/s10593-015-1668-7.
- Dotsenko V.V., Frolov K.A., Chigorina E.A. et al. // Russ. Chem. Bull. 2019. V. 68, No. 4. P. 691. DOI: 10.1007/s11172-019-2476-5.
- Dotsenko V.V., Chigorina E.A., Papaianina E.S. et al. // Macroheterocycles. 2015. V. 8, No. 3. P. 310. DOI: 10.6060/mhc150870d.
- Krauze A.A., Odynets A.G., Verreva A.A. et al. // Pharm. Chem. J. 1991. V. 25, No. 7. P. 477. DOI: 10.1007/BF00772003.
- Osolodkin D.I., Kozlovskaya L.I., Dueva E.V. et al. // ACS Med. Chem. Lett. 2013. V. 4, No. 9. P. 869. DOI: 10.1021/ml400226s.
- Bibik E.Yu., Saphonova A.A., Yeryomin A.V. et al. // Res. Results Pharmacol. 2017. V. 3, No. 4. P. 20. DOI: 10.18413/2313-8971-2017-3-4-20-25.
- Bibik E.Yu., Yaroshevskaya O.G., Devdera A.V. et al. // Pharm. Chem. J. 2017. V. 51, No. 8. P. 648. DOI: 10.1007/s11094-017-1669-1.
- Бибик Е.Ю., Некраса И.А., Деменко А.В. и др. // Бюлл. Сиб. Мед. 2019. Т. 18, № 3, с. 21. DOI: 10.20538/1682-0363-2019-3-21-28.
- Rice W.G., Turpin J.A., Schaeffer C.A. et al. // J. Med. Chem. 1996. V. 39, No. 19. P. 3606. DOI: 10.1021/jm960375o.
- Norman D.D., Ibezim A., Scott W.E. et al. // Bioorg. Med. Chem. 2013. V. 21, No. 17. P. 5548. DOI: 10.1016/j.bmc.2013.05.061.
- Mullan M.J., Paris D., Bakshi P. Pat. WO2008070875 (2008). Avail. URL: https://worldwide.espacenet.com/.
- Bibik E.Yu., Kurbanov L.I., Grygoryan S.A. et al. // J. Siber. Med. Sci. 2021. V. 3. P. 45. DOI: 10.31549/2542-1174-2021-3-45-55.
- Кривоколыско Д.С., Доценко В.В., Бибик Е.Ю. и др. // ЖОХ. 2021. Т. 91, № 9. С. 1359. DOI: 10.31857/S0044460X21090079.
- Кривоколыско Д.С., Доценко В.В., Бибик Е.Ю. и др. // ЖОХ. 2022. Т. 92, № 1, С. 72. DOI: 10.31857/S0044460X22010097.
- Кривоколыско Д.С., Доценко В.В., Бибик Е.Ю. и др. // Биоорг. хим. 2022. Т. 48, № 4. С. 486. DOI: 10.31857/S0132342322030101.
- Ivasiv V., Albertini C., Gonçalves A.E. et al. // Curr. Top. Med. Chem. 2019. V. 19, No. 19. P. 1694–1711. DOI: 10.2174/1568026619666190619115735.
- Prasher P., Sharma M., Aljabali A.A.A. et al. // Drug Dev. Res. 2020. V. 81, No. 7. P. 837. DOI: 10.1002/ddr.21704.
- Auti P.S., George G., Paul A.T. // RSC Adv. 2020. V. 10, No. 68. P. 41353. DOI: 10.1039/d0ra06642g.
- Decker M. // Mini Rev. Med. Chem. 2007. V. 7, No. 3. P. 221. DOI: 10.2174/138955707780059817.
- Mishra S., Singh P. // Eur. J. Med. Chem. 2016. V. 124. P. 500. DOI: 10.1016/j.ejmech.2016.08.039.
- Oliveira R., Miranda D., Magalhães J. et al. // Bioorg. Med. Chem. 2015. V. 23, No. 16. P. 5120. DOI: 10.1016/j.bmc.2015.04.017.
- Anusionwu C.G., Aderibigbe B.A., Mbianda X.Y. // Mini Rev. Med. Chem. 2019. V. 19, No. 6. P. 450. DOI: 10.2174/1389557519666181210162003.
- Design of hybrid molecules for drug development. Decker M. (ed.). Amsterdam: Elsevier, 2017. 338 pp.
- Panda P., Chakroborty S. // ChemistrySelect. 2020. V. 5, No. 33. P. 10187. DOI: 10.1002/slct.202002790.
- Shiri P. // Mini Rev. Med. Chem. 2021. V. 21, No. 5. P. 536. DOI: 10.2174/1389557520666201027160436.
- Upadhyay H.C. // Curr. Top. Med. Chem. 2021. V. 21, No. 8. P. 737. DOI: 10.2174/1568026621666210303145759.
- Lukevits É, Demicheva L. // Chem. Heterocycl. Compds. 1993. V. 29, No. 3. P. 243. DOI: 10.1007/BF00531499.
- Alizadeh M., Jalal M., Khodaei Hamed A.S. et al. // J. Inflam. Res. 2020. V. 13. P. 451. DOI: 10.2147/JIR.S262132.
- Sander T. OSIRIS Property Explorer. Available URL: http://www.organicchemistry.org/prog/peo/. Idorsia Pharmaceuticals Ltd, Switzerland.
- Daina A., Michielin O., Zoete V. // Sci. Reports. 2017. V. 7. Article No. 42717. DOI: 10.1038/srep42717.
- Gfeller D., Grosdidier A., Wirth M. et al. // Nucl. acids Res. 2014. V. 42, No. W1. P. W32. DOI: https://doi.org/10.1093/nar/gku293.
- Cheng F., Li W., Zhou Y. et al. // J. Chem. Inf. Model. 2012. V. 52, No. 11. P. 3099. DOI: 10.1021/ci300367a.
- Dotsenko V.V., Krivokolysko S.G., Polovinko V.V. et al. // Chem. Heterocycl. Compds. 2012. V. 48. P. 309. DOI: 10.1007/s10593-012-0991-5.
- Наркевич А.Н., Виноградов К.А. // Социальные аспекты здоровья населения. 2019. Т. 65, № 6. С. 10. DOI: 10.21045/2071-5021-2019-65-6-10.
- Ассоциация ревматологов России, Российское общество по изучению боли, Российская гастроэнтерологическая ассоциация, Российское кардиологическое общество, Ассоциация травматологов-ортопедов России, Ассоциация междисциплинарной медицины, Российская ассоциация паллиативной медицины // Журнал неврологии и психиатрии им. С.С. Корсакова. 2015. Т. 115, № 4. С. 70. DOI: 10.17116/jnevro20151154170-82.
- Дядык А.И., Куглер Т.Е. // Consilium Medicum. 2017. Т. 19, № 12. С. 94–99. DOI: 10.26442/2075-1753_19.12.94-99.
- Лесная О.А., Русанова Е.И., Прокофьева Е.Б. и др. // Трудный пациент. 2019. Т. 17б № 10. С. 31. DOI: 10.24411/2074-1995-201910072.


