Цистатин С: взаимосвязь с некоторыми маркерами иммунитета, воспаления и его роль в прогрессировании диабетической ретинопатии у больных сахарным диабетом 2-го типа
Автор: Саклакова О. А., Фефелова Е. В., Максименя М. В., Терешков П. П., Караваева Т. М., Переломова А. А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.39, 2024 года.
Бесплатный доступ
Цель: изучить корреляции между уровнем цистатина C (Cys-C) и величинами маркеров иммунитета, воспаления, а также клиническими проявлениями диабетической ретинопатии (ДР) у пациентов с сахарным диабетом (СД) 2-го типа.Материал и методы. Сформированы 3 группы пациентов с СД 2-го типа и разными стадиями ДР (по 21 человеку в каждой): I группа - непролиферативная стадия ДР (НПДР), II - препролиферативная (ППДР), III - пролиферативная (ПДР). Группу сравнения составили больные СД 2-го типа без сосудистых осложнений. Клиническое исследование включало: визометрию, тонометрию, оценку критической частоты слияния мельканий, биомикроскопию переднего отдела глаза, офтальмоскопию, биомикроскопию и ультразвуковое исследование (УЗИ) сетчатки, хрусталика, стекловидного тела, фоторегистрацию глазного дна, оптическую когерентную томографию. В сыворотке крови определяли содержание Cys-C, растворимых форм молекул B7.2 (CD86), 4-1ВВ, CTLA-4, Tim-3, LAG-3, PD-1, PD-L1, Галактина-9, белков sICAM-1, SAA, NGAL, а также ферментов (МРО, ММР-2, ММР-9) методом иммуноферментного анализа (ИФА) (мультиплексный анализ).Результаты. По мере прогрессирования ДР уровень Cys-C нарастает относительно группы сравнения: при НПДР - на 94,1% (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Сахарный диабет, диабетическая ретинопатия, цистатин c, иммунитет, воспаление
Короткий адрес: https://sciup.org/149146304
IDR: 149146304 | УДК: 616.379-008.64-06:577.151.4 | DOI: 10.29001/2073-8552-2024-39-3-89-95
Текст научной статьи Цистатин С: взаимосвязь с некоторыми маркерами иммунитета, воспаления и его роль в прогрессировании диабетической ретинопатии у больных сахарным диабетом 2-го типа
Саклакова О.А., Фефелова Е.В., Максименя М.В., Терешков П.П., Караваева Т.М., Пе-реломова А.А. Цистатин С: взаимосвязь с некоторыми маркерами иммунитета, воспаления и его роль в прогрессировании диабетической ретинопатии у больных сахарным диабетом 2-го типа. Сибирский журнал клинической и экспериментальной медицины. 2024;39(3):89–95.
В 2019 г. сахарный диабет (СД) был выявлен почти у 463 млн человек во всем мире. Согласно оценкам экспертов, к 2030 г. это число достигнет 578 млн. Серьезным микрососудистым осложнением, возникающим при СД, является диабетическая ретинопатия (ДР), остающаяся основной причиной слепоты у взрослого населения [1, 2]. На фоне развития заболевания возникает значительное снижение социальной активности, поэтому потеря зрения пациентами воспринимается более катастрофично, чем другие хронические осложнения СД. ДР разделяют на три стадии, самой ранней из которых является непролифера- тивная (НПДР). Без эффективного лечения НПДР может достаточно быстро перерасти в последнюю – пролиферативную стадию (ПДР). Такие факторы, как гипертония, ожирение, гиперлипидемия и гипергликемия вызывают возникновение и прогрессирование ДР [2–5]. Однако не все молекулярные механизмы развития данной микроангиопатии изучены и сведены к общепринятой концепции, а роль многих молекул остается без внимания.
Цистатин С (Cys-C) относится к важным внеклеточным эндогенным ингибиторам цистеиновых протеаз. Он представляет собой негликозилированный основной белок с низкой молекулярной массой (13кДа), который состоит из цепочки 120 аминокислот и экспрессируется практически всеми клетками организма человека [6]. Имеются исследования, указывающие на то, что более высокие уровни Cys-C в сыворотке крови положительно коррелируют с развитием некоторых сосудистых осложнений у пациентов с СД 2-го типа при нормальной функции почек, в том числе у пациентов с ДР [5, 7]. Национальное исследование здоровья и питания (NHANES) показало, что Cys-C может быть лучшим предиктором ДР по сравнению с креатинином, что, вероятно, обусловлено участием данного белка в патогенетических механизмах развития ретинопатии, однако эти механизмы остаются не до конца понятыми [5].
Цель исследования: изучить корреляции между уровнем цистатина C (Cys-C) и величинами маркеров иммунитета, воспаления, а также клиническими проявлениями ДР у пациентов с СД 2-го типа.
Материал и методы
В ходе проведения офтальмологического обследования более 100 человек на кафедре офтальмологии ФГБОУ ВО ЧГМА и в офтальмологическом отделении ГУЗ ККБ г. Читы было сформировано 3 группы пациентов с СД 2-го типа и разными стадиями ДР: I группа – 21 человек с непролиферативной (НПДР) стадией заболевания, II группа – 21 пациент с препролиферативной стадией (ППДР), III группа – 21 человек с пролиферативной ДР (ПДР). Диагностику ДР проводили в соответствии с международной классификацией болезней 10-го пересмотра (МКБ-10. Класс VII. Болезни глаза и его придаточного аппарата H00-H59).
Поскольку проведенные нами биохимические исследования и данные научной литературы показали существенные различия между изучаемыми в этой работе показателями у здоровых лиц и пациентов с СД, в группу сравнения был включен 21 больной СД 2-го типа без сосудистых осложнений. Средний возраст обследуемых составил 47,3 года.
Клиническое исследование включало визометрию, тонометрию, оценку критической частоты слияния мельканий, биомикроскопию переднего отдела глаза, офтальмоскопию, биомикроскопию и ультразвуковое исследование сетчатки, хрусталика, стекловидного тела, фоторегистрацию глазного дна, оптическую когерентную томографию сетчатки глаза.
Выявленные нами офтальмологические изменения на глазном дне у обследуемых пациентов не отличались от уже известных.
У пациентов, страдающих СД без диабетических изменений глазного дна, максимальная корригированная острота зрения была не изменена, центральная толщина сетчатки находилась в пределах верхней границы нормы, наблюдалось снижение светочувствительности макулы.
У больных с НПДР выявлено наличие микроаневризм и микрогеморрагий, падение максимальной корригированной остроты зрения в среднем до 0,7; значительное снижение светочувствительности макулы и выход центральной толщины сетчатки за верхнюю границу нормы. У пациентов с ППДР в большинстве случаев диагностирован отек сетчатки в центре, наличие твердых и мягких экссудатов, с интраретинальными микроваскулярными аномалиями, ростом центральной толщины сетчатки до 400–500 мкм и более, значительно выраженным снижением светочувствительности макулы и максимально корригированной остроты зрения. У лиц с ПДР наблюдались признаки неоваскуляризации сетчатки и резкое ухудшение всех офтальмологических показателей.
Для объективизации процесса нами использовалась «Шкала оценки изменений глазного дна при офтальмоскопии на модели эксайтотоксического повреждения сетчатки (баллы)» [8].
Критериями исключения из исследования явились: тяжелые осложнения диабета, НЬА1с выше 12%, уровень артериального давления выше 160/100 мм рт. ст., симптоматическая артериальная гипертензия, острое нарушение мозгового кровообращения, сердечная недостаточность, нарушение прозрачности сред глаза, зрелая катаракта, другие заболевания сетчатки.
Группы были сопоставимы по возрасту, полу, социальному статусу. От всех участников исследования было получено добровольное информированное согласие на проводимое исследование. В работе соблюдались этические принципы, предъявляемые Хельсинкской декларацией Всемирной медицинской ассоциации (World Medical Association Declaration of Helsinki, 1964, 2013 – поправки).
У всех участников забирали кровь утром натощак, в сыворотке крови определяли содержание Cys-C и уровень ряда показателей иммунитета и воспаления: растворимых форм молекул B7.2 (CD86), 4-1ВВ, CTLA-4, Tim-3, LAG-3, PD-1, PD-L1, Галактина-9, белков sICAM-1, SAA, NGAL, а также ферментов (МРО, ММР-2, ММР-9) методом иммуноферментного анализа (ИФА), используя наборы для мультиплексного анализа Human Immune Checkpoint Panel 1 и Human Vascular Inflammation Panel 1 (Biolegend, США). Результаты оценивали с помощью проточного цитофлуориметра CytoFlex.
Статистический анализ полученных данных проводили с помощью пакета программ Jamovi 2.3. Перед началом анализа вариационные ряды тестировали на нормальность при помощи критерия Шапиро – Уилка. Учитывая распределение признаков, отличное от нормального, полученные количественные данные представлены медианой ( Ме ) и межквартильным интервалом ( Q1; Q3 ). Сравнение количественных показателей в трех независимых группах выполняли с применением критерия Краскела – Уоллиса. При наличии статистически значимых различий с учетом поправки Бонферрони проводили попарное сравнение показателя в группах с помощью критерия Двасса – Стила – Кричлоу – Флигнера. Для определения корреляционных связей между количественными показателями использовали коэффициент корреляции Спирмена (ρ) [9].
Результаты
Биохимические исследования показали, что уровень Cys-C в сыворотке крови у пациентов с ДР был повышен по сравнению с таковым у пациентов с СД. Медианные значения количества данного белка в группе лиц с СД составили 204 (175; 240) нг/мл, а в общей группе лиц с ДР на фоне СД – 726 (426; 819) нг/мл. По мере прогрессирования ДР уровень данного белка нарастал: при НПДР его медианные значения были выше, чем в группе сравнения на 94,1% ( р < 0,001), при ППДР – на 293,6% ( р < 0,001) и выше, чем в I группе на 102,8% ( р < 0,001). При пролиферативной стадии ретинопатии концентрация Cys-C была статистически значимо больше, чем в группе сравнения, и выше, чем при непролиферативной стадии и относительно II клинической группы (на 83,7%, р < 0,001) (табл. 1).
Таблица 1. Уровень Cystatin С, маркеров иммунитета и воспаления в сыворотке крови у пациентов с сахарным диабетом 2-го типа и различными стадиями диабетической ретинопатии ( Me ( Q 1; Q 3))
Table 1. Cystatin С levels, immune markers and changes in serum in patients with type 2 diabetes and various stages of diabetic retinopathy ( Me ( Q 1; Q 3))
|
Показатели / Группы |
Группа сравнения (СД 2-го типа), n = 20 |
НПДР I группа n = 20 |
ППДР II группа n = 20 |
ПДР III группа n = 21 |
p-value |
|
Cystatin C, нг/мл |
204 (175; 240) |
396* (336; 487) |
803* (777; 816) p 1< 0,001 |
1475* (1349; 1550) p 2< 0,001 p 3< 0,001 |
р < 0,001 |
|
PD-1, пг/мл |
14,7 (13,4; 15,1) |
30,4* (25,3; 35,2) |
24,0* (22,2; 28,3) |
23,1* (21,8; 25,4) |
р < 0,001 |
|
РD-L1, пг/мл |
18,0 (17,5; 19,0) |
24,3* (19,0; 29,2) |
22,4* (20,0; 31,3) |
30,9* (25,0; 50,3) |
p = 0,002 |
|
ICAM-1, нг/мл |
772 (705; 812) |
987* (831; 1377) |
1493* (1248; 1879) p 1 = 0,059 |
3036* (2047; 3824) p 2 = 0,009 p 3 = 0,049 |
р < 0,001 |
|
NGAL, нг/мл |
196 (162; 247) |
230 (176; 251) |
274 (223; 410) |
365* (321; 427) p 2 = 0,001 |
р < 0,001 |
|
МРО, нг/мл |
239 (191; 322) |
567* (519; 692) |
742* (670; 763) p 1 = 0,049 |
1047* (975; 1174) p 2 = 0,001 p 3 = 0,013 |
р < 0,001 |
|
ММР-9, нг/мл |
220 (170; 282) |
249 (219; 284) |
302* (301; 304) p 1 = 0,010 |
391* (343; 767) p 2 = 0,002 p 3 = 0,002 |
р < 0,001 |
Примечание: * – статистически значимые различия при попарном сравнении с III группой с помощью критерия Двасса – Стила – Кричлоу – Флигне-ра; р -value – уровень значимости различий Cystatin С между тремя группами по критерию Краскела – Уоллиса; p 1 – уровень значимости различий между НПДР и ПДР (I и III клинические группы); p 2 – уровень значимости различий между ППДР и ПДР (II и III клинические группы); p 3 – уровень значимости различий между ППДР и ПДР (I и II клинические группы).
Следует отметить, что по сравнению с пациентами, страдающими СД, у лиц с ДР в сыворотке крови возрастали концентрации растворимых форм коингибирующих молекул PD-1 и его рецептора PD-1L, значения белков NGAL, молекулы межклеточной адгезии 1 (ICAM-1)) и концентрации ферментов: матричной металлопротеиназы-9 (ММР-9) и миелопероксидазы (МПО) (см. табл. 1). Следует заметить, что с усугублением степени тяжести ДР увеличивался уровень ICAM-1, МПО и ММР-9.
С помощью непараметрического корреляционного анализа было установлено наличие умеренных прямых связей между значениями Cys-C, с одной стороны, и PD-1 (r = 0,38; р < 0,05), PD-L1 (r = 0,53; р = 0,001), с другой. Прямую сильную корреляционную связь с концентрациями Cys-C демонстрировали значения ICAM-1 (r = 0,742; р < 0,001), величины NGAL (r = 0,602; р < 0,001), ММР-9 (r = 0,734; р < 0,001), МРО (r = 0,663; р < 0,001) (рис. 1).
Кроме того, цифры Cys-C указывали на сильную прямую корреляционную связь со значениями шкалы глазного дна ( r = 0,927; р < 0,001).
Значения шкалы глазного дна представлены в таблице 2.
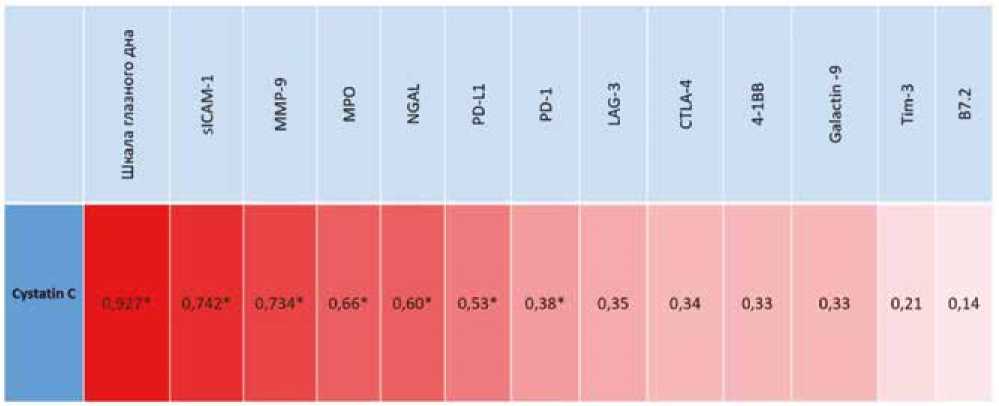
Рис. 1. Корреляции между величинами Cys-C и значениями маркеров иммунитета, воспаления: положительные корреляции показаны красным. Цифрами указаны коэффициент корреляции Спирмена. Значимые корреляции отмечены звездочкой ( p < 0,05)
Fig. 1. Correlations between Cys-C values and values of markers of immunity and inflammation: positive correlations are shown in red. Numbers indicate Spearman’s correlation coefficient. Significant correlations are denoted with a star ( p < 0,05)
Таблица 2. Значения шкалы глазного дна у пациентов с сахарным диабетом 2-го типа и различными стадиями диабетической ретинопатии, Me ( Q 1; Q 3)
Table 2. Fundus index values in patients with type 2 diabetes and various stages of diabetic retinopathy, Me ( Q 1; Q 3)
|
Показатели / Группы |
Группа сравнения (СД 2-го типа) n = 20 |
НПДР n = 20 |
ППДР n = 20 |
ПДР n = 21 |
p-value |
|
Шкала глазного дна (баллы) |
0 (0; 0) |
3* (2; 3) |
7* (7; 8) p 1< 0,001 |
9,5* (9; 10,3) p 2< 0,001 p 3< 0,001 |
р < 0,001 |
Примечание: * – статистически значимые различия при попарном сравнении с III группой с помощью критерия Двасса – Стила – Кричлоу Флигнера; р -value – уровень значимости различий Cystatin С между тремя группами по критерию Краскела Уоллиса; p 1 – уровень значимости различий между НПДР и ПДР (I и III клинические группы); p 2 – уровень значимости различий между ППДР и ПДР (II и III клинические группы); p 3 – уровень значимости различий между ППДР и ПДР (I и II клинические группы).
Обсуждение
Все молекулы, с которыми коррелировали значения Cys-C, являются участниками иммунных и / или воспалительных процессов.
Так, белок запрограммированной смерти PD-1 относится к коингибирующим рецепторам, который экспрессируется активированными T-клетками, B-клетками и клетками Natural Killer и участвует в поддержании иммунной толерантности. При связывании с лигандом PD-L1, экспрессируемым антигенпрезентирующими клетками, PD-1 подавляет пролиферацию Т-клеток, их выживаемость, синтез цитокинов и таким образом отвечает за предотвращение аутореактивных ответов Т-клеток. В то же время имеются данные, что Cys-C регулирует пролиферацию, дифференцировку и экспрессию костимулиру-ющих молекул Т-лимфоцитов прямо или косвенно [10]. В связи с этим обнаружение нами связи между цистатином и РD-1 является весьма интересным.
Протеин ICAM-1 регулирует образование контактов между клетками иммунной системы, обеспечивает прочную адгезию лейкоцитов к сосудистой стенке и миграции этих клеток в слой интимы в очаг воспаления. Однако есть данные, что растворимая форма молекулы межклеточной адгезии (sICAM-1), образующаяся вследствие протеолитического расщепления мембранной формы, способствует «отслойке» лейкоцитов от сосудистой стенки [11].
Липокалин, связанный с желатиназой нейтрофилов (NGAL), является белком, который секретируется в основном нейтрофилами, макрофагами и дендритными клетками. Однако его экспрессируют и эпителиальные клетки в ответ на воспаление, ишемию и неоплазию. Он участвует во врожденном иммунитете посредством антимикробного защитного механизма, секвестрируя бактериальные сидерофоры катехолатного типа и ограничивая рост бактерий [12]. Хотя секвестрация является основной бактериостатической функцией NGAL, он также участвует в активации и трансформации Т-клеток в сторону типа Th1 [13]. Установлено, что при дефиците NGAL нарушается хемотаксис, адгезия и миграция воспалительных клеток, в частности нейтрофилов [14].
Кроме того, показано, что NGAL принимает участие в регуляции метаболических процессов. Так, у детей с
СД уровень NGAL коррелирует с концентрацией гликированного гемоглобина и дислипидемией [12]. NGAL может связываться с proMMP-9 (которая как NGAL экспрессируется активированными эпителиальными и воспалительными клетками (моноцитами и нейтрофилами)) с образованием гетеродимера с дисульфидной связью массой 130 кДа. Комплексирование NGAL/proMMP-9 происходит внутри клетки, повышает активность MMP-9 и защищает ее от деградации [12].
Ферменты семейства MMP играют двойную роль в патогенезе воспаления, стимулируя защитные врожденные и / или адаптивные иммунные функции и в то же время разрушение тканей [15, 16].
В литературных источниках данные об изменениях МПО при ДР малочисленны, хотя сообщается о ее роли в патогенезе сердечно-сосудистых заболеваний [17], что подтверждает высокую повреждающую способность фермента. МПО выбрасывается нейтрофилами во внеклеточное пространство во время активации последних с целью инициации каскада иммунологических реакций. Повышенный уровень МПО в крови рассматривается как маркер воспалительного и окислительного стресса. С другой стороны, лизосомальный протеолиз, ингибитором которого является Cys-C, служит одним из механизмов защиты организма от накопления перекисно-модифицированных белков [18, 19].
Таким образом, значения всех изученных нами белков будут отражать как уровень воспаления, так и иммунного ответа при ретинопатии.
Cys-C, являясь ингибитором всех папаин-подобных протеаз, участвует в различных физиологических процессах, в том числе и в регуляции иммунного ответа за счет того, что может способствовать протеолитическому процессингу програнзимов и других субстратов в иммунных клетках, презентации антигена MHC-II, созреванию дендритных клеток, [19], экспрессии костимулирующих молекул [10].
В ходе корреляционного анализа нами выявлено множество связей между значениями Cys-C в крови и содержанием белков, участвующих в иммунитете и воспалении, а также значениями шкалы глазного дна, что свидетельствует о роли Cys-C в прогрессировании ДР.
Некоторые из корреляционных связей понятны и выглядят логично, для объяснения других требуется проведение дополнительных исследований, но, безусловно, все они помогут раскрыть роль Cys-C в развитии ДР.
Выводы
У пациентов с СД 2-го типа и ДР в сыворотке крови увеличивается количество Cys-C относительно пациентов с СД без микроангиопатии. В группах с усугублением степени тяжести офтальмопатии регистрируется рост концентрации Cys-C со статистически значимой разницей между группами.
В группах с ДР с усугублением степени тяжести повышается уровень молекулы межклеточной адгезии 1 (ICAM-1) и ферментов: матричной металлопротеиназы-9 (ММР-9) и МРО.
Установлены умеренные прямые корреляционные связи между количеством Cys-C, с одной стороны, и PD-1, PD-L1, а также заметные корреляционные связи с величинами ICAM-1, NGAL, ММР-9, МРО, с другой. Выявлена прямая заметная корреляционная связь между уровнем Cys-C и значениями шкалы глазного дна.
Список литературы Цистатин С: взаимосвязь с некоторыми маркерами иммунитета, воспаления и его роль в прогрессировании диабетической ретинопатии у больных сахарным диабетом 2-го типа
- Saeedi P., Petersohn I., Salpea P., Malanda B., Karuranga S., Unwin N. et al. IDF Diabetes Atlas Committee. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: Results from the International Diabetes Federation Diabetes Atlas, 9th edition. Diabetes Res. Clin. Pract. 2019;157:107843. DOI: 10.1016/j.diabres.2019.107843.
- Yang Q.H., Zhang Y., Zhang X.M., Li X.R. Prevalence of diabetic retinopathy, proliferative diabetic retinopathy and non-proliferative diabetic retinopathy in Asian T2DM patients: a systematic review and Meta-analysis. Int. J. Ophthalmol. 2019;12(2):302–311. DOI: 10.18240/ijo.2019.02.19.
- Chou Y., Ma J., Su X., Zhong Y. Emerging insights into the relationship between hyperlipidemia and the risk of diabetic retinopathy. Lipids Health Dis. 2020;19(1):241. DOI: 10.1186/s12944-020-01415-3.
- Zhu B.T. Biochemical mechanism underlying the pathogenesis of diabetic retinopathy and other diabetic complications in humans: the methanol- formaldehyde-formic acid hypothesis. Acta Biochim. Biophys. Sin. (Shanghai). 2022;54(4):415–451. DOI: 10.3724/abbs.2022012.
- Yang N., Lu Y.F., Yang X., Jiang K., Sang A.M., Wu H.Q. Association between cystatin C and diabetic retinopathy among type 2 diabetic patients in China: a Meta-analysis. Int. J. Ophthalmol. 2021;14(9):1430–1440. DOI: 10.18240/ijo.2021.09.21.
- Yuan H.Q., Miao J.X., Xu J.P., Zhu S.X., Xu F., Wang X.H. et al. Increased serum cystatin C levels and responses of pancreatic α- and β-cells in type 2 diabetes. Endocr. Connect. 2022;11(3):e210597. DOI: 10.1530/EC-21-0597.
- Gurudas S., Frudd K., Maheshwari J.J., Revathy Y.R., Sivaprasad S., Ramanathan S.M. et al. Multicenter evaluation of diagnostic circulating biomarkers to detect sight-threatening diabetic retinopathy. JAMA Ophthalmol. 2022;140(6):587–597. DOI: 10.1001/jamaophthalmol. 2022.1175.
- Соловьев Н.В. Возможность фармакологической коррекции, NMDA-индуцированной эксайтотоксичности сетчатки производными 3-гидроксипиридина. Современные технологии в офтальмологии. 2023;2:64. Soloviev N.V. Possibility of pharmacological correction of NMDA-induced excitotoxicity of 3-hydroxypyridine derivatives. Modern technologies in ophthalmology. 2023;2:64. (In Russ.). DOI: 10.25276/2312-4911-2023-2-64-70.
- Мудров В.А. Алгоритмы статистического анализа количественных признаков в биомедицинских исследованиях с помощью пакета программ SPSS. Забайкальский медицинский вестник. 2020;1:140–150. Mudrov V.A. Statistical analysis algorithms of quantitative features in biomedical researchusing the SPSS software package. The Transbaikal medical bulletin. 2020;1:140–150. (In Russ.). DOI: 10.52485/19986173_2020_1_140.
- Zi M., Xu Y. Involvement of cystatin C in immunity and apoptosis. Immunol. Lett. 2018;196:80–90. DOI: 10.1016/j.imlet.2018.01.006.
- Москалец О.В. Молекулы клеточной адгезии ICAM-1 и VCAM-1 при инфекционной патологии. Тихоокеанский медицинский журнал. 2018;2:21–25. Moskalets O.V. Molecules of cellular adhesion ICAM-1 and VCAM-1 in infectious pathology. Pacific Medical Journal. 2018;2:21–25. (In Russ.). DOI: 10.17238/PmJ1609-1175.2018.2.21-25.
- Romejko K., Markowska M., Niemczyk S. The review of current knowledge on Neutrophil Gelatinase-Associated Lipocalin (NGAL). Int. J. Mol. Sci. 2023;24:10470. DOI: 10.3390/ijms241310470.
- Floderer M., Prchal-Murphy M., Vizzardelli C. Dendritic cell-secreted lipocalin2 induces CD8+ T-cell apoptosis, contributes to T-cell priming and leads to a TH1 phenotype. PLoS One. 2014;9(7):e101881. DOI: 10.1371/journal.pone.0101881.
- Lu F., Inoue K., Kato J., Minamishima Sh., Morisaki H. Functions and regulation of lipocalin-2 in gut-origin sepsis: a narrative review. Crit. Care. 2019;23:269. DOI: 10.1186/s13054-019-2550-2.
- Kowluru R.A., Zhong Q., Santos J.M. Matrix metalloproteinases in diabetic retinopathy: potential role of MMP-9. Expert Opin. Investig. Drugs. 2012;21(6):797–805. DOI: 10.1517/13543784.2012.681043.
- Kim I.S., Yang W.S., Kim C.H. Physiological properties, functions, and trends in the matrix metalloproteinase inhibitors in inflammation-mediated human diseases. Curr. Med. Chem. 2023;30(18):2075–2112. DOI:10.2174/0929867329666220823112731.
- Kargapolova Y., Geißen S., Zheng R., Baldus S., Winkels H., Adam M. The enzymatic and non-enzymatic function of myeloperoxidase (MPO) in inflammatory communication. Antioxidants (Basel). 2021;10(4):562. DOI: 10.3390/antiox10040562.
- Shamsi A., Bano B. Journey of cystatins from being mere thiol protease inhibitors to at heart of many pathological conditions. Int. J. Biol. Macromol. 2017;102:674–693. DOI: 10.1016/j.ijbiomac.
- Perišić Nanut M., Pečar Fonović U., Jakoš T., Kos J. The role of cysteine peptidases in hematopoietic stem cell differentiation and modulation of immune system function. Front. Immunol. 2021;12:680279. DOI: 10.3389/fimmu.2021.680279.


