Цитофлуориметрическая оценка популяционного спектра иммунных клеток крови и слюны у здоровых молодых людей
Автор: Рахматулина Э.Х., Теплова С.Н., Коченгина С.А., Альтман Н.Д.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 6 (182), 2010 года.
Бесплатный доступ
Изучен популяционный состав иммуноцитов слюны на основе авторского метода цитофлуорометрического анализа клеток, экспрессирующих линейный дифференцировочный рецептор CD45+. Показаны принципиальная возможность применения данного метода для оценки мукозального иммунитета. Результаты цитофлуориметрического анализа состава иммуноцитов слюны предлагается использовать в качестве нормативных при изучении мукозального иммунитета у молодых лиц.
Мукозалъный иммунитет, спектр иммуноцитов слюны, цитофлуориметрический анализ
Короткий адрес: https://sciup.org/147152808
IDR: 147152808
Текст научной статьи Цитофлуориметрическая оценка популяционного спектра иммунных клеток крови и слюны у здоровых молодых людей
Введение. В настоящее время метод проточной цитофлуориметрии является общепринятым для определения популяционного и субпопуляционного спектра лимфоцитов крови. До сих пор этот метод не применялся для оценки спектра иммуноцитов слюны. Особенностью современных аппаратных методов иммунологического анализа является их высокая специфичность и чувствительность, возможность регистрации большого числа событий, что позволяет анализировать состав клеток при небольшом их количестве в единице объема изучаемой биологической жидкости [4].
Авторами данной публикации разработан метод определения спектра иммунных клеток слюны (номер патентной заявки 2008120724, приоритет от 23.05.08).
Целью настоящего исследования было цито-флуориметрическое определение популяционного спектра иммунных клеток крови и слюны у молодых лиц, проживающих на Южном Урале.
Материалы и методы исследования. Всего в исследование включено 42 здоровых человека в возрасте от 18 до 30 лет. Средний возраст обследуемых 20,5 года, женщин было 13 человек, мужчин 29. У 11 человек определяли популяционный спектр лимфоцитов крови. Мужчин в группе было 4 и женщин 7 человек, средний возраст составил 20 лет.
Критериями включения служили:
-
- постоянное проживание в регионе Южного Урала;
-
- возраст от 18 до 21 лет;
-
- отсутствие острых или обострений хронических заболеваний;
-
- отсутствие иммунопатологии;
-
- отсутствие заболеваний слизистой оболочки ротовой полости.
Критерий исключения:
-
- несанированные заболевания зубов.
Осмотр ротовой полости стоматологом проводился непосредственно перед взятием исследуемого материала. Слюну забирали у здоровых лиц в соответствии с критериями включения и исключения, принятыми в данной работе. Забор слюны проводили утром натощак, через 10 минут после полоскания ротовой полости водой в сухие пластиковые флаконы без стимуляции слюноотделения. Кровь для анализа популяционного состава лимфоцитов забирали из вены утром натощак.
Иммунологические методы исследования:
Определение спектра лимфоцитов крови проводили по стандартной методике на проточном цитофлуориметре BD FACSCanto II с набором моноклональных антител той же фирмы. Подготовка исследуемой слюны и определение клеточного состава иммуноцитов с помощью проточного цитофлуорометра «BD FACSCanto II» проводилось по методике, разработанной С.Н. Тепловой, С.А. Ко-ченгиной, Э.Х. Рахматуллиной и др. (2008). Характерной чертой клеточного состава слюны является присутствие в ней не только иммунных клеток, но и эпителиоцитов. Для отличия иммунных клеток от эпителиоцитов использовали линейный дифференцировочный CD45+ маркер. Другой особенностью клеточного состава слюны является присутствие в ней большого числа нежизнеспособных клеток и клеточного детрита, что требует специальной подготовки проб с помощью отмывочной технологии с использованием специальной среды (RPMI с бикарбонатом).
Определение популяционного спектра жизнеспособных иммуноцитов в слюне, экспрессирующих линейный CD45+ мембранный антиген, проводили на проточном цитофлуориметре BD FACSCanto IL Для оценки жизнеспособности клеток использовали витальный краситель 7-AAD. Для анализа CD-маркеров применяли моноклональные антитела фирмы Becton Dickinson, серии MultiTest с использованием четырех меток следующими флуоресцентными красителями: Fluorescein izotyocyanat (FITC), Phycoerytrin (PE), Perpidin chlorofhyll protein (PerCP), Allophycocyanin (APC). Использовался оптимизированный лизирующий раствор той же фирмы в рабочем разведении. Во всех случаях проводилась постановка негативного изотипического контроля [6].
Число жизнеспособных клеток, экспрессирующих общелейкоцитарный линейно-ассоциированный дифференцировочный антиген CD45+, определяли с помощью метки CD45APC и красителя 7-AAD. Среди популяций иммуноцитов подсчитывали: гранулоциты (CD45+CD13+CD143, моноциты (CD45+ CD14+ CD 133, Т-цитотоксические лимфоциты (CD45+CD3+CD83, Т-хелперы (CD45+CD33, NK-клетки (CD45+CD 5б+ 1бЗ [5].
Статистическая обработка проведена применением программного комплекса Statistica for Windows версия 6.0 фирмы StatSoft Inc. (США). В таблицах представлены данные в виде средней арифметической (М), доверительного интервала (195) универсальной средней - медианы (Me) и межквартильного интервала (Q25-Q75).
Результаты и обсуждение. Полученные результаты определения основных популяций лимфоцитов крови у обследуемых здоровых молодых лиц, проживающих на Южном Урале, представлены в табл. 1, в которой приведены общее число наблюдений (п), средняя арифметическая (М) и ний этих показателей во всех случаях перекрывают друг друга [1].
Нами впервые разработан и использован метод цитофлуориметрической оценки иммуноцитов слюны.
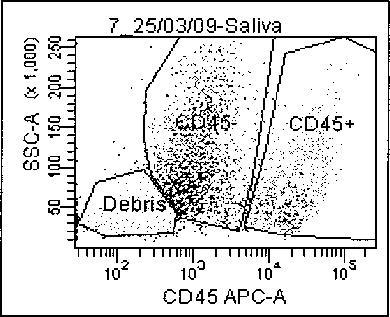
Клеточный состав слюны: иммуноциты (СО45+), эпителиальные и другие клетки (CD453, клеточный детрит (дебрис)
Рисунок демонстрирует результат цитофлуо-риметрического определения всей совокупности клеток слюны. Как следует из рисунка, в ротовой полости обнаруживаются в максимальном количестве CD45" клетки, к которым относятся в основном эпителиоциты. В большом количестве в слюне представлены клетки, экспрессирующие линейный дифференцировочный маркер CD45+, включающие все иммуноциты: гранулоциты, макрофаги, популяции лимфоцитов. Достаточно большую область на графике занимает клеточный дебрис, т.е. фрагменты разрушенных клеток ротовой полости.
. Таблица 1
Результаты цитофлюориметричекого определения спектра лимфоцитов крови у молодых людей, проживающих на Урале
Далее для сопоставления полученных данных с результатами других авторов в табл. 2 приведены материалы цитофлюориметрического определения спектра лимфоцитов крови, опубликованные разными исследователями из разных регионов, вместе с полученными нами показателями.
Как следует из табл. 2, процентное содержание основных популяций лимфоцитов крови (CD3, CD4, CD8, CD19, CD16/56) при цитофлуоримет-рическом определении, по данным разных лабораторий, практически совпадает, интервалы колеба-
Далее в слюне было определено число жизнеспособных CD45+ клеток (табл. 3) с помощью красителя 7-AAD.
Средние показатели численности популяций жизнеспособных иммуноцитов в слюне (средняя арифметическая и интервал достоверности, а также медиана и квартильный размах), у 42 молодых людей, которые были определены с помощью проточной цитофлуориметрии, приведены в табл. 3. Среди жизнеспособных CD45+ клеток преобладающими в слюне здоровых молодых людей были популяции лейкоцитов, экспрессирующих маркеры гранулоцитов (CD45+CD13+), количество кото-
Проблемы здравоохранения
Таблица 2 Сопоставление результатов цитофлюориметричекого определения спектра иммунных клеток крови у молодых людей Южно-Уральского региона с результатами других исследователей
Распределение субпопуляций лимфоцитов оценивалось в пределах общей популяции жизнеспособных лимфоцитов, число которых принималось за 100 %. Оказалось, что доля Т - лимфоцитов (CD45+ CD34) в слюне составила 19,5 %, Т хелперов (CD45+CD4+) - 19,7 %, Т цитотоксических клеток (CD45+CD84) - 0,65 %. Соотношение Т - хелперов и Т - цитотоксических клеток было равным 30,3. Число В-лимфоцитов (CD45+CD19+) равным 2,01 % [3].
В целом, общая закономерность распределения лимфоцитов в слюне напоминает распределение соответствующих субпопуляций в крови: максимально в изучаемой биологической жидкости представлены Т лимфоциты, из них Т хелперы и в меньшей степени Т цитотоксические клетки и В лимфоциты. Особенностью популяционного состава лимфоцитов слюны является более низкое содержание Т клеток и Т хелперов, чем в крови, очень низкое количество Т цитотоксических лимфоцитов и соответственно высокий иммунорегу-ляторный индекс - соотношение CD4/CD8 клеток, достигающий 30,3.
Таким образом, в настоящее время в иммунологии стандартным методом оценки системного
Таблица 3
Спектр иммунных клеток слюны у молодых людей, проживающих на Южном Урале (п = 42)
Список литературы Цитофлуориметрическая оценка популяционного спектра иммунных клеток крови и слюны у здоровых молодых людей
- Зуева, Е.Е. Иммунофенотипирование в диагностике острых лейкозов/Е.Е. Зуева//Российский медицинский журнал. -2003. -Т. 4. -С. 471-478.
- Луговская, С.А. Иммунофенотипирование в диагностике гемобластозов/С.А. Луговская, М.Е. Почтарь, Н.Н. Тупицин. -М., 2005.
- Симонова, А.В. Фенотип лимфоцитов крови при воспалительных заболеваниях человека/А.В. Симонова. -М.: ИНТО, 2001.
- Чередеев, А.Н. CD-маркеры в практике клинико-диагностических лабораторий/А.Н. Чередеев, Н.К. Горлина, И.Г. Козлов//Клиническая лабораторная диагностика. -1999. -№ 6. -С. 25-31.
- Flow cytometry analysis of OKT4 epitope deficiency in South African children/E.J. Hughes, E.A. Goddard, P. Bouic, D. W. Beatty//Clin Exp Immunology. -1994. -№98 (3). -P. 526.
- Immunobiology, 6-th edition//Garland Science. -New York and London, 2005.
- Analysis of recently activated, memory and naive lymphocyte T subsets in the peripheral blood of patients with Graves' disease and insulin-dependent diabetes mellitus/A. Kretowski, J. Mysliwiec, D. Turowski, I. Kinalska//Rocz Akad Med Bialymst. -1999. -V. 44.-P. 226-234.
- Laurence, J. T-Cell subsets in Health, Infectious Disease, and Idiopathic CD 4+ T Lymphocytopenia/J. Laurence//Annals of Internal Medicine. -1993. -V. 119 (1). -P. 55-62.
- Lymphocyte subset reference ranges in adult Caucasians/T. Reichert, M. De Bruyere, V. Deneys et al.//Clin Immunol Immunolpathoi. -1991. -V. 60. -P. 190-208.


