Цитогенетические эффекты водорастворимой формы гиперицина у дефицитных по антиоксидантной защите особей Drosophila melanogaster
Автор: Юшкова Елена Александровна, Зайнуллин Владимир Габдуллович, Пунегов Василий Владимирович, Зайнуллин Г.Г.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии и биологии
Статья в выпуске: 3-1 т.15, 2013 года.
Бесплатный доступ
Оценено влияние водорастворимой формы гиперицина в разных концентрациях на частоту повреждений ДНК в нейробластах sod мутантных особей Drosophila melanogaster, имеющих нарушения в антиоксидантной защите (по Cu/ZnSod, MnSod изоферментам), и дрозофил дикого типа Canton-S с учетом его световой и темновой активации. Введение в питательную среду гиперицина приводит к повышению в нейробластах личинок уровня повреждений ДНК. Генотоксические эффекты при световой активации гиперицина наиболее выражены у Sod -мутантов. Для особей нормального фенотипа выявлена доза гиперицина (1 мкМ), при которой частота разрывов ДНК ниже контроля. Установлена существенная зависимость биологической эффективности гидрофильного гиперицина от его концентрации, генотипа животных и условий освещения. Предполагается, что исследуемая форма гиперицина может проявлять антиоксидантное действие преимущественно через MnSod-активацию.
Водорастворимая форма гиперицина, повреждения днк, антиоксидантная защита, дрозофила
Короткий адрес: https://sciup.org/148201819
IDR: 148201819 | УДК: 575.167:57.04/57.017.3
Текст научной статьи Цитогенетические эффекты водорастворимой формы гиперицина у дефицитных по антиоксидантной защите особей Drosophila melanogaster
В последнее время ведется активный поиск новых эффективных фармакологических средств, способных повышать общую резистентность организма. Важную роль в этом играет применение различных препаратов из природного растительного сырья, способных включаться в клеточный гомеостаз и обладающих, как правило, низкой токсичностью. Экспериментально наиболее изученным в качестве фотосенсибилизатора [2], антидепрессанта [7], а также агента антимикробной защиты [10] является гиперицин – природный нафтодиантроновый пигмент, содержащийся в зверобое (сем. Hypericaceae Juss.).
Применяемый сегодня гиперицин практически не растворим в водных средах, поэтому эффективность его использования, например в противоопухолевой терапии, наблюдается только совместно с токсичными растворителями (диметилсульфоксида, N-метил-пирролидона), необходимыми для "доставки" указанного пигмента в опухолевую ткань [13]. В других клинических исследованиях он применяется в составе водно-масляных эмульсий. В таком виде гиперицин не стабилен и при введении в организм животного из-за фотосенсибилизации может привести к омертвлению тканей (некрозу), сопровождающееся интенсивным воспалительным процессом, или к летальному исходу.
В данном сообщении рассмотрено повреждающее ДНК действие химически чистого натив-
ного препарата гиперицина, полученного методом флешхромотографии, в соматических клетках дрозофилы. За счет модификации гиперицина на наночастицах достигается его растворимость и равномерное распределение в жидких средах организма, что может существенно изменить биологическую эффективность вещества и найти более широкое применение его в практике. Отметим, что ранее цитогенетические эффекты гиперицина не изучались. Более того, использование в тестировании модифицированного гиперицина разных генотипов дрозофилы, в частности с нарушениями в системе антиоксидантной защиты, позволит оценить механизмы, обусловливающие его эффект.
Цель работы — оценить действие гиперицина на уровень образования повреждений ДНК в клетках особей Drosophila melanogaster , имеющих дефекты в антиоксидантной системе защиты.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использовали нейробласты (клетки нервных ганглиев) личинок дрозофил дикого типа Сanton-S и линий ( Sodn1/+ с генотипом Sod[n1]red[1]/TM3,Sb[1]Ser[1] ) и sod2Delta02/+ с генотипом y[1]w[*]; Sod2[Delta02]/CyO ) с мутациями генов цитоплазматической ( Cu/ZnSod ) и митохондриальной ( MnSod ) супероксиддисмутазы, участвующей в детоксикации свободных радикалов [9, 12]. Данные линии получены из дрозофилиной коллекции Центра в Блумингтоне (Университет штата Индиана, Блумингтон, США).
Питательную сахаро-агаровую дрожжевую среду обрабатывали экспериментальным образцом гиперицина (водорастворимая форма) разной концентрации (1, 10, 20 и 100 мкМ), на которую помещали родительские формы исследуемых линий дрозофилы для получения кладок. Обработку гиперицином проводили на протяжении всего развития дрозофил, от стадии яйца до личинки третьего возраста (общее время экспозиции для всех концентраций составило 5 суток). Контрольные варианты содержали на среде без добавления препарата. Новый экспериментальный образец гиперицина, выделенный из надземной массы зверобоя продырявленного (Hipericum perforatum L.), был модифицирован в гидрофильную форму путем иммобилизации его на наночастицах неорганической матрицы в Институте химии Коми НЦ УрО РАН.
Известно, что гиперицин может обладать фотосенсибилизирующим действием [11]. В этой связи эксперимент был запланирован с учетом световой и темновой активации препарата. Исследуемые генотипы дрозофилы, в состав диеты которых входил гиперицин, содержали в разных условия освещения (при периодичности 12:12 ч, круглосуточном воздействии и в темноте). Интенсивность от лампы дневного света, измеряемая прибором «Lux light meter» DVM 1300 (Velleman, China), составила 70 лк.
Оценку повреждений ДНК в нейробластах, полученных из нервных ганглиев личинок дрозофил, проводили по методу «ДНК-комет» в нейтральных условиях электрофореза [1, 4]. Клеточную суспензию (10 мкл) смешивали с 0.5% легкоплавкой агарозой (100 мкл) и наносили на предметные стекла, предварительно покрытые слоем 1% нормальной агарозой, накрывали покровным стеклом и выдерживали при температуре 4.0 ± 0.1 оС в течение 20 мин. Стекла помещали в холодный лизирующий раствор (2.5 M NaCl, 10 мM Na 2 EDTA, 10 мM Tris-HCl, 1% Triton X-100, pH 10.0) на 2 ч. По окончании лизиса препараты переносили в камеру для электрофореза с охлажденным нейтральным буфером (10 мM Trizma-Base, 0.9 М борная кислота, 20 мM Na 2 EDTA, рН 8.2) на 20 мин. Электрофорез проводили в течение 20 мин при напряженности поля 0.7 В/см и силе тока 30 мА. После электрофореза стекла фиксировали в 70% этаноле в течение 15 мин.
Фиксированные препараты окрашивали флуоресцентным красителем SYBR Green (“ДНК-синтез”, 0.2 мкл/мл в ТЕ-буфере, рН=7.5). Окрашенные препараты были проанализированы с помощью флуоресцентного микроскопа “Infiniti XS-148 FS”. Обработку изображения «комет» вели с помощью специальной программы CometScoreТМ (версия 1.5, TriTek Corp.). Степень фрагментации ДНК оценивали по показателю момент «хвоста кометы» по П.Л. Оливе (ОТМ, Olive tail moment), равный произведению процентного содержания ДНК в «хвосте» на расстояние между центром ядра и центром флуоресцирующего «хвоста кометы» в условных единицах [8]. Эксперимент проводили в пяти повторно- стях, всего было просчитано 500 клеток на вариант. Статистический анализ результатов проводили по t-критерию Стьюдента.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Согласно предварительным результатам оценки выживаемости имаго дрозофилы были определены минимальные и медианные действующие концентрации модифицированного гиперицина и они составили 1-5 и 10-20 мкМ, соответственно (данные не приведены).
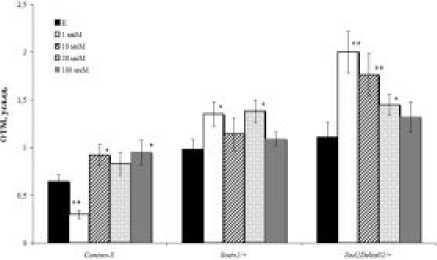
Рисунок 1. Уровень повреждений ДНК в нейробластах дрозофилы в контроле и после воздействия гиперицина в разных концентрациях. Примечание: *р < 0.05, ** р < 0.001 по сравнению с контролем (К).
В ответ на действие гиперицина обнаружена высокая вариабельность частоты повреждений ДНК, обусловленная генотипическими различиями и дозой тестируемого вещества. Показано (Рис. 1), что в условиях стандартного освещения (12:12 ч) относительно мутантных линий Sod особи дикого типа Сanton-S оказались наименее чувствительными к воздействию препарата, значения ОТМ которой в зависимости от концентрации варьировали в пределах от 0.30 до 0.95. Действительно, спонтанные уровни нарушений ДНК у мутантных линий выше, чем у особей дикого типа Сanton-S [15] . Для особей данной линии выявлена концентрация (1 мкМ) вещества, при которой частота повреждений ДНК достоверно ниже контроля, что позволяет предположить, что в физиологически значимых дозах действие гиперицина приводит к снижению уровня повреждений ДНК, вероятно в результате индукции процессов восстановления. Об этом свидетельствуют данные по частотам нарушений ДНК у мутантных линий, в клетках которых образование разрывов ДНК было выше при всех вариантах обработки, и тот факт, что при введении в диету линии Сanton-S препарата в бóльших концентрациях наблюдали значимое увеличение количества поврежденных клеток, т.е. обнаруживали токсический эффект.
Поскольку точный механизм действия гиперицина не известен, было проведено тестирование препарата с использованием генотипов, имеющих нарушения в системе антиоксидантной защиты
(Рис. 1). Выраженный генотоксический эффект гиперицина, в отличие от Sodn1/+ мутантов, был зарегистрирован у дефицитной по гену митохондриальной супероксиддисмутазы (MnSod) линии SodDelta02/+. При этом с повышением концентрации вещества частота фрагментации ДНК падала, что свидетельствует об ослаблении действия мутации после введения в диету животных препарата в концентрациях выше медианных. По-видимому, гидрофильная форма гиперицина способна проявлять антиоксидантные свойства в случае, когда уровень активности природных ан- тиоксидантов (Cu/ZnSod и MnSod) достаточно низкий. Из этого следует, что влияя на интенсивность свободнорадикальных процессов, он защищает клетки от гибели. В то время как в клетках, претерпевающих неопластическую трансформацию, гиперицин может действовать через каспаз-зависимый апоптоз [3]. Более того, гиперицин может выступать мощным внутриклеточным катализатором, возбуждение которого приводит к выходу цитохрома с из митохондрий и активации апоптосомы [14].
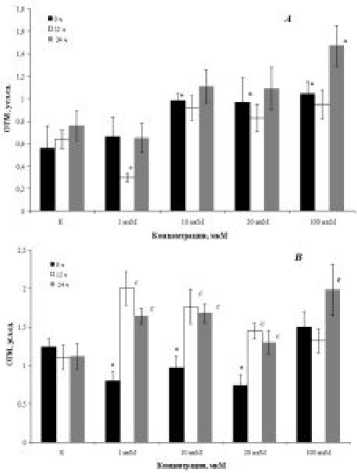
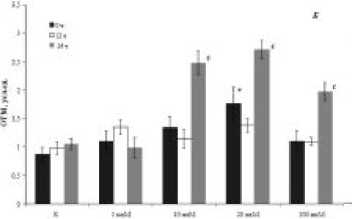
Рисунок 2. Уровень фрагментации ДНК в клетках дрозофил дикого типа (А), Sodn1/+ (Б) и SodDelta02/+ (В) мутантов, развивающихся в разных условиях освещения, после воздействия гиперицина. Примечание: различия статистически значимы при ар < 0.05, вр < 0.01, cр < 0.001 - между вариантами (0 ч, 12 ч и 24 ч); *р < 0.05 – по сравнению с интактным вариантом при темновой активации гиперицина.
Используемые современные гиперицинсодержащие препараты чрезвычайно токсичны и могут привести к разрушению не только опухолевых, но и здоровых тканей вследствие высокой фотосенсибилизации пигмента. Это послужило основанием провести оценку фотосенсибилизирующего действия исследуемого экспериментального образца гиперицина (Рис. 2А-В). Как показано на рис. 2А, у линии дикого типа Сanton-S не выявлены достоверные отличия между гипе-рицин-индуцированными эффектами при различных режимах освещения. Однако в зависимости от концентрации вещества обнаружена минимальная (при добавлении в диету 1 мкМ) и максимальная (при добавлении в диету 100 мкМ) световая токсичность водорастворимой формы гиперицина. В первом случае значения ОТМ составили 0.3 ± 0.04, во втором – 1.47 ± 0.18, соответственно. При этом токсичность препарата была усилена в условиях круглосуточного освеще- ния.
У Sod-мутантов с нарушением детоксикации свободных радикалов биологическая эффективность гиперицина значимо зависела от условий освещенности (Рис. 2Б, В). Дрозофилы, имеющие мутацию гена Cu/Zn-цитоплазматической супер-оксиддисмутазы и содержащиеся в условиях круглосуточного освещения, обладали высокой чувствительностью к действию вещества в концентрациях выше 1 мкМ (Рис. 2Б). Более выраженные цитотоксические эффекты при световой активации исследуемого образца гиперицина наблюдали в соматических клетках мутантных по гену Mn-митохондриальной супероксиддисмута-зы особей SodDelta02/+, у которых образование количества ДНК-разрывов было повышенно уже при минимальной его концентрации в 1 мкМ (Рис. 2В). Следует отметить, что для особей данного генотипа гиперицин может оказывать положительное действие в низких и средних концентрациях, снижая уровень фрагментации ДНК в клетках, но только при его темновой активации. Об этом свидетельствуют значения ОТМ, которые достоверно ниже контрольного уровня (1.24 ± 0.11) примерно в 1.5 раза и в зависимости от концентрации составляют 0.80 ± 0.12 (1 мкМ), 0.90 ± 0.13 (10 мкМ), 0.74 ± 0.11 (20 мкМ), соответственно.
Таким образом, в проведенном исследовании обнаружены принципиально новые особенности действия водорастворимой формы гиперицина. Наряду с цитогенетическим эффектом, гиперицин в зависимости от концентрации обладает антиоксидантной активностью у животных с генетиче- ски детерминированным снижением антиоксидантной защиты. При этом его антиоксидантное действие проявляется преимущественно через MnSod-активацию. У особей нормального генотипа добавление в диету 1 мкМ раствора гиперицина приводит к снижению частоты фрагментации ДНК. Максимальная генотоксичность препарата выявлена для клеток Sod-мутантов при его световой активации.
Полученные результаты позволяют говорить о высокой биологической эффективности водорастворимой формы гиперицина.
Работа выполнена при финансовой поддержке Программы Президиума РАН, проект № 12-П-34-2009.
Список литературы Цитогенетические эффекты водорастворимой формы гиперицина у дефицитных по антиоксидантной защите особей Drosophila melanogaster
- Зайнуллин В.Г. Радиационно-индуцированное изменение уровня двуцепочечных разрывов ДНК в нейробластах личинок и частоты летальных мутаций в половых клетках самцов Drosophila melanogaster/В.Г. Зайнуллин, Е.А. Юшкова, Д.В. Гурьев//Радиац. биол. Радиоэкология. 2010. Т. 50, № 5. С. 523-527.
- Agostinis P. Hypericin in cancer treatment: more light on the way/P. Agostinis, A. Vantieghem, W. Merlevede, P.A.de Witte//Int. J. Biochim. Cell Biol. 2002. Vol. 34, № 3. P. 221-241.
- Ali S.M. Induction of apoptosis by hypericin through activation of caspase-3 in human carcinoma cells/S.M. Ali, M. Olivo, G.Y. Yuen, S.K. Chee//Int. J. Mol. Med. 2001. Vol. 8. P. 521-530.
- Bilbao С. Influence of mus201 and mus308 mutations of Drosophila melanogaster on the genotoxicity of model chemicals in somatic cells in vivo measured with the Comet assay/С. Bilbao, J.A. Ferreiro, M.A. Comendador, L.M. Sierra//Mutat. Res. 2002. Vol. 503, № 1. P. 11-19.
- International Human Genome Sequencing Consortium: Initial sequencing and analysis of the human genome//Nature. 2001. Vol. 409, № 6822. Р. 860-921.
- Martínez-Poveda B. Hipericin in the dark inhibits key steps of angiogenesis in vitro/B. Martínez-Poveda, A.R. Quesada, M.A. Medina//Eur. J. Pharmacol., 2005. Vol. 5, № 16. Р. 97-103.
- Mennini T. The antidepressant mechanism of Hipericum perforatum/T. Mennini, M. Gobbi//Life Sci. 2004. Vol. 75, № 9. P. 1021-1027.
- Olive P.L. Factors influence DNA migration from individual cells subjected to gel electrophoresis/P.L. Olive, D. Wlodek, R.E. Durand, J.P. Banath//Exp. Cell. Res. 1992. Vol. 198. P. 259-260.
- Phillips J.P. Drosophila copper/zinc superoxide dismutase: Neuropathology and a model of dimer disequilibrium/J.P. Phillips, J.A. Tainer, E.D. Getzoff, G.L. Boulianne, K. Kirby, A.J. Hilliker//Proc. Natl. Acad. Sci. USA. 1995. Vol. 92, № 9. P. 8574-8578.
- Saddiqe Z. A review of the antibacterial activity of Hipericum perforatum L./Z. Saddiqe, I. Naeem, A. Maimoona//J. Ethnopharmacol. 2010. Vol. 131, № 3. Р. 511-521.
- Schulz H.U. Investigation of the effect on photosensitivity following multiple oral dosing of two different Hypericum extracts in healthy men/H.U. Schulz, M. Schürer, D. Bässler, D. Weiser//Arzneimittelforschung. 2006a. Vol. 56. Р. 212-221.
- Sun J. Induced overexpression of mitochondrial Mn-superoxide dismutase extends the life span of adult Drosophila melanogaster/J. Sun, D. Folk, T.J. Bradley, J. Tower//Genetics. 2002. Vol. 161, № 2. Р. 661-672.
- Thong P.S. Hypericin-photodynamic therapy (PDT) using an alternative treatment regime suitable for multi-fraction PDT/P.S. Thong, F. Watt, M.Q. Ren, P.H. Tan, K.C. Soo, M. Olivo//J. Photochem. Photobiol. 2006. Vol. 82. P. 1-8.
- Vantieghem A. Phosphorylation of Bcl-2 in G2/M phase-arrested cells following photodynamic therapy with hypericin involves a CDK1-mediated signal and delays the onset of apoptosis/A. Vantieghem, Y. Xu, Z. Assefa, J. Piette, J.R. Vandenheede, W. Merlevede, P.A. de Witte, P. Agostinis//J. Biol. Chem. 2002 Vol. 277, № 40. Р. 37718-37731.
- Woodruff R.C. Increased spontaneous DNA damage in Cu/Zn superoxide dismutase (SOD1) deficient Drosophila/R.C. Woodruff, J.P. Phillips, A.J. Hilliker//Genome. 2004. Vol. 47. P. 1029-1035.


