Цитогенетический статус кобыл (Equus caballus) украинской верховой породы в связи с оплодотворяемостью
Автор: Ткачв А.В., Ткачва О.Л., Россоха В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Репродуктивные биотехнологии
Статья в выпуске: 2 т.53, 2018 года.
Бесплатный доступ
В странах с развитым коневодством цитогенетические исследования кобыл широко применяются на практике (в случаях эмбриональной смертности - в обязательном порядке), активно ведутся работы по генетической оценке Equus caballus. Тем не менее, в доступной литературе нам не удалось найти публикаций о связи между цитогенетическими нарушениями у кобыл и результативностью искусственного осеменения замороженной и оттаянной спермой. Мы впервые изучили влияние цитогенетического статуса конематок украинской верховой породы на полноценность их полового цикла и оплодотворяемость по харьковской технологии. Показано, что при установлении гипофункции яичников, которая вызвана повышенной хромосомной изменчивостью (в отсутствие геномных мутаций и сбалансированных цитогенетических нарушений, передаваемых потомству), кобыл целесообразно разделять на три группы по общей хромосомной нестабильности - с числом метафаз с аберрациями до 5 %, от 5 до 10 % и более 10 %. Такое разделение позволяет лучше охарактеризовать физиологическое состояние животных, оптимизировать план лечебных мероприятий, что в дальнейшем влияет на результативность искусственного осеменения при проведении работ по харьковской технологии. В случае охлажденной спермы оплодотворяемость (по проценту рожденных жеребят) у кобыл с цитогенетическим статусом более 10 % метафаз с аберрациями оказалась наименьшей и в среднем была на 29,81-31,86 % ниже (р
Цитогенетический статус кобыл, оплодотворяемость, хромосомные аберрации
Короткий адрес: https://sciup.org/142214170
IDR: 142214170 | УДК: 636.1: | DOI: 10.15389/agrobiology.2018.2.302rus
Текст научной статьи Цитогенетический статус кобыл (Equus caballus) украинской верховой породы в связи с оплодотворяемостью
Генетическая оценка Equus caballus проводится во многих странах (1-3). Несмотря на это, в доступной литературе нам не удалось найти публикаций о влиянии цитогенетического статуса кобыл на результативность искусственного осеменения замороженной и оттаянной спермой. В странах с развитым коневодством цитогенетические исследования кобыл применяются на практике гораздо шире, чем в Украине, а в случаях эмбриональной смертности — в обязательном порядке (4-6). Известно, что в коневодстве Украины интенсивная селекция без достаточно широких фундаментальных цитогенетических исследований могла привести к распространению цитогенетических аномалий, которые способны снижать репродуктивную функцию (7-9). Возможно, именно поэтому выход жеребят в целом по отрасли коневодства Украины не превышает 50 %, а для большинства разводимых пород не обеспечен необходимый минимум племенного воспроизводительного поголовья. Из 12 официально зарегистрированных в Украине пород E . caballus только 3 имеют достаточное количество племенных животных; при этом общая численность поголовья лошадей на начало 2015 года сократилась до 320-330 тыс. (10). Поэтому фундаментальной задачей становится сохранение и увеличение численности поголовья, что отражено в программе развития коневодства в Украине до 2020 года. Определенная роль в этом отводится применению современных методов биотехнологии репродукции (11, 12), однако они неэффективны, 302
если у кобыл диагностируется ановуляторный половой цикл, вызванный гипофункцией яичников либо цитогенетическими нарушениями.
Отметим, что в последние годы у всех видов животных (как и у человека) отмечают снижение репродуктивной функции, рост числа акушерско-гинекологических заболеваний, что, возможно, отчасти связано с ухудшением экологической ситуации (13-16). В условиях зоопарков все шире применяют цитогенетические исследования с целью сохранения полноценного генофонда и эффективной репродукции животных (17-18).
Эти факты указывают на необходимость применения цитогенетических исследований для выявления причин ановуляторных половых циклов и повышения оплодотворяемости кобыл как при естественной случке, так и после искусственного осеменения. В первую очередь цитогенетическому обследованию следует подвергать кобыл с ректально подтвержденной гипофункцией яичников как наиболее распространенной патологией. Однако в Украине проводили лишь несколько цитогенетических исследований E . caballus в связи с репродуктивной функцией, но без изучения связи с результативностью искусственного осеменения (19, 20).
В настоящей работе мы впервые показали, что оплодотворяемость кобыл украинской верховой породы зависит от степени нестабильности их хромосомного аппарата (при отсутствии геномных мутаций и сбалансированных цитогенетических нарушений, передаваемых потомству), причем этот эффект проявляется сильнее, если конематок осеменяют не охлажденной, а деконсервированной спермой.
Целью исследования было установление влияния цитогенетического статуса самок Equus caballus на полноценность их полового цикла и результативность оплодотворяемости по харьковской технологии.
Методика. В одних и тех же хозяйствах (частные конные заводы и племрепродукторы в Харьковской, Полтавской, Днепропетровской, Запорожской и Киевской областях Украины) на протяжении 3 лет (2012-2015 годы) проводили обследование 143 кобыл украинской верховой породы.
Кровь для цитогенетических исследований отбирали до осеменения один раз в неделю общепринятыми методами из яр¸мной вены с соблюдением правил асептики и антисептики в стерильные пробирки с гепарином. В стерильных условиях лимфоциты культивировали в среде Игла или среде 199 («Sigma», США) с добавлением инактивированной сыворотки теленка, фитогемагглютинина («Sigma», США) и антибиотиков (пенициллин или стрептомицин, 100 мг/см3) при 37 ° С на протяжении 48-56 ч, после чего готовили препараты метафазных пластинок лимфоцитов (21, 22). Препараты просматривали в световом микроскопе Jenaval («Carl Zeiss», Германия) под масляной иммерсией при увеличении ½1000.
На основании цитогенетических данных до начала случного сезона и осеменения кобыл разделили на группы в зависимости от процента метафаз с аберрациями (до 5 %, 5-10 % и более 10 %). После этого провели комплекс зоотехнических и ветеринарных мероприятий для усиления репродуктивной функции (улучшение кормления и содержания, увеличение длительности моциона, применение разработанного комплекса лечебных мер) у кобыл с установленной гипофункцией яичников. Животных с геномными мутациями и сбалансированными цитогенетическими аномалиями, передающимися по наследству, из исследования исключали.
Оптимальное время осеменения диагностировали комплексно с применением ультразвукового сканера Aquila Pro («Esaote», Spain) для ветеринарии с ректальным линейным зондом (частота 6-8 МГц).
Искусственное осеменение проводили при первом полноценном овуляторном половом цикле по харьковской технологии (10) с помощью разработанного нами инструмента (23). Использовали охлажденную и де-консервированную сперму. Охлажденная сперма жеребцов перед осеменением хранилась в бытовом холодильнике при температуре 2-4 °С не более 48 ч. Сперму замораживали по харьковской технологии (10), спермодозы были расфасованы в шприц-тюбы объемом 5 см3 с концентрацией сперми-ев 150-200 млн/см3. На одно осеменение использовали одну спермодозу. Размораживали спермодозы (шприц-тюбы) в водяной бане при температуре 38-40 °С в течении 2-3 мин. После размораживания для осеменения использовали только те спермодозы, в которых подвижность спермиев была не ниже 3 баллов (не менее 30 % спермиев с прямолинейно-поступательным движением). Жеребцы-доноры имели допустимую хромосомную изменчивость (менее 5 % метафаз с аберрациями), геномные мутации и наследуемые сбалансированные цитогенетические нарушения отсутствовали.
Статистическую обработку результатов проводили общепринятыми методами (24), а также с применением специализированной программы SPSS («IBM», США). В таблицах приведены средние ( M ) и стандартные ошибки средних (±SEM). Различия оценивали по t -критерию Стьюдента и считали статистически значимыми при р < 0,05.
Результаты. При сохранении украинского генофонда E . caballus первоочередная проблема заключается в снижении числа кобыл с ановуля-торными половыми циклами, так как у таких животных оплодотворение становится невозможным (25). При комплексной диагностике состояния репродуктивной сферы отклонения от физиологической нормы отмечали у животных с хромосомной изменчивостью, превышающей 5 %. На рисунке 1 представлен физиологический предовуляторный фолликул кобылы при допустимом числе метафаз с аберрациями и гипофункциональный яичник особи, у которой их процент повышен.
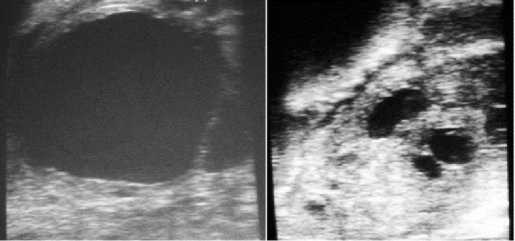
Рис. 1. Физиологический фолликул кобылы ( Equus caballus ) украинской верховой породы с допустимым цитогенетическим статусом (слева) и гипофунк-циональный яичник при повышенном проценте метафаз с аберрациями (справа) .
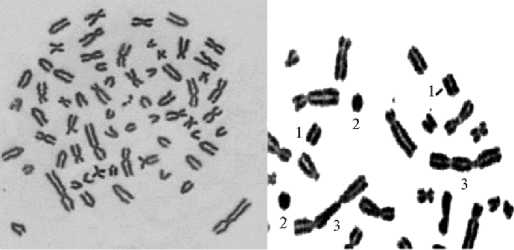
Рис. 2. Метафазные пластинки кобыл ( Equus caballus ) украинской верховой породы без аберраций (слева) и с повышенной хромосомной нестабильностью (справа) : 1 — парные фрагменты, 2 — кольцевые образования, 3 — дицентри-ческие хромосомы.
Вид нормальной метафазной пластинки и пример наблюдаемых цитогенетических нарушений иллюстрирует рисунок 2.
Как следует из данных, представленных в таблицы 1, кобылы с показателем общей хромосомной нестабильности до 5 % и физиологическим половым циклом имели на 5,31 % меньше (р < 0,001) метафаз с аберрациями, чем животные из группы с 5-10 % аберраций, и на 17,09 % меньше (р < 0,001) метафаз с аберрациями по сравнению с конематками, у которых регистрировали более 10 % аберрантных метафаз.
1. Цитогенетический статус кобыл ( Equus caballus ) украинской верховой породы и их оплодотворяемость при искусственном осеменении по харьковской технологии ( M ±SEM, частные конные заводы и племрепродукторы Украины, 2012-2015 годы)
|
Показатель |
Метафазы с аберрациями |
||
|
до 5 % |
5-10 % |
более 10 % |
|
|
Число исследованных метафаз |
2418 |
2486 |
2930 |
|
Число кобыл в группе |
44 |
45 |
54 |
|
Метафаз с аберрациями |
1,48±0,08 |
4,40±0,11*** |
10,67±0,22*** |
|
Относительное число метафаз с аберрациями, % |
2,70±0,14 |
8,01±0,22*** |
19,79±0,46*** |
|
Родилось жеребят от охлажденной спермы, % |
92,00±1,15 |
90,00±1,11 |
60,19±0,93** |
|
Родилось жеребят от оттаянной спермы, % |
71,60±1,14 |
56,67±1,11* |
37,04±1,85** |
|
*, **, *** Различия статистически значимы в сравнении с первой группой кобыл (до 5 % рациями) соответственно при р < 0,05; р < 0,01 и р < 0,001. |
метафаз с абер- |
||
При применении деконсервированной спермы влияние цитогенетического статуса самок на оплодотворяемость при осеменении прослеживалось более четко, чем в случае охлажденной, что согласуется с результатами применения замороженно-оттаянной спермы жеребцов другими исследователями (26, 27). Осеменение проводили при первом полноценном овуляторном половом цикле. Оплодотворяемость от применения охлажденной спермы (по проценту рожденных жеребят) у кобыл с цитогенетическим статусом более 10 % метафаз с аберрациями была наименьшей: в среднем на 29,81 и 31,86 % ниже (р < 0,01), чем у животных из групп соответственно с 5-10 % и < 5 % метафаз с аберрациями. При осеменении охлажденной спермой у конематок из первой (до 5 % метафаз с аберрациями) и второй (5-10 % метафаз с аберрациями) групп оплодотворяемость не имела достоверных различий.
Оплодотворяемость оттаянной спермой была наибольшей в группе с общей хромосомной нестабильностью < 5 %, в среднем превысив на 14,93 % (р < 0,05) показатель у кобыл из второй группы и на 34,56 % (р < 0,01) — у особей с наибольшим процентом метафаз с аберрациями (> 10 %). Другие исследователи тоже отмечают, что цитогенетический статус кобыл особенно важен при использовании деконсервированной спермы (28, 29).
2. Структура хромосомных аберраций у кобыл ( Equus caballus ) украинской верховой породы с разной степенью хромосомной нестабильности ( M ±SEM, частные конные заводы и племрепродукторы Украины, 2012-2015 годы)
|
Показатель |
Метафазы с аберрациями |
||
|
до 5 % |
1 5-10 % 1 |
более 10 % |
|
|
Всего аберраций Структура аберраций, %: |
1,95±0,10 |
6,69 ±0,27*** |
14,41±0,33*** |
|
единичные фрагменты хромосом |
70,08±3,78 |
47,57±2,10*** |
43,02±1,85*** |
|
парные фрагменты хромосом |
23,11±5,10 |
27,75±1,65 |
23,11±0,77 |
|
кольцевые хромосомы |
0,00±0,00 |
10,36±1,70 |
16,84±1,20** |
|
пробелы и разрывы хромосом |
6,81±5,29 |
13,74±1,95 |
16,27±1,03 |
|
дицентрические хромосомы |
0,00±0,00 |
0,58±0,66 |
0,76±0,87 |
*, **, *** Различия статистически значимы в сравнении с первой группой кобыл (до 5 % метафаз с аберрациями) соответственно при р < 0,05; р < 0,01 и р < 0,001.
Изучение структуры хромосомных аберраций (табл. 2) показало, что их общее число у кобыл из первой группы (с допустимой общей хромосомной нестабильностью) было в среднем на 4,74 меньше (р < 0,001), чем во второй группе, и на 12,46 меньше (р < 0,001), чем в третьей. Среди аберраций преобладали единичные фрагменты хромосом, причем в первой группе этот показатель был на 22,51 % выше (р < 0,001), чем во второй, и на 27,06 % выше (р < 0,001), чем в третьей, где число ановуляторных циклов наибольшее. Процент парных фрагментов хромосом был в среднем практически одинаков у самок с общей хромосомной нестабильностью до 5 % и более 10 %, а во второй группы этот показатель недостоверно превышал таковой в первой и третьей группах на 4,64 %. У животных с из первой группы кольцевых хромосом не наблюдали, а в третьей группе их было на 6,48 % больше (р < 0,01), чем во второй. Число пробелов и разрывов в обследованных метафазных пластинках было наименьшим у кобыл из первой группы, что в среднем на 6,93 % меньше, чем во второй, и на 9,46 % меньше, чем в третьей. У обследованных кобыл с допустимым уровнем хромосомной нестабильности (до 5 %) дицентрических хромосом не обнаружили, их наибольший процент был установлен у животных из третьей группы, имеющих более 10 % метафаз с аберрациями, что оказалось на 0,18 % больше, чем во второй группе с общей хромосомной нестабильностью 5-10 %.
Таким образом, впервые в Украине изучено влияние цитогенетического статуса конематок Equus caballus украинской верховой породы на полноценность их полового цикла и оплодотворяемость по харьковской технологии. Установлено, что для повышения оплодотворяемости кобыл целесообразно разделять их в зависимости от цитогенетического статуса (с числом метафаз с аберрациями до 5 %, 5-10 % и более 10 %). Такое разделение позволяет повысить оплодотворяемость как при естественной случке, так и при искусственном осеменении. При этом оплодотворяемость декон-сервированной спермой у кобыл с числом аберрантных метафаз до 5 % составила в среднем 71,60 %, с 5-10 % таких метафаз — 56,67 %, более 10 % — только 37,04 %. Следовательно, особенно важно учитывать цитогенетический статус кобыл при использовании деконсервированной спермы.
Список литературы Цитогенетический статус кобыл (Equus caballus) украинской верховой породы в связи с оплодотворяемостью
- Aldridge L.I., Kelleher D.L., Reilly M., Brophy P.O. Estimation of the genetic correlation between performances at different levels of show jumping competition in Ireland. J. Anim. Breed. Genet., 2000, 117: 65-72 ( ) DOI: 10.1046/j.1439-0388.2000.00232.x
- Shubertova Z., Candrak J., Rolinec M. Genetic evaluation of show jumping horses in the Slovak Republic. Ann. Anim. Sci., 2016, 16(2): 387-398 ( ) DOI: 10.1515/aoas-2015-0072
- Stefaniuk-Szmukier M., Ropka-Molik K., Zagrajczuk A., Piorkowska K., Szmatola T., Luszczynski J., Bugno-Poniewierska M. Genetic variability in equine GDF9 and BMP15 genes in Arabian and Thoroughbred mares. Ann. Anim. Sci., 2018, 18(1): 39-52 ( ) DOI: 10.1515/aoas-2017-0035
- Zabek T., Semik E., Fornal A., Bungo-Poniewierska M. Genetic variation of two horse breeds in Cpg islands of Oas1 locus. Ann. Anim. Sci., 2014, 14(4): 841-850 ( ) DOI: 10.2478/aoas-2014-0069
- Curik I., Zechner P., Sölkner J., Achmann R., Bodo I., Dovc P., Kavar T., Marti E., Brem G. Inbreeding, microsatellite heterozygosity, and morphological traits in Lipizzan horses. J. Hered., 2003, 94: 125-132 ( ) DOI: 10.1093/jhered/esg029
- Khanshour A., Juras R., Blackburn R., Cothran E.G. The legend of the Canadian Horse: genetic diversity and breed origin. J. Hered., 2015, 106(1): 37-44 ( ) DOI: 10.1093/jhered/esu074
- Ducro B.J., Koenen E.P.C., Tartwijk J.M.F.M., Bovenhuis H. Genetic relations of movement and free-jumping traits with dressage and show-jumping performance in competition of Dutch Warmblood horses. Livest. Sci., 2007, 107: 227-234 ( ) DOI: 10.1016/j.livsci.2006.09.018
- Druml T., Grilz-Seger G., Neuditschko M., Neuhauser B., Brem G. Phenotypic and genetic analysis of the leopard complex spotting in Noriker horses. J. Hered., 2017, 108(5): 505-514 ( ) DOI: 10.1093/jhered/esx039
- Collins C.W., Songsasen N.S., Vick M.M., Wolfe B.A., Weiss R.B. Abnormal reproductive patterns in Przewalski's mares are associated with a loss in gene diversity. Biol. Reprod., 2012, 86(2): 1-10 ( ) DOI: 10.1095/biolreprod.111.092676
- Tkachev A.V., Sheremetа V.I., Tkachevа O.L., Rossokha V.I. Physiological relationship of erythrocyne antigens with indicators of horse spermogram. Fiziol. Zh., 2017, 63(1): 84-90 ( ) DOI: 10.15407/fz63.01.084
- Choi Y.H., Love C.C., Chung Y.G., Varner D.D., Westhusin M.E., Burghardt R.C., Hinrichs K. Production of nuclear transfer horse embryos by Piezo-driven injection of somatic cell nuclei and activation with stallion sperm cytosolic extract. Biol. Reprod., 2002, 67(2): 561-567 ( ) DOI: 10.1095/biolreprod67.2.561
- McPartlin L.A., Suarez S.S., Czaya C.A., Hinrichs K., Bedford-Guaus S.J. Hyperactivation of stallion sperm is required for successful in vitro fertilization of equine oocytes. Biol. Reprod., 2009, 81(1): 199-206 ( ) DOI: 10.1095/biolreprod.108.074880
- Moskalets V.V., Moskalets T.Z., Vasylkivskyi S.P., Grynyk I.V., Vovkohon A.H., Tarasyuk S.I., Rybalchenko V.K. Adaptability and stability mechanisms of Triticeae tribe to epiphytoparasites in anthropical ecosystem. Ukrainian Journal of Ecology, 2017, 7(2): 230-238 ( ) DOI: 10.15421/2017_41
- Taguchi T., Kubota S., Mezaki T., Tagami E., Sekida S., Nakachi S., Okuda K., Tominaga A. Identification of homogeneously staining regions by G-banding and chromosome microdissection, and FISH marker selection using human Alu sequence primers in a scleractinian coral Coelastrea aspera Verrill, 1866 (Cnidaria). Comp. Cytogenet., 2016, 10(1): 61-75 ( ) DOI: 10.3897/CompCytogen.v10i1.5699
- Dean W., Santos F., Reik W. Epigenetic reprogramming in early mammalian development and following somatic nuclear transfer. Seminars in Cell and Developmental Biology, 2003, 14: 93-100 ( ) DOI: 10.1016/s1084-9521(02)00141-6
- Савина Н.В., Смаль М.П., Кужир Т. Д. Метод ДНК-комет в выявлении геномной нестабильности. Мониторинг состояния генома у работников ОАО «МАЗ». Молекулярная и прикладная генетика, 2008, 10: 108-114.
- Kosowska B., Strzała T., Moska M. Cytogenetic examination of South American tapirs, Tapirus terrestris (Perissodactyla, Tapiridae) from the Wroclaw Zoological Garden. Vestnik zoologii, 2015, 49(6): 529-536 ( ) DOI: 10.1515/vzoo-2015-0063
- Перевозкин В.П., Бондарчук С.С., Минич А.С. Цитогенетический анализ видового состава и инверсионной структуры популяций малярийных комаров Астраханской области. Генетика, 2015, 51(8): 924-933.
- Pawlina K., Bugno-Poniewierska M. The application of zoo-fish technique for analysis of chromosomal rearrangements in the Equidae family. Ann. Anim. Sci., 2012, 12(1): 5-13 ( ) DOI: 10.2478/v10220-012-0001-y
- Danielak-Czech B., Rejduch B., Kozubska-Sobocińska A. Identification of telomeric sequences in pigs with rearranged karyotype using prins technique/Identyfikacja sekwencji telomerowych u świń z rearanżacją kariotypu przy wykorzystaniu techniki PRINS. Ann. Anim. Sci., 2013, 13(3): 495-502 ( ) DOI: 10.2478/aoas-2013-0022
- Warchałowska-Śliwa E., Grzywacz B., Heller K.G., Chobanov D.P. Comparative analysis of chromosomes in the Palaearctic bush-crickets of tribe Pholidopterini (Orthoptera, Tettigoniinae). Comp. Cytogenet., 2017, 11(2): 309-324 ( ) DOI: 10.3897/CompCytogen.v11i2.12070
- Sadílek D., Angus R.B.,ŠTáhlavský F., Vilímová J. Comparison of different cytogenetic methods and tissue suitability for the study of chromosomes in Cimex lectularius (Heteroptera, Cimicidae). Comp. Cytogenet., 2016, 10(4): 731-752 ( ) DOI: 10.3897/CompCytogen.v10i4.10681
- Ткачов О.В. Пристрiй атравматичний для штучного осiменiння кобил. Патент України на корисну модель № 105004, МПК А61D 19/02. Заявл. 05.10.2015. Опубл. 25.02.2016. Бюл. № 4.
- Плохинский Н.А. Руководство по биометрии для зоотехников. М., 1969.
- Wejer J., Lewczuk D. Effect of the age on the evaluation of horse conformation and movement. Ann. Anim. Sci., 2016, 16(3): 863-870 ( ) DOI: 10.1515/aoas-2015-0092
- Melo C.M., Papa F.O., Fioratti E.G., Magalhaes L.C.O., Alvarenga M.A. Application of equine epididymal sperm. Biol. Reprod., 2010, 83(Suppl_1): 672-680 ( ) DOI: 10.1093/biolreprod/83.s1.672
- Robeck T.R., Steinman K.J., Gearhart S., Reidarson T.R., McBain J.F., Monfort S.L. Reproductive physiology and development of artificial insemination technology in killer whales (Orcinus orca). Biol. Reprod., 2004, 71(2): 650-660 ( ) DOI: 10.1095/biolreprod.104.027961
- Lindsey A.C., Morris L.H., Allen W.R., Schenk J.L., Squires E.L., Bruemmer J.E. Hysteroscopic insemination of mares with low numbers of nonsorted or flow sorted spermatozoa. Equine Vet. J., 2002, 34: 128-132 ( ) DOI: 10.2746/042516402776767178
- Lindsey A.C., Schenk J.L., Graham J.K., Bruemmer J.E., Squires E.L. Hysteroscopic insemination of low numbers of flow sorted fresh and frozen/thawed stallion spermatozoa. Equine Vet. J., 2002, 34: 121-127 ( ) DOI: 10.2746/042516402776767321


