Цитокиновый статус у больных с обструктивным коронарным атеросклерозом
Автор: Атамась О. В., Антонюк М. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Обоснование. Исследования роли цитокинов в патогенезе ишемической болезни сердца (ИБС) сохраняют свою актуальность. Выраженный цитокиновый дисбаланс наблюдается у больных с острым коронарным синдромом. При стабильной стенокардии данные о содержании цитокинов противоречивы. Вопрос о взаимосвязи цитокинов с тяжестью коронарного атеросклероза остается открытым.Цель: исследовать уровни про- и противовоспалительных цитокинов в сыворотке крови больных стабильной ИБС и установить их связь со степенью атеросклеротического поражения коронарных артерий (КА).Материал и методы. Обследованы 70 больных ИБС, которым в плановом порядке проведена коронарная ангиография (КАГ). Количественная оценка атеросклероза определена с помощью шкалы Gensini (GS). Сформированы группы с умеренным (GS = 8-37 баллов) и тяжелым поражением сосудов (GS ≥ 38). Контрольная группа - 24 здоровых добровольца. В сыворотке крови определяли содержание ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10, ФНО-α. Статистическая обработка проводилась с помощью программы SPSS STATISTICA 26.0.Результаты. У больных с обструктивным атеросклерозом выявлено повышенное содержание ФНО-α (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Цитокины, атеросклероз, коронароангиография, шкала gensini
Короткий адрес: https://sciup.org/149142824
IDR: 149142824 | УДК: 616.132.2-004.6:577.17 | DOI: 10.29001/2073-8552-2023-38-2-114-121
Текст научной статьи Цитокиновый статус у больных с обструктивным коронарным атеросклерозом
Воспаление играет ключевую роль в возникновении и прогрессировании атеросклероза, на долю которого приходится подавляющее большинство сердечно-сосудистых событий. Теория воспаления в патогенезе атеросклероза была предложена еще в середине XIX столетия немецким ученым-патологом Рудольфом Вирховым. Он рассматривал воспаление как процесс, провоцирующий изменения в сосудистой стенке и являющийся первопричиной развития атеросклероза [1]. В течение 150 лет воспалительная теория вызывала немало научных дискуссий. И только за последнее десятилетие три крупных исследования CANTOS (2017 г.), COLCOT (2019 г.), LoDoCo2 (2020 г.) подтвердили теорию воспаления, сообщив о существенном снижении сердечно-сосудистых событий у больных ишемической болезнью сердца (ИБС), принимавших противовоспалительное лечение [2–4].
Роль иммунной системы в патофизиологии атеросклероза многогранна и регулируется врожденными и адаптивными компонентами. В воспалительном процессе участвуют множество типов клеток, включая макрофаги, Т- и В-лимфоциты на различных стадиях воспаления, активации, апоптоза и некроза. Одной из общих черт между этими типами клеток является то, что они активируются и взаимодействуют друг с другом паракринным способом через сложную сеть цитокинов. Некоторые провоспали-тельные цитокины, включая интерлейкин-1 (ИЛ-1), ИЛ-6, ИЛ-8, фактор некроза опухоли – альфа (ФНО-α), а также противовоспалительные цитокины ИЛ-4 и ИЛ-10, были идентифицированы как часть воспалительного процесса при атеросклерозе [5]. Цитокины сопровождают атероге-нез на всех его стадиях, указывая на их важную роль в патогенезе заболевания. Поддержание иммунного гомеостаза определяется их сбалансированным действием, а нарушение баланса приводит к запуску механизма хронического воспаления.
В настоящее время имеется множество работ, посвященных исследованию сывороточных уровней цитокинов при ИБС. Их дисбаланс чаще наблюдается у больных с острым коронарным синдромом (ОКС). Так, по данным литературы, при ОКС определяется повышенный уровень ИЛ-6, ФНО-α и пониженный ИЛ-2 [6]. Тем не менее у больных стабильной стенокардией при хроническом течении заболевания роль отдельных цитокинов и их соотношение до сих пор остаются противоречивыми. Согласно некоторым исследованиям, на начальном этапе развития атеросклероза отмечаются повышенные уровни провос-палительных ИЛ-1, ИЛ-8, ФНО-α и сниженные уровни противовоспалительного ИЛ-4 в сыворотке крови [7]. В некоторых исследованиях показано, что сывороточные уровни IL-6, IL-8, ФНО-α не связаны с атеросклерозом и стабильной стенокардией [8]. Несмотря на большое количество исследований, вопрос о роли цитокинов в иммунном патогенезе стабильной стенокардии остается открытым.
Цель : исследовать уровни про- и противовоспалительных цитокинов в сыворотке крови больных стабильной ИБС, установить их связь со степенью атеросклеротического поражения коронарных артерий (КА).
Материал и методы
Работа выполнена в дизайне проспективного сравнительного исследования в период с января по ноябрь 2021 г. на базе Медицинского центра Дальневосточного федерального университета (г. Владивосток). В исследование включены 70 пациентов с документированной стабильной ИБС, которым в плановом порядке была проведена диагностическая коронарная ангиография (КАГ). Среди обследованных – 44 мужчины и 26 женщин, средний возраст составил 61,0 (57,0; 64,25) лет. Длительность заболевания ИБС – от 3 мес. до 11 лет. В группу контроля включены 24 клинически здоровых добровольца, среди которых 13 мужчин и 11 женщин, средний возраст – 58,5 (53,75; 61,0) лет. Группы были сопоставимы по возрасту и полу. Характеристика обследованных представлена в таблице 1.
Таблица 1. Клиническая и лабораторная характеристика пациентов, Мe ( Q 1; Q 3), n (%)
Table 1. The clinical and laboratory data of studied groups, Мe ( Q 1; Q 3), n (%)
|
Показатели Data |
Основная группа ( n = 70) Study group ( n = 70) |
Контрольная группа ( n = 24) Control group ( n = 24) |
p |
|
Муж. пол, n (%) Male, n (%) |
44 (62,9) |
13 (54,2) |
0,09 |
|
Возраст, лет Age, years |
61,0 (57,0; 64,2) |
58,5 (53,75; 61,0) |
0,078 |
|
ИМТ, кг/м2 BMI, kg/m |
28,0 (25,0; 32,25) |
24,4 (21,2; 25,7) |
< 0,001 |
|
САД, мм рт. cт. SBP, mm Hg |
130,0 (115,0;140,0) |
120,0 (105,0;130,0) |
0,042 |
|
ДАД, мм рт. cт. DBP, mm Hg |
80,0 (80,0; 85,0) |
80,0 (79,0; 80,0) |
0,225 |
|
ЧСС, уд/мин Heart rate, bpm |
68,0 (63,0; 76,0) |
70,0 (68,0; 78,0) |
0,218 |
|
Курение, n (%) Smoking, n (%) |
16 (22,9) |
5 (22,7) |
0,837 |
|
Артериальная гипертензия, n (%) Hypertension, n (%) |
64 (91,4) |
1 (4,2) |
< 0,001 |
|
Сахарный диабет, n (%) Diabetes mellitus, n (%) |
17 (24,3) |
1 (4,2) |
0,031 |
|
Тревожность, n (%) Anxiety, n (%) Депрессия, n (%) Depression, n (%) |
21 (30,0) 14 (21,4) |
5 (20,8) 1 (4,2) |
0,730 0,042 |
|
Терапия статинами, n (%) Statins usage, n (%) |
57 (81,4) |
– |
– |
|
Глюкоза крови, ммоль/л Fasting blood glucose, mmol/L |
6,10 (5,35; 7,8) |
5,25 (5,05; 5,4) |
< 0,001 |
|
ОХС, ммоль/л TC, mmol/L |
4,5 (3,58; 5,19) |
5,47 (5,42; 5,67) |
0,008 |
|
ТГ, ммоль/л TG, mmol/L |
1,3 (0,91; 1,18) |
0,67 (0,59; 1,01) |
0,002 |
|
ХС ЛПВП, ммоль/л HDL-C, mmol/L |
1,16 (1,01; 1,4) |
1,64 (1,28; 1,95) |
0,002 |
|
ХС ЛПНП, ммоль/л LDL-C, mmol/L |
2,6 (1,98; 3,21) |
3,37 (3,13; 3,68) |
0,01 |
Примечание: ИМТ – индекс массы тела, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, ЧСС – частота сердечных сокращений, ОХС – общий холестерин, ТГ – триглицериды, ХС ЛПНП – холестерин липопротеинов низкой плотности, ХС ЛПВП –холестерин липопротеинов высокой плотности.
Note: BMI – body mass index, SBP – systolic blood pressure, DBP – diastolic blood pressure, HR, bpm – heart rate, beats per minute, TC – Total cholesterol, TG – Triglyceride, HDL-C – high-density lipoprotein cholesterol, LDL-C – low-density lipoprotein cholesterol.
Критерии включения: стабильная стенокардия II–IV функционального класса (ФК) по Канадской классификации, показания для проведения диагностической КАГ. В исследование не включались пациенты, перенесшие ОКС в течение последних 6 мес., больные с тяжелой хронической сердечной недостаточностью, онкологическими, иммунными и воспалительными заболеваниями.
Всем больным проводились клинико-лабораторные и инструментальные обследования в соответствии со стандартами диагностики ИБС, учитывались факторы риска. В сыворотке крови методом твердофазного иммуно-ферментного анализа определялось содержание ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-10 и ФНО-α с применением наборов Вектор-БЕСТ (Россия). Количественная оценка содержания цитокинов в сыворотке крови выражалась в пг/мл.
КАГ выполнялась по стандартной методике с использованием ангиографической установки Philips Allura Xper FD 20. Анализ ангиограмм осуществлялся с помощью программного обеспечения Xcelera (Philips, Нидерланды). При анализе данных учитывались локализация, степень сужения и количество пораженных КА. Обструктивным стенозом считалось сужение диаметра ≥ 50% просвета основных артерий и/или ствола левой КА.
Тяжесть коронарного атеросклероза оценивалась с помощью ангиографической шкалы Gensini ( GS ). Подсчет баллов по шкале GS проводился с учетом степени стеноза КА, локализации и количества пораженных КА. Индекс GS рассчитывался как сумма произведений тяжести каждого стеноза, выраженного в баллах, умноженного на коэффициент, рассчитанный для каждого сегмента КА [9].
Исследование проведено в соответствии с требованиями Хельсинской декларации (пересмотр 2013), одобрено локальным этическим комитетом (протокол № 10 от
28.12.2020 г.). Все обследуемые подписали добровольное информированное согласие.
Статистический анализ полученных данных проведен с помощью программного обеспечения IBM SPSS STATISTICS 26.0 (StatSoft Inc., США). Нормальность распределения количественных показателей оценивалась с помощью критериев Колмогорова – Смирнова и Шапиро – Уилка. Количественные переменные представлены как Мe ( Q 1; Q 3) где Me – медиана, Q 1 – нижний квартиль, Q 3 – верхний квартиль, так как большинство количественных показателей имели значения, отличные от нормального распределения. Качественные показатели описывались абсолютными ( n ) и относительными (в %) частотами. При сравнении трех независимых выборок количественных показателей использовался критерий Краскела – Уоллиса, для попарных апостериорных сравнений групп – критерий Манна – Уитни с поправкой Бон-феррони. Различия между качественными показателями оценивались по критерию χ 2 Пирсона .
Связь между уровнями цитокинов и тяжестью поражения КА оценивались с помощью коэффициента ранговой корреляции Спирмена. Для анализа вклада возможных предикторов тяжелого обструктивного атеросклероза примененялся логистический регрессионный анализ. Пороговый уровень статистической значимости при проверке гипотез составлял p = 0,05.
Результаты
У всех обследованных пациентов выявлены обструктивные стенозы КА, при этом индекс GS варьировал от 8 до 198 баллов, медиана составила 38,00 (23,5; 84,0) баллов. Поражение в бассейне одной артерии (медиана GS 15,0 баллов) выявлено у 22 больных, двух КА ( GS 39,0 баллов) – у 24 пациентов и трех КА ( GS 80,0 баллов) – у 24 больных (табл. 2).
Таблица 2. Соотношение между степенью стеноза коронарной артерии, тяжестью коронарного атеросклероза по шкале Gensini и количеством пораженных сосудов
Table 2. The relationship between the degree of coronary artery stenosis with lesion severity according Gensini score and the number of vessel diseases
|
Степень стеноза КА, % Degree of artery stenosis, % |
Индекс Gensini (баллы), Мe ( Q 1; Q 3) Gensini score (points), Мe ( Q 1; Q 3) |
|||
|
38,0 (23,5; 84,0) |
15,0 (12,0; 26,0) |
39,0 (26,5; 78,0) |
80,0 (65,0; 120,0) |
|
|
Основная группа ( n = 70) Study group ( n = 70) |
1-сосудистое поражение ( n = 22) 1-vessel lesion ( n = 22) |
2-сосудистое поражение ( n = 24) 2-vessel lesion ( n = 24) |
3-сосудистое поражение ( n = 24) 3-vessel lesion ( n = 24) |
|
|
50–70 |
3 (4,3%) |
3 (13,6%) |
– |
– |
|
71–90 |
46 (65,7%) |
18 (81,9%) |
15 (62,5%) |
13 (54,2%) |
|
≥ 91 |
21 (30,0%) |
1 (4,5%) |
9 (37,5%) |
11 (45,8) |
Согласно результатам КАГ с учетом медианы индекса Gensini (38 баллов), cформированы группы наблюдения: 1-я группа – пациенты с умеренным поражением КА (n = 32), индекс GS составлял 8–37 баллов; 2-я группа – с тяжелым поражением (n = 38), у которых индекс GS ≥ 38 баллов. Группу контроля (3-я группа) составили здоровые добровольцы (n = 24). По клинико-лабораторным показателям 1-я и 2-я группы отличались по статусу курения и наличию депрессивных расстройств. В группе с тяжелым поражением КА количество бросивших курить было больше (48,6 против 21,2%, χ2 = 5,719; р = 0,024), у больных с умеренным атеросклерозом чаще встречались депрессивные расстройства (27,3 против 13,5%, χ2 = 4,63; р = 0,032).
Сравнительная оценка цитокинового профиля у обследованных представлена в таблице 3. У больных с умеренным поражением КА (1-я группа) относительно контроля выявлено повышенные уровни ФНО-α ( р < 0,001) и пониженные – ИЛ-4 ( р < 0,001). 1-я и 3-я группы статистически не различались по содержанию ИЛ-6 ( р = 0,482), ИЛ-2 ( р = 0,096) и ИЛ-10 ( р = 0,085).
Таблица 3. Уровни цитокинов в сыворотке крови обследуемых, Мe ( Q 1; Q 3)
Table 3. Serum cytokine levels of patients in each group, Мe ( Q 1; Q 3)
|
Цитокины, пг/мл Cytokines, pg/ml |
1-я группа, GS = 8–37 ( n = 32) Moderate CAD group ( n = 32) |
2-я группа, GS ≥ 38 ( n = 38) Severe CAD group ( n = 38) |
3-я группа, контроль ( n = 24) Control group 1 ( n = 24) |
Критерий Краскела Уоллиса Kruskal – Wallis test p -value |
Критерий Манна – Уитни Mann – Whitney U test р -value |
|
ИЛ-2 IL-2 |
2,26 (2,15; 2,42) |
2,25 (2,13; 2,38) |
2,51 (2,27; 2,56) |
0,003 |
р 1–2 = 0,643 р 1–3 = 0,096 р 2–3= 0,002 |
|
ИЛ-4 IL-4 |
1,91 (1,77; 2,18) |
2,0 (1,86; 2,10) |
3,21 (2,57; 3,53) |
< 0,001 |
р 1–2= 1,0 р 1–3< 0,001 р 2–3< 0,001 |
|
ИЛ-6 IL-6 |
4,72 (4,21; 5,28) |
5,72 (5,34; 6,47) |
4,55 (4,16; 5,59) |
< 0,001 |
р 1–2 = 0,001 р 1–3 =0,482 р 2–3< 0,001 |
|
ИЛ-10 IL-10 |
4,91 (4,36; 5,33) |
4,81 (4,24; 5,86) |
5,34 (4,64; 6,67) |
0,085 |
– |
|
ФНО-α TNF-α |
2,94 (2,49; 3,35) |
2,89 (2,68; 3,51) |
2,23 (2,06; 2,74) |
< 0,001 |
р 1–2= 1,0 р 1–3< 0,001 р 2–3< 0,001 |
|
ИЛ-6/ИЛ-10 IL-6/IL-10 |
0,98 (0,83; 1,12) |
1,29 (0,90; 1,43) |
0,89 (0,72; 1,14) |
0,005 |
р 1–2= 0,014 р 1–3 = 0,877 р 2–3 = 0,009 |
|
ФНО-α/ИЛ-10 TNF-α/ IL-10 |
0,56 (0,48; 0,69) |
0,59 (0,49; 0,72) |
0,38 (0,33; 0,52) |
< 0,001 |
р 1–2= 1,0 р 1–3< 0,001 р 2–3< 0,001 |
Примечание: ИЛ-2 – интерлейкин 2, ФНО-α – фактор некроза опухоли альфа.
Note: IL-2 – interleukin 2, TNF-α – tumor necrosis factor alpha.
В группе больных с тяжелым поражением КА (2-я группа) наблюдалась повышенная экспрессия провоспа-лительных цитокинов ФНО-α ( р < 0,001) и ИЛ-6 ( р < 0,001) относительно контроля. Уровень ИЛ-2 и ИЛ-4 в сыворотке кроки оказался ниже контрольных показателей ( р = 0,002; р < 0,001 соотвественно). Содержание ИЛ-10 статистически значимо не отличалось от группы контроля ( р = 0,085).
При сравнительном анализе цитокинового профиля 1-й и 2-й групп выявлено увеличение концентрации ИЛ-6 у больных с тяжелым поражением КА ( р = 0,001).
Известно, что иммунновоспалительный статус определяется балансом про- и противовоспалительных цитокинов, который оценивается с помощью цитокиновых индексов (ЦИ). Несмотря на то, что уровень ИЛ-10 статистически значимо не отличался между группами, его использование в анализе ЦИ имело диагностическое значение. Определение соотношений ИЛ-6/ИЛ-10 и ФНО-α/ ИЛ-10 показало доминирование воспалительных цитокинов с увеличением степени поражения КА. У пациентов с тяжелым поражением КА индекс ИЛ-6/ИЛ-10 превышал показатель в группе пациентов с умеренным поражением и контроля ( р = 0,014; p = 0,009 соотвественно). Значение показателя ФНО-α/ИЛ-10 было повышено в 1-й и 2-й группах по сравнению с контролем ( р < 0,001). Статистически значимых различий этого показателя между пациентами с умеренным и тяжелым поражением КА не выявлено ( р = 1,0).
Таким образом, у больных с умеренным и тяжелым поражением КА выявлены общие и отличительные осо- бенности продукции цитокинов. Повышение провос-палительного ФНО-α и понижение противоспалитель-ного ИЛ-4 наблюдалось независимо от степени атеросклеротического повреждения сосудов. Для пациентов с тяжелым поражением КА характерным явилось увеличение провоспалительного ИЛ-6 и соотношения ИЛ-6/ИЛ-10.
Непараметрический корреляционный анализ выявил прямую умеренную связь между показателями GS и уровнем ИЛ-6 ( r = 0,467; р < 0,001), умеренную прямую – с ИЛ-6/ИЛ-10 ( r = 0,346; p = 0,003). Степень стеноза ассоциировалась с ИЛ-6 (связь прямая умеренная, r = 0,381; р = 0,001). Наблюдалась прямая слабая связь между количеством пораженных КА и ИЛ-6 ( r = 0,295, p = 0,013). Корреляционных связей между этими параметрами КАГ и другими цитокинами не выявлено.
При построении модели бинарной логистической регрессии (зависимая переменная – номера 1-й и 2-й групп, независимые переменные – ИЛ-6 и ЦИ ИЛ-6/ИЛ-10) было выявлено, что предиктором тяжелого коронарного атеросклероза является только ИЛ–6. Его повышенная экспрессия увеличивает шансы выявления тяжелого поражения КА более чем в 3,5 раза (OШ = 3,836; 95% ДИ 1,8 – 8,177; р < 0,001). ROC-анализ модели логистической регрессии показал, что площадь под кривой (area under the curve, AUC) составила 0,767 (95% ДИ 0,765 – 0,879; р < 0,001), указывая на хорошее качество модели (рис. 1). Пороговое значение ИЛ-6 составило 5,19 пг/мл, чувствительность и специфичность метода выявления тяжелого поражения КА достигли 75,0 и 70,0 % соответственно.
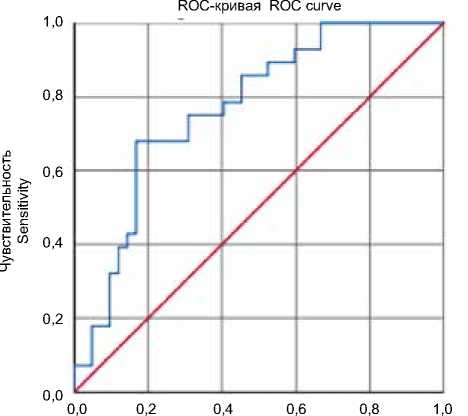
1 – Специфичность Specificity
Рис. 1. ROC-кривая диагностической способности логистической регрессионной модели ИЛ-6 прогноза тяжелого коронарного атеросклероза
Fig. 1. ROC curve of the IL-6 logistic regression model for the prognosis of severe coronary artery atherosclerosis
Обсуждение
В настоящее время иммунные и воспалительные механизмы, участвующие в процессе атерогенеза, до конца не изучены. Поскольку воспаление играет ключевую роль в прогрессировании и дестабилизации атеросклеротических бляшек, что связано с развитием сердечно-сосудистых осложнений, изучение цитокинов не теряет своей актуальности. В проведенном исследовании для оценки степени поражения коронарного русла у больных ИБС использовали ангиографическую шкалу GS , которая позволила определить больных с умеренным и тяжелым поражением. С учетом тяжести коронарного атеросклероза оценивался цитокиновый статус. У больных стабильной ИБС наблюдалось увеличение провоспалительных цитокинов ФНО-α, ИЛ-6 и понижение уровней ИЛ-2, ИЛ-4.
Аналогичные результаты были получены в ранее проведенном исследовании [10]. У больных стабильной стенокардией были выявлены низкие концентрации противовоспалительных ИЛ-4, ИЛ-10 и повышенные концентрации провоспалительных цитокинов. При этом от стенокардии II ФК к IV ФК отмечено прогрессирующее понижение противоспалительных цитокинов. В настоящем исследовании также наблюдалась пониженная экспрессия ИЛ-4, однако уровень ИЛ-10 хотя и был снижен, но не достиг статистической значимости. Известно, что ИЛ-10 и ИЛ-4 играют основную роль в регуляции адаптивных иммунных реакций. Снижение их уровней свидетельствует об угнетении защитной функции иммунной системы у больных с хроническим воспалением.
Выявленное пониженное содержание ИЛ-2 у больных с тяжелым коронарным атеросклерозом указывает на нарушения в системе Т-регуляторных клеток, ответственных за ингибирование воспаления и уменьшение атеросклероза [11]. Интерлейкин-2 играет ключевую роль в иммунном гомеостазе и участвует в развитии и стабильности Т-регуляторных клеток [11]. Данная гипотеза явилась основанием для проведения исследований LILACS и IVORY, в котором пациентам со стабильной ИБС вводились низкие дозы ИЛ-2 с целью увеличения Т-регулятор-ных клеток и, соответственно, уменьшения воспалительной реакции сосудов [12, 13].
В литературе представлено множество исследований, подтверждающих роль ИЛ-6 и ФНО-α в развитии атеросклероза [7, 10]. Повышенные уровни провоспалитель-ных цитокинов выявлены и в настоящем исследовании. Согласно некоторым авторам, повышенное содержание ФНО-α в сыворотке крови наблюдается как на ранних стадиях развития атеросклероза, так и при тяжелом поражении сосудов [14]. Уровень ФНО-α является независимым биомаркером тяжести раннего атеросклероза, а его наиболее высокие уровни обнаружены у пациентов со стенокардией III–IV ФК [10].
Рядом авторов показано, что повышенная концентрация ИЛ-6 связана с сердечно-сосудистым риском [15, 16]. По данным исследования STABILITY , в котором участвовали 14 611 пациентов со стабильной ИБС, ИЛ-6 был независимо связан с риском развития неблагоприятных коронарных событий, сердечно-сосудистой смертностью и смертностью от всех причин, инфарктом миокарда, сердечной недостаточностью и смертностью от онкологии [16]. В настоящей работе у лиц с умеренным поражением сосудов ИЛ-6 не отличался от контроля, статистически значимо он был повышенным у больных с тяжелым атеросклерозом. Выявлена прямая ассоциация между уровнем ИЛ-6 и показателями GS , степенью стеноза и количеством поврежденных артерий. При возрастании индекса GS уровень ИЛ-6 увеличивался. Логистический регрессионный анализ показал, что шансы выявления тяжелого атеросклероза увеличиваются более чем 3,5 раза у больных ИБС с высокими уровнями ИЛ-6. Результаты указывают на прогностическое значение ИЛ-6, который является маркером тяжелого поражения КА. Повышение данного цитокина, возможно, связано с нестабильностью атеросклеротической бляшки.
Подтверждение этой гипотезы продемонстрировано в исследовании C. Lai и соавт. Более высокий уровень ИЛ-6 выявлен у больных с мягкими бляшками в сравнении с группой больных с кальцинированными бляшками, которые идентифицировали с помощью мультиспиральной компьютерной томографии [17].
В исследовании при оценке иммунного статуса использовали ЦИ ИЛ-6/ИЛ-10 и ФНО-α/ИЛ-10, которые показали преобладание воспалительного над противовоспалительным компонентом иммунной системы у больных ИБС. Результаты сопоставимы с исследованием R. Kumari и соавт., в котором индекс ФНО-α/ИЛ-10 был выше у больных стабильной ИБС относительно контроля, а повышенные уровни ФНО-α и пониженные ИЛ-10 указывали на развитие атеросклероза сосудов [18]. По данным О.В. Хлыновой и соавт., дисбаланс ИЛ-6/ИЛ-10 и ФНО-α/ИЛ-10 также был связан с нарастанием степени коронарного атеросклероза у больных с ОКС [19].
По результатам работы была построена модель логистической регрессии и проведен ее ROC-анализ, который показал хорошую прогностическую значимость ИЛ-6 для выявления больных с тяжелым поражением КА. ИЛ-6, находящийся выше значения 5,19 пг/мл, у больных стабильной ИБС ассоциирован с повышенной вероятностью распространенного атеросклеротического поражения КА. Тем не менее для стратификации пациентов высокого риска необходимы дополнительные исследования с учетом биомаркеров неоваскуляризации атеросклеротических бляшек и других факторов.
Заключение
Для стабильного течения ИБС характерно повышение уровня провоспалительных цитокинов ФНО-α, ИЛ-6, понижение регуляторного ИЛ-2 и противовоспалительного ИЛ-4. С прогрессированием атеросклеротического поражения КА цитокиновый дисбаланс увеличивается. У пациентов с тяжелым поражением КА увеличивается секреция ИЛ-6 и нарастает провоспалительный потенциал крови, о чем свидетельствует ИЛ-6/ИЛ-10. С повышением уровня ИЛ-6 шансы выявления тяжелого обструктивного коронарного атеросклероза увеличиваются в 3,5 раза. При стабильной ИБС определение сывороточного содержания ИЛ-6, наряду с другими методами диагностики, позволяет идентифицировать пациентов с тяжелым поражением коронарным сосудов с хорошей прогностической точностью.
Список литературы Цитокиновый статус у больных с обструктивным коронарным атеросклерозом
- Libby P., Hansson G.K. From focal lipid storage to systemic inflammation: JACC review topic of the week. J. Am. Coll Cardiol. 2019;74(12):1594-1607. https://doi.org/10.1016/j.jacc.2019.07.061.
- Ridker P.M., Everett B.M., Thuren T., MacFadyen J.G., Chang W.H., Ballantyne C. et al. CANTOS Trial Group. Anti-inflammatory therapy with canakinumab for atherosclerotic disease. N. Engl. J. Med. 2017;377(12):1119-1131. https://doi.org/10.1056/NEJMoa1707914.
- Tardif J.C., Kouz S., Waters D.D., Bertrand O.F., Diaz R., Maggioni A.P. et al. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. N. Engl. J. Med. 2019;381(26):2497-2505. https://doi.org/10.1056/NEJMoa1912388.
- Nidorf S.M., Fiolet A.T.L., Mosterd A., Eikelboom J.W., Schut A., Opstal T.S.J. et al. LoDoCo2 Trial Investigators. Colchicine in patients with chronic coronary disease. N. Engl. J. Med. 2020;383(19):1838-1847. https://doi.org/10.1056/NEJMoa2021372.
- Omer W., Naveed A.K., Khan O.J., Khan D.A. Role of cytokine gene score in risk prediction of premature coronary artery disease. Genet. Test Mol. Biomarkers. 2016;20(11):685-691. https://doi.org/10.1089/gtmb.2016.0108.
- Шаленкова М.А., Мухаметова Э.Т., Михайлова З.Д. Роль маркеров некроза и воспаления в прогнозировании острых форм ишемической болезни сердца. Клиническая медицина. 2013;91(11):14-20.
- Арабидзе Г.Г. Клиническая иммунология атеросклероза - от теории к практике. Атеросклероз и дислипидемии. 2013;1(10):4-19.
- Sepehri Z.S., Masoomi M., Ruzbehi F., Kiani Z., Nasiri A.A., Khan F. et al. Comparison of serum levels of IL-6, IL-8, TGF-b and TNF-a in coronary artery diseases, stable angina, and participants with normal coronary artery. Cell Mol. Biol. (Noisy-legrand). 2018;64(5):1-6. https://doi.org/10.14715/cmb/2018.64.5.1.
- Gensini G.G. A more meaningful scoring system for determining the severity of coronary heart disease. Am. J. Cardiol. 1983;51(3):606. https://doi.org/10.1016/s0002-9149(83)80105-2.
- Закирова Н.Э., Хафизов Н.Х., Карамова И. М., Закирова А. Н., Оганов Р.Г. Иммуновоспалительные реакции при ишемической болезни сердца. Рациональная фармакотерапия в кардиологии. 2007;3(2):16-19. URL: https://www.rpcardio.com/jour/article/view/405/424 (12.01.2023).
- Foks A.C., Frodermann V., ter Borg M., Habets K.L., Bot I., Zhao Y. et al. Differential effects of regulatory T cells on the initiation and regression of atherosclerosis. Atherosclerosis. 2011;218(1):53-60. https://doi.org/10.1016/j.atherosclerosis.2011.04.029.
- Zhao T.X., Kostapanos M., Griffiths C., Arbon E.L., Hubsch A., Kaloyirou F. et al. Low-dose interleukin-2 in patients with stable ischemic heart disease and acute coronary syndromes (LILACS): protocol and study rationale for a randomised, double-blind, placebo-controlled, phase I/II clinical trial. BMJ Open. 2018;8(9):e022452. https://doi.org/10.1136/bmjopen-2018-022452.
- Sriranjan R., Zhao T.X., Tarkin J., Hubsch A., Helmy J., Vamvaka E. et al. Low-dose interleukin 2 for the reduction of vascular inflammation in acute coronary syndromes (IVORY): protocol and study rationale for a randomised, double-blind, placebo-controlled, phase II clinical trial. BMJ Open. 2022;12(10):e062602. https://doi.org/10.1136/bmjopen-2022-062602.
- Poredos P., Spirkoska A., Lezaic L., Mijovski M.B., Jezovnik M.K. Patients with an inflamed atherosclerotic plaque have increased levels of circulating inflammatory markers. J. Atheroscler. Thromb. 2017;24(1):39-46. https://doi.org/10.5551/jat.34884.
- Stewart L.K., Nordenholz K.E., Courtney M., Kabrhel C., Jones A.E., Rondina M.T. et al. Comparison of acute and convalescent biomarkers of inflammation in patients with acute pulmonary embolism treated with systemic fibrinolysis vs. placebo. Blood Coagul. Fibrinolysis. 2017;28(8):675-680. https://doi.org/10.1097/ MBC.0000000000000669.
- Held C., White H.D., Stewart R.A.H., Budaj A., Cannon C.P., Hochman J.S. et al. STABILITY Investigators. Inflammatory biomarkers interleukin-6 and c-reactive protein and outcomes in stable coronary heart disease: experiences from the STABILITY (Stabilization of atherosclerotic plaque by initiation of darapladib therapy). Trial. J. Am. Heart Assoc. 2017;6(10):e005077. https://doi.org/10.1161/JAHA.116.005077.
- Lai C.L., Ji Y.R., Liu X.H., Xing J.P., Zhao J.Q. Relationship between coronary atherosclerosis plaque characteristics and high sensitivity C-reactive proteins, interleukin-6. Chin. Med. J. (Engl.). 2011;124(16):2452-2456.
- Kumari R., Kumar S., Ahmad M.K., Singh R., Pradhan A., Chandra S. et al. TNF-α/IL-10 ratio: An independent predictor for coronary artery disease in North Indian population. Diabetes Metab. Syndr. 2018;12(3):221-225. https://doi.org/10.1016/j.dsx.2017.09.006.
- Хлынова О.В., Шишкина Е.А., Абгарян Н.И. Цитокиновый статус пациента с инфарктом миокарда как возможный предиктор степени коронарного атеросклероза. Кардиоваскулярная терапия и профилактика. 2020;19(3):2316. https://doi.org/10.15829/1728-8800-2020-2316. https://doi.org/10.15829/1728-8800-2020-2316.


