Цитологические и морфометрические особенности клеток крови тритона до и после тотальной резекции конечностей
Автор: Донкова Н.В., Рубай А.А.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Сельскохозяйственные науки
Статья в выпуске: 6, 2017 года.
Бесплатный доступ
В статье приведены результаты цитоло-гического и морфометрического анализа кле-ток периферической крови у иглистого три-тона до и после резекции конечностей. Уста-новлено, что иглистые тритоны имеют лим-фоцитарный профиль крови, который не ме- няется после тотальной резекции конечно-стей, нейтрофильная реакция после утраты конечностей у тритонов отсутствует. Об-щее количество эритроцитов и лейкоцитов зависит от физиологического состояния тритонов и изменяется в процессе пост-травматической регенерации. Клетки крови иглистого тритона имеют цитологические и морфометрические особенности, зависящие от стадии посттравматической регенера-ции. В эритроцитах периферической крови существенно изменяется ядерно-цитоплазматическое отношение, при этом площадь эритроцитов у животных, находя-щихся в стадии регенерации, уменьшается втрое. У животных, утративших конечности и находящихся в процессе посттравматиче-ской регенерации, размеры лимфоцитов зна-чительно увеличиваются по сравнению с ин-тактными. После тотальной утраты конеч-ности эритроциты, напротив, уменьшаются в размерах, их форма становится более раз-нообразной. Ядерно-цитоплазматическое от-ношение в эритроцитах в процессе пост-травматической регенерации увеличивается, что свидетельствует об активации клеток гемопоэтического ростка в красном костном мозге.
Цитология, тритон, ре-генерация, эритроциты, лимфоциты
Короткий адрес: https://sciup.org/14084930
IDR: 14084930 | УДК: 616.7
Текст научной статьи Цитологические и морфометрические особенности клеток крови тритона до и после тотальной резекции конечностей
Введение. Иглистый, или ребристый, тритон (лат. Pleurodeles waltl) - вид животных из рода ребристых тритонов отряда хвостатых земно водных. Иглистый тритон - один из самых крупных видов тритонов, обитает на западной части Пиренейского полуострова - юго-западная Испа ния, Португалия и север Марокко [6].
Особенностью этого (и некоторых других, ему родственных) вида тритонов являются выступающие по бокам в случае опасности заострённые концы рёбер, на концах ребер находится ядовитое вещество, вызывающее раздражение и жжение в пасти хищника и заставляющее его бросить добычу [1]. Данных по типу дыхания и кровообращения у тритонов в литературных источниках не найдено, поэтому опорным материалом являются данные по аксолотлям (биологически самый близкий представитель амфибий). Тип дыхания отличается у личинок и взрослых особей. Первые дышат за счет жабр, а взрослые особи за счет легких, также большую роль в дыхании играет кожа. У личинок кровеносная система подобна таковой молодого головастика, то есть функционирует система жаберных сосудов, а сердце имеет неполную перегородку между предсердиями. У взрослых особей, дышащих легкими, также сохраняется три жаберных сосуда. От последнего идет артериальный сосуд к легким. Перегородка между предсердием полная. Хвостовая артерия является прямым продолжением спинной аорты в хвост. Хвостовая вена - темный венозный сосуд, просвечивающийся через прозрачные стенки гемального канала и лежащий вентральнее хвостовой артерии [3]. Особенности дыхания и кровообращения отражают морфофункциональное состоянии клеток крови, однако сведения о цитологии и морфометрии клеток крови иглистого тритона ограничены, что и послужило поводом к их изучению.
Цель исследования . Изучить цитологические особенности и провести морфометрический анализ клеток крови у иглистого тритона до и после тотальной резекции конечностей.
Материалы и методы исследования. Исследования проведены в гистологической лаборатории кафедры анатомии, патологической анатомии и хирургии Института прикладной биотехнологии и ветеринарной медицины Красноярского государственного аграрного университета в 2014–2016 гг.
Объектом исследования явились самки испанского тритона в возрасте от 3 до 5 лет . Материалом для исследования послужили образцы крови иглистого тритона. Тритоны содержались в оборудованном аквариуме, на дне которого находились камни, необходимые в качестве вспомогательных средств в период линьки, а также живые растения. Вода непрерывно фильтровалась и температура поддерживалась на уровне 20–25°С. Уровень воды достигал 20– 25 см, и поскольку тритоны дышат кислородом, им необходимо периодически всплывать на поверхность. Кормили тритонов один раз в три дня сырой куриной печенью. Содержание и кормление осуществлялись в соответствии с рекомендациями [8].
Перед отбором крови тритона извлекали из воды для естественного высушивания поверхности тела в течение 1–2 минут, для предотвращения попадания влаги и образования артефактов (гемолиза) при исследовании. Кровь отбирали из хвостовой артерии, предварительно отсекая кончик хвоста хирургическими ножницами.
Кровь сцеживали в вакуумную пробирку для гематологических исследований, содержащую уже готовый химический стабилизатор крови (K3E K3EDTA).
Для изготовления мазков крови на предварительно обезжиренное и обработанное гепарином стекло (так как кровь имеет очень высокую скорость свертывания) наносили каплю крови и равномерно распредели по стеклу. Затем высушивали на воздухе в течение 5 минут и окрашивали по Паппенгейму. Это комбинированный метод, сочетающий окрашивание краской Май-Грюнвальда (1 г эозиновокислой метиленовой сини на 100,0 мл метиленового спирта и 50,0 мг глицерина) с последующим докрашиванием краской Романовского-Гимза. В связи с тем, что краска приготовлена на метиловом спирте, предварительная фиксация препарата не нужна. Мазок покрывали неразведенной краской Май-Грюнвальда и выдерживали в течение 3 минут, затем к покрывающей мазок краске добавляли равное количество дистиллированной воды, которую тщательно смешивали с краской, и окрашивали в течение 1–2 минут. После этого краску сливали и препарат докрашивали рабочим раствором краски Романовского-Гимза в течение 10–20 минут. Затем мазки обильно промывали водой и высушивали [4].
Идентификация форменных клеток крови осуществлялась по атласу И.М. Карпуть «Гематологический атлас сельскохозяйственных животных». Проводили измерение и подсчет клеток крови исследуемых животных. Полученные мазки просматривали под бинокулярным микроскопом Микомед-5 и производили съемку фотокамерой Canon PC1201.
Для морфометрического анализа клеток крови использовали методику «точечного подсчета» на базе программы Cito20. При этом высчитывали площадь клеток по формуле эллипса
„ я ∙ a ∙ в
sэлипса = ,
, где n – математическая константа (3,1415…); a – длина эллипса; в – ширина эллипса.
Подсчитывали ядерно-цитоплазматическое отношение (ЯЦО) в эритроцитах, так как это важная морфологическая характеристика, позволяющая оценить уровень метаболизма, выявить проявление компенсаторных реакций. Подсчет проводили по формуле
ЯЦО = Sя/Sц, где Sя – площадь ядра клетки; Sц – площадь цитоплазмы [2].
Подсчет форменных элементов крови проводился в счетной камере Горяева. Кровь предварительно разводили с целью уменьшения числа клеток, подлежащих счету. Для подсчета эритроцитов в химические пробирки отмеряли пипеткой по 4 миллилитра раствора хлорида натрия (рН 6,5) и осторожно выдували в нее 0,02 миллилитра крови. Полученное разведение можно практически принять равным 1:200. Взвесь тщательно перемешивали и заполняли камеру Горяева. После заполнения камеру оставляли на 1–2 минуты в покое для оседания форменных элементов, затем приступали к подсчету при малом увеличении микроскопа в затемненном поле зрения (прикрытой диафрагме и опущенном конденсоре).
Эритроциты считали в пяти больших квадратах (5х16=80 малых квадратах), расположенных по диагонали. Для того чтобы дважды не сосчитать одни и те же эритроциты, лежащие на пограничных линиях, соблюдали правило: к данному квадрату принадлежат те эритроциты, которые находятся большей своей частью внутри него и разделены пограничной линией.
Количество эритроцитов в 1 миллилитре крови рассчитывали по формуле
(а · 4000 · 200) /80, где а – число подсчитанных эритроцитов; 4000 – приведение к объему 1 мкл крови; 200 – степень разведения; 80 – количество малых квадратов.
Для подсчета лейкоцитов в видалевскую пробирку вносили 0,4 мл жидкости Тюрка и 0,02 мл крови. В качестве разводящей жидкости употребляли 3–5%-й раствор уксусной кислоты, подкрашенной метиленовым синим (уксусная кислота лизирует эритроциты, метиленовый синий окрашивает ядра лейкоцитов). Перед заполнением камеры Горяева пробирку с разведенной кровью тщательно встряхивали. Лейкоцитов гораздо меньше, чем эритроцитов (1–2 на большой квадрат), поэтому для точности подсчет производили в 100 больших квадратах.
Количество лейкоцитов рассчитывали в 1 мкл крови
(а · 4000 · 20) /1600, где а – число подсчитанных эритроцитов; 4000 – приведение к объему 1 мкл крови; 20 — степень разведения; 1600 – количество малых квадратов.
В среднем ошибка метода составляет ± 7 % [5].
Расчет показателей вариационного ряда и t-критерия Стьюдента при сравнении средних величин проводился на он-лайн калькуляторе для расчета статистических критериев [9].
Результаты исследования. Микроструктурный анализ клеток периферической крови у иглистых тритонов показал, что в интактном состоянии и после тотальной резекции конечностей лимфоцитарный профиль крови на нейтрофильный не меняется. На мазках крови тритона, окрашенных краской Романовского-Гимза или гематоксилином и эозином, относительное количество эритроцитов достигает 88– 92 %. При подсчете в камере Горяева абсолютное количество эритроцитов составляет 190х10³/мкл, или 1,90х1012/л.
Микроскопически эритроциты у интактных тритонов имеют разнообразную форму, ядра чаще смещены эксцентрично. Хроматин окрашен интенсивно базофильно. Цитоплазма слабо ок-сифильна (рис. 1). Эритроциты у тритонов в процессе посттравматической регенерации уменьшаются в размерах, форма их очень варьируется от округлой до эллипсоидной, ядра располагаются эксцентрично. При окраске по Романовскому-Гимза цитоплазма мутная голубовато-серого цвета, а ядра – сине-фиолетовые (рис. 2).
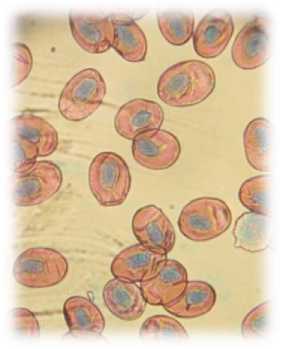
Рис. 1. Эритроциты крови тритона в интактном состоянии. Об. 40х (окраска: гематоксилин и эозин)
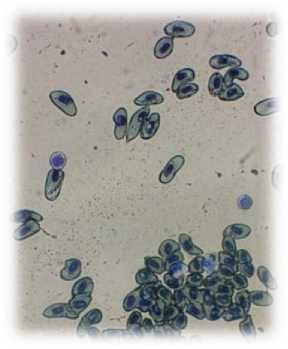
Рис. 2. Эритроциты крови тритона после резекции конечности. Об. 40х (окраска: Романовского-Гимза)
Ядерно-цитоплазматическое отношение определяли при объективе 40х. Размеры ядра и цитоплазмы высчитывали с использованием программы Cito 2,0. Измерения проводили в пяти полях зрения мазка крови по 25 клеток в каждом. Место для подсчета выбирали по мак- симально удобному для подсчетов количеству эритроцитов в поле зрения. Результаты вычисления ЯЦО в интактном состоянии и после резекции конечностей у тритона представлены в таблицах 1, 2.
ЯЦО в эритроцитах тритона в интактном состоянии
Таблица 1
|
Количество измеренных эритроцитов, шт. |
Среднеарифметическая площадь клетки (S к ), мкм |
Среднеарифметическая площадь цитоплазмы клетки (S ц ), мкм |
Среднеарифметическая площадь ядра клетки (S я ), мкм |
Среднеарифметическое ЯЦО |
|
25 |
391,51 |
328,51 |
63,00 |
0,19 |
|
25 |
386,17 |
327,66 |
58,51 |
0,18 |
|
25 |
388,60 |
328,54 |
60,06 |
0,18 |
|
25 |
392,21 |
325,48 |
66,73 |
0,2 |
|
25 |
387,81 |
328,01 |
59,80 |
0,18 |
Таблица 2
Подсчет ЯЦО в эритроцитах тритона после резекции конечностей
|
Количество эритроцитов, шт. |
Среднеарифметическая площадь клетки (S к ), мкм |
Среднеарифметическая площадь цитоплазмы клетки (S ц ), мкм |
Среднеарифметическая площадь ядра клетки (S я ), мкм |
Среднеарифметическое ЯЦО |
|
25 |
96,69 |
75,43 |
21,26 |
0,28 |
|
25 |
106,14 |
85,42 |
20,72 |
0,24 |
|
25 |
114,5 |
95,95 |
18,55 |
0,19 |
|
25 |
114,82 |
95,83 |
18,99 |
0,19 |
|
25 |
118,52 |
100,78 |
17.74 |
0,18 |
Из анализа данные таблиц 1, 2 видно, что в процессе регенерации у иглистого тритона раз- меры эритроцитов претерпевают изменения. Площадь эритроцитов у животных, находящихся в стадии регенерации, уменьшилась втрое. Суммарное количество площади клетки (Sк) у интактных животных составило 389,26± 1,27 мкм, а у животных в стадии регенерации 110,13±4,39 мкм. Суммарное количество площади цитоплазмы клетки (Sц) у тритонов до резекции в среднем составляло 327,64±0,63 мкм, а у подопытной группы после резекции значительно уменьшилось и составило 90,68± 5,1 мкм. Среднее суммарное количество площади ядра клетки у тритонов в интактном состоянии (Sя) 61,62±1,65 мкм, а после резекции конечности, при запуске механизма регенерации, оно существенно снижается и составляет 19,88±0,76 мкм. С учетом этих данных был произведен подсчет среднего ЯЦО. Установлено, что до резекции ЯЦО составляло 0,19±0,02 мкм, а через два месяца после резекции, в процессе регенерации, ЯЦО увеличивалось до 0,22± 0,02 мкм. Таким образом, на структуру эритроцитов периферической крови иглистого тритона влияют регенераторные процессы, развивав- шиеся после тотальной резекции конечности. Эритроциты при процессе регенерации изменяют свои размеры, они становятся втрое меньше, их форма становится более разнообразной, от округлой до эллипсоидной, а ядерно-цитоплазмтическое отношение возрастает.
Уровень лейкоцитов в крови тритона до и после резекции конечности существенно не изменялся и составил 2,7х109/л. Из них 8–12 % составили лимфоциты. У интактных тритонов лимфоциты имеют размытую плазмолемму, в цитоплазме содержатся глыбки хроматина, ядро неровной формы. Ядро крупное базофильное с тонким ободком бледной кариолеммы. В ядре различается ядрышко и глыбки хроматина (рис. 3). На мазках крови от тритонов, в стадии регенерации, лимфоциты имеют округлую форму, цитоплазма окрашена в сине-голубой цвет, а ядра – в цвет от интенсивно-пурпурного до фиолетового. Глыбки хроматина в ядре различимы и окрашены более интенсивно (рис. 4).
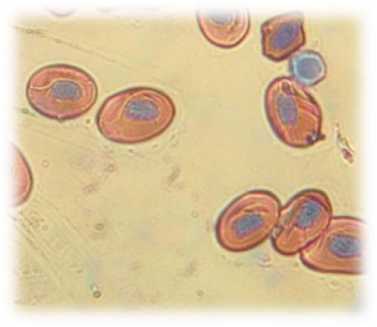
Рис. 3. Лимфоцит у тритона в интактном состоянии. Об. 40х (окраска: гематоксилином и эозином)
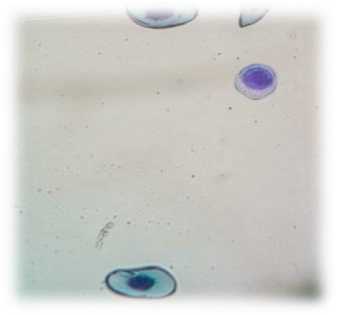
Рис 4. Лимфоцит у тритона после резекции конечности. Об. 40х (окраска: Романовского-Гимза)
Подсчет ЯЦО производили на фотографиях мазков крови при увеличении 40х, измерение площади ядра и цитоплазмы проводили в программе Cito 2,0 по 10 лимфоцитов на каждом мазке. Место для подсчета выбиралось по мак- симально удобному для подсчетов количеству лимфоцитов в поле зрения.
Результаты вычисления ЯЦО в лимфоцитах периферической крови у тритонов в интактном состоянии и после резекции конечностей представлены в таблицах 3, 4.
Таблица 3
|
Количество лимфоцитов, шт. |
Среднеарифметическая площадь клетки (S к ), мкм |
Среднеарифметическая площадь цитоплазмы клетки (S ц ), мкм |
Среднеарифметическая площадь ядра клетки (S я ), мкм |
Среднеарифметическое ЯЦО |
|
10 |
216,53 |
132,17 |
84,36 |
0,65 |
|
10 |
211,54 |
126,72 |
84,82 |
0,73 |
|
10 |
228,01 |
141,61 |
86,4 |
0,61 |
|
10 |
215,71 |
134,1 |
81,61 |
0,61 |
|
10 |
216,88 |
132,84 |
84,04 |
0,63 |
Таблица 4
|
Количество лимфоцитов, шт. |
Среднеарифметическая площадь клетки (S к ), мкм |
Среднеарифметическая площадь цитоплазмы клетки (S ц ), мкм |
Среднеарифметическая площадь ядра клетки (S я ), мкм |
Среднеарифметическое ЯЦО |
|
10 |
62,1 |
34,32 |
27,78 |
0,81 |
|
10 |
65,95 |
35,14 |
30,81 |
0,88 |
|
10 |
71,3 |
39,65 |
31,65 |
0,8 |
|
10 |
64,24 |
36,86 |
27,38 |
0,74 |
|
10 |
64,08 |
34,39 |
29,69 |
0,86 |
ЯЦО в лимфоцитах крови иглистого тритона в интактном состоянии
Подсчет ЯЦО в лимфоцитах на мазках крови иглистого тритона в состоянии посттравматической регенерации
Из данных таблиц 3, 4 следует, что лимфоциты имеют различные размеры до и после резекции. Суммарное количество площади клетки (Sк) у иглистого тритона в интактном состоянии в среднем составляет 217,73±3,06 мкм, а у тритонов после резекции конечности – 65,5± 1,75 мкм. Суммарное количество площади цитоплазмы клетки (Sц) у тритонов до резекции конечности составляет 133,49±2,67 мкм, а в процессе регенерации – 36,1±1,12 мкм. При этом среднее суммарное количество площади ядра клетки (Sя) у интактных тритонов составило 84,25±0,87 мкм, а после ампутации – 29,5±0,93 мкм. Среднее ЯЦО у интактных тритонов составило 0,64±0,02 мкм, а у тритонов после тотальной резекции, находящихся в процессе регенерации, 0,82±0,03 мкм. Таким образом, количество лимфоцитов и их структура в периферической крови иглистого тритона в возрасте от 1 года до 3 лет зависят от стадии регенерации. Так, у животных, не подвергнутых травмам или утрате конечностей, клетки крови значительное крупнее, чем у тритонов, которые утратили конечности и находятся в процессе восстановления утраченных частей тела.
Нейтрофилы в мазке крови тритонов немногочисленны, имеют небольшое по размеру сегментированное ядро, цитоплазма окрашена слабооксифильно. Также встречаются малодифференцированные клетки с нечетко конту- рированной цитолеммой, в цитоплазме просматривается вакуализированная зона и протоплазма, в которой содержатся гранулы в виде длинных оксифильных волн. Тромбоциты располагаются группами, имеют сливовидную форму, насыщенную темно-фиолетовую окраску.
Выводы . Таким образом, клетки крови иглистого тритона имеют цитологические и морфометрические особенности, зависящие от стадии посттравматической регенерации. У животных, которые утратили конечности и находятся в процессе восстановления утраченных частей тела, не подвергнутых травмам или утрате конечностей, лимфоциты значительно крупнее. После тотальной утраты конечности эритроциты в стадии регенерации, эритроциты уменьшаются в размерах, их форма становится более разнообразной, а ядерно-цитоплазматическое отношение, напротив, увеличивается, что свидетельствует об активации клеток гемопоэтического ростка в красном костном мозге.
Список литературы Цитологические и морфометрические особенности клеток крови тритона до и после тотальной резекции конечностей
- Ананьева Н.Б., Бор Л.Я., Даревский И.С. . Пятиязычный словарь названий жи-вотных. Амфибии и рептилии. Латинский, русский, английский, немецкий, француз-ский/под общ. ред. В.Е. Соколова. -М.: Рус.яз., 1988. -С. 33.
- Грузова М.Н. Экстрахромосомная ядерная ДНК в оогенезе//Метаболизм клеточного ядра и ядерно-цитоплазматические отно-шения: тез. докл. -Киев, 1970. -С. 229-230.
- Гуртовой Н.Н., Матвеев Б.С., Дзержин-ский Ф.Я. Практическая зоотомия позво-ночных. Земноводные. Пресмыкающиеся. -М.: Высшая школа, 1978. -С. 40-41.
- Карпуть И.М. Гематологический атлас сельскохозяйственных животных. -Минск: Ураджай, 1986. -С. 20.
- Кост Е.А. Справочник по клиническим и лабораторным методам исследования. -М.: Медицина, 1975. -383 с.
- Медников Д. Хвостатые земноводные. -М.: Аквариум, 2009. -48 с.
- Силс Е.А. Сравнительный анализ гематоло-гических показателей остромордой и озер-ной лягушек городских популяций//Вестник ОГУ. -2009. -№ 10 (92). -C. 230-235.
- Veterinary Nursing of Exotic Pets, Second Edi-tion/Ed. by Simon J. Girling. © 2013 John Wiley & Sons, Ltd. Published 2013 by John Wiley & Sons, Ltd.
- URL: http://medstatistic.ru/calculators.html (дата обращения: 12.11.2016).


