Цитотоксический и прооксидантный эффекты аскорбата лития in vitro
Автор: Лосенков Иннокентий Сергеевич, Плотников Евгений Владимирович, Епимахова Елена Викторовна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 1 (98), 2018 года.
Бесплатный доступ
В настоящее время ведется разработка и изучение новых комплексных препаратов лития с антиоксидантными свойствами. Перспективным в этом отношении может быть аскорбат лития. Проведена оценка цитотоксичности аскорбата лития и аскорбиновой кислоты, а также изучено их влияние на окислительный стресс на клеточной модели мононуклеаров периферической крови. Обнаружен выраженный цитотоксический эффект аскорбата лития и аскорбиновой кислоты, заключающийся в повышении процента клеток как в состоянии раннего апоптоза, так и в состоянии позднего апоптоза/некроза. Продемонстрирована индукция окислительного стресса (повышение процента клеток с активными формами кислорода) в присутствии этих соединений. Таким образом, в экспериментах in vitro в используемых концентрациях аскорбат лития не является антиоксидантом, то есть для оценки аскорбата лития как потенциального фармакологического препарата требуются дальнейшие исследования как на других клеточных культурах in vitro, так и в экспериментах in vivo.
Литий, аскорбата лития, аскорбиновая кислота, окислительный стресс, цитотоксичность, апоптоз
Короткий адрес: https://sciup.org/142212913
IDR: 142212913 | УДК: 616.89:661.834:547.475.2
Текст научной статьи Цитотоксический и прооксидантный эффекты аскорбата лития in vitro
Литиевые соли, внедренные в психиатрию в середине прошлого века, до сих пор широко используются в качестве нормотимиков – стабилизаторов настроения [1]. Наиболее распространенным препаратом остается карбонат лития.
Механизм действия лития весьма сложен и продолжает активно изучаться. Достоверно показано, что литий включается в целый ряд механизмов внутриклеточной регуляции. Ключевой мишенью лития является ингибирование киназы гликогенсин-тазы 3 (GSK-3)[2]. Вместе с тем литий обладает ан-тиапоптотическим действием и, вероятно, влияет на Akt1/PI3K/mTOR путь [3]. Помимо этого литий обладает выраженной нейропротективной активностью in vivo [4].
В последнее время появились публикации о комплексном защитном действии ионов лития при индуцированном окислительном стрессе [5, 6]. Развитие окислительного стресса отмечается при ряде соматических и психических патологий, в частности показано истощение антиоксидантных систем при алкоголизме [7, 8]. Поэтому применение антиоксидантов в комплексной терапии патогенетически обосновано.
В настоящее время ведется разработка и изучение новых комплексных препаратов лития с антиоксидантными свойствами [9]. Показано, что среди изученных соединений выраженной антиоксидантной активностью обладает аскорбат лития, который в то же время характеризуется нейропротекторными свойствами [10] и способен защищать белки и липиды плазмы крови от повреждающего действия этанола [11].
В этой связи важной задачей является оценка биологической активности соединений лития, в частности их влияние на окислительный стресс и цитотоксичность в клеточных культурах. В данной работе впервые проведена оценка цитотоксического действия аскорбата лития и изучен его эффект на продукцию активных форм кислорода в культуре мононуклеаров периферической крови человека.
Цель исследования – изучение цитотоксического и прооксидантного эффектов аскорбата лития in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы
Необходимое для эксперимента количество аскорбата лития синтезировано на кафедре физической и аналитической химии Томского политехнического университета. Синтез произведен из химически чистых реагентов карбоната лития и аскорбиновой кислоты (Sigma-Aldrich, Германия). Аскорбат лития перекристаллизовывали и использовали в дальнейших опытах.
Получение клеточной культуры мононуклеаров крови человека
В исследовании использовали кровь 9 здоровых лиц – 3 мужчин и 6 женщин в возрасте от 25 до 54 лет, медиана – 35,0 (25,0–53,0). Кровь получена из локтевой вены в пробирки с гепарином натрия системы однократного применения Vacutainer («Bec-ton Dickinson», США). Мононуклеары выделяли из крови путем центрифугирования на градиенте плотности фиколла (ρ=1,077 г/см3) («Sigma-Aldrich», США) по стандартной методике [9]. Полученные клетки ресуспендировали в среде RPMI-1640. Клеточную суспензию сразу использовали в экспери- менте.
Изучение цитотоксической активности
Исследование окислительного стресса
Влияние соединений на окислительный стресс исследовали с использованием набора реагентов «Oxidativestress» (MerckMillipore, Германия) на проточном цитолюориметре «MuseCellAnalyzer» (MerckMillipore, Германия). Левый пик графика (гейт M1) считали как процент клеток, свободных от активных форм кислорода, и обозначали как ROS(-), правый пик графика (гейт M2) считали как процент клеток, содержащих активные формы кислорода, – ROS(+).
С целью оценки цитотоксической активности и окислительного стресса мононуклеары инкубировали в присутствии аскорбата лития или аскорбата в течение 24 часов при 37°С в среде 5% углекислого газа. В исследовании использованы следующие концентрации: 0,5, 1 или 2 ммоль/л конечной концентрации ионов лития в лунке.
Статистическая обработка результатов п роведена с помощью программы SPSS (версия 20.0). Рассчитывали медиану, первый и третий квартили.
Для сравнения количественных переменных использовались критерии Манна-Уитни и Краскела-Уоллиса. Различия считали статистически достоверными при уровне значимости р<0,05.
РЕЗУЛЬТАТЫ
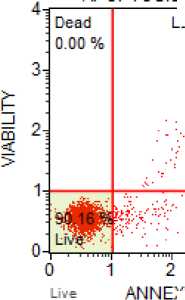
Была проведена оценка цитотоксического действия аскорбата лития. Данные о проценте клеток в состоянии апоптоза и некроза представлены в таблице 1 и на рисунке 1.
Таблица 1
Уровень клеточной гибели (%) при воздействии аскор бата лития - Me (Q 1 - Q3) (критерий Манна-Уитни)
|
Показатель |
Группа |
||
|
Ранний апоптоз (early apoptosis) |
Поздний апоптоз/некроз (late apoptosis/dead) |
Некроз (dead) |
|
|
Интактные клетки |
13,30 (10,20–13,45) |
12,88 (10,20–13,45) |
0 |
|
0,5 ммоль/л |
31,941 |
61,734 |
0,08 |
|
аскорбата лития |
(30,55–35,24) |
(52,85–67,36) |
(0–0,2) |
|
1 ммоль/л |
28,02 |
64,935 |
0,05 |
|
аскорбата лития |
(27,10–34,29) |
(52,98–72,07) |
(0–4,0) |
|
2 ммоль/л |
28,803 |
69,306 |
0,05 |
|
аскорбата лития |
(25,50–34,64) |
(50,77–72,22) |
(0–0,9) |
П р и м е ч а н и е. 1, 4, 5 – р<0,001 по сравнению с интактными клетками; 2 – p=0,004 по сравнению с интактными клетками; 3 – p=0,001 по сравнению с интактными клетками; 6 – p=0,006 по сравнению с интактными клетками.
Был обнаружен цитотоксический эффект аскорбата лития, заключающийся в статистически значимом (р<0,05) повышении процента клеток в состоянии раннего апоптоза и позднего апоптоза/некроза при инкубации с данным соединением. Дозозависимого эффекта аскорбата лития на вышеперечисленные параметры не найдено (р>0,05).
APOPTOSIS PROFILE
Late Apop./Dead
2.38%
а
APOPTOSIS PROFILE
7.46 %
Early Apop.
V Apoptotic
V Apoptotic
б
LateApop./Dead
54.90 %
31.55% Early Apop.
4-
Live ANNEXIN V Apoptotic
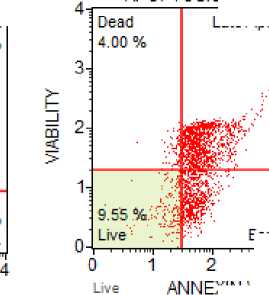
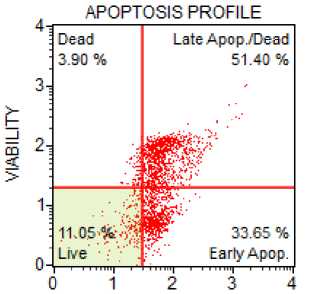
Рисунок 1. Цитотоксичность аскорбата лития и аскорбиновой кислоты в эксперименте: (а) интактная культура, (б) культура в присутствии 2,0 ммоль/л аскорбата лития, (в) культура в присутствии 2,0 ммоль/л аскорбиновой кислоты
По результатам эксперимента нами была выдвинута гипотеза и том, что цитотоксический эффект аскорбата лития может реализоваться через действие аскорбат-аниона. Для подтверждения данной гипотезы проведена оценка цитотоксичности аскорбиновой кислоты (табл. 2 и рис. 1).
Как видно из таблицы 2 и рисунка 1, аскорбиновая кислота обладала выраженным цитотоксическим действием, проявляющимся в статистически значимом (р<0,05) повышении процента клеток в состоянии апоптоза и некроза. Не было обнаружено дозо- зависимого цитотоксического эффекта данного соединения (р>0,05).
Таблица 2
Уровень клеточной гибели (%) при воздействии аскор бата лития - Me (Q 1 - Q3) (критерий Манна-Уитни)
|
Показатель |
Группа |
||
|
Ранний апоптоз (early apoptosis) |
Поздний апоптоз/некроз (late apoptosis/dead) |
Некроз (dead) |
|
|
Интактные клетки |
13,30 (10,20–13,45) |
12,88 (10,20–13,45) |
0 |
|
0,5 ммоль/л аскорбиновой кислоты |
30,551 (26,35–37,58) |
60,274 (56,20–63,04) |
0,10 (0–5,51) |
|
1 ммоль/л аскорбиновой кислоты |
34,902 (16,32–38,44) |
54,975 (47,28–61,60) |
1,71 (0–7,71) |
|
2 ммоль/л аскорбиновой кислоты |
29,393 (26,11–40,30) |
62,606 (50,25–70,50) |
0 |
П р и м е ч а н и е. 1, 4, 5, 6 – р<0,001 по сравнению с интактными клетками; 2, 3 – p=0,001 по сравнению с интактными клетками.
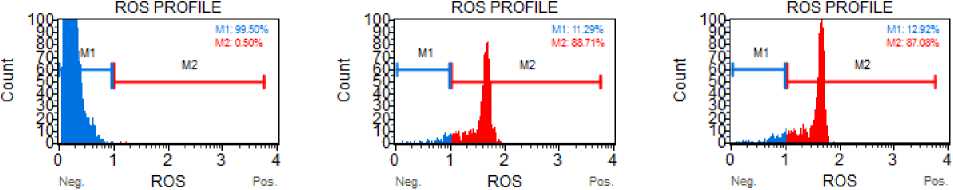
Известно, что аскорбиновая кислота способна выступать как в качестве восстановителя (антиоксидант), так и качестве окислителя (прооксидант). Нами было выдвинуто предположение, что цитотоксический эффект аскорбат-аниона может быть опо- средован индукцией окислительного стресса. Произведена оценка содержания активных форм кислорода в мононуклеарах периферической крови при действии аскорбата лития и аскорбиновой кислоты. Данные представлены в таблице 3 и на рисунке 2.
Таблица 3
Содержание клеток с активными формами кислорода (%) при воздействии аскорбата лития и аскорбиновой кислоты - Ме (Q1 - Q3) (критерий Манна-Уитни).
|
Показатель |
Клетки с активными формами кислорода, (%) |
|
Интактные клетки |
13,0 (6,45–23,68) |
|
0,5 ммоль/л аскорбата лития |
83,101 (80,88–90,46) |
|
1 ммоль/л аскорбата лития |
83,322 (80,22–89,13) |
|
2 ммоль/л аскорбата лития |
90,583 (81,55–91,41) |
|
0,5 ммоль/л аскорбиновой кислоты |
84,574 (71,74–90,23) |
|
1 ммоль/л аскорбиновой кислоты |
85,935 (82,44–88,89) |
|
2 ммоль/л аскорбиновой кислоты |
87,196 (84,81–88,87) |
П р и м е ч а н и е. 1, 2, 3, 4, 5, 6 – р<0,001 по сравнению с интактными клетками.
а б В
Рисунок 2 . Содержание активных форм кислорода (ROS) в интактных мононуклеарах периферической крови (а) и при действии аскорбата лития (б) и аскорбиновой кислоты (в) Гейт M1 – ROS-негативные клетки, гейт М2 – ROS-позитивные клетки.
Как видно из таблицы 3 и рисунка 2, как аскорбат лития, так и аскорбиновая кислота обладала выраженным прооксидантным действием, статистически значимо (р<0,001) повышая содержания клеток с активными формами кислорода. Дозозависимого эффекта данных соединений в отношении продукции активных форм кислорода не было обнаружено (р>0,05).
ОБСУЖДЕНИЕ
Таким образом, в нашем исследовании обнаружена выраженная цитотоксичность аскорбата лития, реализуемая прооксидантным действием аскорбат-аниона. Исследование уровня окислительного стресса в культуре клеток полностью коррелирует с уровнем цитотоксичости в культуре, что подтверждает окислительный пусковой механизм данного процесса. Аналогичные результаты получены для аскорбиновой кислоты в тех же дозах, что подтверждает основное действие аскорбат-аниона, однако действие иона лития в данном случае не вносит существенного вклада в цитотоксический эффект, наблюдаемый в культуре мононуклеаров периферической крови.
Традиционно считается, что аскорбиновая кислота и аскорбат-анион являются антиоксидантами, обладая выраженными восстановительными свойствами, метаболизируясь до дегидроаскорбиновой кислоты [10] (рис 3).
но—с
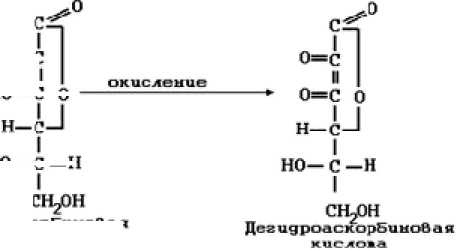
ЛскорБиноВая кислова
Р и с у н о к 3 . Окисление аскорбиновой кислоты
НО—С О
но— с —н
стресса при действии аскорбата аниона. В ряде исследований доказано, что аскорбиновая кислота может запускать окислительный стресс. Продемонстрировано, что этот процесс катализируется ионами металлов: железо (III) [11], медь (II) [12] (рис. 4), кадмий (II) и никель (II) [13]. Результатом этого процесса является образование гидроперекиси водорода. В здоровых клетках организма экспрессия антиоксидантных ферментов достаточна, чтобы нейтрализовать перекись водорода и предотвратить индукцию окислительного стресса.
Нами было показана индукция окислительного
Ascorbate + Си2+ + О2 + 2Н+ —»Dehydroascorbate 4- Си+ + Н2О2
Си+ + Н2О2 — Си2+ + ОН’ + ОН*
Рисунок 4 . Окисление аскорбиновой кислоты в присутствием ионов меди (II) с образованием гидроперекиси водорода
N.H. Riordan et al. (1995) предположили, что аскорбиновая кислота в дозах, превышающих физиологические, может быть использована как препарат химиотерапии ввиду того, что в опухолевых клетках понижена экспрессия антиоксидантных ферментов [14]. Вследствие этого перекись, образованная окислением аскорбиновой кислоты, слабо утилизируется, приводя к индукции окислительного стресса и цитотоксичности аскорбат-аниона.
Аскорбат лития, являясь солью аскорбиновой кислоты, сохраняет присущие ей антиоксидантные свойства. Ранее была установлена высокая активность аскорбата лития в отношении кислородных радикалов [15]. Однако это исследование было выполнено на плазме крови. Так же, как было сказано выше, аскорбат лития обладает нейропротекторным свойствами in vivo [8]. Вероятно, что в изолированной культуре мононуклеаров, культивируемых в среде RPMI-1640, предназначенной для работы с лимфоидными клетками, не достигается достаточный уровень экспрессии антиоксидантных ферментов, способных утилизировать гидроперекись водорода и, как следствие, нивелировать прооксидант-ные свойства аскорбат-аниона.
ЗАКЛЮЧЕНИЕ
Установлен цитотоксический эффект аскорбата лития в отношении мононуклеаров периферической крови. Данный эффект объясняется проокислитель-ным действием аскорбат-аниона. Цитотоксического и прооксидантного эффектов ионов лития не выявлено. Для оценки аскорбата лития как потенциального фармакологического препарата требуются дальнейшие исследования как на других клеточных культурах in vitro, так и в экспериментах in vivo.
Список литературы Цитотоксический и прооксидантный эффекты аскорбата лития in vitro
- Машковский М.Д. Лекарственные средства: в двух частях. Часть 1. 12-е изд. М.: Медицина; 1986: 544.
- Freland L., Beaulieu J.M. Inhibition of GSK3 be lithium, from single molecules to signaling networks. Frontiers in molecular neuroscience. 2013; 5: 9-15.
- Wu J., Zhu D., Zhang J., Li G., Liu Z., Sun J. Lithium protects against methamphetamine-induced neurotoxicity in PC12 cells via Akt/GSK3b/mTOR pathway. Biochem. Biophys. Res. Commun. 2013;465: 368-373.
- Zheng J., Liu Z., Li W., Tang J., Zhang D., Tang X. Lithium posttreatment confers neuroprotection through glycogen synthase kinase-3ß inhibition in intracerebral hemorrhage rats. J. Neurosurg. 2017; 127: 716-724.
- Saberzadeh J., Omrani M., Takhshid M.A. Protective effects of nimodipine and lithium against aluminum-induced cell death and oxidative stress in PC12 cells. Iran J. Basic. Med. Sci. 2016; 19: 1251-1257.
- da-Rosa D.D., Valvassori S.S., Steckert A.V., Ornell F., Ferreira C.L., Lopes-Borges J. Effects of lithium and valproate on oxidative stress and behavioral changes induced by administration of m-AMPH. Psychiatry Res. 2012; 198: 521-526.
- Plotnikov E., Korotkova E., Voronova O., Sazhina N., Petrova E., Artamonov A., Chernyavskaya L., Dorozhko E. Comparative investigation of antioxidant activity of human serum blood by amperometric, voltammetric and chemiluminescent methods. Archives of medical sciences. 2016; 12: 1071-1076.
- Прокопьева В.Д., Ярыгина Е.Г., Кротенко Н.М., Бойко А.С., Бохан Н.А., Иванова С.А. Показатели антиоксидантной системы и дофамина плазмы крови в динамике микроволновой резонансной терапии у больных алкоголизмом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017; 117 (9): С.67-70.
- Plotnikov E., Voronova O., Linert W., Martemianov D., Korotkova E., Dorozhko E., Astashkina A., Martemianova I., Ivanova S., Bokhan N. Antioxidant and Immunotropic Properties of some Lithium Salts. J. App. Pharm. Sci. 2016; 6: 86-89.
- Балашов П.П., Аникина Е.Ю., Плотников Е.В., Потапов А.В., Чучалин В.С. Сравнительное изучение нейротоксического действия солей лития. Сибирский вестник психиатрии и наркологии. 2008; 4 (51): 84.
- Plotnikov E., Prokopieva V., Yarygina E., Losenkov I. Lithium ascorbate as a protector of human blood biomolecules under ethanol impact. National Journal of Physiology, Pharmacy and Pharmacology. 2018; 8: 82-86.
- Натвиг Д.Б. Лимфоциты, выделение, фракционирование, характеристики. М.: Букинист, 1980: 280.
- Pohanka M., Pejchal J., Snopkova S., Havlickova K., Karasova J.Z., Bostik P., Pikula J. Ascorbic acid: an old player with a broad impact on body physiology including oxidative stress suppression and immunomodulation: a review. Mini Rev. Med. Chem. 2012; 12: 35^3.
- Kang J.S., Cho D., Kim Y.I., Hahm E., Kim Y.S., Jin S.N., Kim H.N., Kim D., Hur D., Park H., Hwang Y.I., Lee W.J. Sodium ascorbate (vitamin C) induces apoptosis in melanoma cells via the down-regulation of transferrin receptor dependent iron uptake. J. Cell Physiol. 2005; 204: 192-197.
- Dutta M., Ghosh A.K., Mishra P., Jain G., Rangari V., Chattopadhyay A., Das T., Bhowmick D., Bandyopadhyay D. Protec tive effects of piperine against copper-ascorbate induced toxic injury to goat cardiac mitochondria in vitro. Food Funct. 2014; 5: 2252-2267.
- Littlefield N.A., Hass B.S. Damage to DNA by cadmium or nickel in the presence of ascorbate. Ann. Clin. Lab. Sci. 1995; 25: 485-492.
- Riordan N.H., Riordan H.D., Meng X., Li Y., Jackson J.A. Intravenous ascorbate as a tumor cytotoxic chemotherapeutic agent. Med Hypotheses. 1995; 44: 207-213.
- Plotnikov E., Korotkova E., Voronova О., Dorozhko Е., Bohan N., Plotnikov S. Lithium-based antioxidants: electrochemical properties and influence on immune cells. Physiologyandpharmacology, 2015; 19: 107-113.


