COVID-19. Этиология, патогенез, диагностика и лечение
Автор: Баклаушев Владимир Павлович, Кулемзин Сергей Викторович, Горчаков Андрей Александрович, Лесняк Виктор Николаевич, Юсубалиева Гаухар Маратовна, Сотникова Анна Геннадиевна
Журнал: Клиническая практика @clinpractice
Рубрика: Срочно в номер
Статья в выпуске: 1 т.11, 2020 года.
Бесплатный доступ
Резюме: COVID-19 (от англ. Coronavirus disease 2019) - новое эпидемическое инфекционное заболевание, характеризующееся сравнительно высокой контагиозностью и вероятностью развития жизнеугрожающих осложнений в виде острого респираторного дистресс-синдрома, острой дыхательной и полиорганной недостаточности. Возбудитель заболевания - оболочечный зоонозный РНК-вирус SARS-CoV-2 - относится к семейству Coronaviridae, роду Betacoronavirus, как и известные ранее вирусы SARS-CoV и MERS-CoV, которые вызывают тяжелый острый респираторный синдром и ближневосточный респираторный синдром соответственно. Эпидемия COVID-19 быстро распространилась по всему миру и в настоящее время охватывает 213 стран, в которых зарегистрировано более 1,6 млн заболевших, из которых на данный момент умерло более 90 000 человек. Постановлением Правительства Российской Федерации SARS-CoV-2 включен в перечень заболеваний, представляющих опасность для окружающих наряду с особо опасными инфекциями. Вирус передается воздушно-капельным, воздушно-пылевым и контактным путями, поэтому для защиты медперсонала необходимо применение индивидуальных защитных костюмов и принадлежностей с защитой дыхательных путей и глаз, проведение дезинфекции рук и поверхностей, как при работе с микроорганизмами I-II группы патогенности...
Коронавирус, этиопатогенез, кт-терапия, мск, nk-клетки
Короткий адрес: https://sciup.org/143170838
IDR: 143170838 | DOI: 10.17816/clinpract26339
Текст научной статьи COVID-19. Этиология, патогенез, диагностика и лечение
В настоящее время мир переживает эпидемию нового вирусного заболевания COVID-19 (от англ. Coronavirus Disease 2019), обусловленного обнаруженным в декабре 2019 года новым штаммом коронавирусов SARS-CoV-2 (Severe Acute Respiratory Syndrome, Coronavirus-2) [1]. Первые случаи заболевания были зарегистрированы в китайском г. Ухане провинции Хубей в декабре 2019 г. [2], а уже 11 марта 2020 г. Всемирная организация здраво- охранения официально классифицировала эпидемическую ситуацию как пандемию. По состоянию на 11 апреля 2020 г., 1 610 909 случаев COVID-19 выявлено в 213 странах мира, 99 690 человек скончались в результате этого заболевания [3]. В России на сегодняшний день официально подтверждены более 13 500 случаев COVID-19, из которых 106 закончились летально. Несмотря на карантинные мероприятия, ежедневно регистрируются более 1000 новых случаев, и можно прогнозировать, что
<линическая’2п20 п эакти ка Том 11 №1
этот показатель будет расти в течение ближайших нескольких суток, поскольку пик эпидемии в России еще не пройден. По мнению многих экспертов, фактическое количество случаев COVID-19 во всем мире может быть значительно выше, чем официально подтвержденное, поскольку диагностика методом полимеразной цепной реакции (ПЦР) не проводится повсеместно, валидированные лабораторные тесты на наличие антител к SARS-CoV-2 в России пока недоступны, и значительная доля случаев заболевания остается недиагностирован-ной. Кроме того, как показывает опыт китайского регистра по COVID-19, около 1/3 пациентов с характерной клинической и рентгенологической картиной могут иметь отрицательный результат тестирования на SARS-CoV-2 при заборе материала из верхних дыхательных путей [4].
В связи с эпидемиологической обстановкой ряд медицинских центров города Москвы, в том числе и ФГБУ «ФНКЦ ФМБА России», были перепрофилированы под прием инфицированных пациентов. Специалисты различного профиля вынуждены заниматься диагностикой и лечением пациентов с COVID-19. Министерство здравоохранения Российской Федерации оперативно разработало временные методические рекомендации по COVID-19 (версия 5 от 08.04.2020 [5]). Доступны руководство для врачей, разработанное китайскими специалистами Первой клинической больницы медицинского факультета университета Чжэцзя, которые первыми столкнулись с эпидемией [6], рекомендации Американского торакального общества [7] и ряд других зарубежных пособий. По состоянию на 8 апреля на сайте Clinicaltrials.gov зарегистрировано более 300 клинических испытаний различных способов терапии COVID-19 [8], включая испытания первой вакцины mRNA-1273 против SARS-CoV-2 [9]. В силу стремительного развития ситуации любые методические рекомендации быстро устаревают и нуждаются в доработке.
Цель данной работы — обобщить имеющиеся на сегодняшний день в мире данные по диагностике и лечению этого заболевания и познакомить практикующих врачей с наиболее интересными методами терапии.
ЭТИОЛОГИЯ
Коронавирус SARS-CoV-2 является оболочечным РНК-вирусом, который относится к царству Riboviria , отряду Nidovirales , подотряду Cornido -virineae , семейству Coronaviridae , подсемейству
Orthocoronavirinae , роду Betacoronavirus , подроду Sarbecovirus , виду SARS [1]. К этому же роду относятся вирусы SARS-CoV и MERS-CoV, вызывающие тяжелый острый респираторный синдром (Severe Acute Respiratory Syndrome, SARS; вспышка 2003 года) и ближневосточный респираторный синдром (Middle East Respiratory Syndrome, MERS; вспышка 2013–2015 гг.) соответственно. Референсный геном «китайского» SARS-CoV-2 (изолят Wuhan-Hu-1) полностью секвенирован и хранится онлайн в базе GenBank: MN908947.3 . Степень гомологии геномов SARS-CoV-2 и SARS-CoV составляет 79%.
Все перечисленные выше коронавирусы являются зоонозными, природный резервуар SARS-CoV-2 неизвестен: возможно, им, как и у SARS-CoV, являются летучие мыши [1]. Вирус в большом количестве содержится в их кишечнике и довольно долго сохраняется в фекалиях. Трансмиссия SARS-CoV-2 к человеку произошла, вероятно, через промежуточного хозяина, употребляемого в пищу. Первые случаи заболевания в Ухане в подавляющем большинстве были связаны с посещением рынка морепродуктов Хуанань (Huanan), где, вероятно, и произошла передача вируса от животных к человеку [2, 10]. В отличие от коронавирусов SARS-CoV и MERS-CoV, SARS-CoV-2 характеризуется существенно меньшим уровнем летальности, точное определение которого возможно будет лишь по окончании эпидемии. Вместе с тем динамика развития эпидемии позволяет уже сейчас сделать вывод, что SARS-CoV-2 по сравнению с другими патогенными коронавирусами характеризуется гораздо более высокой контагиозностью и вирулентностью для человека [10].
ПАТОГЕНЕЗ
SARS-CoV-2 включен в перечень заболеваний, представляющих опасность для окружающих, наряду с особо опасными инфекциями (Постановление Правительства РФ от 31 января 2020 г. № 66) [11]. Механизмы передачи инфекции — воздушно-капельный, воздушно-пылевой и контактный. Клетками-мишенями для SARS-CoV-2 являются эпителиоциты дыхательных путей и желудочно-кишечного тракта.
К настоящему моменту описан тропизм SARS-CoV-2 к клеткам человека, экспрессирующим ан-гиотензинпревращающий фермент-2 (angiotensin converting enzyme, ACE2) а также трансмембранный гликопротеин CD147. При этом взаимодействие
SARS-CoV-2 с ACE2 изучено несравнимо лучше, чем связывание вируса с белком CD147. Данные о тропизме SARS-CoV-2 в отношении CD147-пози-тивных клеток пока базируются только на одной работе [12]. При этом возникают вопросы, насколько велика роль этого механизма проникновения вируса в клетку, так как CD147 характеризуются крайне широким паттерном экспрессии в самых разных органах и тканях. Возможным доводом в пользу значимости этого пути проникновения вируса может быть проведенное в Китае клиническое испытание препарата моноклональных антител меплазумаба, блокирующего CD147. По данным исследователей, применение меплазумаба достоверно снизило тяжесть течения заболевания и ускорило элиминацию вируса из организма [13].
Основной мишенью SARS-CoV-2 считаются ACE2-позитивные клетки. Помимо пневмоцитов, ACE2 экспрессируются в некоторых клетках кишечника, почек и печени, соответственно, эти клетки также могут быть мишенями SARS-CoV-2. Попав в организм, SARS-CoV-2 проникает в ACE2-позитивные клетки, где начинает реплицироваться. Необходимо отметить, что нативный SARS-CoV-2 не может проникать в ACE2-позитивные клетки, пока не произойдет расщепление его S-белка при помощи протеазы TMPRSS2 [14]. Учитывая эти «первые шаги» вируса, логично предположить, что различные агенты, направленные на блокирование взаимодействия вируса с белком ACE2, а также нарушающие работу протеазы TMPRSS2, могут иметь как терапевтическое, так и профилактическое действие, что будет подробнее рассмотрено в разделе «Лечение». На основании клинической картины развития COVID-19 у пациентов с тяжелой формой заболевания можно сделать вывод, что наибольшую угрозу для жизни представляет не инфекция как таковая, а следующий за ней цитокиновый шторм [15, 16]. Этот феномен, представляющий собой выброс иммунокомпетентными клетками большого количества цитокинов (преимущественно провоспалительной направленности), наблюдается при ряде инфекционных заболеваний (птичий грипп, SARS, стрептококковая инфекция, хантавирусная инфекция) [15], а также может быть следствием противораковой терапии, например CAR T-клеточной терапии. Полностью причины инициации цитокинового шторма и детальная картина его развития неясны, однако известно, что он характеризуется высокими концентрациями таких цитокинов, как IL-1β, IFN γ, IL6, TNF α и др. В каче- стве компенсаторного механизма повышается также и концентрация иммуносупрессивного цитокина IL10. Важным является вопрос о том, какой из цитокинов стоит выше в каскаде иммунологических реакций и запускает основные процессы цитокино-вого шторма. Блокада именно такого мастер-регу-лятора цитокинового шторма позволит эффективнее предотвращать или купировать это состояние. Анализ цитокинового шторма, вызванного медикаментозной активацией иммунной системы (введение липополисахаридов или антител к CD28), показывает, что одной из первых повышается концентрация TNF α, за которым следует повышение концентраций IL6 и IFN γ [17, 18]. Исследования ци-токинового шторма на мышиных моделях при CAR T-клеточной терапии свидетельствуют, что наибольший вклад в его развитие вносят не лимфоидные, а миелоидные клетки [19, 20]. При этом отсутствует единая точка зрения, является ли ключевым индуктором цитокинового шторма IL6, IL-1β [20] или гранулоцитарно-макрофагальный колониестимулирующий фактор (granulocyte-macrophage colonystimulating factor, GM-CSF) [21].
Изучения цитокинового шторма при SARS привело к обнаружению интересного факта: у модельных мышей, нокаутных по гену Ifnar1 (кодирует рецептор интерферона alpha и beta), экспериментальная инфекция SARS-CoV не вызывала летальности, в то время как все животные контрольной группы погибали. Также после инъекции летальной дозы вируса выживали животные, у которых предварительно были удалены провоспалительные моноциты и макрофаги [22]. Таким образом, по-види-мому, именно цитокиновый шторм, индуцируемый миелоидным звеном посредством интерфероно-вого сигналинга, является причиной летальности при SARS. Цитокиновый шторм при COVID-19 пока исследован не настолько хорошо, однако были предприняты попытки профилирования цитокинов у больных с целью поиска прогностических маркеров тяжести заболевания. Было обнаружено, что повышение IP-10, MCP-3 и IL-1ra достоверно коррелирует с тяжестью течения COVID-19 [23], однако непосредственная роль этих цитокинов в патогенезе цитокинового шторма при COVID-19 неясна. Также было показано, что высокое отношение нейтрофилов к лимфоцитам (NLR) и концентрация антител к SARS-CoV-2 коррелирует с повышенной концентрацией IL2, IL6, IL10 и с тяжестью заболевания [24]. В настоящее время запущено большое количество клинических испытаний различных
<линическая’2п20 п эакти ка Том 11 №1
препаратов, блокирующих провоспалительные цитокины, что будет подробнее рассмотрено в разделе «Лечение».
КЛИНИЧЕСКАЯ КАРТИНА У ВЗРОСЛЫХ
Клиническая картина COVID-19 впервые была описана группой китайских специалистов под руководством C. Huang в журнале Lancet 24 января 2020 г. на выборке из 41 пациента [25]. Основные симптомы заболевания почти не отличались от гриппа и включали лихорадку, непродуктивный кашель и миалгию на фоне лимфопении и признаков воспалительной реакции в крови (повышение С-реактивного белка, IL2, IL7, IP10, MCP1, MIP1A, и TNF α). При этом у всех пациентов по данным компьютерной томографии наблюдалась пневмония, более чем у половины пациентов имело место диспное, и почти в 30% случаев развивалось тяжелое осложнение в виде острого респираторного дистресс-синдрома. Проведенный позже метаанализ результатов наблюдений 46 959 пациентов с COVID-19, опубликованных в 31 статье, позволил более точно описать клиническую картину [26]. Согласно этому метаанализу, клиническая картина COVID-19 складывается из следующих проявлений: лихорадка (87,3%), сухой кашель (58,1%), диспное (38,3%), миалгии или мышечная слабость (35,5%), боль и «заложенность» в грудной клетке (31,2%). Ключевыми признаками COVID-19 на компьютерной томограмме являются двусторонняя полисегментарная пневмония (75,7%) в виде субплевральных и перибронховаскулярных фокусов «матового стекла» (69,9%) в отличие от бактериальных пневмоний, при которых преобладает асимметричная консолидация, а «матовое стекло» выражено существенно меньше. Нуждают- ся в лечении в условиях отделения реанимации 29,3% стационарных пациентов; у 28,8% развивается острый респираторный дистресс-синдром, который в 8,5% случаев приводит к полиорган-ной недостаточности (Multiple Organ Dysfunction Syndrome, MODS) и в 6,8% заканчивается летальным исходом [26]. Как мы уже упоминали, общая летальность заболевания точно будет определена по завершении эпидемии; в настоящее время показатели летальности колеблются от 1,5–1,8% в Германии и Южной Корее до 12,3% в Италии .
По данным метаанализа, средний возраст пациентов, инфицированных SARS-COV-2, составляет 46,62 года, распределение по полу примерно одинаково (55,6% мужчин). Более 1/3 (35,6%) составляют коморбидные пациенты, у которых чаще всего встречаются гипертоническая болезнь (18,3%), сердечно-сосудистые заболевания (11,2%) и сахарный диабет (10,3%) [26].
По тяжести течения выделяют легкую, среднюю, тяжелую и крайне тяжелую формы (табл. 1).
ДИАГНОСТИКА
Согласно рекомендациям Минздрава России, подозрительным на COVID-19 должен считаться любой случай, характеризующийся клиническим проявлением острой респираторной вирусной инфекции, бронхита, пневмонии, острого респираторного дистресс-синдрома или сепсиса в сочетании с неблагоприятным эпидемиологическим анамнезом (посещение в течение последних 14 дней зарубежных стран с неблагоприятной обстановкой по COVID-19 или наличие контакта с человеком, имеющим лабораторно подтвержденный COVID-19 или находящемся на карантине) [ 5 ].
Таблица 1
Клиническая классификация COVID-19 (по данным [5, 6],
|
Клиническая форма |
Легкая |
Средняя |
Тяжелая |
Крайне тяжелая |
|
Описание |
Умеренная клиническая манифестация в виде ОРВИ без рентгенологических признаков пневмонии |
Признаки развернутой ОРВИ с рентгенологически подтвержденной пневмонией без изменения SatO2 |
Умеренная дыхательная недостаточность, ЧДД ≥ 30/мин, SatO2 89–93% |
Тяжелая дыхательная недостаточность, ОРДС, шок, полиорганная недостаточность, SatO2 ≤ 88% |
|
Частота, % |
81 |
14 |
5 |
|
|
Летальность, % |
0 |
2,4 |
49 |
|
Примечание. ОРВИ — острая респираторная вирусная инфекция, ЧДД — частота дыхательных движений, SatO 2 — сатурация (насыщение) артериальной крови кислородом, ОРДС — острый респираторный дистресс-синдром.
Клиническая диагностика COVID-19 заключается в сборе эпидемиологического анамнеза и выявлении клинических симптомов (описаны в разделе «Клиническая картина»).
Лабораторная диагностика
Решающее значение в постановке диагноза COVID-19 имеет определение РНК вируса SARS-CoV-2 в отделяемом слизистых верхних дыхательных путей и других биологических жидкостях пациентов с помощью ПЦР в реальном времени или NGS-секвенирования [5 , 6 , 25 ]. Разработано несколько диагностических ПЦР тест-систем, в т.ч. и российских. Чувствительность и специфичность данных тест-систем оценить затруднительно в связи с отсутствием референсных коллекций образцов. Наш опыт показывает, что в случае отрицательного ПЦР решающее значение в постановке диагноза COVID-19 приобретает КТ грудной клетки, выявляющая специфическую для этого заболевания рентгенологическую картину (см. ниже).
В лабораторных исследованиях важными критериями являются лимфопения (наблюдается у 80% пациентов) [26] и повышение С-реактивного белка, уровень которого положительно коррелирует с объемом поражения легких [27]. Значительное повышение С-реактивного белка указывает на прогрессирующее течение заболевания и возможность присоединения вторичной инфекции и в целом свидетельствует о неблагоприятном прогнозе. Из биохимических показателей, помимо С-реак-тивного белка, необходимо определять прокальцитонин, ферритин, D-димер, высокая концентрация которого также является неблагоприятным прогностическим фактором, а также уровень калия и показатели печеночного и почечного обмена. Дополнительно для прогнозирования острого респираторного дистресс-синдрома и исхода заболевания может быть проведен анализ популяционного состава лимфоцитов, IL4, IL6, IL10, TNF α, INF γ. Выраженная лимфопения в начале болезни также является неблагоприятным прогностическим фактором. При утяжелении состояния количество лимфоцитов периферической крови неуклонно снижается, а уровень IL6 и IL10, наоборот, значительно возрастает, что свидетельствует о возникновении цитокинового шторма с последующим развитием острого респираторного дистресс-син-дрома и мультиорганной недостаточности. Мониторинг уровней IL6 и IL10, таким образом, помогает оценить риск развития летальных осложнений [6], однако, к сожалению, мало применим в реальной клинической практике в условиях эпидемии.
Важное значение в диагностике и определении стадии COVID-19 и прогноза заболевания на этапе сортировки пациентов имеет пульсоксиметрия. Прогрессирующее уменьшение сатурации O2 является крайне неблагоприятным прогностическим фактором, свидетельствующим о развитии острого респираторного дистресс-синдрома и острой дыхательной недостаточности [ 5 , 6 ]. Пациентам с признаками острой дыхательной недостаточности (SрO2 >90% по данным пульсоксиметрии) рекомендуется исследование газов артериальной крови с определением PaO2, PaCO2, pH, бикарбонатов, лактата [ 5 ].
Инструментальная диагностика
Компьютерная томография (КТ) . Решающее значение в инструментальной диагностике COVID-19 (как для выявления пневмонии, так и для мониторинга эффективности терапии) имеет КТ органов грудной клетки. При технической возможности настоятельно рекомендуется проводить КТ высокого разрешения. Рекомендуется проводить исследование в день госпитализации; повторное исследование показано при прогрессирующем течении заболевании и подозрении на развитие осложнений [ 5 , 6 ]. На ранних стадиях пневмонии COVID-19 часто обнаруживаются множественные субплевральные фокусы уплотнения по типу «матового стекла», а также фокусы, расположенные перибронховас-кулярно (рис. 1, А, Б). В некоторых случаях в толще «матового стекла» наблюдаются утолщения междольковых перегородок и междолькового ин-терстиция, визуализируемые как рисунок «булыжной мостовой». В небольшом числе случаев могут обнаруживаться солитарные локальные тени либо очажки, распределенные вокруг бронхов. В случае прогрессирования заболевания внутри «матового стекла» появляются участки консолидации (рис. 1, В–Е), которые в критических случаях, в частности у больных острым респираторным дистресс-синдромом, захватывают большие зоны, преимущественно в базальных и субплевральных областях (рис. 1, Ж, З). По мере выздоровления обычно происходит полное исчезновение симптома «матового стекла», а в местах консолидации может формироваться интерстициальный фиброз.
Бронхоскопия . Согласно клиническим рекомендациям китайских коллег, они достаточно широко применяли гибкую бронхоскопию у пациентов с тя-
<линическая’2п20 п эакти ка Том 11 №1
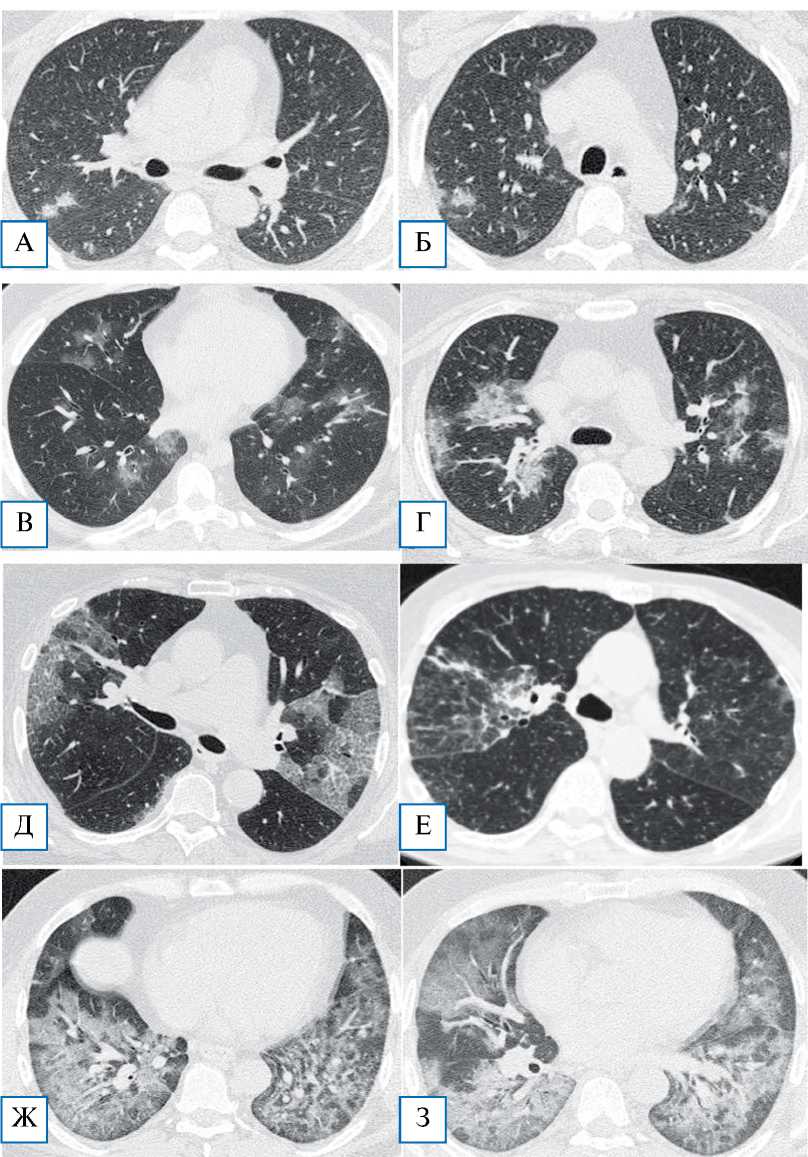
Рис. 1. КТ-диагностика COVID-19
А, Б — начальная стадия заболевания: характерно появление немногочисленных, чаще субплеврально расположенных, небольшого размера лоскутных зон матового стекла; В — перибронховаскулярная локализация участков матового стекла; Г — появление зон консолидации (еще один характерный признак пневмоний, вызванных COVID-19); Д — распространенные двусторонние зоны матового стекла, довольно четко отграниченные от неизмененной легочной ткани, на фоне которых визуализируются ретикулярные изменения по типу утолщенных внутридольковых перегородок: картина напоминает КТ-симптомокомплекс, характерный для легочного альвеолярного протеиноза; Е — встречаются варианты преимущественного утолщения междольковых перегородок в пределах зон матового стекла; Ж, З — на поздних стадиях заболевания наблюдается трансформация всех зон матового стекла в участки консолидации, сливающиеся между собой. Преимущественная локализация изменений — базальные отделы нижних долей легких. КТ-данные из COVID-архива ФНКЦ ФМБА России.
желым COVID-19, находящихся на искусственной вентиляции легких, для забора биоматериала из нижних дыхательных путей с целью верификации возбудителя (по данным [ 6] , материал из нижних дыхательных путей чаще был SARS-CoV-2-поло-жительным, чем материал из верхних дыхательных путей), а также для исследования чувствительности к антибиотикам патогенной флоры. Однако, с точки зрения экспертов Американского торакального общества (The American Thoracic Society, ATS), бронхоскопия должна выполняться только по строгим показаниям, таким как необходимость санации бронхиального дерева, остановка кровотечений и т.д. [ 7 ].
Трансторакальное ультразвуковое исследование для диагностики COVID-19 предлагают использовать G. Soldati и соавт. — группа итальянских исследователей под руководством L. Demi [28 ]; ученые разработали даже проект международного стандарта проведения и интерпретации такого исследования. Безусловно, диагностическая ценность ультразвукового исследования уступает КТ, вместе с тем это исследование может быть проведено у постели больного в инфекционном боксе, что существенно облегчает противоэпидемические мероприятия.
ЛЕЧЕНИЕ
Лекарственная терапия
Лекарственную терапию COVID-19 можно разделить на этиотропную, с которой начинают лечение в попытке минимизировать количество инфицированных клеток и свободного вируса, а также терапию осложнений, прежде всего купирование так называемого цитокинового шторма. Средства терапии в зависимости от этапа заболевания должны в значительной степени отличаться: если стимуляция иммунной системы в начале терапии оправдана, то по мере развития цитокинового шторма она может быть вредной.
Этиотропная терапия. Среди потенциально этиотропныхпрепаратов, применяемых вразличных странах для лечения COVID-19, следует отметить лопинавир + ритонавир, хлорохин, гидроксихлорохин, препараты интерферонов, умифеновир, ремде-сивир, фавипиравир [5]. Первоначально в Китае довольно широко применяли лопинавир/ритонавир [6], поэтому эта комбинация вошла и в российские рекомендации, однако первое рандомизированное исследование не выявило достоверного превосходства лопинавира/ритонавира над стандартной симптоматической терапией при тяжелом течении COVID-19 [29]. Довольно обнадеживающие данные первоначально были получены при применении гидроксихлорохина в качестве этиотропной терапии. Проведенные во Франции клинические испытания гидроксихлорохина и азитромицина на ограниченной выборке пациентов показали, что такое лечение существенно уменьшает вирусную нагрузку [30]. К сожалению, авторы этой работы не сообщили подробностей ни о выраженности побочных эффектов, ни о клинической картине после противовирусной терапии.
Необходимо отметить, что первоначальный энтузиазм в отношении препаратов хлорохина и его производных сменился более взвешенным подходом. Критике со стороны различных исследователей подверглась статья группы профессора D. Raoult [ 31 ], в которой обнаружились нестыковки [32 ]. Клиницисты указывают также на тяжелые побочные эффекты, которые могут значительно усугублять течение COVID-19. В настоящее время в отсутствии данных масштабных клинических испытаний хлорохина и его производных целесообразно тщательно взвешивать пользу и риск от применения этих препаратов. Тем не менее эксперты Американского торакального общества рекомендуют хлорохин и гидроксихлорохин для пациентов с COVID-19 и тяжелой пневмонией, тогда как для остальных возможных препаратов (лопинавир/ ритонавир, ремдесивир, тоцилизумаб) консенсуса в отношении целесообразности их применения пока не достигнуто [ 7] . В качестве этиотропной терапии также предлагается дарунавир/кобици-стат [6 ], однако систематических данных об эффективности этих препаратов в отношении SARS-CoV-2 не получено.
В попытке патогенетического лечения, направленного на нарушение взаимодействия вируса с рецепторами ангиотензина, проводят клинические испытания антагониста ангиотензиновых рецепторов II типа лозартана [ 33 ] и даже рекомбинантного ангиотензинпревращающего фермента-2 [ 34 ] (см. в разделе «Инновационные методы лечения»). Результаты этих исследований пока неизвестны.
Данные о новых препаратах, потенциально активных против SARS-CoV-2, появляются буквально каждый день. В числе самых последних можно отметить препарат ивермектин, о котором в конце марта сообщила группа австралийских исследователей [ 35 ]. Ивермектин — противопаразитарный препарат, одобренный Управлением по санитар-
<линическая’2п20 п эакти ка Том 11 №1
ному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA), c подтвержденной противовирусной активностью в отношении целого ряда вирусов, включая вирус иммунодефицита человека. Согласно данным исследований in vitro , добавленный в культуру клеток, зараженных SARS-CoV-2, ивермектин в течение 48 ч в 5000 раз снижал уровень вирусной РНК по сравнению с контролем. Следует в ближайшее время ожидать начала клинических испытаний.
Купирование цитокинового шторма. Как мы уже упоминали ранее, ключевой индуктор цитоки-нового шторма при COVID-19 пока неясен, однако можно предполагать, что блокаторы основных провоспалительных цитокинов способны снижать тяжесть течения заболевания. В настоящее время при терапии COVID-19 запущены клинические испытания блокаторов цитокинов или их рецепторов для IL6 (сарилумаб, силтуксимаб, тоцилизумаб) [ 36 – 40 ], IL-1 β (анакинра) [ 39 , 41 ], IFN γ (эмапалумаб) [41 ], TNF α (адалимумаб) [42 ], GM-CSF (намилумаб) [43 ], CCR5 (леронлимаб) [44 ]. Учитывая, что время полувывода тоцилизумаба из организма превышает 7 дней, возможно, целесообразным будет введение этого препарата пациентам еще до начала развития симптомов цитокинового шторма. Обсуждается возможность использования ингибиторов янус-киназ (janus-kinase, JAK), таких как барицити-ниб, федратиниб и руксолитиниб [ 37 , 45 – 50] . Следует отметить, что ингибиторы JAK могут быть противопоказаны при микст-инфекциях, поскольку они драматически снижают иммунореактивность [ 51 ]. В качестве потенциального средства смягчения цитокинового шторма китайские исследователи указывают на мелатонин, ссылаясь на его противовоспалительные свойства [ 52 ].
Нелекарственные и инновационные методы лечения
Плазма реконвалесцентов. Тропность вируса к альвеолярному эпителию, быстрое развитие ци-токинового шторма, вызывающего острый респираторный дистресс-синдром и острую дыхательную недостаточность, отсутствие специфической этиотропной терапии и неэффективность гормональной терапии в борьбе с осложнениями заставляют специалистов искать новые методы лечения и профилактики COVID-19. Одним из таких методов является применение плазмы реконвалесцентов, содержащей высокоаффинные противовирусные антитела. Применение гипериммунной плазмы или сыворотки — хорошо известный метод, применяемый многие десятки лет для лечения особо опасных инфекций. Первыми сообщили об эффективности такой терапии при COVID-19 китайские коллеги. B. Zhang и соавт. [53] ввели аллогенную плазму реконвалесцентов четырем пациентам в критическом состоянии (включая беременную женщину), в результате чего всех четверых удалось спасти. K. Duan и соавт. [54] вводили 10 тяжелым пациентам в титре выше 1:640 плазму реконвалесцентов, содержащую противовирусные антитела, и у всех получили хороший клинический результат, улучшение сатурации O2 в течение 3 сут и снижение концентрации С-реактивного белка. У 7/10 пациентов в данном исследовании перед введением плазмы наблюдалась виремия, которая после терапии SARS-CoV-2 перестала определяться в крови. В аналогичном исследовании C. Shen и соавт. [55] применили у 5 пациентов с острым респираторным дистресс-синдромом плазму реконвалесцентов с титром специфических антител к SARS-CoV-2 (IgG) больше 1:1000. Все пятеро (возраст 36–65 лет, двое мужчин) находились на искусственной вентиляции легких; плазму в объеме 200–250 мл вводили однократно на 10–22-е сут от начала заболевания. У всех пациентов в течение 12 сут после инфузии наблюдались положительная клиническая динамика и регресс виремии. Острый респираторный дистресс-синдром разрешился у 4/5 пациентов в течение 12 сут.
Во всех перечисленных исследованиях каких-либо серьезных побочных эффектов не зафиксировано. Вместе с тем сами авторы отмечают, что необходимо проведение клинических исследований эффективности и безопасности этого метода терапии, которые бы позволили подтвердить безопасность, четко определить показания и оптимизировать режим терапии. Такое исследование в настоящий момент проводится группой итальянских специалистов. На выборке из 49 пациентов применяют однократную инфузию 250–300 мл плазмы реконвалесцентов с высоким титром антител к SARS-CoV-2 [56 ]. Аналогичные исследования проводятся в Клинике Мэйо в США [57 ], в Китае [58 ], Мексике [59 ] и ряде других стран (полный список клинических исследований доступен по ссылке [60 ]). Имеющиеся на сегодняшний день данные позволяют считать этот метод наиболее простым и эффективным средством терапии тяжелых осложнений COVID-19.
Нейтрализующие моноклональные антитела. Опыт терапии других вирусных заболеваний
(вызванных респираторно-синцитиальным вирусом, вирусом Эбола и др.) свидетельствует о высокой эффективности использования препаратов моноклональных антител, нейтрализующих вирус. Этот подход продолжает методологию лечения плазмой реконвалесцентов, однако, если в плазме доля нейтрализующих антител незначительна, то в генно-инженерном препарате она составляет 100%. Кроме того, отсутствуют риски, связанные с переливанием компонентов крови переболевших доноров, что делает терапию более безопасной и не накладывает ограничений на количество препарата. Многие отмечают, что получение такого рекомбинантного нейтрализующего агента в виде антител или другого аффинного белка будет поворотной точкой в терапии COVID-19 [ 61 , 64 ], поэтому усилия большого числа научных лабораторий и биотехнологических компаний направлены на подобные разработки. В качестве альтернативы традиционным моноклональным антителам перспективным выглядит разработка и применение нейтрализующих агентов на основе наноантител. Это однодоменные антитела, обнаруженные у семейства верблюжьих, имеющие в своей структуре только тяжелую цепь [ 6 2]. Однодоменная структура значительно упрощает биотехнологическое производство рекомбинантных белков на их основе; небольшой размер (~15кДа) и другие структурные особенности наноантител могут обеспечивать лучшее проникновение в ткани и узнавание необычных, «скрытых» для классических антител эпитопов [63]. Технология наноантител активно применяется для разработки нейтрализующих препаратов при различных инфекциях, включая зоонозные, в том числе SARS-CoV и MERS-CoV [64, 65]. Было обнаружено, что наноантитела, специфичные в отношении SARS-CoV и MERS-CoV, могут обладать выраженной кросс-нейтрализующей активностью и в отношении SARS-CoV-2, что может существенно ускорить разработку нейтрализующего агента для лечения COVID-19 [64].
Химерный белок ACE2-IgG. В экспериментах in vitro была показана высокая вируснейтрализу-ющая способность химерного белка, состоящего из внеклеточного домена ACE2 и Fc-части IgG1 [66]. ACE2-IgG связывает свободный вирус, блокируя его S-белок и предотвращая проникновение SARS-CoV-2 в клетки. Возможным преимуществом такого химерного белка по сравнению с моноклональными антителами является его устойчивость к возникновению мутантных форм вируса, усколь- зающих от антител. Так как этот терапевтический агент взаимодействует с вирусом тем же участком, что и ACE2 на клетках, вирус не имеет возможности заражать клетки, ускользая от растворимого ACE2-IgG (за исключением смены тропизма, что является маловероятным). К настоящему моменту неизвестно, каковы будут вируснейтрализующие свойства этого агента in vivo.
Клеточная терапия: МСК. Мезенхимальные стволовые клетки (МСК) хорошо известны в регенеративной медицине своим иммуномодулирующим и противовоспалительным действием. В проведенных ранее исследованиях [ 67 ], включая наше собственное [ 68 ], было показано, что внутривенная инфузия аллогенных МСК способствует уменьшению выраженности интерстициального фиброза легких даже при таком тяжелом заболевании, как идиопатический легочный фиброз. Механизм действия МСК обусловлен их миграцией в очаги воспаления и экскрецией экзосом, содержащих противовоспалительные цитокины, микроРНК и факторы роста, обеспечивающие уменьшение интерстициального воспаления [ 69 ], что нашло применение, в том числе, и в лечении острого респираторного дистресс-синдрома [ 70 ]. Таким образом, можно предполагать, что назначение МСК при тяжелой коронавирусной пневмонии может быть мощным профилактическим и лечебным средством, предотвращающим развитие постпневмонического фиброза и хронической дыхательной недостаточности у тяжелых коморбидных пациентов. В новейшем исследовании, проведенном в январе-феврале 2020 г. в госпитале YouAn в Пекине, Z. Leng и соавт. [ 71 ] применили аллогенные МСК у 7 пациентов с COVID-19 в остром периоде лечения тяжелой пневмонии. Наблюдение в течение 14 дней показало отсутствие побочных эффектов. У всех 7 пациентов, из которых у одного было крайне тяжелое состояние, у 4 — тяжелое, у 2 — состояние средней тяжести, в течение 3 дней после инфузии МСК наблюдались регресс симптоматики и улучшение функциональных показателей дыхания. В течение 10 дней все пациенты выздоровели. Лабораторные исследования показали, что после инфузии МСК увеличивается количество лимфоцитов в периферической крови, уменьшается концентрация С-реактивного белка и, что самое интересное, в течение 3–6 дней из кровотока исчезают сверхактивные секретирующие цитокины CXCR3+CD4+ и CXCR3+CD8+ T-клетки, а также CXCR3+ NK-клетки. При этом наблюдается увеличение кон-
Список литературы COVID-19. Этиология, патогенез, диагностика и лечение
- Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat Microbiol. 2020;5(4):536-544. DOI: 10.1038/s41564-020-0695-z
- Zhu N, Zhang D, Wang W, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020;382(8):727-733. DOI: 10.1056/NEJMoa2001017
- Coronavirus disease (COVID-19) Pandemic. Avalable from: https://www.who.int/emergencies/diseases/novel-coronavirus-2019.
- Yang Y, Yang MH, Shen CG, et al. Evaluating the accuracy of different respiratory specimens in the laboratory diagnosis and monitoring the viral shedding of 2019- nCoV infections. medRxiv. 2020; published online Feb 17. DOI: 10.1101/2020.02.11.20021493
- Временные методические рекомендации Минздрава России: Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19), версия 5 (08.04.2020). - М.: Минздрав РФ, 2020. - 122 с.
- Handbook of COVID-19 prevention and treatment. The First Affiliated Hospital, Zhejiang University School of Medicine, 2020. Available from: https://covid-19.alibabacloud.com.
- COVID-19: Interim Guidance on Management Pending Empirical Evidence. From an American Thoracic Society-led International Task Force. Avalable from: https://www.thoracic.org/professionals/clinical-resources/disease-related-resources/covid-19-guidance.pdf.
- Online resource. Avalable from: https://clinicaltrials.gov/ct2/results?cond=COVID-19.
- Safety and Immunogenicity Study of 2019-nCoV Vaccine (mRNA-1273) for Prophylaxis SARS CoV-2 Infection. ClinicalTrials.gov; 2020. Identifier: NCT04283461.
- Li Q, Guan X, Wu P, et al. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. N Engl J Med. 2020;382(13):1199-1207.
- DOI: 10.1056/NEJMoa2001316
- Постановление Правительства РФ от 31 января 2020 г. № ٦٦ "О внесении изменения в перечень заболеваний, представляющих опасность для окружающих". Доступно по: https://base.garant.ru/73492109/. Ссылка активна на 20.03.2020.
- Wang K, Chen W, Zhou YS, et al. SARS-CoV-2 invades host cells via a novel route: CD147-spike protein. bioRxiv. 2020.
- DOI: 10.1101/2020.03.14.988345
- Bian H, Zheng ZH, Wei D, et al. Meplazumab treats COVID-19 pneumonia: an open-labelled, concurrent controlled add-on clinical trial. bioRxiv. 2020.
- DOI: 10.1101/2020.03.21.20040691
- Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 Cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020.
- DOI: 10.1016/j.cell.2020.02.052
- Tisoncik JR, Korth M, Simmons CP, et al. Into the eye of the cytokine storm. Microbiol Mol Biol Rev. 2012;76(1):16-32.
- DOI: 10.1128/MMBR.05015-11
- Zhang C, Wu Z, Li JW, et al. The cytokine release syndrome (CRS) of severe COVID-19 and Interleukin-6 receptor (IL-6R) antagonist Tocilizumab may be the key to reduce the mortality. Int J Antimicrob Agents. 2020:105954.
- DOI: 10.1016/j.ijantimicag.2020.105954
- Da Silva AM, Kaulbach HC, Chuidian FS, et al. Shock and multiple-organ dysfunction after self-administration of salmonella endotoxin. N Engl J Med. 1993;328:1457-1460.
- DOI: 10.1056/NEJM199305203282005
- Suntharalingam G, Perry MR, Ward S, et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. N Engl J Med. 2006;355:1018-1028.
- DOI: 10.1056/NEJMoa063842
- Singh N, Hofmann TJ, Gershenson Z, et al. Monocyte lineage-derived IL-6 does not affect chimeric antigen receptor T-cell function. Cytotherapy. 2017;19(7):867-880.
- DOI: 10.1016/j.jcyt.2017.04.001
- Giavridis T, van der Stegen SJ, Eyquem J, et al. CAR T cell-induced cytokine release syndrome is mediated by macrophages and abated by IL-1 blockade. Nat Med. 2018;24(6):731-738.
- DOI: 10.1038/s41591-018-0041-7
- Sterner RM, Sakemura R, Cox MJ, et al. GM-CSF inhibition reduces cytokine release syndrome and neuroinflammation but enhances CAR-T cell function in xenografts. Blood. 2019;133(7):697-709.
- DOI: 10.1182/blood-2018-10-881722
- Channappanavar R, Fehr AR, Vijay R, et al. Dysregulated type I interferon and inflammatory monocyte-macrophage responses cause lethal pneumonia in SARS-CoV-infected mice. Cell Host Microbe. 2016;19(2):181-193.
- DOI: 10.1016/j.chom.2016.01.007
- Yang Y, Shen C, Li J, et al. Exuberant elevation of IP-10, MCP-3 and IL-1ra during SARS-CoV-2 infection is associated with disease severity and fatal outcome. medRxiv. 2020.
- DOI: 10.1101/2020.03.02.20029975
- Zhang B, Zhou X, Zhu C, et al. Immune phenotyping based on neutrophil-to-lymphocyte ratio and IgG predicts disease severity and outcome for patients with COVID-19. medRxiv. 2020.
- DOI: 10.1101/2020.03.12.20035048
- Huang C, Wang Y, Li X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;15;395(10223):497-506.
- DOI: 10.1016/S0140-6736(20)30183-5
- Cao Y, Liu X, Xiong L, Cai K. Imaging and clinical features of patients with 2019 novel coronavirus SARS-CoV-2: a systematic review and meta-analysis. J Med Virol. 2020.
- DOI: 10.1002/jmv.25822
- Ling W. C-reactive protein levels in the early stage of COVID-19. Med Mal Infect. 2020.
- DOI: 10.1016/j.medmal.2020.03.007
- Soldati G, Smargiassi A, Inchingolo R, et al. Proposal for international standardization of the use of lung ultrasound for COVID-19 patients; a simple, quantitative, reproducible method. J Ultrasound Med. 2020.
- DOI: 10.1002/jum.15285
- Cao B, Wang Y, Wen D, et al. A Trial of lopinavir-ritonavir in adults hospitalized with severe Covid-19. N Engl J Med. 2020.
- DOI: 10.1056/NEJMoa2001282
- Gautret P, Lagier JC, Parola P, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020:105949.
- DOI: 10.1016/j.ijantimicag.2020.105949
- Colson P, Rolain JM, Lagier JC, et al. Chloroquine and hydroxychloroquine as available weapons to fight COVID-19. Int J Antimicrob Agents. 2020 Mar 4:105932.
- DOI: 10.1016/j.ijantimicag.2020.105932
- Darren D, Gates S, Morris T. Statistical review of Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial (Version 1.1). Zenodo. 2020.
- DOI: 10.5281/zenodo.3725560
- Study of open label losartan in COVID-19. ClinicalTrials.gov; 2020. Identifier: NCT04335123.
- Recombinant human angiotensin-converting enzyme 2 (rhACE2) as a treatment for patients with COVID-19. ClinicalTrials.gov; 2020. Identifier: NCT04287686.
- DOI: 10.31525/ct1-nct04287686
- Caly L, Druce JD, Catton MG, et al. The FDA-approved Drug Ivermectin inhibits the replication of SARS-1 CoV-2 in vitro. Antiviral Research. 2020.
- DOI: 10.1016/j.antiviral.2020.104787
- Evaluation of the Efficacy and Safety of Sarilumab in Hospitalized Patients With COVID-19. ClinicalTrials.gov; 2020. Identifier: NCT04315298.
- Treatment of Moderate to Severe Coronavirus Disease (COVID-19) in Hospitalized Patients. ClinicalTrials.gov; 2020. Identifier: NCT04321993.
- Evaluation of the Efficacy and Safety of Sarilumab in Hospitalized Patients With COVID-19. ClinicalTrials.gov; 2020. Identifier: NCT04315298.
- Treatment of COVID-19 Patients With Anti-interleukin Drugs (COV-AID). ClinicalTrials.gov; 2020. Identifier: NCT04330638.
- A multicenter, randomized controlled trial for the efficacy and safety of tocilizumab in the treatment of new coronavirus pneumonia (COVID-19). Chinese Clinical trial registry: ChiCTR2000029765. ChiCTR; 2020.
- Efficacy and Safety of Emapalumab and Anakinra in Reducing Hyperinflammation and Respiratory Distress in Patients With COVID-19 Infection. ClinicalTrials.gov; 2020. Identifier: NCT04324021.
- A clinical study for the efficacy and safety of Adalimumab Injection in the treatment of patients with severe novel coronavirus pneumonia (COVID-19). Chinese Clinical trial registry: ChiCTR2000030089. ChiCTR; 2020.
- Izana starts compassionate use study of potential Covid-19 drug. Available from: https://www.clinicaltrialsarena.com/news/izana-namilumab-covid-19-study/.
- Novant Health operates a fully integrated healthcare system throughout four states. Available from: https://www.cytodyn.com/newsroom/press-releases/detail/411/novant-health-initiates-phase-2-covid-19-trial-with.
- Mehta Р, McAuley DF, Brown M, et al. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020.
- DOI: 10.1016/S0140-6736(20)30628-0
- Stebbing J, Phelan A, Griffin I, et al. COVID-19: combining antiviral and anti-inflammatory treatments. Lancet. 2020.
- DOI: 10.1016/S1473-3099(20)30132-8
- Wu D, Yang XO. TH17 responses in cytokine storm of COVID-19: An emerging target of JAK2 inhibitor Fedratinib. J Microbiol, Immunol Infect. 2020.
- DOI: 10.1016/j.jmii.2020.03.005
- Safety and Efficacy of Baricitinib for COVID-19. ClinicalTrials.gov; 2020. Identifier: NCT04340232.
- Baricitinib in Symptomatic Patients Infected by COVID-19: an Open-label, Pilot Study. (BARI-COVID). ClinicalTrials.gov; 2020. Identifier: NCT04320277.
- Study of the Efficacy and Safety of Ruxolitinib to Treat COVID-19 Pneumonia. ClinicalTrials.gov; 2020. Identifier: NCT04331665.
- Praveen D, Chowdary PR, Aanandhi MV. Baricitinib - a januase kinase inhibitor - not an ideal option for management of COVID 19. Int J Antimicrob Agents. 2020 Apr 4 [Online ahead of print]
- DOI: 10.1016/j.ijantimicag.2020.105967
- Zhang R, Wang X, Ni L, et al. COVID-19: Melatonin as a potential adjuvant treatment. Life Sci. 2020 Mar 23:117583.
- DOI: 10.1016/j.lfs.2020.117583
- Zhang B, Liu S, Tan T, et al. Treatment with convalescent plasma for critically ill patients with SARS-CoV-2 infection. Chest. 2020. pii: S0012-3692(20)30571-7.
- DOI: 10.1016/j.chest.2020.03.039
- Duan K, Liu B, Li C, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci U S A. 2020 Apr 6. pii: 202004168.
- DOI: 10.1073/pnas.2004168117
- Shen C, Wang Z, Zhao F, et al. Treatment of 5 Critically Ill Patients With COVID-19 With Convalescent Plasma. JAMA. 2020 Mar 27.
- DOI: 10.1001/jama.2020.4783
- Hyperimmune plasma for critical patients with COVID-19 (COV19-PLASMA). ClinicalTrials.gov; 2020. Identifier: NCT04321421.
- Convalescent plasma to limit coronavirus associated complications. ClinicalTrials.gov; 2020. Identifier: NCT04325672.
- Anti-SARS-CoV-2 inactivated convalescent plasma in the treatment of COVID-19. ClinicalTrials.gov; 2020. Identifier: NCT04292340.
- DOI: 10.31525/ct1-nct04292340
- Safety in convalescent plasma transfusion to COVID-19. ClinicalTrials.gov; 2020. Identifier: NCT04333355.
- Online resource. Available from: https://clinicaltrials.gov/ct2/results?cond=COVID-19%2C++Convalescent+Plasma+&term=&cntry=&state=&city=&dist=.
- Jiang S, Hillyer C, Du L, et al. Neutralizing antibodies against SARS-CoV-2 and other human coronaviruses. Science Society. 2020.
- DOI: 10.1016/j.it.2020.03.007
- Горшкова Е.Н., Василенко Е.А., Тиллиб С.В., Астраханцева И.В. Однодоменные антитела и биоинженерные препараты на их основе: новые возможности для диагностики и терапии // Медицинская иммунология. - 2016. - Т.18. - №6. - С. 505-520.
- DOI: 10.15789/1563-0625-2016-6-505-520
- Krah S, Schröter C, Zielonka S, Empting M, Valldorf B, Kolmar H. Single-domain antibodies for biomedical applications. Immunopharmacol Immunotoxicol. 2016;38(1):21-8.
- Wrapp D, de Vlieger D, Corbett KS, et al. Structural Basis for Potent Neutralization of Betacoronaviruses by Single-domain Camelid Antibodies. medRxiv. 2020.
- DOI: 10.1101/2020.03.26.010165
- Lafaye P, Li T. Use of camel single-domain antibodies for the diagnosis and treatment of zoonotic diseases. Comp Immunol Microbiol Infect Dis. 2018;60:17-22.
- Lei C, Fu W, Qian K, et al. Potent neutralization of 2019 novel coronavirus by recombinant ACE2-Ig. BioRxiv. 2020.
- DOI: 10.1101/2020.02.01.929976
- Toonkel RL, Hare JM, Matthay MA, Glassberg MK. Mesenchymal stem cells and idiopathic pulmonary fibrosis: potential for clinical testing. Am J Respir Crit Care Med. 2013;188(2):133-140.
- DOI: 10.1164/rccm.201207-1204PP
- Averyanov A, Koroleva I, Konoplyannikov M, et al. First-in-human high-cumulative-dose stem cell therapy in idiopathic pulmonary fibrosis with rapid lung function decline. Stem Cells Transl Med. 2020;9(1):6-16.
- DOI: 10.1002/sctm.19-0037
- Bernardo ME, Fibbe WE. Mesenchymal stromal cells: sensors and switchers of inflammation. Cell Stem Cell. 2013;13(4):392-402.
- DOI: 10.1016/j.stem.2013.09.006
- Wilson JG, Liu KD, Zhuo H, et al. Mesenchymal stem (stromal) cells for treatment of ARDS: a phase 1 clinical trial. Lancet Respir Med. 2015;3(1):24-32.
- DOI: 10.1016/S2213-2600(14)70291-7
- Leng Z, Zhu R, Hou W, et al. Transplantation of ACE2- mesenchymal stem cells improves the outcome of patients with COVID-19 pneumonia. Aging Dis. 2020;11(2):216-228.
- DOI: 10.14336/AD.2020.0228
- Stem cell educator therapy treat the viral inflammation caused by Severe Acute Respiratory Syndrome Coronavirus 2. ClinicalTrials.gov; 2020. Identifier: NCT04299152.
- DOI: 10.31525/ct1-nct04299152
- Cell therapy using umbilical cord-derived mesenchymal stromal cells in SARS-CoV-2-related ARDS (STROMA-CoV2). ClinicalTrials.gov; 2020. Identifier: NCT04333368.
- Sorrento to provide manufacturing support to celularity as CYNK-001 NK cell trial for COVID-19 begins enrolling patients [news release]. San Diego, CA.; 2020. Available from: globenewswire.com/news-release/2020/04/02/2010998/0/en/SORRENTO-TO-PROVIDE-MANUFACTURING-SUPPORT-TO-CELULARITY-AS-CYNK-001-NK-CELL-TRIAL-FOR-COVID-19-BEGINS-ENROLLING-PATIENTS.html.
- Xconomy National. Celularity to test natural killer cell therapy for cancer against COVID. Xconomy National website; 2020. Available from: xconomy.com/national/2020/04/02/celularity-to-test-natural-killer-cell-therapy-for-cancer-against-covid/.
- A Phase I/II Study of Universal Off-the-shelf NKG2D-ACE2 CAR-NK Cells for Therapy of COVID-19. ClinicalTrials.gov; 2020. Identifier: NCT04324996.


