Деарилирование три(орто-толил)висмута мезитиленсульфоновой кислотой
Автор: Калимуллина Людмила Вячеславовна, Шарутин Владимир Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.14, 2022 года.
Бесплатный доступ
Взаимодействием три(орто-толил)висмута с дигидратом мезитиленсульфоновой кислоты в эфире получен гидрат мезитиленсульфоната ди(орто-толил) висмута. Методом рентгеноструктурного анализа определено его строение. По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD - детектор, Мо Kα-излучение, λ = 0,71073 Å, графитовый монохроматор), в кристаллах гидрата мезитиленсульфоната ди(орто-толил)висмута: [C23H27О4SBi, M 608,48; сингония триклинная, группа симметрии Р-1; параметры ячейки: a = 8,872(7), b = 11,476(10), c = 13,119(10) Å; a = 109,48(5)°, β = 92,55(2)°, g = 110,89(2)°; V = 1155,9(16) Å3; Z = 1; размер кристалла 0,32 × 0,1 × 0,06 мм; интервалы индексов отражений -11 ≤ h ≤ 11, -15 ≤ k ≤ 15, -17 ≤ l ≤ 17; всего отражений 30469; независимых отражений 5781; Rint 0,0327; GOOF 1,044; R1 = 0,0330, wR2 = 0,0811; остаточная электронная плотность 2,85/-2,12 e/Å3]. Полные таблицы координат атомов, длин связей и валентных углов для структуры депонированы в Кембриджском банке структурных данных (№ 2165866; deposit@ccdc.cam.ac.uk; https://www.ccdc.cam.ac.uk). В кристалле гидрата его молекулы содержат координационно-связанную воду, причем расстояние Bi∙∙∙OH2 составляет 2,487(4) Å, что сопоставимо с длиной связи Bi-O (2,388(4) Å) в группировке Bi-OSO2Mez и суммой ковалентных радиусов висмута и кислорода (2,31 Å). Длины связей Bi-C (2,235(5) и 2,237(5) Å) несколько меньше суммы ковалентных радиусов атомов висмута и углерода (2,36 Å), а угол CBiC составляет 97,77(19)°. Поэтому можно считать, что координационный полиэдр атома висмута представляет собой тригональную бипирамиду с атомами кислорода в аксиальных положениях и двумя арильными лигандами с неподеленной электронной парой - в экваториальных позициях. Проанализированы особенности синтеза и строения аренсульфонатов диарилвисмута и их сольватов с амино- и кислородсодержащими лигандами. Если первые являются координационными полимерами, то вторые представляют собой молекулы с координационно-связанными n-донорными лигандами.
Синтез, гидрат мезитиленсульфоната ди(орто-толил)висмута, строение, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147239534
IDR: 147239534 | УДК: 546.87+547.53.024+548.312.4 | DOI: 10.14529/chem220405
Текст научной статьи Деарилирование три(орто-толил)висмута мезитиленсульфоновой кислотой
Взаимодействием три(орто-толил)висмута с дигидратом мезитиленсульфоновой кислоты в эфире получен гидрат мезитиленсульфоната ди(орто-толил) висмута. Методом рентгеноструктурного анализа определено его строение. По данным рентгеноструктурного анализа, проведенного при 293 К на автоматическом четырехкружном дифрактометре D8 Quest Bruker (двухкоординатный CCD – детектор, Мо Kα-излучение, λ = 0,71073 Å, графитовый монохроматор), в кристаллах гидрата мезитиленсульфоната ди(орто-толил)висмута: [C23H27О4SBi, M 608,48; сингония триклинная, группа симметрии Р-1; параметры ячейки: a = 8,872(7), b = 11,476(10), c = 13,119(10) А; а = 109,48(5)°, в = 92,55(2)°, Y = 110,89(2)°; V = 1155,9(16) А3; Z = 1; размер кристалла 0,32 × 0,1 × 0,06 мм; интервалы индексов отражений –11 ≤ h ≤ 11, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17; всего отражений 30469; независимых отражений 5781; Rint 0,0327; GOOF 1,044; R1 = 0,0330, wR2 = 0,0811; остаточная электронная плотность 2,85/–2,12 e/Å3]. Полные таблицы координат атомов, длин связей и валентных углов для структуры депонированы в Кембриджском банке структурных данных (№ 2165866; ; . В кристалле гидрата его молекулы содержат координационносвязанную воду, причем расстояние Bi∙∙∙OH2 составляет 2,487(4) Å, что сопоставимо с длиной связи Bi-O (2,388(4) А) в группировке Bi-OSO2Mez и суммой ковалентных радиусов висмута и кислорода (2,31 А). Длины связей Bi-C (2,235(5) и 2,237(5) А) несколько меньше суммы ковалентных радиусов атомов висмута и углерода (2,36 А), а угол CBiC составляет 97,77(19)°. Поэтому можно считать, что координационный полиэдр атома висмута представляет собой тригональную бипирамиду с атомами кислорода в аксиальных положениях и двумя арильными лигандами с неподеленной электронной парой – в экваториальных позициях. Проанализированы особенности синтеза и строения аренсульфонатов диарилвисмута и их сольватов с амино- и кислородсодержащими лигандами. Если первые являются координационными полимерами, то вторые представляют собой молекулы с координационно-связанными n-донорными лигандами.
Арильные производные трехвалентного висмута (Ar 3 Bi, Ar 2 BiX и ArBiX 2 , Х – электроотрицательный лиганд) привлекают внимание многих исследователей. Для получения производных висмута несимметричного строения используют преимущественно реакции деарилирования триарилвисмута кислотами НХ [1 - 3]. Полнота деарилирования триарилвисмута определяется соотношением исходных реагентов, природой кислоты и условиями проведения реакций. Так, при взаимодействии триарилвисмута с уксусной или трифторуксусной кислотой в эфире в зависимости от количества исходных реагентов замещаются одна или две арильные группы [4]:
Ar3Bi + n RCO 2 H ^ Ar3- n Bi(O2CR)n + n ArH
Ar = Ph, C 6 H 4 Me- p , C 6 H 4 OMe- p , C 6 H 4 Et- p , C 6 F 5 ; R = Me, CF 3 ; n = 1 или 2
Эти же авторы получили бензолсульфонат дифенилвисмута и 4-метилбензолсульфонат ди- n -толилвисмута внедрением оксида серы (VI) по связи Bi-C в триарилвисмуте или деарилировани-ем триарилвисмута аренсульфоновой кислотой [5]:
Ar3Bi + SO3 ^ Ar 2 BiOSO 2 Ar
Ar3Bi + HOSO 2 Ar ^ Ar 2 BiOSO 2 Ar
Ar = Ph, p -Tol
В [6] описан синтез из трифенилвисмута и 2,5-диметилбензолсульфоновой кислоты в толуоле бис(2,5-диметилбензолсульфоната) фенилвисмута, представляющего собой координационный полимер. О получении двух координационных полимеров винилсульфонатов висмута(III) сообщалось в [7]. Три органосульфоната дифенилвисмута были синтезированы взаимодействием эквимолярных количеств трифенилвисмута и органосульфоновой кислоты в спирте [8]. По аналогичной схеме был получен трифлат дифенилвисмута [9].
В работе [10] описан синтез аренсульфонатов диарилвисмута из триарилвисмута и аренсульфоновой кислоты в эфире с выходом до 99 %:
Ar 3 Bi + HOSO 2 Ar’ → Ar 2 BiOSO 2 Ar’ + ArH
Ar = Ph; Ar’ = C 6 H 4 Me-4; C 6 H 3 Me 2 -2,5; C 6 H 3 Me 2 -2,4; C 6 H 3 Me 2 -3,4
Ar = p -Tol; Ar’ = C 6 H 3 Me 2 -2,4;
Ar = о -Tol; Ar’ = C 6 H 3 Me 2 -3,4
Оптимальное время протекания реакций при комнатной температуре составляет 48 ч. Полученные аренсульфонаты диарилвисмута представляют собой мелкокристаллические неокрашенные вещества, нерастворимые в ароматических и алифатических углеводородах. Однако эти соединения хорошо растворяются в таких органических растворителях, как ацетон и диметилсульфоксид. Диаграммы дифференциального термического анализа полученных комплексов содержали один широкий экзотермический пик малой интенсивности, свидетельствующий о том, что они разлагаются без плавления. Высокие температуры разложения и плохая растворимость полученных аренсульфонатов диарилвисмута в большинстве органических растворителей предполагают их полимерное строение. В ИК-спектрах данных соединений наблюдаются интенсивные полосы поглощения в области 1100 см–1 и 1200 см–1, относящиеся к валентным колебаниям связей S-O и S=O соответственно [11]. Однако по ИК-спектру сложно судить о характере связывания аренсульфонатного заместителя с центральным атомом. Отметим, что в литературе известны примеры, когда сульфонатные группы могут выступать в роли монодентатного лиганда [2], би-дентатного лиганда, как в сульфонатах олова [12], а тройная координация сульфонатного заместителя отмечена для таллийорганических сульфонатов [13].
Результаты и их обсуждение
Проведенное рентгеноструктурное исследование 2,5-диметилбензолсульфоната дифенилвисмута показало, что в кристалле имеются цепочки, образованные из фрагментов Ph2BiOSO2C6H3Me2-2,5, связанных между собой атомами кислорода сульфогруппы мостикового аренсульфонатного лиганда, то есть в кристалле соединение существует в полимерной форме (риc. 1) [10].
Рис. 1. Структурная формула 2,5-диметилбензолсульфоната дифенилвисмута
Атом висмута с учетом стереохимически активной роли неподеленной электронной пары – так называемого «фантом»-лиганда – имеет тригонально-бипирамидальную координацию. Псевдо-валентный угол О(1)Bi(1)O(3) равен 166,2(2)о, а углы между псевдоаксиальными атомами кислорода и ипсо-атомами углерода фенильных заместителей варьируют от 82,2(2) до 91,4(2)о. Длины связей Bi-C в пределах экспериментальной погрешности одинаковы [2,223(7) и 2,227(7) Å], а рас- стояния Bi-O заметно различаются [2,400(5) и 2,424(5) Å]. Длины связей S-O(3) [1,461(5) Å] и S-O(1) [1,476(5) Å] в цепочке атомов неравноценны: более короткой связи Bi-O соответствует более длинная связь S-O. Расстояние S-O(2) существенно короче (1,431 Å) из-за более высокой кратности данной связи. Различные значения длин связей Bi-O и S-O свидетельствуют о том, что бидентатный аренсульфонатный лиганд координируется на атоме висмута несимметрично. Более короткая связь Bi(1)-O(1) имеет ковалентный характер, а другая связь Bi(1)-O(3) образуется по донорно-акцепторному механизму и является координационной.
Можно предположить, что близкое к линейному расположение атомов О(1)-Bi(1)-O(3) благоприятно для гиперконъюгационного стереоэлектронного взаимодействия неподеленной электронной пары атома О(3) с разрыхляющей орбиталью связи Bi(1)-O(1) ( n - о * -взаимодействие), которое и приводит к заметному удлинению связи Bi(1)-O(1) по сравнению с суммой ковалентных радиусов атомов Bi и О (2,31 А [14]) и образованию трехцентровой связи =O(3) ^ Bi(1)-O(1). Однако в кристалле полимерного 2,4-диметилбензолсульфоната дифенилвисмута, имеющего аналогичное строение, разница в длинах связей Bi-O более заметна (2,406 и 2,459 Å) [15], чем в предыдущем комплексе (2,400 и 2,424 Å), несмотря на то что аксиальный угол OBiO в 2,4-диметилбензолсульфонате дифенилвисмута (175,1 ° ) приближается к теоретическому значению 180 ° .
Особенности строения тригонально-бипирамидальных комплексов Bi хорошо объясняются теорией отталкивания электронных пар валентных орбиталей (ОЭПВО) [16]. В соответствии с основными положениями этой теории наиболее электроотрицательные заместители занимают аксиальные позиции в тригонально-бипирамидальном окружении центрального атома, а неподе-ленная пара электронов предпочтительно занимает экваториальное положение, причем отталкивает соседнюю электронную пару сильнее по сравнению со связывающей электронной парой. В аренсульфонатах диарилвисмута аксиальные положения занимают, как предсказывает теория ОЭПВО, наиболее электроотрицательные заместители, а в экваториальных положениях располагаются фенильные группы [угол С(Ph)-Sb-C(Ph) равен 96,6(3)о] и неподеленная пара электронов, наличие которой и приводит к уменьшению валентного угла по сравнению с теоретическим значением 120о.
Таким образом, на основании анализа структурных исследований [17] можно заключить, что аренсульфонаты дифенилвисмута являются координационными полимерами и проявляют свойства соединений подобного строения: разлагаются при высоких температурах без плавления, не растворяются в ароматических и алифатических углеводородах, но растворяются в растворителях, проявляющих донорные свойства.
Cинтез и особенности строения сульфонатов диарилвисмута, содержащих в координационной сфере центрального атома такие электронодонорные лиганды, как амины или оксиды триал-килолова, описаны в работах [18, 19]. В связи с этим представлялось интересным расширить ряд подобных аренсульфонатов диарилвисмута и сравнить структурные особенности представителей этого ряда соединений на бóльшем числе примеров, поэтому мы продолжили исследования в этой области химии и попробовали получить из три( орто -толил)висмута и гидрата мезитилен-сульфоновой кислоты в эфире мезитиленсульфонат ди( орто -толил)висмута.
Нами показано, что взаимодействие три( орто -толил)висмута с гидратом мезитиленсульфо-новой кислоты в эфире приводит к образованию гидрата мезитиленсульфоната ди( орто -толил)висмута:
( o -Tol)3Bi + HOSO2C 6 H2Me3-2,4,6 • 2H 2 O ^ ( o -Tol)2BiOSO2C 6 H2Me3-2,4,6 • H2O
Показано, что в кристалле гидрата 1 его молекулы содержат координационно-связанную воду (рис. 2). Расстояние Br-OH2 составляет 2,487(4) А, что сопоставимо с длиной связи Bi - O (2,388(4) А) в группировке Bi - OSO2Mez и суммой ковалентных радиусов висмута и кислорода (2,31 Å [14]).
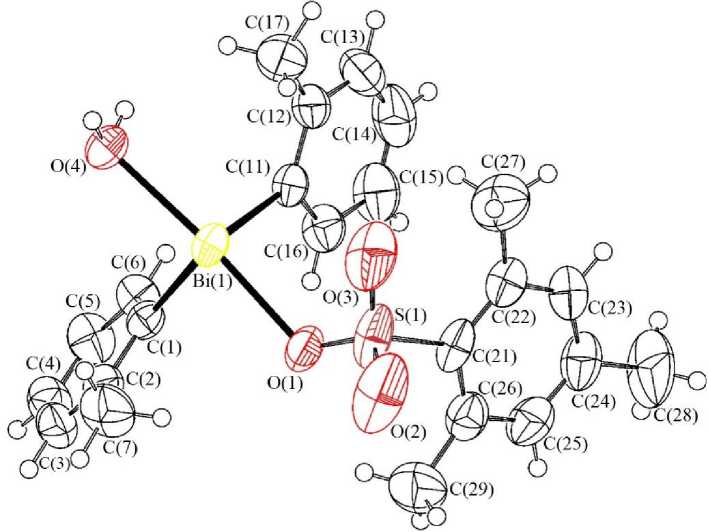
Рис. 2. Общий вид молекулы гидрата мезитиленсульфоната ди( орто -толил)висмута
Длины связей Bi - C (2,235(5) и 2,237(5) А) несколько меньше суммы ковалентных радиусов атомов висмута и углерода (2,36 А [14]), а угол CBiC составляет 97,77(19) ° . Можно поэтому считать, что координационный полиэдр атома металла представляет собой тригональную бипирамиду с атомами кислорода в аксиальных положениях и неподеленную электронную пару с двумя арильными лигандами в экваториальных позициях.
В ИК-спектре соединения 1 присутствуют полосы, характеризующие валентные колебания связей Bi–С (406 см–1) и Bi–O (546 см–1). Две полосы поглощения при 1186 и 999 см–1 относятся к валентным асимметричным и симметричным колебаниям сульфонатной группы. Арильные лиганды при атоме висмута характеризуются полосами валентных колебаний ароматического скелета при 1570, 1450 см–1, а также ароматических и алифатических C–H связей (3025 и 2924 соответственно). Широкая полоса при 3435 см–1 относится к валентным колебаниям О–Н связи в молекуле воды [20–22].
Экспериментальная часть
Элементный анализ на C и H выполнен на элементном анализаторе Carlo Erba CHNS-O EA 1108. ИК-спектры записан на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в области 4000– 400 см–1 в матрице KBr. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
Синтез гидрата мезитиленсульфоната бис ( орто -толил)висмута (3). Смесь три( орто -толил)висмута (0,1 г, 0,206 ммоль), дигидрата мезитиленсульфоновой кислоты (0,49 г, 0,206 ммоль и 10 мл диэтилового эфира выдерживали в закрытой ампуле при 20 °С в течение 72 ч. Крупные белые кристаллы, образовавшиеся на стенке ампулы, собирали, высушивали и взвешивали. Выход 0,072 г, 56 %, т. разл. 118 °С.
ИК-спектр ( v , см-1): 3435, 3025, 2924, 2854, 1805, 1570, 1450, 1254, 1244, 1209, 1186, 1138, 1080, 1055, 989, 961, 845, 746, 679, 579, 546, 530, 505, 424, 406. Найдено, %: С 45,27, Н 4,51. C23H27O4SBi. Вычислено, %: С 45,36, Н 4,44.
Рентгеноструктурный анализ ( РСА ) кристаллов проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo ^ „ -излучение, X = 0,71073 А, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus [23]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [24],
OLEX2 [25]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника ( U изо (H) = 1,2 U экв (C)) . Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, геометрические характеристики координационного полиэдра атома висмута – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
Длины связей и валентные углы в соединении 3
|
Параметр |
1 |
|
Формула |
C 23 H 27 O 4 SBi |
|
М |
608,48 |
|
Т , К |
293 |
|
Сингония |
Триклинная |
|
Пр. группа |
P -1 |
|
a , Å |
8,872(7) |
|
b, Å |
11,476(10) |
|
c, Å |
13,119(10) |
|
α , град. |
109,48(5) |
|
β, град. |
92,55(2) |
|
γ , град. |
110,89(2) |
|
V , Å3 |
1155,9(16) |
|
Z |
1 |
|
ρ (выч.), г/см3 |
1,748 |
|
µ , мм–1 |
7,742 |
|
F (000) |
592,0 |
|
Размер кристалла, мм |
0,32 × 0,1 × 0,06 |
|
Область сбора данных по 2 θ , град. |
6,4 – 56,9 |
|
Интервалы индексов отражений |
–11 ≤ h ≤ 11, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
|
Измерено отражений |
30469 |
|
Независимых отражений |
5781 |
|
R int |
0,0327 |
|
Переменных уточнения |
268 |
|
GOOF |
1,044 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0330, wR 2 = 0,0811 |
|
R -факторы по всем oтражениям |
R 1 = 0,0407, wR 2 = 0,0854 |
|
Остаточная электронная плотность (min/max), e/A3 |
–2,12/2,85 |
Таблица 2
|
Связь |
d , Å |
Угол |
ω , град. |
|
Bi(1)–O(1) |
2,388(4) |
O(1)Bi(1)O(3) |
170,20(14) |
|
Bi(1)–С(1) |
2,235(5) |
C(1)Bi(1)O(1) |
87,20(17) |
|
Bi(1)–O(4) |
2,487(4) |
C(1)Bi(1)O(4) |
83,69(16) |
|
Bi(1)–С(11) |
2,237(5) |
C(1)Bi(1)C(11) |
97,77(19) |
|
S(1)–O(1) |
1,495(5) |
C(11)Bi(1)O(1) |
88,31(17) |
|
S(1)–O(3) |
1,477(6) |
C(11)Bi(1)O(4) |
89,34(17) |
|
S(1)–O(2) |
1,408(6) |
O(1)S(1)C(21) |
104,0(3) |
|
S(1)–С(21) |
1,779(5) |
O(3)S(1)O(1) |
110,3(3) |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2165866 для 1; ; .
Выводы
Взаимодействием три( орто -толил)висмута с гидратом мезитиленсульфоновой кислоты в эфире получен и структурно охарактеризован гидрат мезитиленсульфоната ди( орто -толил)висмута. Координационный полиэдр атома металла представляет собой тригональную бипирамиду с атомами кислорода сульфогруппы и молекулой воды в аксиальных положениях и не-поделенную электронную пару с двумя арильными лигандами в экваториальных позициях.
Список литературы Деарилирование три(орто-толил)висмута мезитиленсульфоновой кислотой
- Шарутин В.В., Поддельский А.И., Шарутина О.К. Синтез, строение и применение органических соединений висмута // Коорд. химия. 2021. Т. 47, № 12. С. 719-788. DOI: 10.31857/S0132344X21120021.
- Шарутин В.В., Мосунова Т.В. Синтез, строение и применение арильных соединений висмута // Вестник ЮУрГУ. Серия «Химия». 2020. Т. 12, № 3. С. 7-66.
- Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Методы элементоорганической химии // Сурьма, висмут. М.: Наука, 1976. 483 с.
- Deacon G.B., Jackson W.R., J.M. Pfeiffer. The preparation and reactivity of arylbismuth(iii) di-carboxylates an diarylbismuth(III) carboxylates // Aust. J. Chem. 1984. Vol. 37. P. 527-535. DOI: 10.1071/CH9840527.
- Synthesis of arylbismuth (III) sulfonates from triarilbismuth compounds and arensulfonic acids or sulfur trioxide / G.B. Deacon, P.W. Felder, M. Domagala et al. // Inorg. Chim. Acta. 1986. Vol. 113, no. 1. P. 43-48. DOI: 10.1016/S0020-1693(00)86855-3.
- Шарутин В.В., Шарутина О.К. Бис(2,5-диметилбензолсульфонат) фенилвисмута. Строение и реакции // Журнал неорганической химии. 2014. Т. 59, № 10. С. 1356-1359. DOI: 10.7868/S0044457X14100183.
- Homo-and heteroleptic coordination polymers and oxido clusters of bismuth(III) vinylsulfonates // L. Wrobel, T. Ruffer, M. Korb et al. // Chemistry. A European Journal. 2018. Vol. 24, no. 62. P. 1663016644. DOI: 10.1002/chem.201803664.
- Structural and solution studies of phenylbismuth(III) sulfonate complexes and their activity against Helicobacter pylori / P.C. Andrews, M. Busse, G.B. Deacon et al. // Dalton Trans. 2010. Vol. 39, no. 40. P. 9633-9641. DOI: 10.1039/c0dt00629g.
- Gupta A., Kumar S., Singh H.B. Structural and reactivity aspects of organoselenium and tellurium cations // Proc. Natl. Acad. Sci., India, Sect. A Phys. Sci. 2016. Vol. 86. P. 465-498. DOI: 10.1007/s40010-016-0301-1.
- Шарутин В.В., Шарутина О.К., Житкевич М.В. Аренсульфонаты дифенилвисмута. Синтез и строение // Журн. общ. химии. 2000. Т. 70, № 5. С. 737-739.
- Беллами Л.Дж. Инфракрасные спектры сложных молекул. М.: Изд. ИЛ, 1963. 590 с.
- Yeats P.A., Sams J.R., Aubke F. The synthesis and Mossbauer and vibrational spectra of some trimethyltin (IV) sulfonates // Inorg. Chem. 1971. Vol. 10, no. 9. P. 1877-1881. DOI: 10.1021/ic50103a007.
- Olapinski H., Weidlein J., Hausen H.D. SO3-Einschicbyngsreaktionen bei aluminium, gallium-, undium- and thallium trialkyle // J. Organomet. Chem. 1974. Vol. 64, no. 2. P. 193-204. DOI: 10.1016/S0022-328X(00)87910-3.
- Бацанов С.С. Атомные радиусы элементов // Журн. неорган. химии. 1991. Т. 36, № 12. С. 3015-3037.
- Взаимодействие бис(аренсульфонатов) трифенилвисмута с трифенилстибином / B.В. Шарутин, О.К. Шарутина, И.И. Павлушкина и др. // Журн. общ. химии. 2001. Т. 71, № 1. C. 87-90.
- Гиллеспи Р., Харгиттаи И. Модель отталкивания электронных пар валентной оболочки и строение молекул. М.: Мир, 1992. 296 с.
- Cambridge Crystallographic Data Center. 2022. deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk
- Consequence of ligand bite angle on bismuth lewis acidity / R. Kannan, S. Kumar, A.P. Andrews et al. // Inorg. Chem. 2017. Vol. 56, no. 16. P. 9391-9395. DOI: 10.1021/acs.inorgchem.7b01243
- Reversing Lewis acidity from bismuth to antimony / D. Sharma, S. Balasubramaniam, S. Kumar et al. // Chem. Commun. 2021. Vol. 57. P. 8889-8892. DOI: 10.1039/d1cc03038h.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Инфракрасная спектроскопия органических и природных соединений: учебное пособие / А.В. Васильев, Е.В. Гриненко, А.О. Щукин, Т.Г. Федулина. СПб.: СПбГЛТА, 2007. 54 с.
- Spectral Database for Organic Compounds, SDBS. Release 2021. National Institute of Advanced Industrial Science and Technology.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete structure solution, refinement and analysis program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. 2009. Vol. 42. P. 339-341. DOI: 10.1107/ S0021889808042726.


