Действие аминогликозидных антибиотиков на генотоксичность в Allium тесте
Автор: Концевая Ирина Ильинична, Минина Анастасия Викторовна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 5 т.8, 2022 года.
Бесплатный доступ
Исследуется влияние аминогликозидных антибиотиков (стрептомицина и гентамицина) на патологию митоза в клетках корневой меристемы Allium cepa L. в первой метафазе после обработки и после завершения восстановительного периода. Методы исследования: Allium тест, цитогенетический анализ, статистический анализ. Опыт был выполнен на партии сорта Штуттгартер, который характеризовался как генетически нестабильный по итогам микроядерного теста. Результаты тестирования аминогликозидных антибиотиков (стрептомицина - в концентрации 1000 мг/л, экспозиции 24 и 48 часов; гентамицина - в концентрации 100,0 мг/л, экспозиции 48 часов) показали их негативное влияние и повышение роста патологических процессов в клетках образовательной ткани корней лука обыкновенного. Сравнительный анализ долей аберраций кластогенного типа и аберраций анеугенного типа по всем вариантам исследования позволил прийти к заключению, что тестируемые антибиотики проявляют большую способность вызывать нарушения митоза, связанные с повреждением митотического аппарата, чем нарушения, связанные с повреждением и нарушением структуры хромосом. Среди аберраций кластогенного типа доминируют: хромосомные и хроматидные мосты. Среди аберраций анеугенного типа доминируют: забегание/отставание хромосом, к-митоз в нескольких морфологических вариантах (гиперспирализация хромосом и их рассеивание в метафазе; рассеивание хромосом в метафазе и анафазе); слипание хромосом в разной степени, вплоть до образования комков на стадии метафазы с образованием аномальных структур). Установлено, что увеличение длительности действия стрептомицина вызывает более негативные последствия по сравнению с меньшим стрессовым давлением. После восстановительного периода на протяжении двух-трех клеточных циклов в вариантах применения стрептомицина происходит частичное восстановление клеток. При действии гентамицина отмечали у 80% клеток слипание хромосом и единичные кольцевые хромосомы. Эти эффекты оказались нерепарируемыми и после периода восстановления была установлена гибель 90% корешков.
Allium тест, аминогликозидные антибиотики, патология митоза
Короткий адрес: https://sciup.org/14123905
IDR: 14123905 | УДК: 577.181.5:576.353 | DOI: 10.33619/2414-2948/78/04
Текст научной статьи Действие аминогликозидных антибиотиков на генотоксичность в Allium тесте
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 577.181.5:576.353
Аминогликозиды относятся к группе антибиотиков, блокирующих синтез белков. Данная группа антибиотиков не менее многочисленная, чем группа антибиотиков, нарушающих синтез клеточной стенки бактерий [1].
Нарушение синтеза белка прокариот может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и заканчивая блокированием связывания т-РНК с 30S субъединицами рибосом [2]. Здесь следует отметить, что стрептомицин действует на 30S субъединицу, другие аминогликозиды связываются с обеими субъединицами рибосом, в их присутствии образуется нестабильный 70S инициаторный комплекс и обрывается биосинтез белка [3]. Избирательность действия антибиотиков этой группы на бактериальную клетку обеспечивается существенным различием рибосом у бактерий и эукариот. Частицы бактериальных рибосом, обозначаемые по коэффициенту седиментации как 50S- и 30S-частицы, отличаются по способности связываться с антибиотиками от частиц рибосом эукариотов, соответственно, 60S- и 40S-частиц. По этой причине цитоплазматические рибосомы животной клетки реагируют с ними гораздо слабее или вообще не связывают указанные антибиотики. Это в первую очередь и создает возможность использования этих антибиотиков в клинике, т.е. делают их малотоксичными для человека [3]. Аминогликозиды относятся к препаратам с низким терапевтическим индексом, т. е. малым разрывом между терапевтической и токсической дозой или концентрацией.
Цель работы: выявление повреждений генетического аппарата в клетках корневой меристемы Allium cepa L. в первой метафазе после обработки и после завершения восстановительного периода [4] при действии в течение одного-трех клеточных циклов аминогликозидных антибиотиков (гентамицина и стрептомицина).
Методика исследований
Исследование ответных реакций растений лука обыкновенного в условиях действия водных растворов антибиотиков выполняли с помощью Allium теста [5] на сорте Штуттгартен. В качестве негативного контроля использовали дистиллированную воду.
Тестировали следующие антибиотики: гентамицин (гентамицина сульфат, РУП «Белмедпрепараты», Беларусь) — 100,0 мг/л; стрептомицин (стрептомицина сульфат; ЗАО «Брынцалов-А», Россия) — 1000,0 мг/л. Согласно рекомендации ВОЗ [4], в эксперименте дополнительно выдерживали период восстановления длительностью 24 часа, в течение которого тестируемое вещество не воздействует (вариант последействия), и только затем выполняли фиксацию корешков. Во всех вариантах опыта фиксация производилась с 6.30 до 7.00 утра.
Давленые препараты для цитогенетического анализа, окрашенные ацетогематоксилином, изготавливали по общепринятой методике [10]. Просмотр препаратов осуществляли на компьютеризированной кариологической станции, оснащенной микроскопом Leica DMR при увеличении 40×10×1,5. Цитогенетический анализ выполняли по [6, 7].
Статистическую обработку результатов исследований проводили с помощью пакета прикладного программного обеспечения Microsoft Excel и Statsoft (USA) Statistica v. 7.0. Для данных, подчиняющихся нормальному закону распределения, использовали t-критерий Стьюдента. Нулевую гипотезу отклоняли при уровне статистической значимости p<0,05 [8].
Результаты исследований
При микроскопировании препаратов в вариантах опыта наблюдали в апикальной меристеме некоторых придаточных корней лука отсутствие деления (Таблица).
Таблица
ВЛИЯНИЕ АМИНОГЛИКОЗДНЫХ АНТИБИОТИКОВ
НА КЛЕТОЧНЫЙ ЦИКЛ МЕРИСТЕМНЫХ КЛЕТОК КОРЕШКОВ ЛУКА ОБЫКНОВЕННОГО
|
№ варианта опыта |
Тестируемые вещества, концентрация в мг/л |
Число корешков с митозом, % |
|
1 |
вода водопроводная |
100,0 |
|
2 |
стрептомицин, 1000,0 — 24 ч |
100,0 |
|
3 |
последействие (стрептомицин, 1000,0 — 24 ч) |
91,9 |
|
4 |
стрептомицин, 1000,0 — 48 ч |
95,0 |
|
5 |
последействие (стрептомицин, 1000,0 — 48 ч) |
100,0 |
|
6 |
гентамицин, 100,0 — 48 ч |
96,4 |
|
7 |
последействие (гентамицин, 100,0 — 48 ч) |
0 |
У них митотический индекс был близок к нулю и большинство клеток находились в профатическом состоянии. Однако, если применение гентамицина и стрептомицина в ряде вариантов опыта подавляло митотическую активность у 5,0–8,1% корешков на момент фиксации материала, то в варианте «последействие (гентамицин)» число выживших корешков составило два, с МИ равным 1,0–2,0%. В данном варианте на препаратах наблюдали как нормальные ядра, так и аномальные. В связи с низкой митотической активностью по указанному варианту не учитывали при анализе результаты критериев генотоксичности.
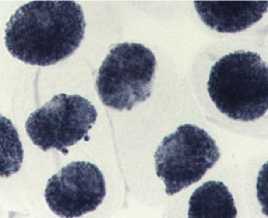
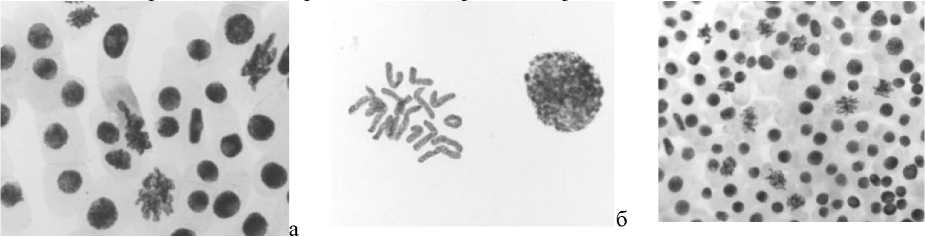
При анализе данных, полученных в результате микроядерного теста (Рисунок 1), наблюдали наличие микроядер в контрольном варианте, число клеток с микроядрами достигало 0,29%. Микроядра формировались в результате отпочковывания ядерных почек у интерфазных ядер (Рисунок 5: 1а, 1б). Наличие микроядер в клетках, как правило, рассматривается как морфологический пассивный маркер генетической нестабильности [9, 10]. Тестируемую партию лука обыкновенного по данному маркеру можно классифицировать как генетически нестабильный материал. В 1,5 раза по сравнению с контролем увеличивалось число клеток с микроядрами в варианте «стрептомицин, 1000,0 мг/л — 24 часа». В остальных вариантах были отмечены единичные клетки с микроядрами. Необходимо подчеркнуть, что микроядра были очень маленького размера.
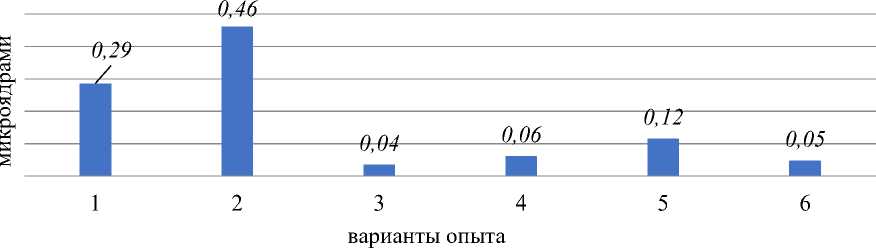
Рисунок 1. Влияние аминогликозидных антибиотиков на процент клеток с микроядрами. Варианты опыта: 1 — вода дистиллированная, 2 — стрептомицин, 1000,0 мг/л — 24 часа, 3 — последействие варианта 2; 4 — стрептомицин, 1000,0 мг/л — 48 ч; 5 — последействие варианта 4; 6 — гентамицин, 100,0 мг/л — 48 ч
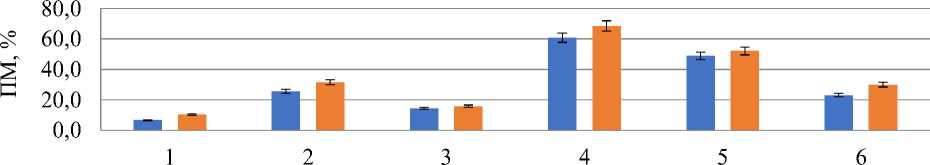
При действии антибиотиков отмечали существенное возрастание значения ПМ, с 6,0% — в контроле до 22,0–61,1% — в опытных вариантах. Пролонгированный эффект стрептомицина оказал негативную реакцию на образование патологических митозов (Рисунок 2, вариант 4) по сравнению с более кратковременным действием антибиотика.
варианты опыта
■ ПМ с учетом профазы ■ ПМ без учета профазы
Рисунок 2. Влияние аминогликозидных антибиотиков на патологию митоза. Варианты опыта: 1 — вода дистиллированная, 2 — стрептомицин, 1000,0 мг/л — 24 часа, 3 — последействие варианта 2; 4 — стрептомицин, 1000,0 мг/л — 48 ч; 5 — последействие варианта 4; 6 —гентамицин, 100,0 мг/л — 48 ч
В вариантах последействия по аминогликозидным антибиотикам наблюдали существенное снижение патологических митозов, что свидетельствует о возможности работы механизмов адаптации и репарации.
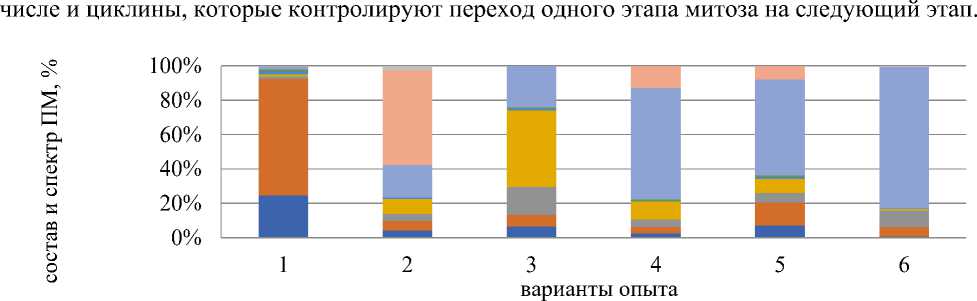
Действие стрептомицина на протяжении одного клеточного цикла вызывало к-митоз — 45,1%, слипание — 18,2%, мосты — 6,2% (Рисунок 3, вариант 2). В восстановительном периоде данного варианта доминирующим типом патологий стали мосты (более 40,0%), слипание хромосом осталось на прежнем уровне (Рисунок 3, вариант 3). Полученные результаты тестирования свидетельствуют о доминировании патологий митоза, связанных с повреждением митотического аппарата. Известно, что здесь задействованы белки, в том
■ АсВер ■ з/отст хр ■ выбр хр ■ мосты ■ рассеив ■ фрагменты ■ слипание ■ к-митоз ■ разное
Рисунок 3. Влияние аминогликозидных антибиотиков состав и спектр патологий митоза. Варианты опыта: 1 — вода дистиллированная, 2 — стрептомицин, 1000,0 мг/л — 24 часа, 3 — последействие варианта 2; 4 — стрептомицин, 1000,0 мг/л — 48 ч; 5 — последействие варианта 4; 6 — гентамицин, 100,0 мг/л — 48 ч
При действии стрептомицина в течение 2–3 клеточных циклов (Рисунок 3, вариант 4, Рисунок 4) отмечено преобладание слипания хромосом (свыше 60,0%), также более 10,1% клеток имели мосты и к-митоз. В варианте 5 (Рисунок 3) (последействие) не наблюдали существенных изменений по составу и спектру ПМ.
в
-
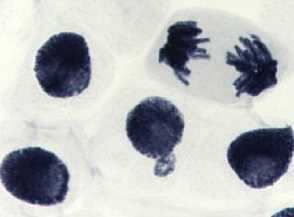
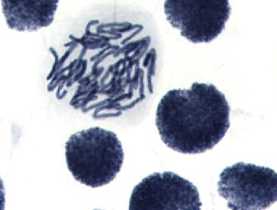
1) контроль — вода дистиллированная: а, б — интерфазное ядро с ядерной почкой (ядерные протрузии); в — рассеивание хромосом
-
• • ® <■ ^ 4 • л * Л’«.
а Ж I . V ^ Ж 'б в
а
-
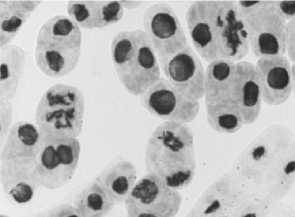
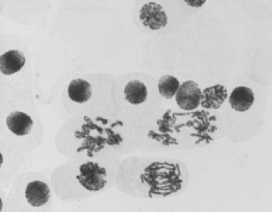
2) стрептомицин, 1000,0 — 24 ч: а-в — рассеивание хромосом + слипание; а — мост в анафазе; а, в — комки
в
-
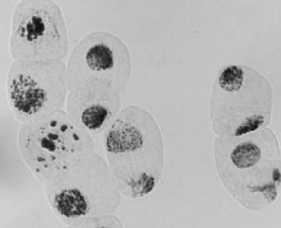
3) последействие «стрептомицин, 1000,0 — 24 ч»: а-в — рассеивание хромосом в метафазе и — множественный мост; в — мост
® It #
ил# * *
• б
анафазе, слипание хромосом; б
-
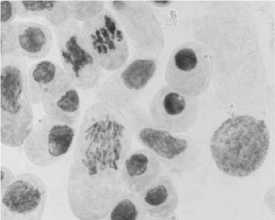
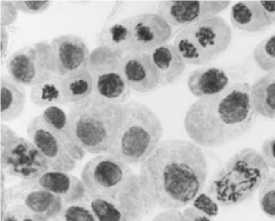
4) стрептомицин, 1000,0 мг/л, 48 ч: а-в — рассеивание хромосом в метафазе и анафазе +
слипание хромосом; в — мосты
4 T

а
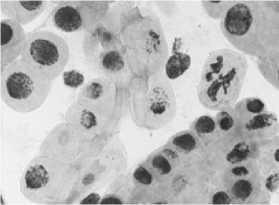
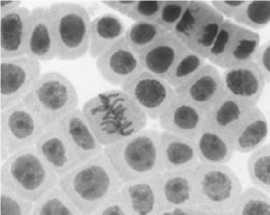
5) последействие «стрептомицин, 1000,0 мг/л, 48 ч»: а, б — рассеивание хромосом в метафазе + слипание; в - нормальный вид хромосом в метафазе и анафазе
6) гентамицин, 100,0 мг/л, 48 ч : а — набухание и склеивание хромосом в метафазе; б — рассеивание хромосом в метафазе + кольцевая хромосома; в — нормальный вид хромосом в метафазе, слипание хромосом
-
Рисунок 4. Типы патологий митоза при действии аминогликозидных антибиотиков (увеличение микроскопа 400×, 100×)
При действии гентамицина среди типов ПМ преобладало слипание хромосом (более 80,1%) (Рисунок 3, вариант 6).
Во всех препаратах при действии аминогликозидных антибиотиков наблюдали набухание хромосом, регистрировали рассеивание хромосом, их слипание (вплоть до образования комков, например, вариант «стрептомицин, 1000,0 мг/л — 24 ч» (Рисунок 4 , 2а, 2б, 2в), мосты одиночные (Рисунок 4, 2а) и двойные, асинхронное веретено деления.
В вариантах «последействие» стрептомицина (Рисунок 4: 3а-3в, 5а, 5б), сохранялись ранее наблюдаемые типы патологий, однако в варианте последействия «стрептомицин, 1000,0 мг/л — 48 ч» у отдельных корней вид ядер и хромосом был нормальным (Рисунок 4, 5в).
В варианте «гентамицин, 100,0 мг/л, 48 ч» наблюдали в большинстве случаев слипание хромосом (Рисунок 4, 6а), в ряде корешков - кольцевые хромосомы, рассеивание хромосом в метафазе (Рисунок 4, 6б). В отдельных корешках вид хромосом у большинства клеток был в норме, но с наличием в 3,1-15,2% такой патологии как слипание хромосом (Рисунок 4, 6в).
Заключение
Таким образом, результаты тестирования аминогликозидных антибиотиков (стрептомицина — в концентрации 1000 мг/л, экспозиции 24 и 48 часов; гентамицина — в концентрации 100,0 мг/л, экспозиции 48 часов) показали их негативное влияние и повышение роста патологических процессов в клетках образовательной ткани корней лука обыкновенного.
Сравнительный анализ долей аберраций кластогенного типа и аберраций анеугенного типа по всем вариантам исследования позволил прийти к заключению, что тестируемые антибиотики проявляют большую способность вызывать нарушения митоза, связанные с повреждением митотического аппарата, чем нарушения, связанные с повреждением и нарушением структуры хромосом. Среди аберраций кластогенного типа доминируют: хромосомные и хроматидные мосты. Среди аберраций анеугенного типа доминируют: забегание/отставание хромосом, к-митоз в нескольких морфологических вариантах (гиперспирализация хромосом и их рассеивание в метафазе; рассеивание хромосом в метафазе и анафазе); слипание хромосом в разной степени, вплоть до образования комков на стадии метафазы с образованием аномальных структур).
Установлено, что увеличение длительности действия стрептомицина вызывает более негативные последствия по сравнению с меньшим стрессовым давлением. После восстановительного периода на протяжении двух-трех клеточных циклов в вариантах применения стрептомицина, происходит частичное восстановление клеток, об этом свидетельствует существенное снижение числа патологических клеток в 1,2–2,0 раза в вариантах последействия. В клетках некоторых корешков наблюдали пикноз ядер с последующей гибелью корней, у другой части корешков клетки полностью восстанавливалась до нормы.
При действии гентамицина отмечали у 80% клеток слипание хромосом и единичные кольцевые хромосомы. Эти эффекты оказались нерепарируемыми и после периода восстановления было установлено в 90,3% гибель корешков, а в 9,7% корешков отмечали низкую интенсивность деления (1–2%).
Список литературы Действие аминогликозидных антибиотиков на генотоксичность в Allium тесте
- Машковский М. Д. Лекарственные средства. М.: Новая волна, 2012. 1216 с.
- Алехин Е. К. Как действуют антибиотики // Биология: электронный Соросовский образовательный журнал. 2000. №4. C. 19-23.
- Желдакова Р. А. Механизмы биосинтеза антибиотиков и их действие на клетки микроорганизмов. Минск: БГУ, 2004. 111 с.
- Руководство по краткосрочным тестам для выявления мутагенных и канцерогенных химических соединений. Гигиенические критерии состояния окружающей среды. Женева: ВОЗ, 1989. №51. 212 с.
- Fiskesjo G. Allium test for screening chemicals; evaluation of cytological parameters // Plants for environmental studies. 1997. V. 11. P. 307-333.
- Паушева З. П. Практикум по цитологии растений. М.: Агропромиздат, 1988. 271 с.
- Алов И. А. Цитофизиология и патология митоза. М.: Медицина, 1972. 264 с.
- Лакин Г. Ф. Биометрия. М.: Высш. шк., 1990. 352 с.
- Iqbal M., Abbas M., Nisar J., Nazir A., Qamar A. Bioassays based on higher plants as excellent dosimeters for ecotoxicity monitoring: a review // Chemistry International. 2019. V. 5. №1. P. 1-80.
- DOI: 10.31221/osf.io/z2ynm
- Сутягина О. И. Микроядра и выживание опухолевых клеток человека в культуре: дисс. … канд. биол. наук. М., 2019. 177 с.


