Делирий в послеоперационном периоде: этиология, патогенез, интенсивная терапия
Автор: Красносельский Михаил Яковлевич, Политов Михаил Евгеньевич
Журнал: Хирургическая практика @spractice
Рубрика: Хирургия и смежные специальности
Статья в выпуске: 2, 2013 года.
Бесплатный доступ
Психические нарушения в послеоперационном периоде, в частности делирий, развиваются у 10-80% больных. Послеоперационный делирий (ПД) существенно увеличивает длительность пребывания больного в стационаре и послеоперационную летальность. В патогенезе делирия принимают участие различные факторы, важнейшим из которых является хирургический стресс-ответ с активацией симпатоадреналовой системы и системной воспалительной реакцией. Предрасполагающими факторами к развитию ПД являются предшествующие когнитивные нарушения, алкоголизм, а также некупированная боль, лихорадка и другие послеоперационные осложнения. В настоящее время выделяют гиперактивную, гипоактивную и смешанную формы ПД. Интенсивная терапия ПД включает назначение нейролептиков (галоперидола, оланзапина). Обсуждается превентивное введение низких доз галоперидола у больных с высоким риском ПД.
Послеоперационный делирий, когнитивные нарушения, анестезиологическое обеспечение, профилактика делирия
Короткий адрес: https://sciup.org/142211518
IDR: 142211518 | УДК: 616.89;
Текст научной статьи Делирий в послеоперационном периоде: этиология, патогенез, интенсивная терапия
Психические нарушения в послеоперационном периоде довольно распространенная патология. По данным разных авторов, они встречаются у 10–80% больных, при этом их частота существенно возрастает в пожилом возрасте [12, 61].
В послеоперационном периоде могут возникать разнообразные психические нарушения от протекающих субклинически (частичная дезориентация, снижение критики) до тяжелых форм (глубокой депрессии и острых психозов с галлюцинациями, бредом и психо-моторным возбуждением) [61]. Следует отметить, что до недавнего времени эти состояния относились к разным патологическим процессам.
В последние годы была сформулирована концепция «делирия у больного в критическом состоянии». Согласно этой концепции делирий – это любые остро развившиеся психопатологические нарушения у больного в критическом состоянии [17]. Показано, что, несмотря на многообразие клинических проявлений, психопатологические нарушения у больных в критических состояниях имеют общий патогенез, и поэтому должны рассматриваться как единый синдром. Делирий – наиболее частое проявление поражения центральной нервной системы в результате полиорганной недостаточности [17].
Послеоперационный делирий (ПД) является одной из форм делирия в критическом состоянии, в развитии которого, наряду с общими механизмами, принимают участие хирургический стресс-ответ и воздействие препаратов для общей анестезии и обезболивания [61].
ПД может развиться после любой операции, даже малотравматичной, выполняемой в амбулаторных условиях. Но обычно ПД возникает после длительных высокотравматичных операций. По мнению Rudolf J.L., Marcantonio E.R. (2011) [44], наиболее часто это следующие операции:
– кардиохирургические вмешательства (чаще с использованием искусственного кровообращения);
– операции на органах брюшной полости (чаще по поводу онкологических заболеваний);
– эндопротезирование крупных суставов.
– нейрохирургические операции.
Однако делирий у этих больных не является в чистом виде ПД, так как его развитие отчасти связано с повреждением головного мозга в результате основного заболевания и хирургической травмы.
ПД – это серьезное осложнение, требующее интенсивной терапии. Развитие делирия в послеоперационном периоде су- щественно повышает летальность (в 2–6 раз) и длительность длительность пребывания больного в отделении реанимации. Так, по данным Koster S. et al., 2012, летальность после кардиохирургических операций у больных с делирием составляет 12,5%, тогда как без делирия – 2,0% [26].
У некоторых больных психические нарушения сохраняются в течение нескольких месяцев и даже лет после операции, существенно ухудшают качество жизни и требуют плановой антипсихотической терапии. Менее выраженные проявления сохраняются длительное время у многих больных: по данным Koster S. et al. (2009), снижение памяти и интеллекта наблюдается у 31–36% больных, нарушения сна – у 47% [25]. По мнению Wacker P. et al. (2006), ПД является фактором риска деменции [58]. Более того, есть исследования, в которых выявлена патогенетическая взаимосвязь между ПД и болезнью Альцгеймера [8].
В связи с этим профилактика ПД должна проводиться в обязательном порядке у предрасположенных лиц. А при развившемся делирии, в том числе малосимптомных его формах, необходимо проводить своевременную интенсивную терапию этого состояния.
Патогенез послеоперационного делирия
Несмотря на множество исследований, посвященных проблеме делирия, следует признать, что патогенез этого состояния до конца не изучен. В развитии делирия у больных в критическом состоянии, в том числе и ПД, принимает участие несколько механизмов, из которых важнейшим, по-видимому, является хирургический стресс-ответ [13]. Хирургический стресс-ответ – комплексная реакция организма на оперативное вмешательство с активацией нейроэндокринных систем (гипоталамо-гипофизарно-надпочечниковой, симпатоадреналовой и др.), а также про- и антивоспалительных механизмов [16]. Хирургический стресс-ответ является естественной реакцией организма, однако чрезмерная активация вышеперечис-
– нарушению продукции нейромедиаторов и изменению реакции на них [50, 51];
– изменению нормального функционирования нейронов: гиперактивации одних и подавлению активности других [50];
– подавлению формирования межнейрональных связей [45];
– в ряде случаев, повреждению гематоэнцефалического барьера, отеку вещества мозга и нейровоспалению – инфильтрации ткани мозга клетками воспаления с последующим повреждением нейронов [10].
Тригерные факторы, приводящие к развитию делирия, вызывают, прежде всего, дисбаланс важнейших нейромедиаторов головного мозга – ацетилхолина и дофамина. Эти нейротрансмиттеры являются антагонистами: дофамин повышает, а ацетилхолин снижает нейрональную возбудимость [51]. Дисбаланс одного или обоих этих медиаторов вызывает нарушение работы нейронов. По мнению ряда авторов, избыток дофамина и/или недостаток ацетилхолина сопровождается развитием делирия. У больных с делирием выявлено повышение в крови активности холинестеразы (Cerejeira J. et al., 2012), которое коррелировало с концентрацией в крови С-реактивного белка и интерлейкина-6. Гиперпродукция холинэстеразы, по мнению авторов, может быть одним их механизмов снижения количества ацетилхолина в головном мозге [11].
В патогенезе ПД также участвует и другие нейромедиаторы, в частности норадреналин, гамма-аминомасляная кислота, серотонин, эндорфины, мелатонин [20].
Изменение синтеза основных нейротрансмиттеров может быть результатом нарушения поступления аминокислот-предшественников нейромедиаторов в головной мозг. Это может происходить при изменении соотношения ароматических и неароматических аминокислот в крови. К ароматическим аминокислотам относятся триптофан (предшественник се- ленных систем может привести к ряду нарушений, в том числе – делирию. Схематично патогенез ПД представлен на рисунке 1.
По мнению Kazmierski J, Kloszewska I. (2011), активация гипоталамо-гипофизарно-надпочечниковой системы с гиперпродукцией кортизола является основным триггером развития делирия в послеоперационном периоде [23].
Другим важнейшим триггером ПД является гиперпродукция провоспалительных цитокинов, которые, по мнению многих исследователей, вызывают нарушение нервной передачи в коре головного мозга и синтеза некоторых нейромедиаторов, что и приводит к развитию делирия [30].
Пусковые факторы – гормоны нейроэндокринных систем (кортизол, катехоламины) и медиаторы воспаления (прежде всего, фактора некроза опухоли-альфа и интерлейкина-1) способствуют:
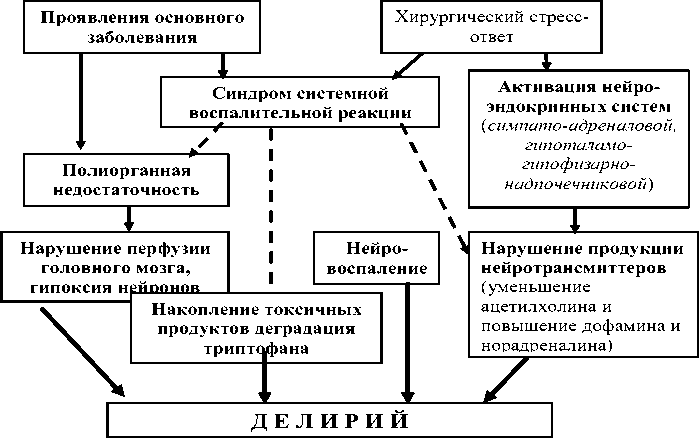
Рис. 1. Схема патогенеза послеоперационного делирия.

ротонина) и фенилаланин (предшественник дофамина и норадреналина). В исследовании Pandharipande P.P. et al. (2009) показано, что нарушение соотношения концентраций триптофана и неаромических нейтральных аминокислот в крови сопровождается развитием делирия [37].
Наряду с повышением триптофана в головном мозге нарушается его метаболизм. Под действием провоспалительных цитокинов (интерферона-гамма, ФНО-альфа, ИЛ-1) происходит индукция фермента индоламин 2,3 диоксигеназы, которая расщепляет триптофан с образованием токсичных веществ, тогда как продукция серотонина снижается [30].
Дополнительным фактором, способствующим дисбалансу нейромедиаторов в головном мозге, является гипоксия нейронов. Нарушение церебральной оксигенации является одним из проявлений синдрома полиогранной недостаточности, к которому приводит, в том числе патологический, хирургический стресс-ответ. Гипоксия нейронов возникает, главным образом, в результате нарушения работы ферментов цепи тканевого дыхания, в меньшей степени – из-за снижения перфузии головного мозга. Активность ферментов цепи тканевого дыхания подавляют некоторые провоспалительные цитокины (фактор некроза опухоли-альфа, интерлейкин-1 и 6) [60].
Факторы риска делирия в послеоперационном периоде
Факторы риска ПД включают в себя некоторые хронические заболевания, состояние больного перед операцией (в том числе психический статус), особенности течения основного заболевания и его осложнения, а также медикаментозные и немедикаментозные вмешательства [13, 17, 44]. В связи с этим все факторы риска ПД можно разделить на три основные группы: некорригируемые анамнестические факторы, факто- ры, связанные с основным заболеванием и ятрогенные факторы (табл. 1).
По мнению многих авторов, важнейшим фактором риска развития ПД является пожилой возраст (старше 70 лет) [56]. Другим предрасполагающим фактором ПД являются предшествующие когнитивные нарушения, депрессия и делирий в анамнезе [12, 13, 18]. При этом частота ПД существенно возрастает у пожилых лиц с когнитивными нарушениями. Есть сведения, о том, что курение является фактором риска ПД [60].
Среди анамнестических факторов риска ПД следует выделить артериальную гипертензию и хронический алкоголизм: Ouimet S. et al., 2007 на большом клиническом материале (820 больных) показали, что эти состояния являются независимыми факторами риска делирия. В том же исследовании продемонстрировано, что использование седативных препаратов и опиоидных анальгетиков в больших дозах также является предрасполагающим фактором к развитию ПД [35].
В последние годы выявлена генетическая предрасположенность к развитию делирия. Показано, что у носителей аллели е4 гена аполипропротеина Е чаще развивается ПД, по сравнению с общей популяцией [29]. Ранее было продемонстрировано, что эта аллель ассоциируется с развитием болезни Альцгеймера [7].
Среди факторов, связанных с основным заболеванием, ведущим является некупированный болевой синдром [33]. Боль активирует симпатоадреналовую и гипоталамо-гипофизарно-надпочечниковую системы, что в условиях хирургического стресса может явиться дополнительным триггером делирия. Кроме того, боль стимулирует выброс провоспалительных цитокинов, способствующих нарушению синтеза нейротранс-миттреров в головном мозге.
Таблица 1
Факторы риска послеоперационного делирия
|
Анамнестические факторы |
Факторы, связанные с основным заболеванием |
Ятрогенные факторы |
|
Возраст (более 70 лет) [56] |
Боль [33, 40] |
Иммобилизация [53] |
|
Алкоголизм [19, 35] |
Анемия [2, 57] |
Продленная ИВЛ в послеоперационном периоде [9, 49] |
|
Полиморфизм гена АРОЕ [29] |
Лихорадка, инфекционный процесс [2, 54] |
Инвазивные методы терапии и мониторинга (катетеры, дренажи, зонды и др.) [12, 61] |
|
Предшествующие когнитивные нарушения и психические заболевания; делирий в анамнезе [13, 18, 33] |
Артериальная гипотония [16] |
Социальная изоляция, одиночество [32] |
|
Артериальная гипертензия [35] |
Выраженные метаболические нарушения (ацидоз, дегидратация, гиперазотемия, гипербилирубиемия, гипер- и гипонатриемия) [15, 22, 32] |
Необычная обстановка (тяжелобольные, обилие аппаратуры, звуки тревожной сигнализации) [55] |
|
Курение [13]. |
Дыхательная недостаточность [2] |
Длительная, глубокая седация больных [17, 46] |
|
Нарушения зрения и слуха [18, 21, 53] |
Большая длительность операции [15] |
Использование некоторых медикаментов (главным образом, опиоидов и бензодиазепинов) [9, 49] |

Факторы, приводящие к развитию полиорганной недостаточности и системной воспалительной реакции (метаболические нарушения, дыхательная недостаточность, инфекционный процесс), существенно повышают вероятность развития ПД [13].
Из ятрогенных факторах следует отметить также дискомфорт от инвазивных методов лечения и мониторинга, изоляции больного и т.п.
Как уже говорилось, использование опиодов и бензодиазепинов, а также глубокая седация больных являются дополнительными факторами риска ПД [46]. Длительная глубокая седация больных может способствовать развитию ПД. По данным Olofsson K. et al. (2004), длительная седация нарушает циркадный ритм секреции мелатонина, что, по мнению авторов, приводит к нарушению цикла сон-бодрствование и тем самым является триггером делирия [34]. Среди препаратов седативного действия наиболее опасными с точки зрения развития делирия являются бензодиазепины и опиоиды.
Клиническая картина и виды послеоперационного делирия
ПД характеризуется следующими основными проявлениями [12, 61]:
– острое начало, волнообразное течение с эпизодами временного улучшения;
– изменение сознания (агрессия, психомоторное возбуждение или угнетение психической активности, сомноленция);
– нарушение концентрации внимания (невозможность сфокусироваться на каком-то вопросе, невозможность изложить мысль);
– нарушение когнитивных функций (снижение памяти, интеллекта, нарушение речи);
– продуктивная психическая симптоматика (галлюцинации, иллюзии, бредовые идеи).
ПД развивается, как правило, в первые сутки после операции (более 80% всех случаев ПД манифестируют через 2–5 часов после операции). Однако это осложнение может возникнуть сразу после пробуждения больного. Описано также развитие делирия в поздние сроки: через 3–5 суток [12, 17, 61]. Продолжительность психотических реакций обычно составляет около 4–5 дней (от 1 до 10) [4].
ПД протекает в трех основных формах: гиперактивный делирий, гипоактивный делирий и смешанный делирий [43, 48].
Гиперактивный делирий – относительно редкая форма: среди всех ПД он встречается в 1–2% случаев [39, 43]. По данным Peterson J.F. et al. (2006), этот вариант ПД практически не развивается у лиц старше 65 лет [39]. Гиперактивный делирий проявляется яркой клиникой: психомоторное возбуждение, агрессия к окружающим, отсутствие критики к собственному состоянию. Часто наблюдается эйфория, потеря ориентации в месте и времени, галлюцинации и бред. Иногда, особенно в начале, на короткое время больным удается объяснить тяжесть состояния и успокоить их. Однако через несколько минут продуктивная симптоматика рецидивирует. В развернутую фазу больные уже не реагируют на уговоры: требуется медикаментозная седация. Во время психомоторного возбуждения больные часто удаляют венозные и мочевые катетеры, дренажи и зонды. Гиперактивный делирий сопровождается активацией симпатоадреналовой системы, что сопровождается тахикардией и артериальной гипертензией [17, 48]. Как правило, развернутая форма гиперактивного делирия не представляет трудности для диагностики. Сложнее выявить делирий в самом дебюте, когда еще нет яркой продуктивной симптоматики и психомоторного возбуждения.
По мнению некоторых авторов, гиперактивный делирий более благоприятен в прогностическом плане [24].
Гипоактивный делирий встречается у 40–50% больных с ПД. Этот вариант делирия проявляется не так ярко, как гиперактивный, что затрудняет его выявление. На первый план выступает сомноленция, депрессия с угнетением когнитивных функций. Контакт с больными затруднен, нарушается сон (обычно бессонница ночью и сонливость в дневные часы), возникает дезориентация. При этом часто больные что-то бессвязно говорят, у них могут возникать галлюцинации [39, 48]. Есть мнение, что угнетение сознания (оглушение, сопор) являются проявлением гипоактивного делирия. Однако другая точка зрения, по-видимому более обоснованная, состоит в том, что угнетение сознания и делирий следует дифференцировать [1, 6]. Делирий – это нарушение ментальных функций головного мозга, точнее их изменение: этот синдром характеризуется продуктивной психической симптоматикой. И апатия, которую можно принять за угнетение сознания, является своеобразным нарушением психики больного, аналогично тому, как это наблюдается при кататонической форме шизофрении. Угнетение сознания характеризуется подавлением всех функций головного мозга (в том числе когнитивных) и не сопровождается психопатологической симптоматикой. Зачастую дифференциальная диагностика гипоактивного делирия и угнетения сознания представляет трудности. Тем не менее, дифференцировать эти состояния чрезвычайно важно, так как интенсивная терапия их существенно отличается. Делирий, в том числе гипоактивный, поддается лечению антипсихотическими препаратами, тогда как угнетение сознания требует совершенно другой терапии, а антипсихотические средства могут привести к ухудшению состояния.
Смешанный делирий диагностируется в 50–60% случаев ПД. При этой форме гипоактивная фаза (с гипотимией и апатией) сменяется гиперактивной фазой (с психомоторным возбуждением, агрессией и эйфорией). Фазы могут длиться от нескольких минут до нескольких часов. Характерно нарушение цикла «сон-бодрствование»: возбуждение в ночные часы и сонливость днем [39, 48].
Диагностика ПД
Диагноз ПД устанавливается на выявлении характерных критериев. Золотым стандартом диагностики делирия является алгоритм выявления ментальных нарушений (Diagnostic and Statistical Manual of Mental Disorders, DSM-IV) [3] (табл. 2).
Диагноз делирия устанавливают на основании выявления критерия D и двух из остальных критериев. Однако этот алгоритм имеет недостаточную специфичность, поэтому предложены другие методы диагностики делирия, в частности алгоритм, основанный на оценке помрачнения сознания (табл. 3) (confusion assessment method, CAM).
На основании этого метода диагноз делирия устанавливается при наличии трех критериев: 1-го и 2-го критериев и одного из последних (3-го или 4-го). По данным Wongpakaran N. et al. (2011), чувствительность алгоритма CAM в диагностике делирия составляет 91,9%, специфичность – 100% [62].
Другой алгоритм, разработан Bergeron N. et al., 2001, оценка делирия у больных в критическом состоянии (Intensive Care Delirium Screening Checklist) (табл. 4).
При наличии признака ему присваивается 1 балл, при его отсутствии – 0 баллов. Нарушение сознания: в случае А и B – диагностируется коматозное состояние и дальнейшая оценка не проводится; С и Е – 1 балл, D – 0 баллов. Диагноз делирия устанавливается в случае, если общая сумма баллов равна или более 4. По мнению авторов, чувствительность этого алгоритма составляет 99%, специфичность – 64% [5].
Интенсивная терапия послеоперационного делирия включает немедикаментозные и медикаментозные методы. Следует подчеркнуть, что психотерапевтические методы, разъяснение больному его состояния, попытка успокоить его не менее важны, чем медикаментозная коррекция. Для прерывания порочного круга необходимо купирование болевого синдрома и нормализация метаболических нарушений (дегидратации, артериальной гипертензии, лихорадки, др.). Немедикаментозные методы и неспецифическая терапия подробно описаны ниже (в разделе «профилактика ПД»).
Медикаментозные методы включают использование антипсихотических и седативных препаратов. В настоящее вре-
Таблица 2
Алгоритм оценки помрачнения сознания
|
Критерий А |
Нарушение сознания: нарушение четкого восприятия внешней среды и нарушение возможности фокусировать внимание |
|
Критерий B |
Нарушение когнитивной сферы: нарушение памяти, ориентации, речевой коммуникации |
|
Критерий C |
Острое развитие и волнообразное течение |
|
Критерий D |
Предрасполагающее к развитию делирия заболевание |
Таблица 3
Алгоритм оценки помрачнения сознания
|
Критерий 1 |
Острое начало, волнообразное течение |
|
Критерий 2 |
Невозможность концентрации внимания |
|
Критерий 3 |
Нарушение мыслительных процессов |
|
Критерий 4 |
Изменение сознания (возбуждение, сомноленция) |
Таблица 4
Алгоритм оценки делирия у больных в критическом состоянии
Существует несколько режимов введения галоперидола при делирии. Однако в последние годы рекомендуется использовать малые дозы препарата. Robinson T.N., Eiseman B. (2008) рекомендуют вводить по 1–2 мг внутривенно каждые 20 минут до купирования возбуждения. Поддерживающая доза составляет 0,2–0,5 мг четыре раза в день и назначается в течение нескольких суток [42].
В настоящее время для лечения ПД с успехом применяется оланзапин – атипичный антипсихотический агент с минимальным влиянием на гистамин- и адренергические рецепторы. Есть данные, что эффективность оланзапина сопоставима с галоперидолом. Кроме того, этот препарат эффективен и безопасен при делирии у детей. Оланзапин назначается в дозах от 2,5 до 12,6 мг в сутки [36].
В ряде случаев гиперактивного и смешанного делирия требуется дополнительная седативная терапия. Не рекомендуется с этой целью вводить бензоциазепины, так как они сами могут способствовать развитию делирия. В настоящее время для седации больных с ПД используется дексмедетомидин. Это агонист альфа-2-адренорецепторов с избирательным действием на нейроны синего пятна в области моста. Препарат обладает седативным, анальгетическим и анксиолитическим действием

[63]. Дексмедетомидин эффективен и безопасен у больных с делирием. По некоторым данным, этот препарат уменьшает продолжительность проявлений делирия [41].
Профилактика послеоперационного делирия , главным образом, направлена на предотвращение корригируемых факторов риска развития делирия:
– ранняя активизация, ограничение инвазивных манипуляций и своевременный перевод больного из отделения реанимации и интенсивной терапии [14, 47].
– создание доброжелательной атмосферы в отделении реанимации и интенсивной терапии, в том числе возможность общения с родственниками и друзьями, прослушивание радиопередач и т.п.
– адекватное обезболивание (предпочтительнее использование регионарных и нейроакиальных методов анальгезии) [47].
– предпочтение регионарных методов анестезии перед общей [38].
– минимизация седации больных, а также ограничение введения опиодов и бензодиазепинов.
– своевременная коррекция вводно-электролитных расстройств, гипотонии, гипертермии и других нарушений [41].
Ранняя активизация больных позволяет существенно снизить частоту делирия после высокотравматичных операций. Chen C.C. et al. (2011) опубликовали результаты своего исследования, в котором применили комплексный подход к ведению послеоперационного периода у пожилых лиц. В исследование были включены больные после травматичных операций на органах брюшной полости. Реабилитационная программа предусматривала раннюю активизацию и питание больных, когнитивные тренировки и психологическую помощь со стороны среднего медперсонала. В результате такого подхода ни у одного пациента не развился ПД, тогда как в контрольной группе его частота составила 16,7% [14].
Метод анестезии во время операции может оказать влияние на развитие ПД. В настоящее время проведены исследования, в которых показано, что регионарные методы анестезии снижают частоту ПД по сравнению с общей анестезией [31, 38]. При этом поверхностная седация во время нейроаксиальных методов анестезии сопровождается меньшей вероятностью развития ПД, чем глубокая седация. В исследовании Sieber F.E. et al., 2010 изучалось влияние глубины седации пропофолом во время спинальной анестезии на частоту развития делирия. Глубина седации контролировалась электроэнцефалографией с определением биспектрального индекса (BIS). Поверхностная седация (BIS >80%) сопровождалось двукратным снижением частоты и длительности делирия по сравнению с больными, у которых использовалась глубокая седация (BIS=50%) [46].
Продленая эпидуральная анальгезия и другие продленные методы регионарной анальгезии в послеоперационном периоде снижают потребность в опиоидах, и, как показано в различных исследованиях, снижают частоту развития ПД [41].
В послеоперационном периоде для снижения риска делирия необходимо избегать назначения бензодиазепинов и опиоидов.
Однако, если другие методы анальгезии невозможны, опиоиды следует назначать для купирования боли, так как сам по себе болевой синдром является более значимым триггером делирия, чем введение опиоидов. При этом введение опиоидов должно осуществляться в режиме «пациент-контролируемой анальгезии»: этот метод минимизирует дозу препарата и обеспечивает адекватную анальгезию. Кроме того, альтернативные методы обезболивания, в частности введение нестероидных противовоспалительных препаратов, габапентиноидов, парацетамола снижают дозу опиоидов и риск развития ПД. В исследовании Leung J.M. et al. (2006) добавление к анальгетической терапии габапентина снижало частоту развития ПД [29].
При необходимости седативной терапии более предпочтительно использование дексмедетомидина. Есть данные, что этот препарат снижает частоту ПД [41].
Не менее важным для профилактики ПД является создание благоприятной атмосферы и психотерапевтические беседы. Возможность коммуникации больных с внешней средой (общение с родственниками, чтение книг, просмотр телепрограмм т.п.) улучшает эмоциональный фон и снижает вероятность развития ПД.
Фармакологическая профилактика ПД – введения антипси-хотическизх препаратов в низких дозах. Wang W. et al (2012) с целью профилактики ПД вводили галоперидол по следующей схеме: 0,5 мг внутривенно болюсно с последующей инфузией со скоростью 0,1 мг/час в течение 12 часов. На фоне введения галоперидола удалось снизить частоту ПД до 15,3% по сравнению с 23,2% в группе плацебо (р=0,031). При этом у лиц с развившимся делирием на фоне профилактики галоперидолом течение психоза было более благоприятным. При этом побочные эффекты галоперидола не возникали, что, вероятно, связано с использованием низких доз препарата [59].
У пожилых более безопасным может быть применение оланзапина. Larsen K.A. et al. (2010) исследовали этот препарат для профилактики ПД у пожилых лиц после эндопротезирования тазобедренного и коленного суставов. Препарат вводился в дозе 5 мг до и сразу после операции. Частота ПД в группе оланзапина составила 7,6%, тогда как в контрольной группе – 30,8% (р<0,001) [27].
Показания для профилактического назначения антипсихотических препаратов в настоящее дискутируются. По-видимому, эти препараты следует назначать в случае высокой вероятности развития ПД, при выявлении нескольких факторов риска, из которых наиболее значимыми являются пожилой возраст (более 70 лет) и предшествующие когнитивные нарушения или алкоголизм.
В заключение следует повторить, что проблема ПД остается одной из важнейших в современной реаниматологии. Выявление стертых, особенно гипоактивных, форм ПД часто затруднено. При этом делирий существенно увеличивает летальность и способствует инвалидизации. В связи с этим чрезвычайно важно выявление факторов риска делирия, тщательный мониторинг когнитивных функций в послеоперационном периоде, в
том числе со стороны среднего медицинского персонала, а также профилактические немедикаментозные мероприятия.
Список литературы Делирий в послеоперационном периоде: этиология, патогенез, интенсивная терапия
- Соловьева Л.А. Послеоперационные нарушения сознания у гериатрических больных//Анестезиология и реаниматология. 2008. № 3. С. 71-74.
- Aldemir M., Ozen S., Kara I.H. et al. Predisposing factors for delirium in the surgical intensive care unit//Crit. Care. 2001. Vol. 5. № 5. P. 265270.
- American Psychiatric Association (1994) Diagnostic and statistical manual of mental disorders. 4th ed. American Psychiatric Association. 1994, Washington D.C.
- Angles E.M., Robinson T.N., Biffl W.L. et al. Risk factors for delirium after major trauma//Am. J. Surg. 2008. Vol. 196. № 6. P. 684-689.
- Bergeron N., Dubois M.J., Dumont A. et al. Intensive Care Delirium Screening Checklist: evaluation of a new screening tool//Intensive Care Med. 2001. Vol. 27, № 5. P. 589-864.
- Bergeron N., Skrobik Y., Dubois M.J. Is disturbance of consciousness an important feature of ICU delirium?//Intensive Care Med. 2005. Vol. 31, № 6. P. 887.
- Bird T.D. Genetic factors in Alzheimer's disease//N. Engl. J. Med. 2005. Vol. 352, № 9. P. 862-864.
- Bilotta F., Doronzio A., Stazi E. et al. Postoperative cognitive dysfunction: toward the Alzheimer's disease pathomechanism hypothesis//J. Alzheimers Dis. 2010. Vol. 22 (Suppl. 3). P. 81-89.
- Burkhart C.S., Dell-Kuster S., Gamberini M. et al. Modifiable and nonmodifiable risk factors for postoperative delirium after cardiac surgery with cardiopulmonary bypass//J. Cardiothorac. Vasc. Anesth. 2010. Vol. 24, № 4. P. 555-559.
- Cerejeira J., Firmino H., Vaz-Serra A., Mukaetova-Ladinska E.B. The neuroinflammatory hypothesis of delirium.//Acta Neuropathol. -2010. -Vol. 119. -P. 737-754.
- Cerejeira J., Nogueira V., Luis P. et al. The cholinergic system and inflammation: common pathways in delirium pathophysiology//J. Am. Geriatr. Soc. 2012. Vol. 60, № 4. P. 669-675.
- Guenther U., Radtke F.M. Delirium in the postanaesthesia period//Curr. Opin. Anaesthesiol. 2011. Vol. 24, № 6. P. 670-675.
- Deiner S., Silverstein J.H. Postoperative delirium and cognitive dysfunction//Br. J. Anaesth. 2009. Vol. 103 (Suppl. 1). P. 41-46.
- Chen C.C., Lin M.T., Tien Y.W. et al. Modified hospital elder life program: effects on abdominal surgery patients//J. Am. Coll. Surg. 2011. Vol. 213, № 2. P. 245-252.
- Chrispal A., Mathews K.P., Surekha V. The clinical profile and association of delirium in geriatric patients with hip fractures in a tertiary care hospital in India//J. Assoc. Physicians India. 2010. Vol. 58. P. 9-15.
- Desborough J.P. The stress response to trauma and surgery//Br. J. Anaesth. 2000. Vol. 85, № 1. P. 109-117.
- Girard T.D., Pandharipande P.P., Ely E.W. Delirium in the intensive care unit//Crit. Care. 2008. Vol. 12 (Suppl. 3). S. 3.
- Galanakis P., Bickel H., Gradinger R. et al. Acute confusional state in the elderly following hip surgery: incidence, risk factors and complications//Int. J. Geriatr. Psychiatry. 2001. Vol. 16, № 4. P. 349-355.
- Hudetz J.A., Iqbal Z., Gandhi S.D. et al. Postoperative cognitive dysfunction in older patients with a history of alcohol abuse//Anesthesiology. 2007. Vol. 106, № 3. P. 423-430.
- Inouye S.K. Delirium in Older Persons//N. Engl. J. Med. 2006. Vol. 354, № 11. P. 1157-1165.
- Inouye S.K., Zhang Y., Jones R.N. et al. Risk factors for delirium at discharge: development and validation of a predictive model//Arch. Intern. Med. 2007. Vol. 167, № 13. P. 1406-1413.
- Inouye S.K., Viscoli C.M., Horwitz R.I. et al. A predictive model for delirium in hospitalized elderly medical patients based on admission characteristics//Ann. Intern. Med. 2011. Vol. 29, № 1. P. 83-97.
- Kazmierski J., Kloszewska I. Is cortisol the key to the pathogenesis of delirium after coronary artery bypass graft surgery?//Crit. Care. 2011. Vol. 15, № 1. P. 102.
- Kiely D.K., Jones R.N., Bergmann M.A., Marcantonio E.R. Association between psychomotor activity delirium subtypes and mortality among newly admitted post-acute facility patients//J. Gerontol. A. Biol. Sci. Med. Sci. 2007. Vol. 62, № 2. P. 174-179.
- Koster S., Hensens A.G., van derPalen J. The long-term cognitive and functional outcomes of postoperative delirium after cardiac surgery//Ann. Thorac. Surg. 2009. Vol. 87, № 5. P. 1469-1479.
- Koster S., Hensens A.G., Schuurmans M.J., van der Palen J. Consequences of delirium after cardiac operations//Ann. Thorac. Surg. 2012. Vol. 93, № 3. P. 705-711.
- Larsen K.A., Kelly S.E., Stern T.A., et al. Administration of olanzapine to prevent postoperative delirium in elderly joint-replacement patients: a randomized, controlled trial//Psychosomatics. 2010. Vol. 51. P. 409-418.
- Leung J.M., Sands L.P., Rico M. et al. Pilot clinical trial of gabapentin to decrease postoperative delirium in older patients//Neurology. 2006. Vol. 67, № 7. P. 1251-1253.
- Leung J.M., Sands L.P., Wang Y. et al. Apolipoprotein E e4 allele increases the risk of early postoperative delirium in older patients undergoing noncardiac surgery//Anesthesiology. 2007. Vol. 107, № 3. P. 406-411.
- Maes M. The cytokine hypothesis of depression: inflammation, oxidative and nitrosative stress and leaky gut as new targets for adjunctive treatments in depression//Neuro Endocrinol. Lett. 2008. Vol. 29, № 3. P. 287-921.
- Mason S.E., Noel-Storr A., Ritchie C.W. The impact of general and regional anesthesia on the incidence of post-operative cognitive dysfunction and post-operative delirium: a systematic review with meta-analysis//J. Alzheimers Dis. 2010. Vol. 22 (Suppl. 3). P. 67-79.
- Marcantonio E.R., Goldman L., Mangione C.M. et al. A clinical prediction rule for delirium after elective noncardiac surgery//J.A.M.A. 1994. Vol. 271, № 2. P. 83-97.
- Nie H., Zhao B., Zhang Y.Q. et al. Pain and cognitive dysfunction are the risk factors of delirium in elderly hip fracture Chinese patients//Arch. Gerontol. Geriatr. 2012. Vol. 54, № 2. P. 57-58.
- Olofsson K., Alling C., Lundberg D., Malmros C. Abolished circadian rhythm of melatonin secretion in sedated and artificially ventilated intensive care patients//Acta Anaesthesiol. Scand. 2004. Vol. 48, № 6. P. 679-684.
- Ouimet S., Kavanagh B.P., Gottfried S.B., Skrobik Y. Incidence, risk factors and consequences of ICU delirium//Intensive Care Med. 2007. Vol. 33, № 1. P. 66-73.
- Ozbolt L.B., Paniagua M.A., Kaiser R.M. Atypical antipsychotics for the treatment of delirious elders//J. Am. Med. Dir. Assoc. 2008. Vol. 9, № 1. P. 18-28.
- Pandharipande P.P., Morandi A., Adams J.R. et al. Plasma tryptophan and tyrosine levels are independent risk factors for delirium in critically ill patients//Intensive Care Med. 2009. Vol. 35, № 11. P. 1886-1892.
- Papaioannou A., Fraidakis O., Michaloudis D. et al. The impact of the type of anaesthesia on cognitive status and delirium during the first postoperative days in elderly patients//Eur. J. Anaesthesiol. 2005. Vol. 22, № 7. P. 492-499.
- Peterson J.F., Pun B.T., Dittus R.S. et al. Delirium and its motoric subtypes: a study of 614 critically ill patients//J. Am. Geriatr. Soc. 2006. Vol. 54, № 3. P. 479-484.
- Radtke P.M., Franck M., Hagemann L. et al. Risk factors for inadequate emergence after anesthesia: emergence delirium and hypoactive emergence//Minerva Anestesiol. 2010. Vol. 76, № 6. P. 394-403.
- Rathier M.O., Baker W.L. A review of recent clinical trials and guidelines on the prevention and management of delirium in hospitalized older patients//Hosp. Pract. (Minneap). 2011. Vol. 39, № 4. P 96-106.
- Robinson T.N., Eiseman B. Postoperative delirium in the elderly: diagnosis and management//Clin. Interv. Aging, 2008. Vol. 3, № 2. P. 351355.
- Robinson T.N., Raeburn C.D., Tran Z.V. et al. Motor subtypes of postoperative delirium in older adults//Arch. Surg. 2011. Vol. 146, № 3. P. 295-300.
- Rudolf J.L, Marcantonio E.R. Review articles: postoperative delirium: acute change with long-term implications//Anesth. Analg. 2011. Vol. 112, № 5. P 1202-1211.
- Sanders R.D. Hypothesis for the pathophysiology of delirium: role of baseline brain network connectivity and changes in inhibitory tone//Med. Hypotheses. 2011. Vol. 77, № 1. P 140-143.
- Sieber F.E., Zakriya K.J., Gottschalk A. et al. Sedation depth during spinal anesthesia and the development of postoperative delirium in elderly patients undergoing hip fracture repair//Mayo Clin. Proc. 2010. Vol. 85, № 1. P 18-26.
- Setiati S. Perioperative assessment and management of the elderly//Eur. J. Anaesthesiol. 2005. Vol. 22, № 7. P. 492-499.
- Stagno D., Gibson C., Breitbart W. The delirium subtypes: a review of prevalence, phenomenology, pathophysiology, and treatment response//Palliat. Support Care. 2004. Vol. 2, № 2. P 171-117.
- Takeuchi M., Takeuchi H., Fujisawa D. et al. Incidence and Risk Factors of Postoperative Delirium in Patients with Esophageal Cancer//Ann. Surg. Oncol. 2012. Jun. 15.
- Trzepacz P., van der Mast R. The neuropathophysiology of delirium//In: Lindesay J., Rockwood K., Macdonald A., eds. «Delirium in old age», Oxford, England: Oxford University Press, 2002. P 51-90.
- Trzepacz P.T. Is there a final common neural pathway in delirium? Focus on acetylcholine and dopamine//Semin. Clin.Neuropsychiatry. 2000. Vol. 5. P. 132-148.
- Turkel S.B., Jacobson J., Munzig E., Tavare C.J. Atypical antipsychotic medications to control symptoms of delirium in children and adolescents//J. Child Adolesc. Psychopharmacol. 2012. Vol. 22, № 2. P 126-130.
- Ushida T., Yokoyama T., Kishida Y. et al. Incidence and risk factors of postoperative delirium in cervical spine surgery//Spine (Phila. Pa. 1976). 2009. Vol. 34, № 23. P. 2500-2504.
- Utzolino S., Hopt U.T., Kaffarnik M. Die postoperative Sepsis: Diagnose, Besonderheiten, Management//Zentralbl. Chir. 2010. Vol. 135, № 3. P. 240-248.
- Van Rompaey B., Elseviers M.M., Schuurmans M.J. et al. Risk factors for delirium in intensive care patients: a prospective cohort study//Crit. Care. 2009. Vol. 13, № 3. P 77.
- Veiga D., Luis C., Parente D. et al. Postoperative delirium in intensive care patients: risk factors and outcome//Rev. Bras. Anestesiol. 2012. Vol. 62, № 4. P. 469-483.
- Vochteloo A.J., Borger van der Burg B.L., Mertens B. et al. Outcome in hip fracture patients related to anemia at admission and allogeneic blood transfusion: an analysis of 1262 surgically treated patients//B.M.C. Musculoskelet. Disord. 2011. Vol. 12. P 262.
- Wacker P., Nunes P.V., Cabrita H., Forlenza O.V. Post-operative delirium is associated with poor cognitive outcome and dementia//Dement. Geriatr. Cogn. Disord. 2006. Vol. 21, № 4. P 221-227.
- Wang W., Li H.L., Wang D.X. et al. Haloperidol prophylaxis decreases delirium incidence in elderly patients after noncardiac surgery: a randomized controlled trial//Crit. Care Med. 2012. Vol. 40, № 3. P. 731-739.
- Wendel M., Heller A.R. Mitochondrial function and dysfunction in sepsis//Wien Med. Wochenschr. 2010. Vol. 160, № 5-6. P 118-123.
- Whitlock E.L., Vannucci A., Avidan M.S. Postoperative delirium//Minerva Anestesiol. 2011. Vol. 77, № 4. P 448-456.
- Wongpakaran N., Wongpakaran T., Bookamana P. et al. Diagnosing delirium in elderly Thai patients: utilization of the CAM algorithm//B.M.C. Fam. Pract. 2011. Vol. 1, № 12. P 65.
- Yu S.B. Dexmedetomidine sedation in ICU//Korean J. Anesthesiol. 2012. Vol. 62, № 5. P. 405-411.


