Диагностическая ценность атомно-силовой микроскопии эритроцитов у больных с панкреонекрозом
Автор: Гуликян Г.Н., Пахомова Р.А., Козлов В.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 1 (91), 2025 года.
Бесплатный доступ
Введение. Актуальность проблемы панкреонекроза в том, что в настоящее количество заболеваний, в том числе и тяжелыми формами, неуклонно возрастает.Цель. Улучшить результаты ранней диагностики панкреонекроза путем изучения мембран эритроцитов.Материалы и методы. Исследование мембраны эритроцитов проводилось при помощи атомно-электронной микроскопии. Дополнительно при помощи данного метода проводилось исследование нейтрофильных эритроцитов. В проведенное исследование включено 17 больных с панкреонекрозом.Результаты. При проведенном исследовании методом атомно-электронной микроскопии у пациентов с панкреонекрозом выявлены изменения мембраны эритроцитов и формы ядра и состояния цитоплазмы нейтрофильных лейкоцитов.Выводы. Исследование мембраны эритроцитов и состояния нейтрофильных лейкоцитов методом атомно-электронной микроскопии у пациентов с панкреонекрозом позволяет выявить ранние изменения в отсутствие клинических проявлений и спрогнозировать возможность развития гнойно-септических осложнений.
Атомно-силовая микроскопия, панкреонекроз, мембраны эритроцитов, нейтрофилы, плазматическая мембрана
Короткий адрес: https://sciup.org/142244683
IDR: 142244683 | УДК: 616.37-002. | DOI: 10.17238/2072-3180-2025-1-49-55
Текст научной статьи Диагностическая ценность атомно-силовой микроскопии эритроцитов у больных с панкреонекрозом
Актуальность проблемы острого панкреатита в том что, несмотря на достаточное количество информации о данном заболевании, частота заболеваемости, в том числе и тяжелыми формами, в настоящее время не только не уменьшается, но, наоборот, возрастает [1]. Это связано не только с количественным ростом заболевания. Среди острых хирургических заболеваний брюшной полости панкреатит занимает пятое место, а по смертности по некоторым источникам занимает лидирующую позицию [3]. Особенность течения острого панкреатита состоит в том, что легкие формы панкреатита могут трансформироваться в более тяжелые, в частности, в панкреонекроз (в 20 % случаев), который в 90 % случаев приводит к летальному исходу, даже при адекватном лечении [4]. Прогнозирование подобного утяжеления на современном этапе в 100 % случаев невозможно.
Развитие тяжелого течения в 40–70% сопровождается формированием гнойно-септических осложнений. И если общая летальность составляет приблизительно 7 %, то при тяжелой форме эта цифра увеличивается до 30 %, а при развитии гнойно-септических осложнений составляет 60–80 % [5].
Ранняя диагностика и прогнозирование возможности развития панкреонекроза позволит снизить частоту гнойнонекротических осложнений, летальность и сократить сроки реабилитационного периода. Это побуждает все медицинское сообщество занимается поиском новых методов ранней диагностики панкреонекроза [6].
С внедрением в практическую медицину атомно-силовой микроскопии (АСМ) наметились новые аспекты в прогнозировании осложнений острого панкреатита. Атомно-силовая микроскопия, в отличие от обычной электронной микроскопии, позволяет проводить исследования в атмосферных условиях, кроме того можно получить данные о магнитных и адгезивных свойствах клеточной мембраны, поверхностных заряде, емкости и проводимости [7]. Таким образом, по полученным изменениям мембраны эритроцита можно косвенно судить об изменения других клеточных мембран [8]. Эритроцит является как бы маркером изменений клеток в других тканях. При этом эритроцит – самая доступная для проведения исследований клетка. Применение методики атомно-силовой микроскопии позволяет определить со-стяние мембраны эритроцита и по изменениям последней прогнозировать течение и исход заболевания [9]. Эритроцит у больных панкреонекрозом форму не меняет, но плазматическая мембрана становится «дырявой» [10].
Цель. Улучшить результаты ранней диагностики панкре-онекроза путем изучения мембран эритроцитов.
Материалы и методы
Исследование мембраны эритроцитов проводилось при помощи атомно-электронной микроскопии. Дополнительно при помощи данного метода проводилось исследование нейтрофильных лейкоцитов.
Методика атомно-электронной микроскопии заключается в получении специального сигнала – DFL, который возникает при отрыве зонда от поверхности эритроцита [7]. При этом возникает адгезивное взаимодействие, которое приводит к изгибанию балки кантилевера и формированию сигнала. С помощью программы «Nova» сигнал DFL преобразуется в график.
В ходе проведения атомно-электронной микроскопии дополнительно проводят исследование упругости и вязкости клеточной мембраны эритроцита, изменения в которой, подобны изменениям в других клетках организма, возникающих при патологических состояниях [7].
В проведенное исследование включено 17 больных с пан-креонекрозом.
По гендерному составу: женщин было 8, мужчин – 9. Возраст больных варьировал от 28 до 82 лет (средний возраст – 50,6 ± 1,9 года). Пациентов госпитализировали в сроки от 1 до 13 суток от начала заболевания с клиническими признаками ПН. В клинической картине превалировал болевой синдром, а также тошнота, рвота. У всех пациентов присутствовали признаки синдрома системного ответа на воспаление, инфильтрат в брюшной полости и асцит.
Больные были обследованы по общепринятым стандартам. Для подтверждения диагноза исследовали концентрацию С-реактивного белка и уровень прокальцитонина (ПН при уровне >2 нг/мл), уровень амилазы крови и мочи, уровень трансаминаз. Всем больным при поступлении выполнили УЗИ для оценки распространенности и локализации воспалительных, жидкостных перипанкреатических скоплений и парапан-креатических отграниченных полостей. Также всем больным выполнили КТ органов брюшной полости. При комплексной оценке клинических, лабораторных, инструментальных и лу- чевых методов обследования у всех пациентов подтвержден диагноз панкреонекроза.
Помимо традиционных методов обследования всем пациентам выполнялась атомно-силовая микроскопия эритроцитов. Для проведения исследования использовали мазок периферической крови, полученной при поступлении пациента в стационар. Исследование выполняли на атомно-силовом микроскопе Integra Aura (ЗАО «НТ-МДТ», Россия).
Для исследования поверхности мембраны эритроцита сканирование проводилось в полуконтактном режиме. Адгезивные свойста исследовались полностью в контактном режиме. Для исследования выбирались отдельные эритроциты в количестве 50–60 для каждого образца. Это позволило избежать получения искажения изображения, возникающего от воздействия близкорасположенных соседних эритроцитов. При этом проводилось двойное сканирование каждого эритроцита. При первом сканировании исследовали мембрану эритроцита, при втором – исследовалась клетка в целом.
Помимо исследования эритроцитов проводилась атомноэлектронная микроскопия нетройфильных лейкоцитов с целью оценки их архитектоники.
Полученные данные статистически обрабатывались с помощью программы Statistica 6.1. Оценка нормальности распределения проводилась с помощью критерия Шапиро-Уилка (W). Если распределение признака не отличалось от нормального, то для описания использовали среднее и стандартное отклонение (М±σ), сравнение проводили с помощью параметрических методов статистики, предварительно оценивая равенство дисперсии с помощью критерия Левена.
При неравенстве дисперсий в случае нормального распределения и при распределении отличном от нормального использовали метод Краскела-Уолисса (Kruskel-Wallis). При альтернативной гипотезе о различии групп, далее попарно сравнивали полученные данные с помощью t-критерия Стьюдента (в случае равных дисперсий при нормальном распределении) или критерия Манна-Уитни (U-test). Для выявления статистически значимых различий в одной группе на разных сроках наблюдения использовали ранговый дисперсионный анализ по Фридмену (Friedman ANOVA). Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
Для изучения влияния интоксикации и системного воспалительного ответа на клеточные мембраны при панкрео-некрозе проводилась сравнительная атомно-силовая микроскопия эритроцитов условно здоровых людей и пациентов с подтвержденным диагнозом панкреонекроза.
Форма нормального эритроцита здоровых людей представляла собой двояковогнутый дискоцит. Около 10% эритроцитов представляли собой эхиноциты, сферациты или стоматоциты.
Средний объем эритроцита здоровых людей составлял 44,970 мкм3, а рассчитанные программой Nova ACM Integra Aura (ЗАО «НТ-МДТ», Россия) адгезивные силы эритроцита здоровых людей составили 1,74 + 0,03 нН (рис. 1).
Норма
Панкреонекроз


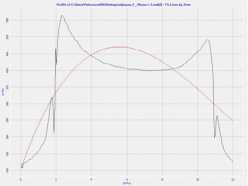

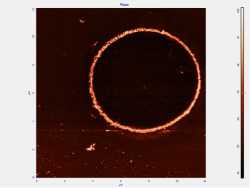

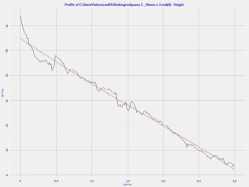
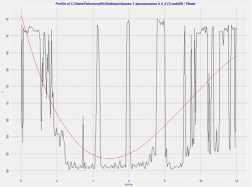
Рис . 1. Форма эритроцита и мембрана эритроцита в норме и при панкреонекрозе
Fig. 1. Erythrocyte shape and erythrocyte membrane in normal and pancreatic necrosis
Также проводилось исследование длины, ширины, высоты максиальной и минимальной и глубины впадины эритроцита (табл. 1).
Изменения длины, ширины и высоты эритроцита при панкре-онекрозе были незначительными, в пределах –0,2 + 3. Наибольшие изменения отмечались в размерах глубины впадины эритроцита.
Таким образом, у больных с панкреонекрозом не изменяется форма эритроцита и его объем.
Аналогичным образом оценивались площадь, объем, количество эррозий мембран и их качественный анализ (табл. 2)
Таблица 1
Сравнение линейных характеристик эритроцитов у здоровых людей и пациентов с панкреонекрозом
Table 1
Comparison of linear characteristics of erythrocytes in healthy people and patients with pancreatic necrosis
|
Длина эр-та, мкм/ Erythrocyte length, microns |
Ширина эр-та, мкм/ Erythrocyte width, microns |
h, max, нм/ h, max, nm |
h, min, нм/ h, min, nm |
Глубина впадины, мкм / Depression depth, microns |
|
|
Здоровые/ Healthy |
8,72 ±0,8 |
8,54 ±0,7 |
348 ±32,4 |
162,5 ±15,9 |
185,5 ±16,2 |
|
Панкреонекроз/ Pancreatonecrosis |
8,74± 0,8 |
8,39 ±0,7 |
346,5 ±31,8 |
160,9 ±15,7 |
182,4±15,7 |
Таблица 2
Сравнение площади, объема и эррозий эритроцитов у здоровых людей и пациентов с панкреонекрозом
Table 2
Comparison of the area, volume, and erosions of red blood cells in healthy people and patients with pancreatic necrosis
|
Площадь эр-та, мкм2/Erythrocyte area, mm2 |
Объём эр-та, мкм3 / Erythrocyte volume, mm3 |
Кол-во эрозий/ язв/ Number of erosions/ulcers |
Длина эрозий/язв, мкм / Length of ero-sions/ulcers, mm |
Ширина эрозий/ язв, мкм / Width of erosions/ulcers, mm |
|
|
Здоровые /Healthy |
44,97±2,4 |
9,09 ±1,2 |
0 ±0 |
0 ±0 |
0 ±0 |
|
Панкреонекроз/ Pancreatonecrosis |
48,4 ±3,7 |
12,7 ±1,4 |
32±3,1 18±1,7 |
0,4 ±0,1 |
0,46 ±0,2 |
При исследовании площади и объема эритроцитов отмечено их значимое увеличение на 7,8 % и 39 % соответственно.
При визуализации эритроцитов больных с панкреонекрозом было выявлено повреждение мембраны. Адгезивные силы изменялись, что в свою очередь вызывало изменения в плазматической мембране эритроцита и она теряла свою эластичность и становилась ригидной.
Особое значение имеет изменение поверхности мембраны эритроцита, а именно появление на ней эррозий различных по протяженности и по ширине, которые отсутствуют у здоровых людей. При этом, количество эррозий прямо пропорционально тяжести течения панкреонекроза. Учитывая, что данные изменения появляются в раннем периоде развития некротических изменений клеток поджелудочной железы, когда еще нет ультразвуковых признаков панкреонекроза, данные изменения мембраны эритроцитов могут иметь важное диагностическое значение.
Для диагностики панкреонекроза и прогнозирования развития гнойно-септических осложнений проводились исследования цитоархитектоники нейтрофильных гранулоцитов с помощью метода атомно-силовой микроскопии. Нейтрофильные лейкоциты пациентов с панкреонекрозом сравнивались с лейкоцитами здоровых пациентов.
При проведении атомно-силовой микроскопии нейтрофильных лейкоцитов были выялены сканировании нейтрофилов на АСМ получены отдельно лежащие клетки (рис. 2).
У здоровых людей, входивших в контрольную группу, обнаружено, что нейтрофилы имеют правильную округлую форму, ядро четко визуализируется, правильно сегментировано.
С увеличением степени тяжести острого панкреатита нейтрофил приобретает выпуклую форму, количество сегментов ядра уменьшается, они становятся размытыми, мембрана клетки неровной. На мембране появляется большое количество пор со средними ориентированными значениями диаметров и глубин равными 520 и 340 нм.
Величина площади сегментоядерных нейтрофилов у пациентов с деструктивным панкреонекрозом не изменяется (табл. 3), однако объем его статистически значимо увеличивается при панкреонекрозе, причем, как по сравнению с контрольной группой, так и в зависимости от тяжести протекания процесса.
Исследование нейтрофильных лейкоцитов методом атомно-электронной микроскопии у пациентов с панкреонекрозом позволяет выявить ранние изменения в отсутствие клинических проявлений и спрогнозировать возможность развития гнойно-септических осложнений. Это позволит своевременно применить адекватную терапию или решить вопрос о необхо- димости оперативного лечения, что в конечном итоге улучшит результаты лечения.
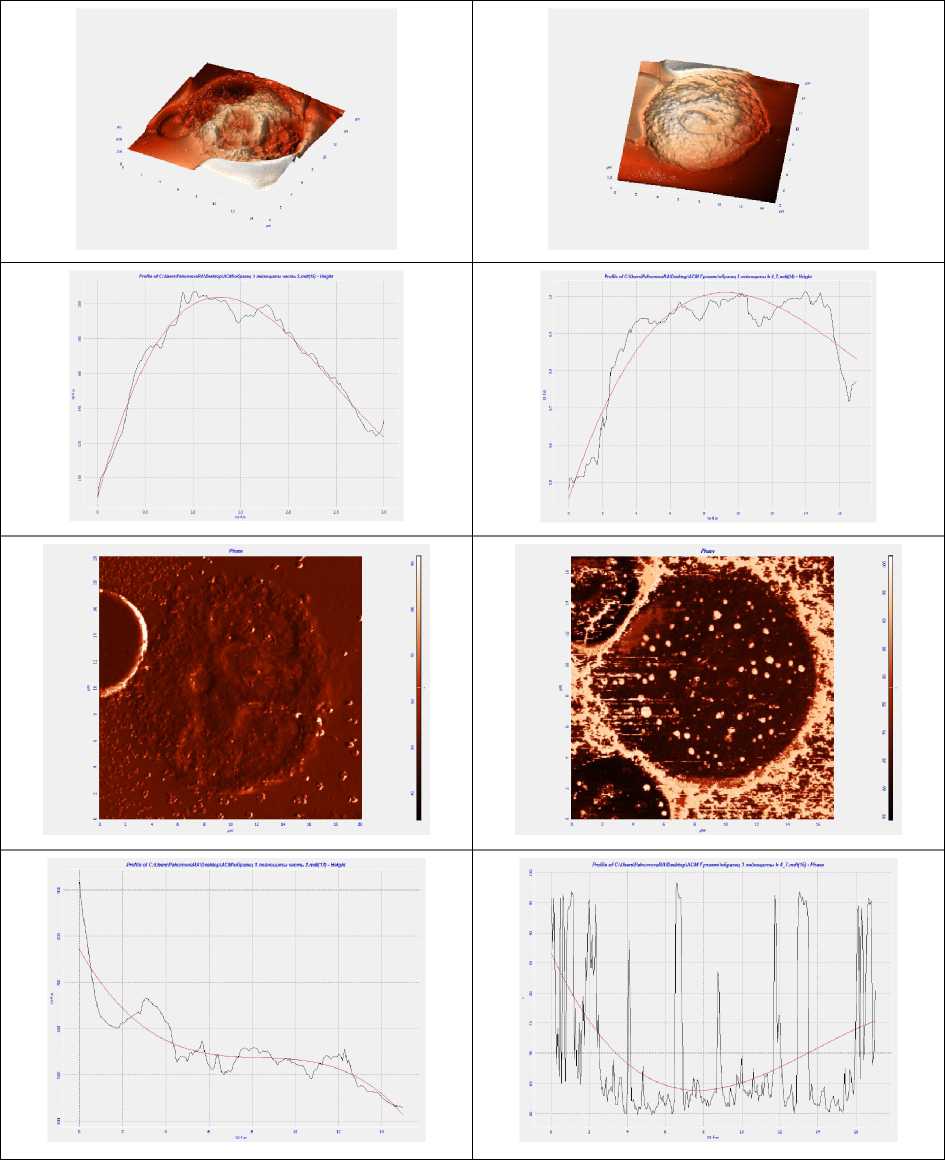
Рис . 2. АСМ сегментоядерных нейрофилов при панкреонекрозе
Fig. 2. AFM of segmented neutrophils in pancreatic necrosis
Таблица 3
Средние значения основных измеряемых величин нейтрофилов больных ДП
Table 3
Average values of the main measured values of neutrophils in DP patients
|
Степень тяжести ОП/Severity of OP |
S, мкм2 (М±σ)/ S, mm2 (M±σ) |
V, мкм3 (М±σ)/ V, mm3 (M±σ) |
F±ΔF, нН по пробе (М±σ)/ F±ΔF, nN by sample (M±σ) |
|
Норма/ Standard |
129,21±9,23 |
51,00±5,00 |
1,07±0,02 |
|
Панкреонекроз/ Pancreatonecrosis |
128,74±5,23 |
64,56±5,11 |
0,67±0,01 |
Примечание: S–площадь нейрофилов, V–объем нейрофилов, Fср±ΔF-сила адгезии
Выводы
У больных с панкреонекрозом плазматическая мембрана клеток крови становится «дырявой». При панкреонекрозе впадины на мембране клетки превращаются в глубокие дефекты, нарущающие целостность билипидного слоя мембраны эритроцита.
Атомно-силовая микроскопия является одним из наиболее современных и информативных методов для проведения исследований на микромолекулярном уровне. Главное отличие АСМ от рентгеноструктурного анализа заключается в том, что при её проведении нет необходимости в жесткой фиксации и сложной подготовке препаратов для исследования, поэтому значимость метода многократно возрастает при изучении плазматических мембран живых тканей, в том случае, когда необходимо исследовать объект в его изначальном состоянии.
Метод атомно-силовой микроскопии клеток крови можно рекомендовать для ранней диагностки панкреонекроза и прогноза развития гнойно-некротических изменений поджелудочной железы.


