Диагностика новообразований кожи методом комбинационного рассеяния
Автор: Захаров В.П., Ларин К.В., Козлов С.В., Морятов А.А., Братченко И.А., Мякинин О.О., Артемьев Д.Н., Христофорова Ю.А.
Журнал: Физика волновых процессов и радиотехнические системы @journal-pwp
Статья в выпуске: 3 т.16, 2013 года.
Бесплатный доступ
Разработан фазовый метод определения типа новообразований кожи, основанный на локализации в фазовой плоскости изменений спектральных интенсивностей комбинационного рассеяния в полосах 1300–1340 см-1 и 1640–1680 см-1 по отношению к интенсивности линии 1450 см-1 На основании ex vivo экспериментов, проведенных на 28 образцах кожи с новообразованиями, показано, что чувствительность предложенного метода близка к абсолютной, а специфичность метода превышает 90 %. Фазовый метод может быть использован для диагностики меланомы и базалиомы в массовом скрининге и мониторинге кожных патологий.
Спектроскопия комбинационного рассеяния, новообразования кожи, онкология, гистология, фазовый метод
Короткий адрес: https://sciup.org/140255830
IDR: 140255830 | УДК: 615.84
Текст научной статьи Диагностика новообразований кожи методом комбинационного рассеяния
Злокачественные новообразования кожи являются одними из самых распространенных видов онкологических заболеваний [1; 2], и число вновь регистрируемых случаев ежегодно существенно увеличивается [3]. Так, с 1950 года количество выявляемой злокачественной меланомы кожи повысилось в пять раз. Показатели эффективности диагностики меланоцитарных новообразований на этапе общей врачебной сети остаются неудовлетворительными, что связано со сложностью интерпретации клинических дифференциальных признаков новообразований на ранней стадии и невозможностью использовать инвазивные (биопсия с последующим гистологическим или цитологическим исследованием) методы подтверждения диагноза. Это может привести к неверным тактическим решениям и способствовать развитию распространенного злокачественного новообразования, радикальное лечение которого уже невозможно. В связи с этим необходимо использование инструментальных методов диагностики. Методы конфокальной микроскопии [4], компьютерной [5], оптической [6]
или магнито-резонансной [7] томографии позволяют уверенно диагностировать топологию кожных новообразований. Однако применение данных методов возможно только в специализированном медицинском центре, и они не дают ответа о типе новообразования, без определения которого невозможен выбор эффективного способа лечения. Применение методов флуоресцентного анализа [8; 9] требует предварительного введения флуорофоров, что делает невозможным использование данной методики для мониторинга и скрининга онкологических заболеваний кожи. В связи с этим большое внимание уделяется развитию неинвазивных методов оптической диагностики новообразований кожи, основанных на спектральном анализе рассеянного назад излучения [10] и комбинационного рассеяния (КР) [11].
Метод дифференциального обратного рассеяния основан на различии в коэффициентах поглощения лазерного излучения кожей и новообразованием в разных спектральных диапазонах. Однако ввиду существенного перекрытия спектров поглощения различных веществ биологической ткани эффективность диагнос- © В.П. Захаров и др., 2013
тики рака кожи не превосходит 80 ^ [10; 12]. Существенный рост эффективности диагностики рака кожи возможен при использовании метода комбинационного рассеяния [11; 13]. Так, в работах [14–16] была продемонстрирована высокая эффективность метода комбинационного рассеяния по диагностике меланомы: достигнута чувствительность (эффективность истинного определения злокачественного новооборазования) метода в 91 ^ и величина специфичности (эффективность правильного определения типа новообразования) в 75 ^. При диагностике базальноклеточного рака (наиболее распространенной формы злокачественных новообразований кожи) чувствительность метода комбинационного рассеяния составила 83 ^, а специфичность – 98 ^ [17–19]. Однако при переходе к массовым скрининговым исследованиям чувствительность и специфичность метода существенно уменьшаются [20]. Последнее связано с высокой вариативностью интенсивности пиков комбинационного рассеяния от концентрации кожных пигментов и использованием абсолютных критериев в методах, предложенных в работах [17–19]. В связи с этим актуальным становится развитие методов вариативного анализа комбинационного рассеяния для диагностики кожных новообразований.
Целью данной работы является разработка фазового метода анализа комбинационного рассеяния кожи для дифференциальной диагностики типа новооборазования, свободного от указанных недостатков.
1. Материалы и методы исследований
Одной из основных экспериментальных трудностей при измерении спектров комбинационного рассеяния является низкая интенсивность линий комбинационного рассеяния по сравнению с интенсивностью обратного рассеяния: интенсивность комбинационного рассеяния в 103 – 104 раз слабее интенсивности обратного рассеяния. Следовательно, для обеспечения уверенной регистрации спектра комбинационного рассеяния необходимо использовать измерительные системы с узкополосным стабилизированным лазерными источниками возбуждения и высокочувствительным приемно-регистриру-ющим трактом, обеспечивающим регистрацию слабых оптических сигналов.
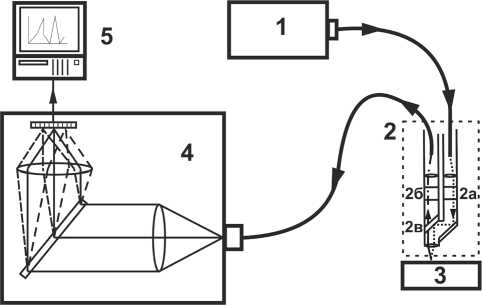
Экспериментальная установка, использовавшаяся в наших экспериментах, представлена на рис. 1. Термостабилизированный лазер ( 1 )
Лазерное излучение Рассеянное излучение Общий путь излучения
Рис. 1. Оптическая схема экспериментальной установки: 1 – лазер; 2 – оптический модуль; 2а – включающий узкополосный фильтр; 2б – широкополосный фильтр; 2в – дихроичное зеркало; 3 – исследуемый образец; 4 – спектрограф с цифровой камерой; 5 – компьютер разработан на основе полупроводникового лазерного модуля LML-785.0RB-04 и обеспечивает генерацию лазерного излучения мощностью 200 ± 50 мВт (с шагом позиционирования 0.1 мВт), длиной волны излучения 785 нм и шириной спектра илучения, не превышающей 1,3 см 1. Регистрация диффузно-рассеянного излучения от исследуемого образца (3) осуществляется с помощью 3-зеркального спектрографа (4) Sharmrock SR-303i с интегрированной камерой ANDOR DV-420A-OE, матрица которой захолаживается до -60 °C. Использование данного спектрографа обеспечивает разрешение 0,05 нм при низком уровне собственных шумов.
Для выделения комбинационного рассеяния использовался оптический модуль ( 2 ), который включал в себя узкополосный фильтр ( 2а ), отрезающий комбинационный и флуоресцентный вклад волоконного подвода излучения возбуждающего лазера к объекту исследования ( 3 ), а широкополосный фильтр ( 2б ) и дихроичное зеркало ( 2в ) предотвращают попадание излучения возбуждающего лазера в регистрирующий тракт спектрографа ( 4 ).
Экспериментальные исследования проводились ex vivo и были одобрены этическим комитетом Самарского государственного медицинского университета Минздрава России. Образцы тканей представляли собой участок кожи с новообразованием, а регистрация КР-спектра происходила в течение часа после резекции. В качестве объектов исследований были использованы образцы различных новообразований
Сдвиги КР, см-1
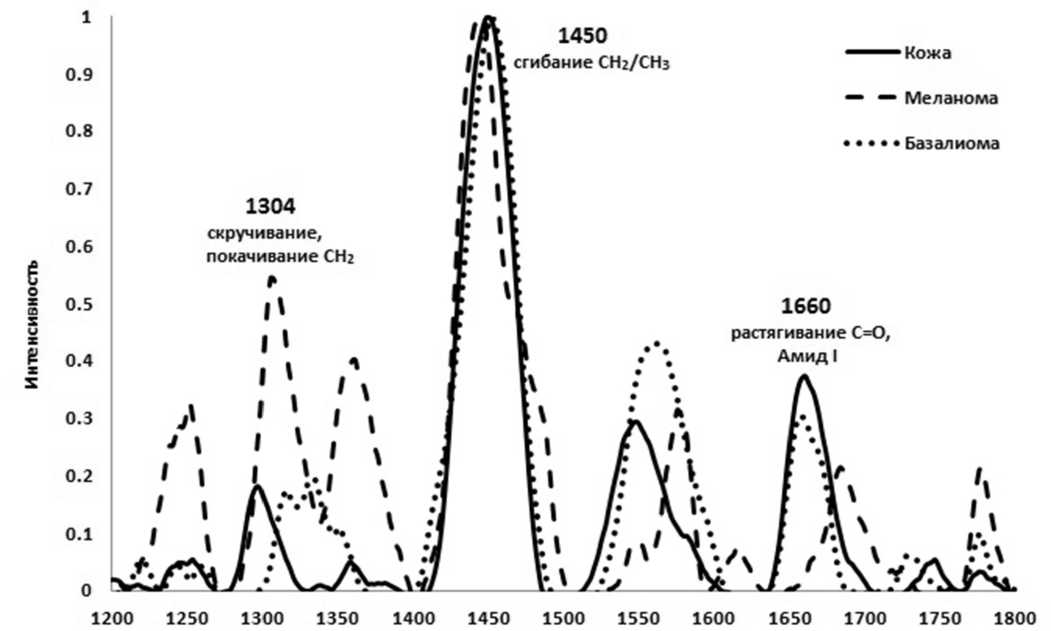
Рис. 2. Нормализованные спектры комбинационного рассеяния здоровой кожи, меланомы и базальноклеточного рака в области 1200–1800 см - 1
кожи человека: 8 меланом, 4 образца базальноклеточного рака (базалиома), 6 пигментных невусов. Для каждого образца проводилось гистологическое исследование с установлением окончательного диагноза.
2. Анализ КР-спектров новообразований и кожи
Ввиду высокой концентрации пигментов кожа человека характеризуется высоким уровнем автофлуоресценции при облучении лазерным излучением ближнего ИК-спектра. Для исключения вклада автофлуоресценции в спектр комбинационного рассеяния использовался метод полиномиальной аппроксимации, предложенный ранее в работе [21]. В отличие от [21], нами проводились дополнительная фильтрация случайных шумовых эффектов и автоматическое определение степени полиномиальной аппроксимации по заданному спектральному интервалу.
Характерные нормированные спектры комбинационного рассеяния для новообразований и нормальной кожи представлены на рис. 2. Видно, что максимум спектра комбинационного рассеяния соответствует сдвигу КР 1450 см - 1 (полоса 1430–1460 см - 1), которой отвечает из-гибная мода колебаний CH2/CH3. Наряду с данной полосой уверенно регистрируются полосы 1240–1280 см - 1 (продольная мода колебаний CN), 1300–1340 см - 1 (изгибные и скручивающие моды связи CH2), 1540–1580 см - 1 (деформационная мода связи C=C и триптофана), 1640–1680 см - 1
(продольная колебательная мода C=O в Амидах) [15].
Наиболее существенные изменения в спектрах комбинационного рассеяния новообразований по сравнению со спектрами нормальной кожи наблюдаются в полосах 1300–1340 см-1 и 1640–1680 см-1. Для меланомы характерно возрастание интенсивности пика в полосе 1300–1340 см-1. Причем если для полосы 1640–1680 см-1 наблюдается спад интенсивности комбинацион- ного рассеяния для всех типов злокачественных новообразований, то в полосе 1300–1340 см-1, в отличие от результатов работы [17], имеет место повышение интенсивности комбинационного рассеяния для меланомы и спад интенсивности для базальноклеточного рака по сравнению с нормальной кожей.
Следует также отметить, что в наших экспериментах, в отличие от работ [16; 19], наблюдался двойной пик комбинационного рассеяния в области 1300–1340 см - 1, причем пик 1300 см - 1 имеет более высокую интенсивность относительно пика в области 1340 см - 1 (см. рис. 2).
Для базалиомы наблюдался 15 ^-ный рост интенсивности комбинационного рассеяния для полосы 1650 см - 1 по сравнению с нормальной кожей, в то время как авторы работы [22] сообщают о схожести спектров новообразований и кожи в указанной области спектра.
Изменение спектров комбинационного рассеяния, на наш взгляд, связано с увеличением концентрации нуклеиновых кислот и структу- ры белков [16; 23] в области новообразования, а падение интенсивности в области 1450 см-1, по-видимому, объясняется снижением плотности белков, встроенных в мембрану клеток новообразований, и увеличением общего удельного веса данных клеток.
3. Метод диагностики кожных новообразований
Большинство известных методов анализа спектров комбинационного рассеяния новообразований кожи [13–19] основано на введении пороговых характеристик интенсивностей в пиках 1300–1340 см - 1, 1640–1680 см - 1и 1440–1460 см - 1 и, как правило, ориентировано на определение конкретного типа онкологического заболевания: меланомы [14–16] или базалиомы [17; 19; 22]. Однако, ввиду высокой вариативности значений данных интенсивностей для разных групп пациентов, связанной с различной концентрацией кожных пигментов, не удается сформулировать однозначный пороговый критерий. В связи с этим чувствительность и специфичность методов, основанных на абсолютных пороговых характеристиках, не превышает 78–82 ^.
Проведенные исследования позволяют сформулировать фазовые критерии определения типа кожных новообразований. Для этих целей введем две фазовые характеристики: отношение максимумов интенсивности рассеяния I 1320 в полосе 1300–1340 см - 1 и I 1660 в полосе 1640–1680 см - 1 по отношению к интенсивности КР в полосе 1440–1460 см - 1. Тогда каждое измерение может быть представлено в виде точки на фазовой плоскости I 1320 - I 1660 (рис. 3). Используя в качестве эталонного метода гистологические исследования образцов, приводящиеся независимо от спектральных измерений, каждая экспериментальная точка на фазовой плоскости может быть отнесена к одной из форм рака или здоровой коже. Из анализа рис. 3 видно, что экспериментальные точки образуют на фазовой плоскости семейство точек, которые в зависимости от типа новообразования группируются в разных областях фазового пространства.
Это позволяет ввести способ оптической идентификации новообразований кожи: фазовая область ( 1 ) соответствует нормальной коже или доброкачественному новообразованию, область ( 2 ) – базалиоме, а при попадании в область ( 3 ) можно с уверенностью диагностировать меланому.
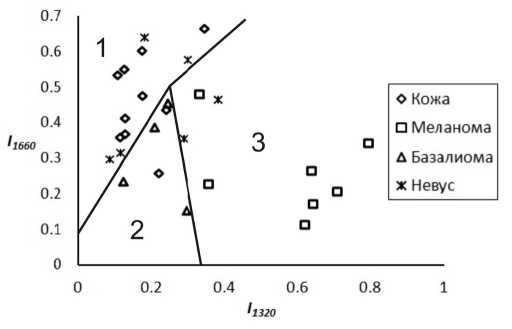
Рис. 3. Классификация новообразований фазовым методом: 1 – нормальная кожа и пигментные невусы (доброкачественные новообразования); 2 – базалиома; 3 – соответствует меланоме
Всего было исследовано 28 образцов здоровой кожи и новообразований. Чувствительность и специфичность предложенного метода определена согласно четырехпольной методике [24] относительно эталонного гистологического метода и представлена в таблице ниже.
Из анализа таблицы следует, что чувствительность фазового метода идентификации злокачественных новообразований кожи близка к абсолютной. Столь высокое значение, с одной стороны, является следствием относительно небольшого количества проведенных экспериментов, а с другой – выражает факт высокой потенциальной эффективности фазового метода. Следует также отметить, что специфичность фазового метода идентификации меланомы выше, чем в пороговых методах [14–16; 18], что позволяет сделать вывод о низкой вероятности ложной идентификации заболевания, которая не превышает 10 ^.
Заключение
Эффективность фазового метода диагностики кожных патологий в среднем на 5–10 ^ выше по сравнению с другими методами диагностики [13; 16; 20], основанными на анализе комбинационного рассеяния. Высокое значение чувствительности особенно важно для организации массового скрининга кожных заболеваний при профилактических осмотрах, т. к. в этом случае фазовый метод не дает ложных отрицательных результатов, поэтому вероятность пропуска заболевания стремится к нулю.
Другим достоинством предложенного метода является его инвариантность относительно размеров опухоли: точность диагностики не снижается при анализе новообразований диаметром менее 5 мм, так как диаметр пятна комбинаци- онного рассеяния не превосходит 2–3 мм. При визуальном осмотре врачом малый размер кожного новообразования является существенным затруднением, и эффективность диагностики по результатам визуального осмотра снижается до 40 ^, а при использовании фазового метода
Таблица
Точность диагностики раковых новообразований кожи точность диагностики злокачественного новообразования сохраняется на уровне 90 ^.
Работа выполнена при поддержке федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009–2013 гг.
|
Диагноз |
Положительные диагнозы |
Отрицательные диагнозы |
|
Меланома |
Истинные положительные результаты – 8 |
Ложные положительные результаты – 2 |
|
Ложные отрицательные результаты – 0 |
Истинные отрицательные результаты – 18 |
|
|
Чувствительность – 100 ^ |
Специфичность – 90 ^ |
|
|
Базалиома |
Истинные положительные результаты – 4 |
Ложные положительные результаты – 2 |
|
Ложные отрицательные результаты – 0 |
Истинные отрицательные результаты – 22 |
|
|
Чувствительность – 100 ^ |
Специфичность – 92 ^ |
Список литературы Диагностика новообразований кожи методом комбинационного рассеяния
- Boyle P., Levin B. World Cancer Report 2008. Lyon: World Health Organization. International Agency for Research on Cancer, 2008. 510 p.
- Cancer Facts & Figures 2013/ed. by R. Siegel, A. Jemal. Atlanta: American Cancer Society, 2013. 62 p.
- Чиссова В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2011 году (заболеваемость и смертность). М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России, 2013. 289 с.
- Morphologic features of melanocytes, pigmented keratinocytes and melanophages by in vivo confocal scanning laser microscopy/K.J. Busam [et al.]//Mod. Pathol. 2001. № 14(9). P. 862-868.
- Perineural tumor extension of facial malignant melanoma: CT and MRI/C. Majoie [et al.]//Journal of Computer Assisted Tomography. 1991. № 15(4). P. 570-574
- Захаров В.П., Ларин К., Братченко И.А. Повышение информативности оптической когерентной томографии при диагностировании кожных патологий//Вестник СГАУ. 2011. № 2(26). С. 232-239
- Intratumor heterogeneity in perfusion in human melanoma xenografts measured by contrast-enhanced magnetic resonance imaging/I. Bjørnaes [et al.]//Magn. Reson. Imaging. 2000. V. 18. № 8. P. 997-1002.
- Wide-field fluorescence lifetime imaging of cancer/J. McGinty [et al.]/ / Biomed. Opt. Express. 2010. № 1(2). P. 152-161.
- Intraoperative delinaration of primary brain tumors using time-resolved fluorescence spectroscopy/P.V. Butte [et al.]//J. Biomed. Opt. 2010. № 15(2). 027008.
- Применение метода обратного дифференциального рассеяния для исследования биообъектов/В.П. Захаров [и др.]//Физика волновых процессов и радиотехнические системы. 2008. Т. 11. № 4. С. 89-97.
- Keller M.D., Kanter E.M., Mahadevan-Jansen A. Raman spectroscopy for cancer diagnosis//Spectroscopy. 2006. V. 21. № 11. P. 33-41.
- In vivo measurements of diffuse reflectance and time-resolved autofluorescence emission spectra of basal cell carcinomas/A.J. Thompson [et al.]//J. Biophotonics. 2012. V. 5. № 3. P. 240-254.
- Prospects for in vivo Raman spectroscopy/E.B. Hanlon [et al.]//Phys. Med. Biol. 2000. № 45(2). R1-59.
- Melanoma diagnosis by Raman spectroscopy and neural networks: structure alterations in proteins and lipids in intact cancer tissue/M. Gniadecka [et al.]//J. Invest. Dermatol. 2004. № 122. P. 443-449.
- Real-time Raman spectroscopy for noninvasive in vivo skin analysis and diagnosis/J. Zhao [et al.]//New developments in biomedical engineering. 2010. № 24. P. 455-474.
- Vargis E., Mahadevan-Jansen A. Using Raman spectroscopy to detect malignant changes in tissues: application note. Trenton: Princeton Instruments, 2011. 5 p.
- Ultraviolet resonance Raman spectroscopy for detection of colon cancer/R. Manoharan [et al.]//Laser Life Sci. 1995. № 6. P. 217-227.
- Mogensen M., Jemec G.B. Diagnosis of nonmelanoma skin cancer/keratinocyte carcinoma: a review of diagnostic accuracy of nonmelanoma skin cancer diagnostic tests and technologies//Dermatol Surg. 2007. № 33(10). P. 1158-1174.
- Principal components analysis of FT-Raman spectra of ex vivo basal cell carcinoma/A. Martin [et al.]//Biomedical vibrational spectroscopy/Biohazard detection technologies. 2004. V. 5321. P. 198-204.
- Real-time Raman spectroscopy for in vivo skin cancer diagnosis/J. Zhao [et al.]//Cancer Res. 2012. № 72(10). P. 2491-2500.
- Automated autofluorescence background subtraction algorithm for biomedical Raman spectroscopy/J. Zhao [et al.]//Society for applied spectroscopy. 2007. № 61(11). P. 1225-1232.
- Discrimination between basal cell carcinoma and hair follicles in skin tissue sections by Raman micro-spectroscopy/M. Larraona-Puy [et al.]//J. Mol. Struct. 2011. № 993. P. 57-61.
- Friedman R.J. The diagnostic performance of expert dermatoscopics vs a computer-vision system on small diameters melanomas//Arch Dermatol. 2008. № 144(4). P. 476-482.
- Altman D.G., Bland J.M. Diagnostic tests. 1: Sensitivity and specificity//BMJ. 1994. № 308(6943). P. 1552.


