Дифференциальные уравнения кинетики некоторых химических реакций
Автор: Убодоев Владимир Викторович
Журнал: Вестник Бурятского государственного университета. Математика, информатика @vestnik-bsu-maths
Рубрика: Математическое моделирование и обработка данных
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
Статья посвящена исследованию системы обыкновенных дифференциальных уравнений, описывающих кинетику химических реакций, связанных с последовательными прямыми и параллельными реакциями, протекающими при постоянной температуре. Рассмотрены системы линейных и квазилинейных дифференциальных уравнений. Указаны условия, при которых вектор концентраций реагирующих веществ стремится к единственному стационарному состоянию.
Асимптотическая устойчивость решений системы дифференциальных уравнений, кинетика химических реакций, последовательные прямые и параллельные реакции, стационарное состояние
Короткий адрес: https://sciup.org/14835192
IDR: 14835192 | УДК: 517.9 | DOI: 10.18101/2304-5728-2016-3-64-71
Текст научной статьи Дифференциальные уравнения кинетики некоторых химических реакций
Рассматриваются системы обыкновенных дифференциальных уравнений со специальной правой частью, в частности системы линейных и квазилинейных дифференциальных уравнений, а также асимптотическая устойчивость решений этих систем. Показано, что кинетика химических реакций, связанных с последовательными прямыми и параллельными реакциями, протекающими при постоянной температуре, описываются такими системами. Указаны условия, при которых вектор концентраций реагирующих веществ стремится к единственному стационарному состоянию при любых значениях начальных концентраций реагирующих веществ.
1.Постановка задачи
Обозначим через K" множество векторов x = (x1,x2,k,xn) действительного n -мерного векторного пространства R", координаты которых удовлетворяют условиям x > 0, (i = 1,2,k,n), £x = m.
i = 1
где число m > 0.
Рассмотрим систему обыкновенных дифференциальных уравнений
— = f ( t , x ), (1)
dt где правая часть f (t, x) = (f1 (t, x),..., fn (t, x)) удовлетворяет каким-либо условиям, обеспечивающим существование и единственность решений системы (1) в K". Требуется установить, при каких условиях система (1) описывает кинетику химических реакций, связанных с последовательными прямыми и параллельными реакциями, протекающими при постоянной температуре. Установить условия, при которых кинетика химических реакций стремится к единственному стационарному состоянию при любых значениях начальных концентраций реагирующих веществ.
-
2.Важные теоремы
Теорема 1. Если векторная функция f ( t , x ) удовлетворяет каким-либо условиям, обеспечивающим существование и единственность решений системы (1) в K n , то при выполнении условий
-
а ) f ( t , x ) > 0 при x i = 0, ^ x k = m ,
k * i
-
б ) f ( t , x ) ^ 0 при x = m , £ x k = 0, (2)
k * i
n
-
в ) Ё f ( t , x ) = 0 ,
i = 1
где m > 0 - число, то каждому начальному условию x 0 е K" в момент t 0 отвечает единственное решение системы (1) x ( t ) = x ( t , t 0, x 0), удовлетворяющее условию x ( t , t 0, x 0) е Kn при V t > 1 0.
Доказательство . При условии 2в) система (1) имеет частный интеграл n
^ xi = m . Условия 2а) и 2б) показывают, что если начальные условия x 0 i = 1
для системы (1) располагаются в множестве K", то и решение x(t) = x(t, 10, x0), системы (1) при t > 10, также будет располагаться в мно- n жестве K .
Замечание 1. Если векторная функция f (t, x) = A(t)x + b(t) линейна относительно компонент вектора x, то система (1) будет линейной системой dx
— = A (t) x + b (t), dt а условия (2) примут вид
-
a ) a il ( t ) + b i ( t ) > 0, i * j ,
-
б ) a ,, ( t ) + b i ( t ) < 0, i = 1, k , n ,
n
в ) Ё [ a j ( t ) + b '( t ) ] = 0 , j = vK n .
i = 1
Теорема 2. Если матрица A и вектор b постоянны и все собственные числа матрицы A имеют отрицательные вещественные части и выполнены условия (4), то существует единственное стационарное решение p е K n системы (3). Все решения x ( t ) = x ( t , t 0, x 0) при x 0 е Kn системы (3) стремятся к нему при t ^ +^ .
Замечание 2. Рассмотрим систему квазилинейных дифференциальных уравнений dx
— = A ( t ) x + b ( t ) + ц f ( t , x , ц ). dt
Для правой части этой системы условия (2) примут следующий вид а ) a j ( t ) + b i ( t ) + ц f ( t , x , ц ) > 0, i * j , б ) a ii ( t ) + b i ( t ) + ц f ( t , x , ц ) < 0, i = 1, k , n , n
-
в ) Е [ al l ( t ) + b ( t ) + ц f ( t , x , ц ) ] = 0 , j = ^K n , i = 1
при любом x е Kn , t > 0 и любом це ( - ц 0, ц 0) , где ц 0 > 0.
Пусть элементы a j . ( t ) матрицы A ( t ) и компоненты b i ( t ) вектора b ( t ) заданы при t > 0, вещественны и непрерывны, и пусть векторная функция f ( t , x , ц ) = ( f l , f ,, k , f ) задана при x e K n , t > 0, и це ( -да , +да ), вещественна, непрерывна и непрерывно дифференцируема по всем своим аргументам.
Теорема 3. Если выполнены условия теоремы 2 и условия (6), то существует положительное число ц 0 такое, что при | ц | < ц 0 в системе (5) будет существовать единственное стационарное решение p е K" . Все остальные решения x ( t ) = x ( t , 1 0, x 0) при x 0 е K n системы (5) будут неограниченно приближаться к нему при t ^ +да . При этом скорость сходимости оценивается экспонентой.
Теперь рассмотрим приложения - кинетику химических реакций, связанных с последовательными прямыми и параллельными реакциями, протекающими при постоянной температуре.
Скорость реакции в газообразных смесях и жидких растворах при постоянном объеме представляет собой изменение концентрации данного вещества в единицу времени. Закон действия масс (основной закон химической кинетики) формулируется следующим образом [3]: если температура системы поддерживается постоянной, то скорость реакции в каждый момент времени пропорциональна произведению наличных, возведенных в некоторые степени, концентраций реагирующих веществ. А принцип независимости в химической кинетике заключается в следующем: если в системе протекает несколько реакций, то каждая из них подчиняется закону действия масс и протекает независимо от других реакций.
При изучении задач химической кинетики, связанных с последовательными прямыми и параллельными реакциями, протекающими при постоянной температуре, в силу закона действия масс и принципа независимости мы приходим к следующей системе обыкновенных дифференциальных уравнений nn
Э = Z Va i - ^ ,< = 1, K , n , (7)
dt j*i m * i где x = (xpx2,k,xn) - вектор концентраций реагирующих веществ Ai (i = 1, к, n) в момент времени t > 0, kj > 0 - концентрации скоростей реакций Aj ^ Ai, i * j, aj (целые положительные числа) - порядок реакции Aj ^ Ai,i * j. Правая часть системы (7) удовлетворяет условиям (2).
Если aj = 1, i, j = 1,к, n, то все реакции Aj ^ Ai , i * j, являются реакциями 1-го порядка и система (7) будет линейной dx
— = Kx , (8)
dt где K = {kj} - квадратная матрица, имеющая вид
' kj, i * j, kj =<
n
-
k.. =- E kj .
. j *
Таким образом, кинетика последовательных и параллельных реакций 1-го порядка реагирующих веществ A i ( i = 1, к , n ) описывается линейной системой (8) дифференциальных уравнений с постоянными коэффициентами, правая часть которой удовлетворяет условиям (4).
Если все реакции являются реакциями одного порядка, то есть a1} = a > 1, i, j = 1,к,n, то система (7) запишется в виде n
-
-i- = Z j J , i = 1, - , n . (9)
—t = 1
С реакциями с порядком выше третьего практически не приходится встречаться [3]. Рассмотрим некоторые частные случаи системы (9).
Пусть A1 ——^ A2 - прямая реакция 2-го порядка, где к - константа скорости реакции A1 ^ A2, A1 - исходное вещество, A2 - продукт. Обозначим через x1(t), x2(t) концентрации веществ A1,A2 соответственно, тогда уравнение кинетики прямой реакции 2-го порядка имеет вид
< x i =- kx,, x 2 = kx 2 .
Последовательные реакции 1-го порядка: A 1 —— ^ A 2 сываются следующей системой
' xi = - к i 5 1 ,
* 5с 2 = к 1 x 1 - к 2 x 2, x 3 = к 2 x 2.
k
---> A 3 опи-
Уравнение кинетики параллельных реакций 1-го порядка на рис.1
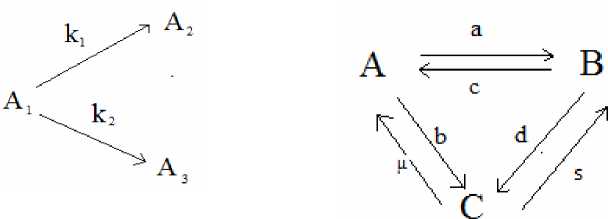
Рис.1. Рис.2.
имеет вид
' x i =- ( к i + к 2 ) x i ,
< x 2 = к 1 x i , (12)
,x 3 = к 2 x 1 .
Обратимые реакции
A1 к' > A 2 и A 2 ——^ A1, где реакция A1 ——^ A2 имеет 2-й порядок и обратная реакция A2 ———> A1 также имеет 2-й порядок, описываются следующей системой нелинейных дифференциальных уравнений
1 2 . 1 .2
x 1 = - к 1 X j + k 2 x 2,
x2 = к 1 X 1 2 - к 2 x 2 .
Предположим, что ку > 0, i, j = 1,k,n, i * j,
и исследуем решения системы (9) на асимптотическую устойчивость в n множестве K .
Теорема 4. Если все константы скоростей k ij > 0 реакций
Ai ^ Ay, i * j, отличны от нуля, то в системе (9) существует единствен ное стационарное решение p е K" и все остальные решения
x ( t ) = x ( t , t 0, x 0) при x 0 е Kn системы (9) стремятся к нему при t ^ +^ .
Доказательство. Из условий (14) следует, что для любого 10 > 0, любого i = 1,..., n и для любого решения x(t) = x(t, 10, x0), где x0 = x(10) е Kn, выполняются соотношения:
xi (t) > xi (10) (i = 1, ..., n) при t > t0.
t > 1 0 и всех i = 1, к , n .
Взяв 3 = min x, ( t 0), получим, что x ( t ) > 3 при I " l < n
Систему (9) перепишем в следующем виде dx dt = C(x) x , где матрица C(x) = {cij (x)} имеет вид cij(x) = ’
k j x a j
n
, i * j ,
-У к -xami mii
,
i = j,
и обладает свойствами: внедиагональные элементы матрицы C(x) неот- рицательны и сумма элементов по каждому столбцу равна единице.
Таким образом, система (9) будет асимптотически устойчивой в K ” . Но множество K ” является выпуклым ограниченным и о - инвариантным [2]. Тогда из теоремы Брауэра о неподвижных точках [2] следует, что в множестве K ” существует стационарная точка системы (15). Отсюда следует, что при выполнении условий теоремы существует единственное стационарное решение в системе (15) и все остальные решения стремятся к нему при t ^ +да . Теорема доказана.
Применив теорему 4 к системе (13), получим, что и в этой системе имеется единственное стационарное решение
Р 1 =
m
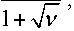
Р 2 =
m V
1+V ’
k где v = -1, к2
и все остальные решения в системе (13) стремятся к нему при t ^+да , если начальные условия удовлетворяют условиям x о > 0, У о > 0, x о + У о = m .
Рассмотрим химическую реакцию на рис. 2. Здесь a,b,c,d,s являются константами скоростей реакций 1-го порядка, а ц является константой скорости реакции 2-го порядка. Кинетика такой реакции описывается системой квазилинейных дифференциальных уравнений dxi 7 П .2
—1 = -(a + b) x j + cx2 + цx3, dt ' 1 2
dx^.
-
<—- = ax ,-(c + d) x2 + px3,(16)
dt - ' 23
dx
-
-j3 = bx 1 + dx 2 - sx 3 - ц x 3, правая часть которой удовлетворяет условиям (6).
По теореме 3 следует, что существует положительное число ц 0 такое, что при 0 < ц < ц 0 в квазилинейной системе (16) будет существовать единственное стационарное решение p е K 3 , и все остальные решения x ( t ) = x ( t , t 0, x 0) при x 0 е K 3 этой системы будут приближаться к нему при t ^ +да . То есть, если концентрация скорости обратимой реакции 2го порядка C ^ A достаточно мала, то при любом значении начальных концентраций реагирующих веществ химическая система стремится к единственному стационарному состоянию.
Заключение
В статье показано, что кинетика химических реакций, связанных с последовательными прямыми и параллельными реакциями, протекающими при постоянной температуре, описываются системами обыкновенных дифференциальных уравнений, правая часть которых удовлетворяет условиям (2). Изучены свойства решений таких систем.
Список литературы Дифференциальные уравнения кинетики некоторых химических реакций
- Зубов В. И. Динамика управляемого движения. -М.: Высшая школа, 1982. -385 с.
- Красносельский М. А. Оператор сдвига по траекториям дифференциальных уравнений. -М.: Наука, 1966. -331 с.
- Панченков Г. М., Лебедев В. П. Химическая кинетика и катализ. -М.: Химия, 1974. -591 с.


