Дикарборанилкарбоксилаты трис(4-фторфенил)сурьмы
Автор: Брегадзе Владимир Иосифович, Глазун Сергей Александрович, Ефремов Андрей Николаевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 4 т.11, 2019 года.
Бесплатный доступ
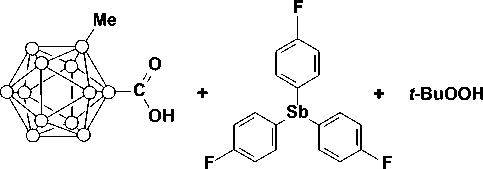
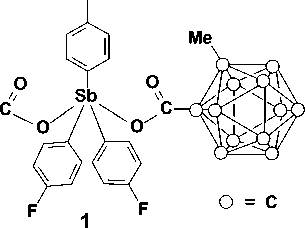
По реакции окислительного присоединения между трис (4-фторфенил)сурьмой, карборансодержащей карбоновой кислотой и гидропероксидом третичного бутила в диэтиловом эфире получены с высоким выходом бис (2-метилкарборанилкарбоксилат) (1) и бис (карборанилкарбоксилат) трис (4-фторфенил)сурьмы (2). Соединения идентифицированы методами ЯМР-, ИК-спектроскопии и рентгеноструктурного анализа. По данным РСА, целевой продукт 1 является сольватом с бензолом. В молекулах соединений 1 и 2 атомы сурьмы имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях. Интервалы изменения длин связей Sb-C составляют 2,086(4)-2,110(3) Å (1), 2,083(5)-2,103(5) Å (2). Связи Sb-O равны 2,116(3), 2,130(3) Å (1) и 2,124(5), 2,111(4) Å (2). Связи Sb-C короче расстояний Sb-O, что характерно для ранее структурно охарактеризованных дикарбоксилатов триарилсурьмы. Значения индивидуальных углов CSbC составляют 115,97(15)°, 116,70(14)°, 127,32(15)° (1) и 113,9(2)°, 114,5(2)°, 131,6(2)° (2). При этом значительное увеличение одного из углов связано с цис -конформацией карбоксилатных лигандов относительно экваториальной плоскости. Аксиальные углы OSbО составляют 172,66(10)° (1) и 175,75(14)° (2). Конформация арильных лигандов по отношению к экваториальной плоскости [С3] пропеллерная. В структурах дикарборанилкарбоксилатов трис (4-фторфенил)сурьмы присутствуют внутримолекулярные контакты между атомами сурьмы и кислорода карбоксилатных лигандов. Расстояния Sb···O=С составляют 3,349(3), 3,237(3) Å (1); 3,284(6), 3,316(7) Å (2), что меньше суммы ван-дер-ваальсовых радиусов сурьмы и кислорода (3,70 Å). Формирование пространственной сетки в кристаллах соединений 1 и 2 обусловлено наличием слабых водородных связей с участием атомов бора карбоксилатных лигандов и фтора арильных лигандов: F···Н (2,49 Å), B···Н (3,18 Å) (1) и F···Н (2,29 Å), B···Н (3,18 Å) (2). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1880056 для 1; № 1919919 для 2; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Трис(4-фторфенил)сурьма, 2-метилкарборанилкарбоновая кислота, карборанил-1, 2-дикарбоновая кислота, бис(2-метилкарборанилкарбоксилат) трис(4-фторфенил)сурьмы, бис(карборанилкарбоксилат) трис(4-фторфенил)сурьмы, реакция окислительного присоединения, рентгеноструктурный анализ
Короткий адрес: https://sciup.org/147233140
IDR: 147233140 | УДК: 547.1’13 | DOI: 10.14529/chem190402
Текст научной статьи Дикарборанилкарбоксилаты трис(4-фторфенил)сурьмы
Дикарбоксилаты триарилсурьмы представлены наиболее широким рядом соединений с различными карбоксилатными и арильными лигандами [1, 2]. Методы синтеза соединений этого класса также разнообразны. Так, например, в работах [3–12] приведены методы синтеза в две и более стадий, основанные на реакциях замещения. Однако наиболее перспективными являются методы, в основе которых лежит реакция окислительного присоединения [13–21]. Преимуществами данного метода являются одностадийность, мягкие условия протекания реакции, высокий выход и чистота целевого продукта.
Вне зависимости от метода синтеза возникают трудности, связанные с выделением индивидуального вещества из реакционной смеси в кристаллическом виде, что необходимо для рентгеноструктурных исследований. Именно по этой причине дикарборанилкарбоксилаты триарилсурьмы представлены единичными случаями структурно охарактеризованных соединений [19, 20].
В настоящей работе впервые синтезированы бис(2-метилкарборанилкарбоксилат) трис(4-фторфенил)сурьмы (1) и бис(карборанилкарбоксилат) трис(4-фторфенил)сурьмы (2) по реакции окислительного присоединения между трис(4-фторфенил)сурьмой, карборансодержащей карбоновой кислоты и трет-бутилгидропероксидом в диэтиловом эфире и определены их структурные особенности методом рентгеноструктурного анализа.
Экспериментальная часть
(4-FC 6 H 4 ) 3 Sb[OC(O)C 2 (B 10 H 10 )Me-2] 2 · ½ PhH (1). Смесь 0,100 г (0,246 ммоль) трис (4-фторфенил)сурьмы, 0,100 г (0,492 ммоль) 2-метилкарборанилкарбоновой кислоты и 0,031 г (0,246 ммоль) 70%-ного водного раствора гидропероксида третичного бутила в 30 мл диэтилового эфира выдерживали при 20 °С в течение 24 ч. После перекристаллизации твердого остатка из смеси растворителей бензол-изопропиловый спирт (2:1 объемн.) получили 0,145 г (73 %) бесцветных кристаллов соединения 1 с т. разл. 170 °С. 1H ЯМР (CDCl 3 , м.д.): 1,3–3,2 (20H, уш., BH), 1,72 (6H, с, CH 3 ), 7,34 (6H, т, J= 8,1 Гц, о -C 6 H 4 F), 7,92 (6H, м, м -C 6 H 4 F). ИК-спектр, ν , см - 1: 3099, 3072, 2947, 2927, 2856, 2594, 1691, 1585, 1492, 1448, 1396, 1388, 1311, 1288, 1267, 1242, 1195, 1165, 1145, 1109, 1093, 1064, 1010, 943, 910, 829, 777, 736, 725, 698, 621, 586, 511, 478, 441, 418.
Найдено, %: С 41,00; Н 4,98; B 26,44. C 26 H 38 O 4 B 20 F 3 Sb · ½ С 6 Н 6 . Вычислено, %: С 41,04; Н 4,88; B 25,48.
Кристаллографические данные, параметры эксперимента и уточнения структуры 1 : C 29 H 41 O 4 B 20 F 3 Sb, М = 848,57; сингония триклинная, группа симметрии P ; a 11,613(8), b 12,754(5), c 15,840(7) Å; α 94,073(16), β 108,665(19), γ 105,86(3) град.; V 2106(2) Å3; Z 2; µ 0,702 мм–1; F (000) 850,0; размер кристалла 0,31 × 0,1 × 0,07 мм; область сбора данных по 2θ 5,9–55,08 град.; интервалы индексов отражений –15 ≤ h ≤ 15, –16 ≤ k ≤ 16, –20 ≤ l ≤ 20; всего отражений 44568; независимых отражений 9641; R int 0,1155; переменных уточнения 576, GOOF 1,007; R 1 = 0,0980; wR 2 = 0,1128; остаточная электронная плотность 0,56/–0,93 e/Å3].
Соединение 2 синтезировали по аналогичной методике. (4-FC 6 H 4 ) 3 Sb[OC(O)C 2 (B 10 H 11 )] 2 (2) : бесцветные кристаллы, выход 98 %, Т разл = 182 °С. ИК-спектр, ν , см - 1: 3211, 3074, 2611, 2582, 2382, 2260, 1909, 1691, 1583, 1492, 1398, 1313, 1300, 1273, 1244, 1193, 1165, 1089, 1060, 1012, 935, 910, 883, 831, 773, 731, 715, 678, 642, 599, 578, 547, 513, 501, 487, 459, 418.
Найдено, %: С 36,74; Н 4,47. C 24 H 34 O 4 B 20 F 3 Sb. Вычислено, %: С 36,88; Н 4,39.
Кристаллографические данные, параметры эксперимента и уточнени я структуры 2 : C 24 H 34 O 4 B 20 F 3 Sb, М = 781,46; сингония триклинная, группа симметрии P ; a 11,465(16), b 12,511(15), c 13,80(2) Å; α 99,36(6), β 96,36(9), γ 107,81(5) град.; V 1832(4) Å3; Z 2; µ 0,801 мм–1; F (000) 776,0; размер кристалла 0,44 × 0,24 × 0,12 мм; область сбора данных по 2θ 6,02–66,58 град.; интервалы индексов отражений –17 ≤ h ≤ 17, –19 ≤ k ≤ 19, –21 ≤ l ≤ 21; всего отражений 108990; независимых отражений 14009; R int 0,0756; переменных уточнения 469, GOOF 1,063; R 1 = 0,1257; wR 2 = 0,2805; остаточная электронная плотность 14,30/–1,46 e/Å3].
ЯМР-спектры 1H регистрировали на ЯМР-спектрометре BRUKER-Avance-400 (частота 400,13 МГц). В качестве стандарта использовали триметилсилан.
ИК-спектры соединений 1 и 2 записывали на ИК-спектрометре Shimadzu IR Affinity-1S в таблетках KBr в области 4000–400 см–1.
Рентгеноструктурный анализ (РСА) кристаллов соединений 1 и 2 проведен на дифрактометре D8 QUEST фирмы Bruker (Mo Kα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [22]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [23], OLEX2 [24]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1880056 для 1; № 1919919 для 2; или .
Обсуждение результатов
Наиболее эффективным методом синтеза дикарбоксилатов триарилсурьмы является метод, в основе которого лежит реакция окислительного присоединения между триарилсурьмой и органическим пероксидом (или пероксидом водорода) в присутствии карбоновой кислоты [13–21]. Эффективность метода заключается в ряде преимуществ: одностадийность, мягкие условия про- текания реакции (комнатная температура, доступные растворители, воздушная атмосфера), высокий выход и чистота синтезируемого продукта.
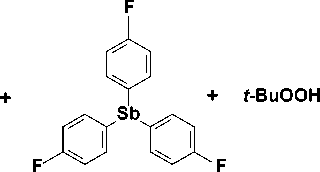
В данной работе синтез бис (2-метилкарборанилкарбоксилата) трис (4-фторфенил)сурьмы ( 1 ) осуществлен по реакции окислительного присоединения между 2-метилкарборанилкарбоновой кислотой и 70%-ным водным раствором гидропероксида третичного бутила в диэтиловом эфире с последующей перекристаллизацией из смеси растворителей бензол–изопропиловый спирт:
Me
F
+ t-BuOH + H2O о = BH
Синтез бис (карборанилкарбоксилата) трис (4-фторфенил)сурьмы ( 2 ) проводился по аналогичной методике, однако в качестве исходной кислоты была взята двухосновная карборанил-1,2-дикарбоновая кислота. Образование соединения 2 происходит, как мы полагаем, в результате декарбоксилирования промежуточно образующегося бис (2-карбоксикарборанилкарбоксилата) трис (4-фторфенил)сурьмы:
OO
HO "C' хC OH
H
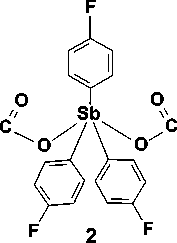
H
+ t-BuOH + H2O о= C
о = BH
Соединения 1 и 2 были выделены в кристаллическом виде после перекристаллизации. Строение данных соединений подтверждено методами ИК-спектроскопии и рентгеноструктурного анализа.
В ИК-спектрах соединений 1 и 2 наблюдается полоса поглощения валентных колебаний фрагмента SbC3 при 511 и 513 см–1 соответственно. Валентным колебаниям связи C–F в ИК-спектрах дикарбоксилатов трис(4-фторфенил)сурьмы соответствует интенсивная полоса поглощения в об- ласти 1011–1013 см–1. Наличие карбонильной группы характеризуется присутствием полосы поглощения валентных колебаний связи С=О сильной интенсивности в области 1691–1692 см–1. Полоса поглощения, характеризующая колебания ν(С–О), наблюдается в области 1288 и 1300 см–1 для соединений 1 и 2 соответственно. Также присутствует полоса поглощения валентных колебаний связей B–H в области 2594–2583 см–1. В ИК-спектре соединения 1 наблюдаются полосы поглощения валентных колебаний метильных групп, асимметричные колебания которых находятся при 2928 см–1, симметричные колебания – 2857 см–1. Отсутствие в ИК-спектрах соединений полос поглощения колебаний гидроксильной группы определяет образование связей Sb–O.
По данным РСА, бис (2-м е ти лк а р б ора н илк а р б окс ила т) трис (4-фторфенил)сурьмы ( 1 ) закриста лли зов а л с я в в иде с ольв а та с молекулой бензола. В молекулах соединени й 1 и 2 атомы сурьмы и ме ют и с ка ж е н н ую три гон альн о-бипирамидальную координацию с атомами кислорода карбоксилатных лигандо в в а к си альн ых п о ло же н и ях (с м. р ис. 1 и 2).
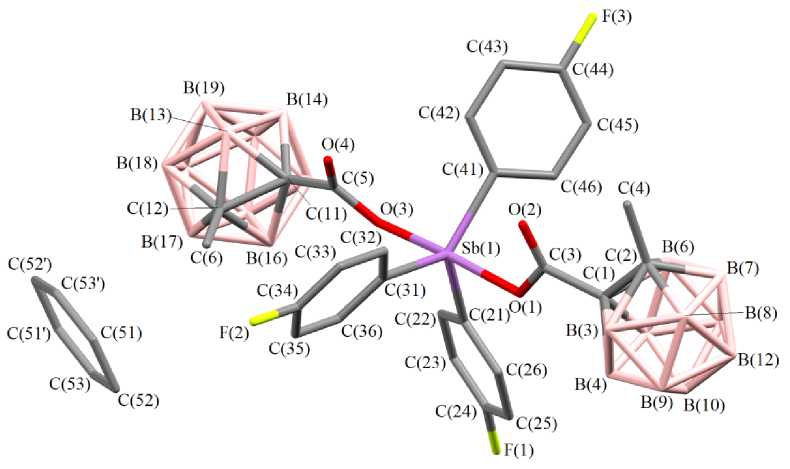
Рис. 1. Строение комплекса 1
F(2)
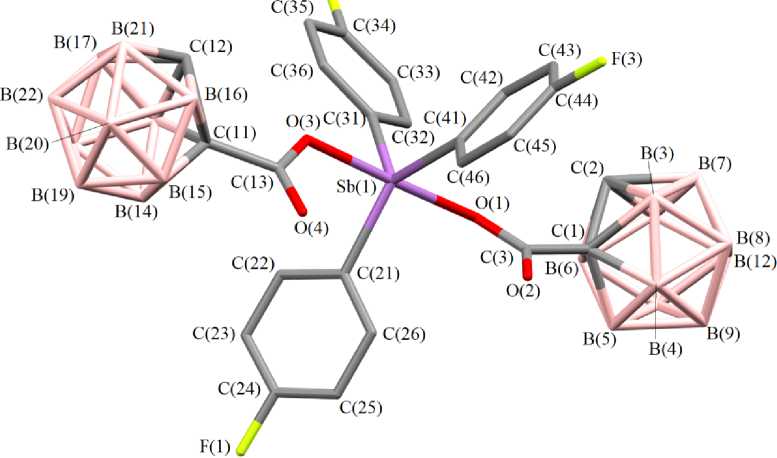
Рис. 2. Строение комплекса 2
Интервалы изменения длин связей Sb–C составляют 2,086(4)–2,110(3) Å (среднее значение 2,097(4) Å) ( 1 ), 2,083(5)–2,103(5) Å (2,092(5) Å) ( 2 ). Связи Sb–O равны 2,116(3), 2,130(3) Å ( 1 ) и 2,124(5), 2,111(4) Å ( 2 ). Связи Sb–C короче расстояний Sb–O, что характерно для ранее структурно охарактеризованных дикарбоксилатов триарилсурьмы [2].
Суммы углов CSbC в экваториальной плоскости в структурах дикарбоксилатов трис (4-фторфенил)сурьмы составляют 360º (в пределах погрешности эксперимента). При этом значения индивидуальных углов составляют 115,97(15)°, 116,70(14)°, 127,32(15)° ( 1 ) и 113,9(2)°, 114,5(2)°, 131,6(2)° ( 2 ). Значительное увеличение одного из углов связано с цис -конформацией карбоксилатных лигандов относительно экваториальной плоскости. Наибольший угол располагается со стороны внутримолекулярных контактов Sb···O=С.
Аксиальные углы OSbО составляют 172,66(10)° ( 1 ) и 175,75(14)° ( 2 ). Фрагменты SbC 3 практически плоские, атом сурьмы выходит из плоскости [C 3 ] на 0,009 Å ( 1 ), 0,021 Å ( 2 ). Значения валентных углов между экваториальными и аксиальными заместителями незначительно отличаются от теоретического значения 90° и варьируются в пределах 86,33(12)°–93,52(13)° ( 1 ), 87,74(18)°–93,2(2)° ( 2 ). Конформация арильных лигандов по отношению к экваториальной плоскости [С 3 ] пропеллерная. Двугранные углы между плоскостями бензольных колец и экваториальной плоскостью составляют 73,69° [C(21)–C(26)], 26,78° [C(31)–C(36)], 35,57° [С(41)–С(46)] ( 1 ); 31,95° [C(21)–C(26)], 82,16° [C(31)–C(36)], 26,24° [С(41)–С(46)].
В структурах дикарборанилкарбоксилатов трис (4-фторфенил)сурьмы присутствуют внутримолекулярные контакты между атомами сурьмы и кислорода карбоксилатных лигандов. Расстояния Sb···O=С составляют 3,349(3), 3,237(3) Å ( 1 ); 3,284(6), 3,316(7) Å ( 2 ), что меньше суммы ван-дер-ваальсовых радиусов сурьмы и кислорода (3,70 Å) [25].
Формирование пространственной сетки в кристаллах соединений 1 и 2 обусловлено наличием слабых водородных связей с участием атомов бора карбоксилатных лигандов и фтора арильных лигандов: F···Н (2,49 Å), B···Н (3,18 Å) ( 1 ) и F···Н (2,29 Å), B···Н (3,18 Å) ( 2 ). Также наблюдается наличие СН-π-взаимодействий бензольных колец арильных лигандов. В кристалле соединения 1 присутствует еще одна водородная связь с участием карбонильной группы и водородом при атоме бора карборанового икосаэдра (2,22 Å).
Выводы
Таким образом, взаимодействие трис (4-фторфенил)сурьмы с 2-метилкарборанилкарбоновой кислотой в присутствии трет -бутигидропероксида приводит к образованию бис (2-метилкарборанилкарбоксилата) трис (4-фторфенил)сурьмы ( 1 ). Замена кислоты на карборанил-1,2-дикарбоновую кислоту дает результатом синтеза бис (карборанилкарбоксилат) трис (4-фторфенил)сурьмы ( 2 ), который образуется в результате декарбоксилирования предполагаемого сурьмаорганического производного (4-FC 6 H 4 ) 3 Sb[OC(O)C 2 (B 10 H 10 )OC(O)H-2] 2 . Рентгеноструктурный анализ показал, что атомы сурьмы в молекулах дикарборанилкарбоксилатов трис (4-фторфенил)сурьмы имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях. В структурах соединений наблюдаются внутримолекулярные контакты Sb···O=С.
Выражаем благодарность проф. В.В. Шарутину за проведенные рентгеноструктурные исследования.
Работа выполнена при финансовой поддержке в рамках государственного задания № 4.6151.2017/8.9.
Список литературы Дикарборанилкарбоксилаты трис(4-фторфенил)сурьмы
- Cambridge Crystallografic Datebase. Release 2019. Cambridge.
- Шарутина, О.К. Молекулярные структуры органических соединений сурьмы (V): монография / О.К. Шарутина, В.В. Шарутин. - Челябинск: Издательский центр ЮУрГУ, 2012. - 395 с.
- Saxena, A.K. Perfluorophenylantimony Acetates (I): Synthetic and Spectroscopic Studies (UV, JR Proton and 19F NMR) of Some New Tris(Pentafluorophenyl)Antimony (V) Diacetates / A.K. Saxena, A. Ranjan, P.S. Venkaramani // J. Fluor. Chem. - 1993. - V. 64, № 1-2. - Р. 107-115.
- Four Triarylantimony(V) Carboxylates: Syntheses, Structural Characterization and in Vitro Cytotoxicities / H. Geng, M. Hong, Y. Yang et al. // J. Coord. Chem. - 2015. - V. 68, № 16. - P. 2938-2952.
- Structural Elucidation and Bioassays of Newly Synthesized Pentavalent Antimony Complexes / T. Iftikhar, M.K. Rauf, S. Sarwar et al. // J. Organomet. Chem. - 2017. - V. 851. - P. 89-96.
- Synthesis and In Vitro Antitumor Activity of Some Triarylantimony Di(N-phenylglycinates) / L. Yu, Y.-Q. Ma, G.-C. Wang et al. // Heteroat. Chem. - 2004. - V. 15, № 1. - P. 32-36.
- Quan, L. Bis(5-bromopyridine-2-carboxylato-κO)triphenylantimony(V) / L. Quan, H. Yin, D. Wang // Acta Crystallogr., Sect. E: Struct. Rep. Online. - 2008. - V. 64, № 12. P. m1503-m1503.
- Highly Symmetrical 24-Membered Macrocyclic Organoantimony(V) Complexes Constructed from Schiff Base Ligands Possessing Two Terminal Carboxyl Groups / M. Hong, H.-D. Yin, W.-K. Li // Inorg. Chem. Commun. - 2011. - V. 14, № 10. - P. 1616-1621.
- Characterising Secondary Bonding Interactions within Triaryl Organoantimony(V) and Organobismuth(V) Complexes / H. Barucki, S.J. Coles, J.F. Costello // J. Chem. Soc., Dalton Trans. - 2000. - V. 200, № 14. - P. 2319-2325.
- Wen, L. Bis(2-amino-4-chlorobenzoato)triphenylantimony(V) / L. Wen, H. Yin, C. Wang // Acta Crystallogr., Sect. E: Struct. Rep. Online. - 2009. - V. 65, № 11. - P. m1442-m1442.
- Triphenylbis(2,4,5-trifluoro-3-methoxybenzoato)antimony(V) / L. Wen, H. Yin, L. Quan et al. // Acta Crystallogr., Sect. E: Struct. Rep. Online. - 2008. - V. 64, № 10. - P. m1303-m1303.
- Novel Triphenylantimony(V) and Triphenylbismuth(V) Complexes with Benzoic Acid Derivatives: Structural Characterization, in Vitro Antileishmanial and Antibacterial Activities and Cytotoxicity against Macrophages / A. Islam, J.G. Da Silva, F.M. Berbet et al. // Molecules. - 2014. - V. 19, № 5. - P. 6009-6030.
- Calorimetric Study of Organic Compounds of Antimony and Bismuth Ph3Sb(O2CCH=CHCH3)2 and Ph3Bi(O2CCH=CHCH3)2 / I.A. Letyanina, A.V. Markin, N.N. Smirnova et al. // J. Therm. Anal. Calorim. - 2016. - V. 125, № 1. - P. 339-349.
- Structural Features of Triorganylantimony Dicarboxylates R3Sb[OC(O)R')]2 / V.V. Sharutin, O.K. Sharutina, A.P. Pakusina et al. // Rus. J. Coord. Chem. - 2003. - V. 29, № 11. - P. 780-789.
- Sharutin, V.V. Tris(4-fluorophenyl)antimony Dicarboxylates (4-FC6H4)3Sb[OC(O)R]2 (R = C10H15 or cyclo-C3H5): Synthesis and Structure / V.V. Sharutin, O.K. Sharutina, A.N. Efremov // Rus. J. Inorg. Chem. - 2016. - V. 61, № 1. - P. 43-47.
- Synthesis and Structure of Bis[(2E)-3-(2-furyl)prop-2-enoato]triphenylantimony Ph3Sb[O2CCH=CH(C4H3O)]2 / O.S. Kalistratova, P.V. Andreev, A.V. Gushchin et al. // Crystallogr. Rep. - 2016. - V. 61, № 3. - P. 391-394.
- Comparative Stability, Toxicity and Anti-leishmanial Activity of Triphenyl Antimony(V) and Bismuth(V) α-Hydroxy Carboxylato Complexes / R.N. Duffin, V.L. Blai, L. Kedzierski et al. // Dalton Trans. - 2018. - V. 47, № 3. - P. 971-980.
- Tris(3-fluorophenyl)antimony Dicarboxylates (3-FC6H4)3Sb[OC(O)R]2 (R = CH2Cl, Ph, CH2C6H4NO2-4, C10H15): Synthesis and Structure / V.V. Sharutin, O.K. Sharutina, R.V. Reshetnikova et al. // Rus. J. Inorg. Chem. - 2017. - V. 62, № 11. - P. 1450-1457.
- Синтез и молекулярные структуры бис(2-метилкарборанилкарбоксилатов) трифенилсурьмы и трифенилвисмута / В.В. Шарутин, О.К. Шарутина, В.С. Сенчурин и др. // Бутлеровские сообщения. - 2012. - Т. 29, № 3. - С. 51 - 56.
- Синтез и строение бис(фенилкарборанилкарбоксилата) три(п-толил)сурьмы / В.В. Шарутин, В.С. Сенчурин, О.К. Шарутина и др. // Бутлеровские сообщения. - 2011. - Т. 28, № 19. - С. 54-58.
- Sharutin, V.V. Tri- and Tetraphenylantimony Propiolates: Syntheses and Structures / V.V. Sharutin, O.K. Sharutina, V.S. Senchurin // Rus. J. Coord. Chem. - 2014. - V. 40, № 2. - P. 109-114.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures From Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- OLEX2: Complete Structure Solution, Refinement and Analysis Program / O.V. Dolomanov, L.J. Bourhis, R.J. Gildea et al. // J. Appl. Cryst. - 2009. - V. 42. - P. 339-341.
- Бацанов, С.С. Атомные радиусы элементов / С.С. Бацанов // Журн. неорган. химии. - 1991. - Т. 36, № 12. - С. 3015-3037.


