Динамика эхокардиографических показателей после циркулярной процедуры циркулярной радиочастотной денервации ствола и устьев легочных артерий (PADN) у пациентов с пороками митрального клапана, фибрилляцией предсердий и высокой легочной гипертензией
Автор: Трофимов Н.А., Медведев А.П., Бабокин В.Е., Драгунов А.Г., Кичигин В.А., Никольский А.В., Жамлиханова С.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.34, 2019 года.
Бесплатный доступ
Цель исследования: проанализировать влияние хирургического лечения высокой легочной гипертензии у пациентов с пороками митрального клапана и фибрилляцией предсердий на эхокардиографические (ЭхоКГ) показатели.Материал и методы. В ходе исследовательской работы был проведен анализ хирургического лечения 202 пациентов с митральным пороком, осложненным легочной гипертензией более 40 мм рт. ст. и фибрилляцией предсердий (ФП). Оперативное вмешательство у этих больных заключалось в хирургической коррекции митральной дисфункции - протезировании клапана искусственным протезом либо клапансохраняющем вмешательстве (первая группа больных, n = 62). У пациентов второй группы (n = 89) дополнительно выполнена процедура Maze IV в связи с сопутствующей фибрилляцией предсердий при помощи биполярного радиочастотного аблатора AtriCure. Пациентам третьей группы (n = 51) проведено комплексное хирургическое вмешательство, заключающееся в ликвидации порока митрального клапана, хирургической коррекции фибрилляции предсердий в виде процедуры Maze IV и выполнении циркулярной радиочастотной денервации ствола и устьев легочных артерий (Pulmonary Artery Denervation - PADN).Выводы. Циркулярная процедура PADN является эффективной и безопасной, позволяет значительно снизить уровень легочной гипертензии в послеоперационном периоде (рχ2 = 0,018 в сравнении с группой без PADN) и способствует обратному ремоделированию полостей сердца. Комплексная хирургическая коррекция пациентов с митральной дисфункцией, фибрилляцией предсердий и высокой легочной гипертензией позволяет значительно уменьшить явления сердечной недостаточности (рχ2 = 0,023 в сравнении с группой без PADN). Необходим дальнейший анализ эффективности радиочастотной денервации легочных артерий с исследованием большего количества больных, анализом отдаленных результатов, а также определение возможностей данной методики у пациентов с неклапанными формами легочной гипертензии.
Вторичная легочная гипертензия, аблация легочного ствола, денервация ганглионарных сплетений, митральный порок, фибрилляция предсердий
Короткий адрес: https://sciup.org/149126056
IDR: 149126056 | УДК: 616.126.42-007.2:616.12-008.313.2:616.131-008.331.1] | DOI: 10.29001/2073-8552-2019-34-3-129-143
Текст научной статьи Динамика эхокардиографических показателей после циркулярной процедуры циркулярной радиочастотной денервации ствола и устьев легочных артерий (PADN) у пациентов с пороками митрального клапана, фибрилляцией предсердий и высокой легочной гипертензией
–143
Актуальность
Рост сердечно-сосудистых заболеваний в последние десятилетия непосредственно связан с увеличением продолжительности жизни в популяции. По данным проведенного исследования Euro Heart Survey on VHD, патология аортального клапана среди приобретенных пороков сердца составляет 44,3%; дисфункция митрального клапана – 34,3%, из них случаев стеноза – 9,5%; недостаточности клапана – 24,8%. Изолированный порок трикуспидального клапана встречается в 1,2%, в то время как сочетанное поражение нескольких клапанов сердца наблюдается в 20,2% [1].
В России ведущим этиологическим фактором клапанных пороков сердца до сих пор является ревматизм, хотя последнее время возрастает количество дегенеративных поражений клапанного аппарата, которое в 2014 г. достигло 46,6% [2, 3].
Распространенность митрального порока в популяции составляет 8% и сопряжено с развитием различных осложнений, требующих индивидуального подхода у каждого пациента [4]. Основными механизмами естественного течения дисфункции митрального клапана является дилатация полостей сердца, увеличение вторичной легочной гипертензии, изменение электрофизиологических свойств стенки предсердий с формированием фибрилляции предсердий, появление комор-бидной патологии и др. [5, 6].
Фибрилляция предсердий выявляется у 30–84% пациентов с диагностированным клапанным поражением сердца, она снижает эффективность хирургической коррекции и качества жизни больных, а также способствует прогрессированию сердечной недостаточности, увеличивает риски осложнений тромбоэмболического характера и летальность. Данная аритмия в популяции достигает 2% и за последние десятилетия значительно увеличилась [10, 11].
Митральный порок способствует нарастанию легочной гипертензии, перегрузке правых отделов сердца с формированием недостаточности трикуспидального клапана и, в конечном итоге, снижению качества жизни пациентов, неблагоприятному исходу заболевания и повышенной летальности [12].
В настоящее время под легочной гипертензией принято понимать группу заболеваний, характеризующихся увеличением легочного сосудистого сопротивления и давления в легочной артерии с последующим формированием правожелудочковой сердечной недостаточности и преждевременной летальностью больных [13]. Различают первичную легочную гипертензию, обусловленную мутацией 2q33 хромосомы, ответственной за рост и пролиферацию клеток эндотелия, и вторичную, ассоциированную с врожденными пороками сердца, коллагеноза-ми, тромбоэмболией легочных артерий, гипертензией левого предсердия, гипоксемией, обструктивными заболеваниями легких [14]. Патогенезом легочной гипертензии является нарушение соотношения метаболитов простациклина и тромбоксана с увеличением активности тромбоксана, снижением синтеза оксида азота, увеличение продукции эндотелиальными клетками вазоконстриктора эндотелина, тромбоза in situ , гипертрофия гладкомышечных клеток с вторичной вазоконстрикцией, а также пролиферативная реакция интимы и адвентиции сосудов [15, 16]. Классификация легочной гипертензии включает четыре группы: тромбоэмболическая; артериальная гипертензия; хроническая гипертензия, ассоциированная с заболеваниями левых отделов сердца и идиопатическая [17]. Повышенное давление в малом круге кровообращения у пациентов с поражением клапанного аппарата сердца уменьшает эффективность оперативного вмешательства, снижает темп послеоперационного ремоделирования камер сердца, а также увеличивает риск рецидива фибрилляции предсердий после радиочастотной аблации предсердий по схеме Maze IV [18]. Целесообразность коррекции легочной гипертензии продемонстрирована в работе S. Briongos Figuero и со-авт., где показано, что дооперационная высокая степень легочной гипертензии тесно коррелирует с сохранением легочной гипертензии даже после оперативного лечения порока митрального клапана (отношение шансов 1,761; p = 0,03) [19].
Расположение симпатических нервных сплетений в адвентиции ствола и устьях легочных артерий, ответственных за спазм легочных артериол и увеличение легочной гипертензии, впервые было освещено в работах J. Osorio в 1962 г. [20]. В дальнейшем эти данные были подтверждены в публикациях B.G. Baylen et al. [21] и C.E. Juratsch et al. [22].
Консервативное лечение высокой легочной гипертензии в настоящее время не позволяет добиться стойкого снижения давления в малом круге кровообращения и сопряжено с приемом дорогостоящих лекарственных средств [23].
Первые хирургические вмешательства при высокой легочной гипертензии впервые были предложены S.L. Chen в 2013 г. в виде процедуры эндоваскулярной катетерной аблации ствола и устьев легочных артерий, которая, по мнению авторов, позволила существенно снизить давление в легочной артерии [24].
В последние годы представлено несколько работ по хирургической коррекции легочной гипертензии у пациентов с митральной дисфункцией в условиях искусственного кровообращения одномоментно с оперативным лечением митрального порока. Группа авторов под руководством А.В. Богачева-Прокофьева предложила методику радиочастотной аблации передней стенки ствола и устьев легочных артерий с применением монополярного электрода [25]. Также в настоящее время используется способ циркулярной радиочастотной денервации легочных артерий с применением биполярного деструктора [26]. Несмотря на существующие методы коррекции легочной гипертензии, проблема хирургического лечения высокой вторичной легочной гипертензии является наиболее актуальной, так как нет общепринятого алгоритма лечения данной патологии, необходимо дальнейшее исследование проблемы с поиском оптимальной методики хирургического лечения этой категории больных.
Цель исследования: проанализировать влияние хирургического лечения высокой легочной гипертензии у пациентов с пороками митрального клапана и фибрилляцией предсердий на эхокардиографические (ЭхоКГ) показатели.
Материал и методы
В ходе исследовательской работы был проведен анализ хирургического лечения 202 пациентов с митральным пороком, осложненным высокой легочной гипертензией (средний градиент давления легочной артерии (СДЛА) более 40 мм рт. ст.) и фибрилляцией предсердий. Оперативное вмешательство у этих больных заключалось в хирургической коррекции митрального порока – протезировании клапана искусственным протезом либо клапаносохраняющем вмешательстве – первая группа больных (n = 62). У пациентов второй группы (n = 89) также выполнялась коррекция порока митрального клапана, была проведена процедура Maze IV в связи с сопутствующей фибрилляцией предсердий при помощи биполярного радиочастотного аблатора AtriCure. Пациентам третьей группы (n = 51) выполнено комплексное хирургическое вмешательство, заключающееся в ликвидации порока митрального клапана, хирургической коррекции фибрилляции предсердий в виде процедуры Maze IV, а также проведена циркулярная радиочастотная денервация ствола и устьев легочных артерий (Pulmonary Artery Denervation – PADN).
Порок митрального клапана, осложненный фибрилляцией предсердий и высокой вторичной легочной гипертензией, явился критерием включения пациентов в группы исследования. Тромбоэмболию легочных артерий в анамнезе и гемодинамически значимое поражение коронарных артерий считали критериями исключения. Всех пациентов третьей группы до операции информировали о предстоящей дополнительной процедуре PADN, были подписаны соответствующие информированные добровольные согласия в соответствии с принципами клинической практики Good Clinical Practice (GCP), а также согласно Хельсинкской декларации.
Статистический анализ проводился в программе Statistica 10.0. При отсутствии нормального распределения количественные данные описывались как среднее и стандартное отклонение ( M ± σ), для ранговых данных – как медиана и верхний и нижний квартили – Me ( Q 1– Q 3). Статистическая значимость различий для количественных данных при нормальном распределении оценивалась по t-критерию Стьюдента, а при отсутствии нормального распределения и для ранговых данных – по критерию Манна – Уитни ( p m-u). Нормальность распределения проверяли по критерию Шапиро – Уилка. Для качественных данных (относительных величин) оценка различий проводилась по критерию хи-квадрат (χ2). Если количество наблюдений хотя бы в одном из полей таблицы 2 на 2 было менее 5, вели расчет точным критерием Фишера. При необходимости сравнить одновременно три группы использовали критерий Крускала – Уоллиса (для количественных и ранговых данных) и критерий хи-квадрат (для качественных данных). Вероятность ошибки ( p ) считали приемлемой при р < 0,05.
При последовательном многократном применении статистических критериев Стьюдента, хи-квадрат, Манна – Уитни (поочередное сравнение групп между собой) вероятность обнаружить различия там, где их нет, возрастает в n раз. Поэтому при трехкратном последовательном сравнении групп использовали поправку Бонферони, приемлемый уровень значимости рассчитывали как p = 0,05/ n , где n = 3, т.е-0,0167.
Статистическую значимость динамических различий рассчитывали для количественных данных по критерию Вилкоксона, для качественных данных – по критерию МакНемара с поправкой Йетса. При проведении статистического анализа руководствовались рекомендациями Stanton A. Glantz [27].
Пациенты всех исследуемых групп были сопоставимы по основным клинико-инструментальным показателям (табл. 1).
Таблица 1. Исходная клинико-инструментальная характеристика исследуемых пациентов ( n = 202)
Table 1. Initial clinical and instrumental characteristics of the studied patients ( n = 202)
|
Показатели Parameters |
Первая группа ( n = 62) Group 1 |
Вторая группа ( n = 89) Group 2 |
Третья группа ( n = 51) Group 3 1–2 |
Статистическая значимость различий между группами, р Significance of intergroup differences, p 1–3 2–3 |
|||
|
Пол (муж./жен.) Gender (male/female) |
19/43 |
28/61 |
23/28 |
0,916 |
0,116 |
0,108 |
|
|
Возраст, лет Age, years |
56,3±8,04 |
55,8±8,3 |
59,4±5,2 |
0,74 |
0,017# |
0,005# |
|
|
ХРБС Chronic rheumatic heart disease |
82 |
85 |
76 |
0,604 |
0,447 |
0,184 |
|
|
Нозология (%) Nosology (%) |
ИЭ Infective endocarditis |
8 |
9 |
20 |
0,842 |
0,073 |
0,072 |
|
ССТД Connective tissue dysplasia syndrome |
10 |
6 |
4 |
0,345 |
0,235 |
0,657 |
|
|
Длительно перстирующая Long-standing persistent |
77 |
84 |
86 |
0,167 |
0,321 |
0,749 |
|
|
Вид ФП (%) Type of AF (%) |
Персистирующая Persistent |
8 |
2 |
8 |
0,094 |
0,965 |
0,116 |
|
Пароксизмальная Paroxysmal |
15 |
13 |
6 |
0,857 |
0,138 |
0,162 |
|
|
Стаж ФП (лет) Duration of AF (years) |
2,7±2,2 |
2,7±1,7 |
2,6±1,4 |
0,841 |
0,887 |
0,688 |
|
|
Трепетание предсердий (%) Atrial flutter (%) |
10 |
20 |
14 |
0,081 |
0,501 |
0,385 |
|
|
Атеросклероз брахиоцефальных сосудов со стенозом более 50%, (%) Atherosclerosis of brachiocephalic vessels with stenosis more than 50% (%) |
27 |
17 |
18 |
0,118 |
0,219 |
0,904 |
|
|
ОНМК в анамнезе (%) History of acute cerebrovascular event (%) |
10 |
8 |
8 |
0,867 |
0,320 |
1,000 |
|
|
EUROSCORE (балл) |
5(3–6) |
4(3–6) |
5(4–8) |
0,817 |
0,004# |
0,004# |
|
|
Время ИК (мин) Cardiopulmonary bypass time (min) |
110(90–136) |
136(118–151) |
111(87–130) |
0,006# |
0,511 |
< 0,001 # |
|
|
Время пережатия аорты, (мин) Aortic cross-clamping time (min) |
84,5(70–102) |
107(92–128) |
79(67–102) |
< 0,001 # |
0,359 |
< 0,001 # |
|
|
Трикуспидальная недостаточность 24-й ст. (%) TVI (%) |
54,8 |
76,4 |
64,7 |
0,016# |
0,533 |
0,095 |
|
|
III–IV ФК ХСН по NYHA (%) NIHA CHF FC III–IV (%) |
27,4 |
28,1 |
43,1 |
0,953 |
0,082 |
0,058 |
|
|
КДР ЛЖ (см) LVIDd (cm) |
5,5(5,2–6,3) |
5,5(5,2–5,7) |
5,6(5,4–6,4) |
0,245 |
0,349 |
0,014# |
|
|
КСР ЛЖ (см) LVIDs (cm) |
4,2(3,7–4,8) |
3,8(3,6–4,1) |
4,0(3,8–4,8) |
0,002# |
0,925 |
< 0,001 # |
|
|
КДО ЛЖ (см) LVEDV (cm) |
147,4 (129,5–201,2) |
143,2 (130,4–160,04) |
153,7 (135,3–208,5) |
0,176 |
0,465 |
0,016# |
|
|
КСО ЛЖ (см) LVESV (cm) |
76,4(58,1–107,5) |
62,0 (54,4–71,2) |
70(62,0–107,5) |
0,001# |
0,902 |
< 0,001 # |
|
|
ФИ ЛЖ (%) LVEF (%) |
51,0 (43,9–57,9) |
56,3(53,1–58,0) |
52,2(49,1–55,1) |
< 0,001 # |
0,080 |
< 0,001 # |
|
|
КСР ПЖ (см) RVD (cm) |
3,4(3,2–3,6) |
3,4(3,2–3,7) |
3,6(3,4–4,0) |
0,182 |
< 0,001 # |
0,003# |
|
|
КСР ЛП (см) LADs (cm) |
5,1(4,8–5,7) |
5,4(5,2–5,6) |
5,5(5,3–5,7) |
0,034 |
0,002# |
0,600 |
|
|
КСР ПП (см) RADs (cm) |
5,2(5–5,7) |
5,6(5,2–5,9) |
5,8(5,6–6) |
0,004# |
< 0,001 # |
0,095 |
|
|
СГДЛА (мм рт. ст.) PASP (mmHg) |
46(43–49) |
46(44–50) |
48(45–60) |
0,440 |
0,002# |
0,018 |
|
Примечание: здесь и далее для большинства случаев (для возраста больных и давности ФП применен t-критерий Стьюдента), межгрупповые различия рассчитывались по критерию Манна – Уитни в связи с отсутствием нормального распределения (в этом случае данные представлены как Me (Q1–Q3)), для качественных значений использован критерий хи-квадрат или точный критерий Фишера. Знаком #обозначен необходимый уровень статистической значимости с учетом поправки Бонферони.
Сокращения: n – число больных, КДР – конечный диастолический размер, ЛЖ – левый желудочек, КСР – конечный систолический размер, КДО – конечный диастолический объем, КСО – конечный систолический объем, ФИ – фракция изгнания, ПЖ – правый желудочек, ЛП – левое предсердие, ПП – правое предсердий, СГДЛА – средний градиент давления в легочной артерии; ССТД – синдром соединительнотканной дисплазии.
Note: n : number of patients, AF: atrial fibrillation, TVI: tricuspid valve insufficiency, LVIDd: left ventricular internal diameter in diastole, LVIDs: left ventricular internal diameter in systole, LVEDV: left ventricular end-diastolic volume, LVESV: left ventricular end-systolic volume, LVEF: left ventricular ejection fraction, NIHA CHF FC III-IV: functional class III-IV chronic heart failure according to New York Heart Association, RVD: right ventricular basal diameter, LADs: left atrium anterior-posterior diameter in systole, RADs: right atrium anterior-posterior diameter in systole, PASP: pulmonary artery systolic pressure.
Приведенные данные характеризуют пациентов третьей группы как более тяжелых по возрастному показателю, шкале EUROSCORE, сократительной способности левого желудочка, исходной дилатации левого желудоч- ка и правых отделов сердца, а также по выраженности легочной гипертензии.
Процедура PADN выполнялась циркулярно с использованием биполярного радиочастотного деструктора AtriCure. После мобилизации легочного ствола и устьев легочных артерий в условиях параллельного искусственного кровообращения наносили две аблационные циркулярные линии на дистальную часть легочного ствола, каждая линия состояла из трех аппликаций (рис. 1).
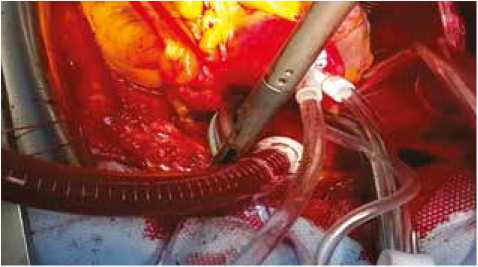
Рис. 2. Аблация устья правой легочной артерии
Fig. 2. Ablation of the mouth of the right pulmonary artery
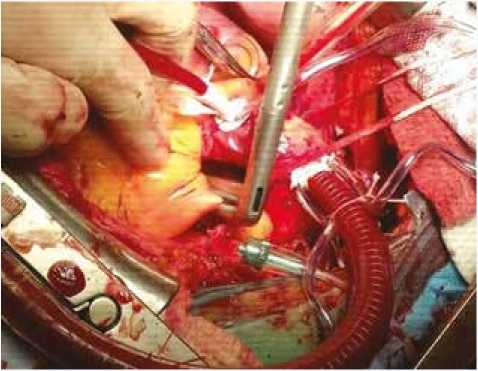
Рис. 1. Циркулярная аблация легочного ствола
Fig. 1. Circular ablation of the pulmonary trunk
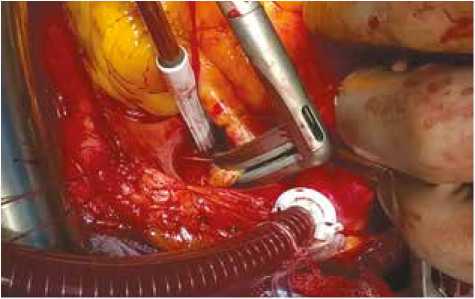
Рис. 3. Аблация устья левой легочной артерии
Fig. 3. Ablation of the left pulmonary artery mouth
В дальнейшем выделяли устья правой легочной артерии и наносили аналогичные циркулярные аблационные линии (рис. 2).
В ряде случаев выделение правой легочной артерии проводили из подаортального доступа, справа от аорты, в области поперечного синуса сердца. Аналогичным образом выполняли циркулярную денервацию в области устья левой легочной артерии (рис. 3).
Конечный вид циркулярной процедуры PADN представлен шестью аблационными линиями, по две на стволе легочной артерии и по две на устьях правой и левой легочных артерий (рис. 4).
На проведение процедуры PADN в среднем уходило 5,5 мин.
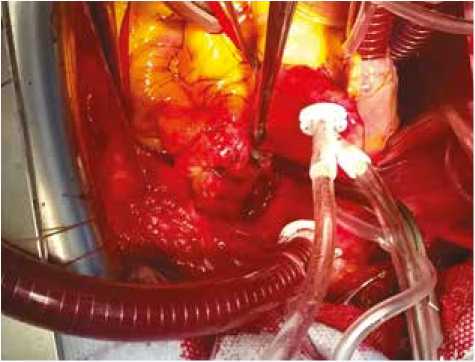
Рис. 4. Конечный вид циркулярной процедуры PADN
Fig. 4. The final view of a circular PADN procedure
После радиочастотной денервации легочных артерий выполняли стандартную кардиоплегию в корень аорты, накладывали зажим на аорту и выполняли основной этап операции – коррекцию митрального порока и процедуру Maze IV. Среднее время искусственного кровообращения в исследовании составило 114,1 мин, время ишемии – 85,2 мин. Нахождение пациентов в отделении анестезиологии и реанимации составило в среднем 2,4 дня. Ведение больных третьей группы в послеоперационном периоде не отличалось от первой и второй групп. Мониторинг ЭхоКГ показателей проводили при помощи трансторакального ЭхоКГ через 3, 6, 12, 24 мес. после операции.
Результаты
Летальные исходы среди пациентов встречались по одному в каждой группе и были обусловлены острой прогрессирующей сердечной недостаточностью в первые сутки после операции. Послеоперационных осложнений, связанных с процедурой PADN, не наблюдалось. По данным трансторакального ЭхоКГ, у всех пациентов отмечалась положительная динамика в послеоперационном периоде, (табл. 2). Существенного снижения частоты ФП не было зарегистрировано только в первой группе.
Таблица 2. Динамика эхокардиографических показателей исследуемых групп
Table 2. Dynamics of echocardiographic parameters of the studied groups
|
Показатели |
Группа 1 |
Группа 2 |
Группа 3 |
р |
||||
|
Parameters |
( n = 62) |
( n = 89) |
( n = |
51) |
1–2 |
1–3 |
2–3 |
|
|
Трикуспидальная недостаточность |
Исходно Baseline |
54,8 |
76,4 |
64,7 |
0,016# |
0,533 |
0,095 |
|
|
2–4-й степеней (%) Degree 2–4 TVI (%) |
Через 24 мес. After 24 months |
32,80* |
20,5* |
0 |
* |
0,044 |
< 0,001 # |
< 0,001 # |
|
III–IV ФК ХСН по NYHA (%) NIHA CHF FC III–IV (%) |
Исходно Baseline Через 24 мес. After 24 months |
100 67,2 |
98,9 36,4* |
100 18,0* |
0,953 < 0,001 # |
0,082 < 0,001 # |
0,058 0,023 |
|
|
КДР (см) |
Исходно Baseline |
5,5(5,2–6,3) |
5,5(5,2–5,7) |
5,6(5,4 |
–6,4) |
0,245 |
0,349 |
0,014# |
|
LVIDd (cm) |
Через 24 мес. After 24 months |
5,3(5–6)* |
4,8(4,6–5,1)* |
4,6(4,5 |
–5,3)* |
< 0,001 # |
< 0,001 # |
0,896 |
|
КСР (см) |
Исходно Baseline |
4,2(3,7–4,8) |
3,8(3,6–4,1) |
4(3,8–4,8) |
0,002# |
0,925 |
< 0,001 # |
|
|
LVIDs (cm) |
Через 24 мес. After 24 months |
3,9(3,4–4,3)* |
3,3(3,1–3,7)* |
3,2(3–3,6)* |
< 0,001 # |
< 0,001 # |
0,625 |
|
|
КДО (см) |
Исходно Baseline |
147,4(129,5–201,2) |
143,2 (130,4–160,0) |
153,7 (135,3–208,5) |
0,176 |
0,465 |
0,016# |
|
|
LVEDV (cm) |
Через 24 мес. After 24 months |
135,3(118,2–180)* |
105,9 (97,3–123,8)* |
97,3 (93,8–135,3)* |
< 0,001 # |
< 0,001 # |
0,858 |
|
|
КСО (см) |
Исходно Baseline |
76,4(58,1–107,5) |
62,0 (54,4–71,2) |
70 (61,9–107,5) |
0,001# |
0,902 |
< 0,001 # |
|
|
LVESV (cm) |
Через 24 мес. After 24 months |
65,9(47,4–83,1)* |
44,1 (36,5–57,7)* |
42,6 (35–54,43)* |
< 0,001 # |
< 0,001 # |
0,691 |
|
|
ФИ (%) |
Исходно Baseline |
51,0 (43,9–57,9) |
56,3 (53,1–58,0) |
52,2 (49,1–55,1) |
< 0,001 # |
0,080 |
< 0,001 # |
|
|
LVEF (%) |
Через 24 мес. After 24 months |
53,4(47,6–57,0)* |
57,9 (54,4–63,3)* |
58,2 (56,3–60,1)* |
< 0,001 # |
< 0,001 # |
0,857 |
|
|
ПЖ (см) |
Исходно Baseline |
3,4(3,2–3,6) |
3,4(3,2–3,7) |
3,6(3,4–4) |
0,182 |
< 0,001 # |
0,003# |
|
|
RVD (cm) |
Через 24 мес. After 24 months |
3,2(3–3,4)* |
3,0(2,9–3,1)* |
2,9(2,8–3,2)* |
< 0,001 |
< 0,001 |
0,156 |
|
|
ЛП (см) |
Исходно Baseline |
5,1(4,8–5,7) |
5,4(5,2–5,6) |
5,5(5,3–5,7) |
0,034 |
0,002# |
0,600 |
|
|
LADs (cm) |
Через 24 мес. After 24 months |
4,8(4,5–5,3)* |
4,3(4–4,6)* |
4,1(3,8–4,3)* |
< 0,001 # |
< 0,001 # |
0,010# |
|
|
ПП (см) |
Исходно Baseline |
5,2(5–5,7) |
5,6(5,2–5,9) |
5,8(5,6–6) |
0,004# |
< 0,001 # |
0,095 |
|
|
RADs (cm) |
Через 24 мес. After 24 months |
5,1(5–5,5)* |
5,0(4,4–5,3)* |
4,5(4,4–5)* |
< 0,001 # |
< 0,001 # |
0,073 |
|
|
ЛГ (мм рт. ст.) |
Исходно Baseline |
46(43–49) |
46(44–50) |
48(45–60) |
0,44 |
0,002# |
0,018 |
|
|
PASP (mm Hg) |
Через 24 мес. After 24 months |
32(30–34)* |
26(23,5– 29,4)* |
23(21–28)* |
< 0,001 # |
0,583 |
0,519 |
|
|
Фибрилляция предсердий (%) AF (%) |
Исходно Baseline Через 24 мес. After 24 months |
100 95 |
100 34* |
100 16* |
1,0 < 0,001 # |
1,0 < 0,001 # |
1,0 0,022 |
|
Так как основными критериями эффективности лечения является достижение целевых показателей, проанализированы итоговые результаты в группах исследования в виде доли достигнутых показателей. Для показателей ЭхоКГ брали границы нормальных значений (табл. 3).
Таблица 3. Целевые показатели через 24 мес. после операции в группах исследования, %
Table 3. Parameters of achieving target values 24 months after surgery in study groups, %
|
Показатели Parameters |
Первая группа ( n = 62) Group 1 |
Вторая группа ( n = 89) Group 2 |
Третья группа ( n = 51) Group 3 |
рχ2 |
|||
|
1 |
2 |
3 |
1–2 |
1–3 |
2–3 |
||
|
ТН 0-1-й степени |
Исходно Baseline |
45,2 |
23,6 |
35,3 |
0,005# |
0,288 |
0,137 |
|
Degree 0-l TVI (%) |
Через 24 мес. After 24 months |
67,2* |
79,5* |
100,0* |
0,089 |
< 0,001# |
< 0,001# |
|
ТН 0 степени |
Исходно Baseline |
1,6 |
0 |
0 |
0,229 |
0,362 |
1,0 |
|
Degree 0 TVI (%) |
Через 24 мес. After 24 months |
0 |
3,4 |
88,0* |
0,091 |
< 0,001# |
< 0,001# |
|
ФК ХСН 1-2 |
Исходно Baseline |
0 |
1,1 |
0 |
0,402 |
1,0 |
0,447 |
|
CHF FC 1-2 (%) |
Через 24 мес. After 24 months |
32,8* |
63,6* |
82,0* |
< 0,001 |
< 0,001 |
0,023 |
|
Исходно |
0 |
0 |
0 |
1,0 |
1,0 |
1,0 |
|
|
Сохранность синусового ритма |
Baseline |
||||||
|
Sinus rhythm (%) |
Через 24 мес. After 24 months |
4,9 |
65,9* |
84,0* |
< 0,001# |
< 0,001# |
0,022 |
|
КДР ЛЖ (см) |
Исходно Baseline |
38,7 |
47,2 |
31,4 |
0,301 |
0,417 |
0,067 |
|
LVIDd (cm) |
Через 24 мес. After 24 months |
50,8* |
87,5* |
92,0* |
< 0,001# |
< 0,001# |
0,414 |
|
КСР ЛЖ (см) |
Исходно Baseline |
24,2 |
38,2 |
19,6 |
0,070 |
0,559 |
0,023 |
|
LVIDs (cm) |
Через 24 мес. After 24 months |
44,3* |
72,7* |
98,0* |
< 0,001# |
< 0,001# |
< 0,001# |
|
КДО ЛЖ (мл) |
Исходно Baseline |
21,0 |
21,3 |
11,8 |
0,955 |
0,193 |
0,154 |
|
LVEDV (cm) |
Через 24 мес. After 24 months |
36,1* |
64,8* |
66,0* |
< 0,001# |
< 0,001# |
0,884 |
|
КСО ЛЖ (мл) |
Исходно Baseline |
14,5 |
19,1 |
11,8 |
0,463 |
0,668 |
0,260 |
|
LVESV (cm) |
Через 24 мес. After 24 months |
29,5* |
64,8* |
62,0* |
< 0,001# |
< 0,001# |
0,745 |
|
ФИ ЛЖ >55% |
Исходно Baseline |
38,7 |
76,4 |
52,9 |
< 0,001# |
0,130 |
0,004# |
|
LVEF >55% |
Через 24 мес. After 24 months |
49,2* |
81,8* |
96,0* |
< 0,001# |
< 0,001# |
0,018 |
|
КСР ПЖ (см) |
Исходно Baseline |
40,3 |
44,9 |
21,6 |
0,573 |
0,033 |
0,006# |
|
RVD (cm) |
Через 24 мес. After 24 months |
68,9* |
83,0* |
96,0* |
0,044 |
< 0,001# |
0,030 |
|
КСР ЛП (см) |
Исходно Baseline |
3,2 |
4,5 |
0,0 |
0,695 |
0,196 |
0,125 |
|
LADs (cm) |
Через 24 мес. After 24 months |
1,6 |
23,9* |
48,0* |
< 0,001# |
< 0,001# |
0,004# |
Окончание табл. 3
End of table 3
|
Показатели Parameters |
Первая группа ( n = 62) Group 1 |
Вторая группа ( n = 89) Group 2 |
Третья группа ( n = 51) Group 3 |
рχ2 |
|||
|
1 |
2 |
3 |
1–2 |
1–3 |
2–3 |
||
|
КСР ПП (см) |
Исходно Baseline |
4,8 |
2,2 |
0 |
0,381 |
0,111 |
0,281 |
|
RADs (cm) |
Через 24 мес. After 24 months |
0 |
33,0* |
54,0* |
< 0,001# |
< 0,001# |
0,016# |
|
СГДЛА < 25 мм рт. ст. |
Исходно Baseline |
0 |
0 |
0 |
1,0 |
1,0 |
1,0 |
|
PASP < 25 mmHg |
Через 24 мес. After 24 months |
3,3 |
34,1* |
62,0* |
< 0,001# |
< 0,001# |
0,002# |
Примечание: для межгрупповых различий использован критерий хи-квадрат или точный критерий Фишера. Знаком #обозначен необходимый уровень статистической значимости с учетом поправки Бонферони. Статистическая значимость повторных измерений качественных признаков оценивали по критерию МакНемара с поправкой Йетса.
Сокращения: n – число больных, КДР – конечный диастолический размер, ЛЖ – левый желудочек, КСР – конечный систолический размер, КДО – конечный диастолический объем, КСО – конечный систолический объем, ФИ – фракция изгнания, ПЖ – правый желудочек, ЛП – левое предсердие, ПП – правое предсердий, СГДЛА – средний градиент давления в легочной артерии.
Note: n : number of patients, TVI: tricuspid valve insufficiency; LVIDd: left ventricular internal diameter in diastole; LVIDs: left ventricular internal diameter in systole; LVEDV: left ventricular end-diastolic volume; LVESV: left ventricular end-systolic volume; LVEF: left ventricular ejection fraction; RVD: right ventricular basal diameter; LADs: left atrium anterior-posterior diameter in systole; RADs: right atrium anterior-posterior diameter in systole; PASP: pulmonary artery systolic pressure.
Из таблицы 3 видно, что при сопоставимых начальных показателях существенно лучше достижение целевых показателей в третьей группе, в том числе и по сравнению со второй группой, даже с учетом поправки Бонферони. Положительная динамика по критерию МакНемара отмечена практически по всем показателям во второй и третьей группах. В первой группе не достигнуто статистически значимое улучшение по размерам левого и правого предсердий, нормализации СГДЛА, восстановлению синусового ритма.
Представленные данные ЭхоКГ демонстрируют значительные положительные изменения в группе комплексного хирургического лечения по обратному ремоделированию полостей сердца, снижению СГДЛА, увеличению фракции изгнания левого желудочка, восстановлению и сохранности синусового ритма в сравнении с первой и второй группами.
Циркулярная денервация симпатических ганглиев в стволе и устьях легочных артерий после процедуры PADN способствует расслаблению гладкомышечных волокон в сосудистой стенке, что приводит к дилатации артерий и артериол, увеличивая емкость сосудистого русла в малом круге кровообращения, и снижает легочную гипертензию в послеоперационном периоде.
В ходе проведенной работы проанализирована динамика среднего градиента давления в легочной артерии по данным трансторакального ЭхоКГ (рис. 5).
Исходные, значительно худшие показатели легочной гипертензии в третьей группе были уже через 3 мес. после операции сопоставимы с показателями первой и второй групп, а в дальнейшем оказались лучшими показателями среди групп исследования.
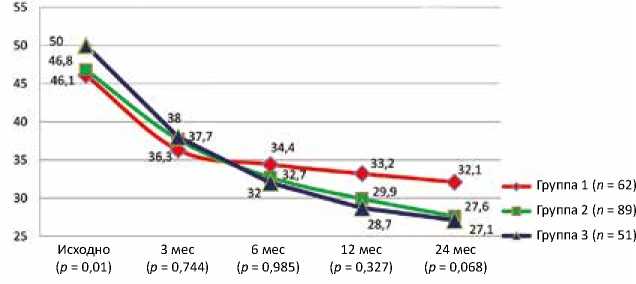
Рис. 5. Динамика легочной гипертензии у пациентов исследуемых групп. Различия между тремя группами здесь и далее рассчитывались по критерию Крускала – Уоллиса
Fig. 5. Dynamics of pulmonary hypertension in patients of the studied groups. Significance of differences between three groups here in further was calculated by Kruskal – Wallis test
Нормализация легочной гипертензии способствовала снижению давления в правых отделах сердца, в первую очередь, в правом желудочке, что имело благоприятный эффект на обратное ремоделирование полости правого желудочка в послеоперационном периоде (рис. 6).
Также значительная исходная дилатация правого желудочка уже через 6 мес. была сопоставима по средним значениям с первой и второй группами, а к 24 мес. зани- мала лидирующее положение среди всех групп исследования.
Сопутствующая недостаточность трикуспидального клапана, которая наблюдалась практически у всех пациентов и была ликвидирована по время операции посредством выполнения пластических реконструкций, также имела положительную динамику в послеоперационном периоде (рис. 7).
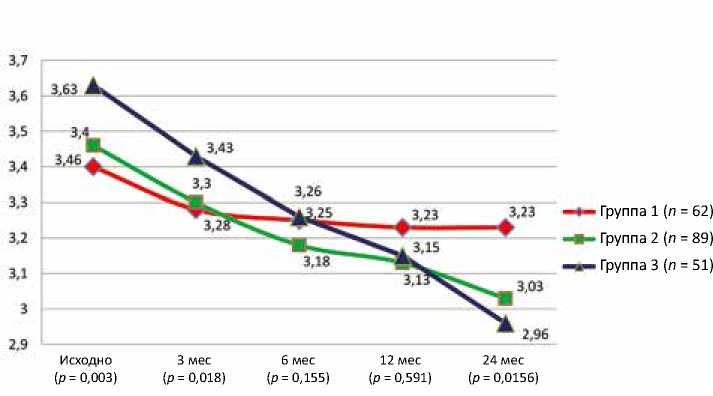
Рис. 6. Динамика обратного ремоделирования полости правого желудочка у пациентов исследуемых групп
Fig. 6. Dynamics of reverse remodeling of the right ventricular cavity in patients of study groups
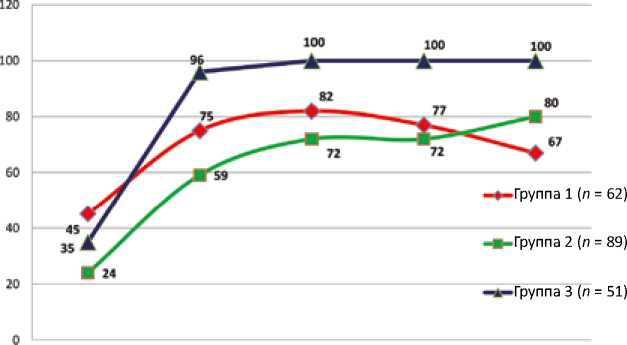
Исходные Через 3 мес Через 6 мес Через 12 мес Через 24 мес значения ( p < 0,001) ( p < 0,001) ( p < 0,001) ( p < 0,001)
( p = 0,137)
Рис. 7. Динамика достижения целевых значений ТН (0-1) в группах исследования. Различия между тремя группами рассчитывались по критерию хи-квадрат (χ2)
Fig. 7. Dynamics of severity of tricuspid insufficiency in study groups. Significance of differences between three groups was calculated by chi-squared test (χ2)
Результаты, представленные на рисунке 7, демонстрируют значительное преимущество комплексного хирургического лечения, примененного в третьей группе, уже через 3 мес. после операции по сравнению с первой и второй группами. Ликвидация трикуспидальной недостаточности на фоне снижения давления в правых отделах сердца способствует уменьшению полости правого предсердия (рис. 8).
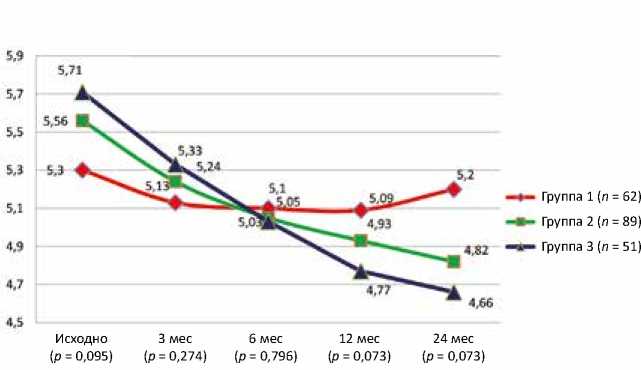
Рис. 8. Динамика обратного ремоделирования полости правого предсердия у пациентов исследуемых групп
Fig. 8. Dynamics of reverse remodeling of the right atrial cavity in patients of study groups
Представленный рисунок 8 демонстрирует лучшую динамику ремоделирования в группе комплексного хирургического лечения (третья группа) – более выраженная дилатация правого предсердия до операции была сопоставима со средними значениями первой и второй групп, а с 12 мес. имела самые лучшие показатели среди групп исследования.
Комплексный хирургический подход в третьей группе повысил эффективность хирургического лечения фибрилляции предсердий, что позволило значительно улучшить результаты восстановления и сохранности синусового ритма в послеоперационном периоде по сравнению с пациентами первой и второй групп (см. табл. 2).
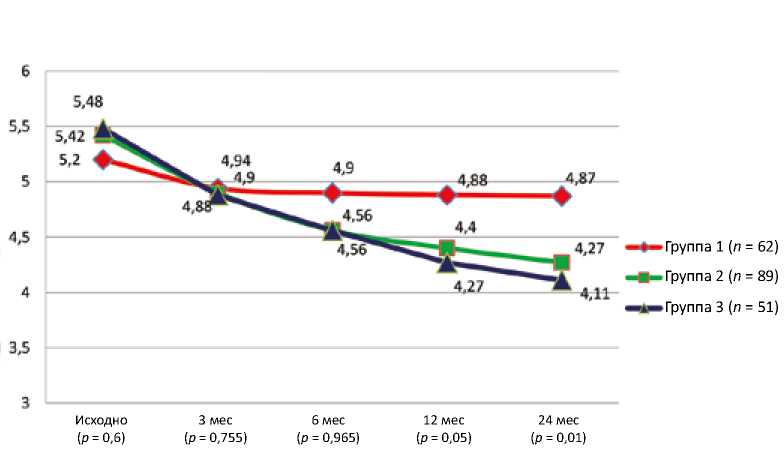
Восстановленный синусовый ритм способствовал лучшему обратному ремоделированию полости левого предсердия (рис. 9).
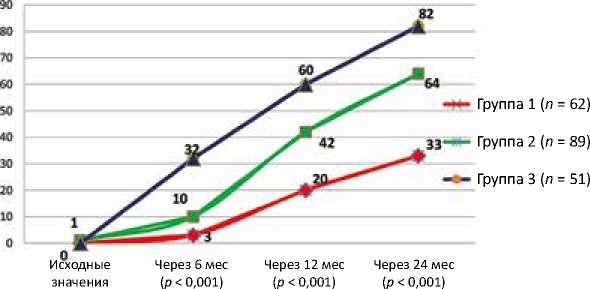
Положительный эффект хирургической коррекции, по данным ЭхоКГ показателей, также отразился на редукции явлений сердечной недостаточности, согласно тесту 6-минутной ходьбы (рис. 10).
Представленные данные демонстрируют значительное снижение сердечной недостаточности в третьей группе уже с 12 мес. после операции по сравнению с пациентами первой и второй групп, что обусловлено положительными изменениями гемодинамических и структурных показателей миокарда.
5,48
5,42 4
5,2 4
4,94 . 4,9
AS?—
4.27
Исходно ( p = 0,6)
3 мес ( p = 0,755)
6 мес ( p = 0,965)
12 мес ( p = 0,05)
24 мес ( p = 0,01)
4,56
4,88
4,27
4,11
-*— Группа 1 ( n
Группа 2 ( n
Группа 3 ( n
= 62)
= 89)
= 51)
Рис. 9. Динамика обратного ремоделирования полости левого предсердия в группах исследования
Fig. 9. Dynamics of reverse remodeling of the cavity of the left atrium in study groups
( p = 0,255)
Рис. 10. Динамика достижения целевого значения ХСН (ФК II) по NYHA в группах исследования Fig. 10. Dynamics of achieving the target values in CHF (NYHA FC II) in study groups
Обсуждение и заключение
Выполненная научно-исследовательская работа наглядно демонстрирует эффективность комплексной хирургической коррекции у пациентов с митральным пороком, фибрилляцией предсердий и выраженной вторичной легочной гипертензией, которым, наряду со стандартным устранением дисфункции митрального клапана и процедурой MAZE IV, была дополнительно выполнена циркулярная процедуры PADN (третья группа). Группы контроля исходно были сопоставимы по основным клинико-инструментальным данным, им также проводилась операция по поводу митрального порока (первая группа) и одномоментное устранение митральной дисфункции и фибрилляции предсердий (вторая группа), но пациентам этих групп не проводили специфического хирургического лечения вторичной легочной гипертензии. Даже при небольшом количестве исследуемых пациентов и отсутствии данных по эффективности процедуры PADN в отдаленном периоде представленные результаты указывают на значительное снижение легочной гипертензии, обратное ремоделирование полостей сердца, а также восстановление и сохранность синусового ритма в послеоперационном периоде и, в конечном итоге, снижение явлений сердечной недостаточности у пациентов третьей группы исследования по сравнению с группами контроля. Достигнутый результат получен не только за счет коррекции митрального порока и восстановления синусового ритма после процедуры Maze IV, но и за счет циркулярной процедуры PADN.
Предложенная методика хирургической коррекции легочной гипертензии проста в техническом исполнении, не занимает много времени и в ходе проведенной исследовательской работы показала себя абсолютно безопасной.
Результатом нашей работы явилась демонстрация эффективности, практической значимости и безопасности предложенной методики. Кроме того, для выполнения процедуры PADN не требуется дополнительных расходных материалов, так как используется тот же радиочастотный деструктор AtriCure, который применяли для хирургической коррекции фибрилляции предсердий. Использование биполярного зажима-деструктора позволяет выполнить радиочастотное воздействие по всей окружности легочных артерий, что имеет преимущество по сравнению с воздействиями только передней стенки ствола и устьев легочных артерий.
На основании полученных данных, можно сделать следующие выводы:
-
1. Циркулярная процедура PADN является эффективной и безопасной, позволяет значительно снизить уровень легочной гипертензии в послеоперационном периоде (рх2 = 0,018 в сравнении с группой без PADN) и способствует обратному ремоделированию полостей сердца.
-
2. Комплексная хирургическая коррекция пациентов с митральной дисфункцией, фибрилляцией предсердий и высокой легочной гипертензией позволяет значительно уменьшить явления сердечной недостаточности (рх2 = 0,023 в сравнении с группой без PADN).
-
3. Необходим дальнейший анализ эффективности радиочастотной денервации легочных артерий с исследованием большего количества больных, анализом отдаленных результатов, а также определение возможностей данной методики у пациентов с неклапанными формами легочной гипертензии.
Список литературы Динамика эхокардиографических показателей после циркулярной процедуры циркулярной радиочастотной денервации ствола и устьев легочных артерий (PADN) у пациентов с пороками митрального клапана, фибрилляцией предсердий и высокой легочной гипертензией
- Iung B., Baron G., Butchart E.G., Delahaye F., Gohlke-Bärwolf C., Levang O.W. et al. A prospective survey of patients with valvular heart disease in Europe: the Euro Heart Survey on Valvular Heart Disease. Eur. Heart J. 2003;24(13):1231-1243. DOI: 10.1016/s0195-668x(03)00201-x
- Goldbarg S.H., Elmariah S., Miller M., Fuster V. Insights into degenerative aortic valve disease. J. Am. Coll. Cardiol. 2007;50(13):1205-1213. DOI: 10.1016/j.jacc.2007.06.024
- Резник Е.В., Шебзухова М.М., Пузенко Д.В., Никитин И.Г. Алгоритмы ведения пациентов с клапанными пороками сердца: ч. 1. Справочник поликлинического врача. 2018;5:61-68.
- Трофимов Н.А., Медведев А.П., Драгунов А.Г., Бабокин В.Е., Никольский А.В., Мизурова Т.Н. и др. Денервация легочного ствола и устьев легочных артерий у пациентов с хирургической коррекцией патологии митрального клапана на фоне высокой легочной гипертензии. Альманах клинической медицины. 2017;45(3):192-199. DOI: 10.18786/2072-0505-2017-45-3-192-199
- Трофимов Н.А., Медведев А.П., Бабокин В.Е., Жамлиханов Н.Х., Драгунов А.Г., Гартфельдер М.В. и др. Эффективность оперативного лечения митральной недостаточности, с фибрилляцией предсердий неишемической этиологии. Медицинский альманах. 2014;5(35):165-169.
- Шипулин В.М., Козлов Б.Н., Кривощеков Е.В., Казаков В.А., Лежнев А.А., Бабокин В.Е., Ватолина Т.В. Морфофункциональная характеристика миокарда пациентов с постинфарктным ремоделированием как возможная причина неблагоприятных результатов оперативного лечения. Грудная и сердечно-сосудистая хирургия. 2009;5:37-41.
- Kim J.S., Lee S.A., Park J.B., Chee H.K., Chung J.W. Preoperative risk factor analysis of postoperative stroke after Cox-maze procedure with mitral valve repair. BMC Cardiovascular Disorders. 2014;14(1):116.
- DOI: 10.1186/1471-2261-14-116
- Бокерия Л.А., Шенгелия Л.Д. Лечение фибрилляции предсердий. Часть II. Сегодняшние реалии и завтрашние перспективы. Анналы аритмологии. 2014;11(2):76-86.
- DOI: 10.15275/annaritmol/2014.2.2
- Тер-Акопян А.В., Ликов В.Ф., Алехин М.Н. Абрамов А.С., Тагаев Н.Б., Гогин Г.Е. Опыт эндоваскулярной имплантации устройства WATCHMAN у больных с фибрилляцией предсердий. Кардиология. 2015;55(9):22-24.
- Сулимов В.А., Лишута А.С. Перспективы лечения пациентов с фибрилляцией предсердий. Рациональная фармакотерапия в кардиологии. 2011;7(3):323-333.
- DOI: 10.20996/1819-6446-2011-7-3-323-333
- Трофимов Н.А., Медведев А.П., Бабокин В.Е., Демарин О.И., Жамлиханов Н.Х., Драгунов А.Г. и др. Улучшение результатов хирургической коррекции сложных нарушений ритма и профилактика их рецидива у кардиохирургических пациентов. Альманах клинической медицины. 2015;38:74-80.
- Железнев С.И., Демидов Д.П., Афанасьев А.В., Назаров В.М., Демин И.И., Богачев-Прокофьев А.В. и др. Радиочастотная денервация легочной артерии при хирургической коррекции диспластических пороков митрального клапана с высокой легочной гипертензией. Российский кардиологический журнал. 2016;11(139):70-72.
- DOI: 10.15829/1560-4071-2016-11-70-72
- Galiè N., Humbert M., Vachiery J., Gibbs S., Lang I., Torbicki A. et al. Рекомендации ESC/ERS по диагностике и лечению легочной гипертензии 2015. Российский кардиологический журнал. 2016;(5):5-64.
- DOI: 10.15829/1560-4071-2016-5-5-64
- Породенко Н.В., Скибицкий В.В., Запевина В.В. Диагностика и лечение первичной легочной гипертензии: современный взгляд на проблему. Кубанский научный медицинский вестник. 2014;3:140- 144.
- Rubin L.J. Current concepts: primary pulmonary hypertension. N. Eng. J. Med. 1997;336(2):111-117.
- DOI: 10.1056/NEJM199701093360207
- Gaine S. Pulmonary Hypertension. JAMA. 2000;284(24):3160-3168.
- Simonneau G., Gatzoulis M.A., Adatia I., Celermajer D., Denton C., Ghofrani A. et al. Updated clinical classification of pulmonary hypertension. J. Am. Coll. Cardiol. 2013;62:D34-D41.
- Трофимов Н.А., Медведев А.П., Бабокин В.Е., Драгунов А.Г., Ефимова И.П., Гартфельдер М.В. и др. Эффективность процедуры PADN у пациентов с высокой легочной гипертензией на фоне дисфункции митрального клапана, осложненной фибрилляцией предсердий, и влияние на сохранность синусового ритма в послеоперационном периоде. Медицинский алфавит. Кардиология. 2018;4(37):18-24.
- Briongos Figuero S., Moya Mur J.L., García-Lledó A., Centella T., Salido L., Aceña Navarro Á. et al. Predictors of persistent pulmonary hypertension after mitral valve replacement. Heart Vessels. 2016;31(7):1091-1099.
- DOI: 10.1007/s00380-015-0700-2
- Osorio J., Russek M. Reflex changes on the pulmonary and systemic pressures elicited by stimulation of baroreceptors in the pulmonary artery. Circ. Res. 1962;10:664-667.
- DOI: 10.1161/01.RES.10.4.664
- Baylen B.G., Emmanouilides G.C., Juratsch C.E., Yoshida Y., French W.J., Criley J.M. Main pulmonary artery distention: a potential mechanism for acute pulmonary hypertension in the human newborn infant. J. Pediatr. 1980;96(3 Pt 2):540-544.
- Juratsch C.E., Jengo J.A., Castagna J., Laks M.M. Experimental pulmonary hypertension produced by surgical and chemical denervation of the pulmonary vasculature. Chest. 1980;77(4):525-530. 10.1378/ Chest.77.4.525.
- DOI: 10.1378/chest.77.4.525
- Guazzi M., Vitelli A., Labate V., Arena R. Treatment for pulmonary hypertension of left heart disease. Current Treatment Options in Cardiovascular Medicine. 2012;14:319-327. 10.1007/s11936- 012-0185-6.
- DOI: 10.1007/s11936-012-0185-6
- Chen S.L., Zhang F.F., Xu J., Xie D.J., Zhou L., Nguyen T. et al. Pulmonary artery denervation to treat pulmonary arterial hypertension: the single-center, prospective, first-in-man PADN-1 study (first-in-man pulmonary artery denervation for treatment of pulmonary artery hypertension). J. Am. Coll. Cardiol. 2013;62(12):1092-1100.
- DOI: 10.1016/j.jacc.2013.05.075
- Богачев-Прокофьев А.В., Железнев С.И., Афанасьев А.В., Фоменко М.С., Демидов Д.П., Шарифулин Р.М. и др. Аблация ганглионарных сплетений легочной артерии при хирургическом лечении пороков митрального клапана у пациентов с высокой легочной гипертензией. Патология кровообращения и кардиохирургия. 2016;19(4):19- 25.
- DOI: 10.21688/1681-3472-2015-4-19-25
- Трофимов Н.А., Медведев А.П., Драгунов А.Г., Никольский А.В., Мизурова Т.Н., Гартфельдер М.В. и др. Способ хирургического лечения вторичной легочной гипертензии у пациентов с хирургической коррекцией патологии митрального клапана. Медицинский альманах. 2017;3(48):33-37. 10.21145/2499-9954-2017-3-33- 37.
- DOI: 10.21145/2499-9954-2017-3-33-37
- Гланц С. Медико-биологическая статистика (пер. с англ.). М.: Практика; 1998:459.


