Динамика микрофлоры желудочно-кишечного тракта телят при применении кормовой добавки
Автор: Лоренгель Т.И., Плешакова В.И., Заболотных М.В., Ковалевская А.А.
Журнал: Вестник Омского государственного аграрного университета @vestnik-omgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 1 (45), 2022 года.
Бесплатный доступ
Желудочно-кишечные болезни телят, проявляющиеся симптомокомплексом диареи, в постнатальный период приводят к значительным экономическим затратам. Ведется постоянный поиск и разработка новых средств и методов профилактики данной патологии. Целью исследования явилось изучение влияния кормовой добавки на микрофлору желудочно-кишечного тракта телят в ранний постнатальный период. Эксперимент проводили в производственных условиях в одном из хозяйств Омской области. По принципу аналогов было сформировано две группы телят (опытная и контрольная) по пять животных в каждой. Животным опытной группы выпаивали с молоком кормовую добавку «Гуматэн», телята контрольной находились на основном рационе. Исследования проводили в два этапа. В начале эксперимента на первом этапе от всех животных (опытных и контрольных) были взяты пробы фекалий из прямой кишки для изучения микробиоценоза пищеварительного тракта в постнатальном периоде. На втором этапе исследований, после завершения эксперимента по применению препарата, вторично были отобраны пробы для изучения качественного и количественного состава микрофлоры желудочно-кишечного тракта животных. Микробиологические исследования проб проведены согласно принятым методическим рекомендациям. Были изучены основные биологические свойства выделенных микроорганизмов, определена их устойчивость к антибактериальным препаратам. В результате эксперимента установлено положительное влияние кормовой добавки «Гуматэн» на микрофлору желудочно-кишечного тракта телят в постнатальном периоде. После курса выпаивания препарата у телят опытной группы отмечены уменьшение количества условно патогенной микрофлоры и отсутствие энтеропатогенных Escherichia coli , а также увеличение непатогенных штаммов кишечной палочки.
Кормовая добавка, микрофлора, телята, желудочно-кишечный тракт
Короткий адрес: https://sciup.org/142234378
IDR: 142234378 | УДК: 636.2:6.085:579
Текст научной статьи Динамика микрофлоры желудочно-кишечного тракта телят при применении кормовой добавки
Одной из проблем современного животноводства для всех видов сельскохозяйственных животных является обеспечение высокой сохранности молодняка, особенно телят в ранний постнатальный период [1]. В общей структуре патологий молодняка крупного рогатого скота ведущее место занимают желудочно-кишечные болезни, проявляющиеся симптомокомплексом диареи и приводящие к задержке развития больного теленка, замедлению прироста живой массы, значительным материальным затратам на кормление таких телят и проведение лечебно-профилактических мероприятий [2].
Качественный и количественный состав микроорганизмов в кишечнике телят до первого приема молозива схож с микробиологическим статусом родовых путей матерей [3]. В организм новорожденных попадают разнообразные микроорганизмы, как полезные и безвредные, так и условно патогенные и патогенные. Равновесие микрофлоры новорожденного животного неустойчивое, легко может нарушиться даже при незначительной стрессовой ситуации [4]. В результате наблюдается интенсивное развитие условно патогенной и патогенной микрофлоры, проявляющееся в первую очередь расстройством пищеварения [5].
Несмотря на значительное количество исследований, связанных с проблемой желудочно-кишечных болезней телят, она до сих пор не решена, о чем свидетельствуют их высокая заболеваемость и гибель [6].
Для профилактики желудочно-кишечных болезней проводится постоянный поиск новых препаратов и способов их применения [7]. Перспективным направлением в области терапии и профилактики желудочно-кишечных патологий молодняка является нормализация микрофлоры [8].
Цель работы – изучить влияние препарата «Гуматэн» на микрофлору желудочнокишечного тракта телят в ранний постнатальный период.
Материалы и методы
Исследования проводили в производственных условиях в одном из хозяйств Омской области. Объектом исследований служили телята с 2-дневного возраста голштинской и красной степной голштинизированной пород, из которых по принципу аналогов были сформированы две группы по пять голов в каждой (опытная и контрольная). Животные находились в одинаковых условиях содержания (индивидуальные клетки, имеющие толстый слой сухой пшеничной или ржаной соломы) и кормления (двукратно выпойка молозива через 1,5–2 и 10 ч после рождения). Затем выпаивали сквашенное молоко со 2-е по 10-е сут, в последующем телята были переведены на трехразовый рацион питания. В возрасте 1–1,5 недель в рацион вводят овес и постепенно дробленку. Телятам опытной группы (n = 5) выпаивали препарат «Гуматэн» (предварительно размешивая его в молоке) два раза в день в дозе 0,5–1 мл/кг массы тела в течение 5 дней подряд (табл. 1). Телята контрольной группы (n = 5) находились на обычном рационе.
Vestnik Omsk SAU, 2022, no. 1(45)
VETERINARY AND ZOOTECHNY
Таблица 1
Схема применения препарата «Гуматэн» для профилактики заболеваний желудочно-кишечного тракта у телят
|
Кол-во голов |
Препарат |
Кратность, дозы и метод введения |
Кратность введения препарата (сут) |
|
Опытная группа |
|||
|
n = 5 |
Гуматэн |
Двукратно в дозе 0,5–1 мл/кг массы тела, внутрь с молоком |
1, 2, 3, 4, 5-е, в течение 5 сут |
Гуматэн представляет кормовую добавку, полученную из переработанного сырья природного происхождения; в его составе гувитан, пропиленгликоль и янтарная кислота. Биологически активные вещества оказывают на организм молодняка общее стимулирующее (тонизирующее) действие за счет содержащихся в гидролизате комплексов органо-минеральных веществ сложной структуры, обеспечивающих активацию защитных механизмов организма, оптимизацию процессов пищеварения и всасывания компонентов рациона.
По данным производителя, гуматы улучшают работу пищеварительного тракта. С одной стороны, гуматэн действует как энтеросорбент и выводит из организма токсичные соединения, с другой, улучшает усвоение питательных веществ и активизирует микрофлору кишечника. В совокупности эти эффекты нормализуют работу пищеварительного тракта, повышаются коэффициент переваривания корма и сопротивляемость организма к неблагоприятным факторам.
Пропиленгликоль, входящий в состав гуматэна, – наиболее изученная глюкоген-ная добавка, некоторые исследователи отмечают, что у него могут присутствовать антибактериальные и противогрибковые эффекты. Оказывается бактерицидное действие и на ряд бактерий, в том числе на E. coli.
Янтарную (сукциновую) кислоту относят к группе двухосновных предельных карбоновых кислот. Она участвует в ряде биохимических реакций энергетического, структурного и ферментного обеспечения организма, стимулирует рост животных и повышает резистентность их организма.
Исследования проводили в два этапа. На первом этапе в начале эксперимента от всех животных (опытных и контрольных) были взяты пробы фекалий из прямой кишки для изучения микробиоценоза пищеварительного тракта в постнатальном периоде. На втором этапе, после завершения применения препарата, вторично были отобраны пробы для изучения качественного и количественного состава микрофлоры желудочнокишечного тракта.
Материалом для бактериологического исследования являлись пробы фекалий, которые отбирали из прямой кишки с помощью стерильных тупферов. Пробы помещали в транспортную среду и в сумке-холодильнике доставляли в лабораторию. Бактериологические исследования проводили на базе БУ «Омская областная ветеринарная лаборатория».
Выделение, культивирование, идентификацию и количественный учет полезных, условно патогенных и патогенных микроорганизмов желудочно-кишечного тракта телят осуществляли согласно методическим указаниям [9].
Для количественного подсчета пробы фекалий разводили физиологическим раствором в соотношении 1 : 10, затем готовили ряд последовательных разведений от 10–1 до 10–8 [10]. Посев биоматериала проводили на простые, специальные и дифференциально-диагностические питательные среды: МПА (мясо-пептонный агар), МПБ (мясопептонный бульон), кровяной агар, агар Эндо, Плоскирева, лактобакагар и бифидоагар, ВСА (висмут-сульфит агар), солевой агар и среду Сабуро. Культивирование осуществ-
Vestnik Omsk SAU, 2022, no. 1(45)
VETERINARY AND ZOOTECHNY ляли при температуре 30–37°С в течение 24–48 ч с последующим выделением чистых культур. У колоний, выросших на плотных питательных средах, описывали размер, форму, края, цвет, профиль, структуру, консистенцию, поверхность, наличие или отсутствие блеска. На жидких средах отмечали прозрачность, характер придонного и поверхностного роста микроорганизмов. Морфологические и тинкториальные свойства изучали в мазках-препаратах, окрашенных по Граму, наличие капсул и спор – по Ольту и Шефферу – Фултону, подвижность – в препаратах «висячая капля» [11].
Ферментативные свойства выделенных культур энтеробактерий определяли с использованием тест-системы Rapid для биохимической идентификации энтеробактерий. Тест-система основана на микрообъемной технологии с использованием жидких дифференциальных сред, содержащих только те субстраты, ферментация которых бактериями завершается немедленно или при инкубации в течение 4 ч. Сокращение сроков исследования достигается также за счет большой посевной дозы бактерий и малого объема среды. Система состоит из прозрачной полимерной пластинки с 20 микропробирками с дегидратированными субстратами для определения 20 тестов. Результаты учитывают визуально по изменению окраски среды через 4 ч инкубации при 36°С. Идентифицируют бактерии по результатам тестов по специальной таблице.
Определение чувствительности выделенных микроорганизмов к химиотерапевтическим препаратам проводили диско-диффузионным методом с использованием агара Гивенталя – Ведьминой (АГВ) и стандартных бумажных дисков, пропитанных антимикробными препаратами, руководствуясь клиническими рекомендациями по определению чувствительности микроорганизмов к антимикробным препаратам (Москва, 2015) и в соответствии с МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам».
Патогенность выделенных культур микроорганизмов определяли при посеве на кровяной агар и постановкой биопробы на лабораторных животных: внутрибрюшинно вводили 0,5 мл бактериальной суспензии в концентрации 0,5 ∙ 109 м.т./мл. Контрольным животным вводили 0,5 мл стерильного 0,9%-ного физиологического раствора, срок наблюдения – 5 сут.
Результаты исследований
На первом этапе исследования микрофлоры желудочно-кишечного тракта телят нами был определен видовой и количественный состав микроорганизмов, представленный бифидо-, лактобактериями, стафилококками, эшерихиями и протеем (табл. 2).
Таблица 2
Видовая и количественная характеристика состава кишечной микрофлоры молодняка КРС (2-4-сут телята) до применения препарата, КОЕ/г
|
№ теленка |
Bifidobacterium spp. |
Lactobacillus spp. |
E. coli |
Staphylococcus spp. |
Proteus spp |
|
Опытная группа |
|||||
|
318 |
107 |
106 |
4,9 ∙ 105 |
1 ∙ 103 |
1 ∙ 104 |
|
316 |
108 |
107 |
2,4 ∙ 107 |
– |
1 ∙ 103 |
|
324 |
106 |
106 |
1,8 ∙ 106 |
>1 ∙ 105 |
– |
|
23320 |
106 |
106 |
1,4 ∙ 105 |
1 ∙ 102 |
1 ∙ 103 |
|
317 |
109 |
107 |
1,4 ∙ 108 |
– |
– |
|
Контрольная группа |
|||||
|
313 |
108 |
106 |
1,3 ∙ 106 |
>1 ∙ 105 |
1 ∙ 104 |
|
21316 |
106 |
106 |
4,8 ∙ 104 |
1 ∙ 103 |
1 ∙ 103 |
|
21329 |
108 |
106 |
5,7 ∙ 106 |
1 ∙ 103 |
1 ∙ 103 |
|
333 |
106 |
107 |
5,1 ∙ 105 |
– |
1 ∙ 103 |
|
21328 |
109 |
107 |
4,3 ∙ 106 |
– |
– |
Vestnik Omsk SAU, 2022, no. 1(45)
VETERINARY AND ZOOTECHNY
Так, микрофлора фекалий исследуемых телят, не подверженных влиянию препарата, была представлена Bifidobacterium spp .: 106–109 КОЕ/г, Lactobacillus spp. : 106–107 КОЕ/г, в целом это соответствует нормативным показателям. Содержание Escherichia coli – в пределах от 5,7 ∙ 106 до 1,3 ∙ 106 КОЕ/г.
У исследуемых телят (возраст – 2–4 сут.) отмечали увеличение количества условно патогенной микрофлоры, а именно Staphylococcus spp .: у трех животных (30%) это показатель верхней границы нормы – 1 ∙ 103 КОЕ/г, а у двух (20%) – более 1 ∙ 105 КОЕ/г, у одного теленка опытной группы выделена патогенная культура Escherichia coli О115. У семи животных выделены микроорганизмы рода Proteus: 1 ∙ 103–1 ∙ 104 КОЕ/г, представленные видами P. mirabilis (57%) и P. vulgaris (43%).
Идентификацию выделенных культур проводили с учетом характера роста на плотных и жидких питательных средах и биохимических свойств. Так, культуры Escherichia coli при культивировании на МПБ вызывали помутнение среды с образованием осадка, который легко разбивался при встряхивании пробирки.
На МПА через 24 ч появлялись сочные, круглые, выпуклые, с ровными краями и гладкой поверхностью (S-форма) серо-белого цвета колонии диаметром 2–3 мм.
На среде Эндо лактозопозитивные штаммы E. coli образовывали колонии темновишневого цвета с металлическим блеском (рис. 1).
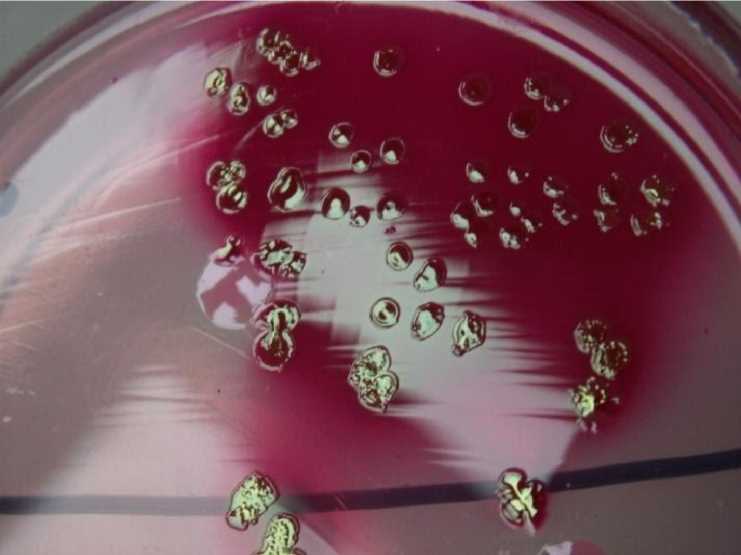
Рис. 1. Культура Escherichia coli. , выделенная из фекалий теленка № 317 (агар Эндо, +37°, 24 ч)
Бактерии рода Proteus на МПБ образовывали поверхностную пленку, на МПА был выражен феномен роения – вуалеобразный налет в виде концентрических колец роста по периферии центральной колонии. Поверхность таких колоний была покрыта тонким слоем налета с голубоватым оттенком.
На среде Плоскирева протей формировал изолированные, крупные, правильной формы, слегка выпуклые, полупрозрачные колонии желтовато-розового цвета (рис. 2).
Vestnik Omsk SAU, 2022, no. 1(45)
VETERINARY AND ZOOTECHNY
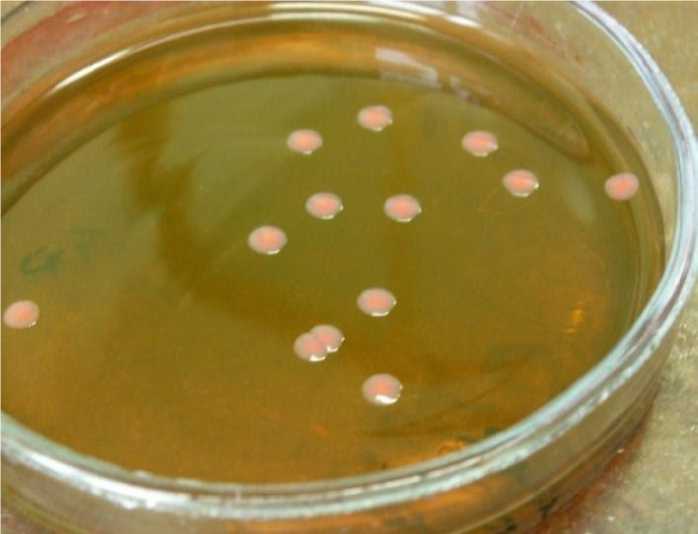
Рис. 2. Культура Proteus mirabilis, выделенная из фекалий теленка № 313 (агар Плоскирева, +37°, 24 ч)
Микроорганизмы рода Staphylococcus spp. на МПБ после 48 ч инкубирования образовывали помутнение и слизистый осадок на дне пробирки, на плотных питательных средах – круглые гладкие блестящие колонии желтого или белого цвета (рис. 3)
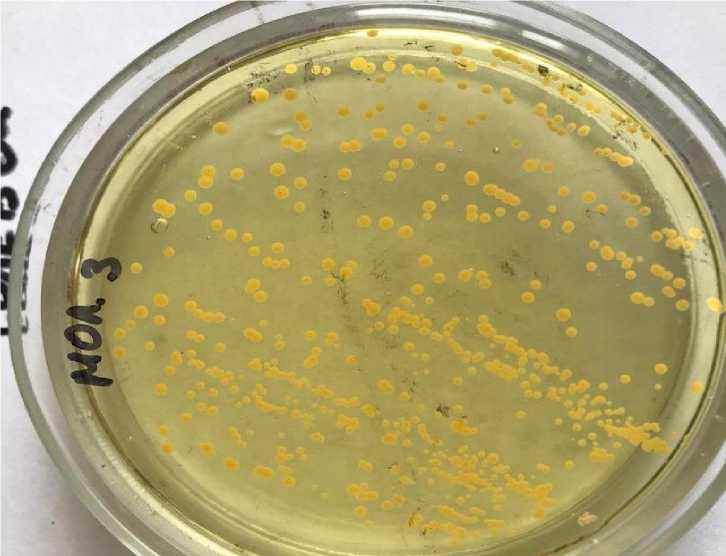
Рис. 3. Культура Staphylococcus spp., выделенная из фекалий теленка № 324 (солевой агар, +37°, 24 ч)
Vestnik Omsk SAU, 2022, no. 1(45)
VETERINARY AND ZOOTECHNY
Для определения патогенности выделенных микроорганизмов проводили биопробу на лабораторных животных. На заражение одной культуры использовали три особи (три особи – контроль).
При патолого-анатомическом вскрытии трупов мышей, зараженных культурами E. coli (серовариант О 115), обнаруживали кровоизлияния в подкожной клетчатке и кишечнике, увеличение печени и селезенки, острое расширение сердца, абсцесс в месте введения суспензии и в паренхиматозных органах (печень, легкие, селезенка, почки).
У погибших лабораторных мышей, зараженных культурами Proteus spp., отмечали кровоизлияния в подкожной клетчатке и кишечнике, наличие крови в брюшной полости, увеличение селезенки, единичные абсцессы в кишечнике и почках.
При вскрытии трупов мышей, зараженных культурами Staphylococcus spp., обнаруживали точечные кровоизлияния в подкожной клетчатке, дистрофию почек, серозный спленит, некрозы в селезенке и печени, острое расширение сердца.
Все культуры E. coli и Staphylococcus spp. при посеве на кровяной агар вызывали гемолиз эритроцитов (рис. 4). Изолированные микроорганизмы рода Proteus spp. гемолитической активностью не обладали.
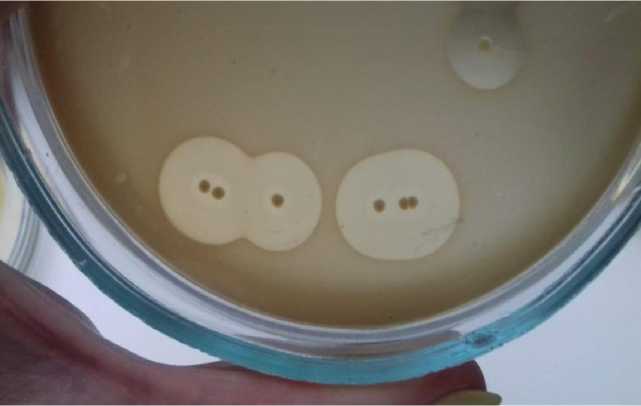
Рис. 4. Культура Escherichia coli , выделена от теленка № 317 β-гемолиз (кровяной агар, +37°, 24 ч)
При определении чувствительности патогенных микроорганизмов, выделенных из проб фекалий, использовали антибактериальные препараты различных фармакологических групп: фторхинолоны (пефлоксацин, ципрофлоксацин, энрофлоксацин и левофлоксацин), аминогликозиды (канамицин, гентамицин, амикацин и стрептомицин), тетрациклины (докси- и тетрациклин), цефолоспорины (цефуроксин и цефалексин), а также макролиды (азитромицин) и пенициллины (амоксиклав).
Установлено, что эффективность в отношении E. coli проявило большинство исследуемых антибиотиков (66,7%). Выявлена высокая активность двух препаратов – амоксициллина и левофлоксацина (табл. 3).
Микроорганизмы рода Proteus spp. обладали менее выраженной чувствительностью к антибактериальным препаратам по сравнению с E. coli, определена 100%-ная устойчивость к доксициклину, пефлоксацину, цефуроксиму и амоксиклаву.
Vestnik Omsk SAU, 2022, no. 1(45)
VETERINARY AND ZOOTECHNY
Такая же тенденция отмечена и у стафилококков, они проявляли резистентность к гентамицину, доксициклину, канамицину, амикацину, стрептомицину и фосфомицину (табл. 3).
Таблица 3
Чувствительность выделенных культур к антибактериальным препаратам
|
Препарат |
E. coli |
P. mirabilis |
P. vulgaris |
Staphylococcus spp. |
|
Гентамицин |
13 (–) |
0 (–) |
20 (+) |
0 (–) |
|
Доксициклин |
17 (ум.) |
0 (–) |
0 (–) |
0 (–) |
|
Канамицин |
16 (ум.) |
12 (–) |
0 (–) |
0 (–) |
|
Пефлоксацин |
21 (ум.) |
0 (–) |
0 (–) |
8 (–) |
|
Тетрациклин |
0 (–) |
11 (–) |
9 (–) |
26 (+) |
|
Амикацин |
20 (+) |
16 (ум.) |
20 (+) |
0 (–) |
|
Ципрофлоксацин |
– |
17 (ум.) |
0 (–) |
31 (+) |
|
Стрептомицин |
30 (+) |
10 (–) |
0 (–) |
0 (–) |
|
Цефуроксим |
30 (+) |
0 (–) |
0 (–) |
4 (–) |
|
Энрофлоксацин |
40 (+) |
– |
– |
32 |
|
Цефалексин |
26 (+) |
18 (ум.) |
15 (ум.) |
14 (ум.) |
|
Азитромицин |
13 (+) |
– |
– |
22 (+) |
|
Фосфомицин |
12 (–) |
17 (+) |
0 (–) |
0 (–) |
|
Левофлоксацин |
40 (+) |
16 (ум.) |
0 (–) |
19 (+) |
|
Амоксиклав |
12 (–) |
0 (–) |
0 (–) |
18 (ум.) |
Примечание . (+) – культура чувствительна; (–) – культура не чувствительна; (ум.) – умеренная чувствительность
При микробиологическом исследовании проб фекалий от телят опытной и контрольной групп после применения препарата «Гуматэн» установлены изменения как в качественном, так и в количественном составе микрофлоры кишечника (табл. 4).
Таблица 4
Видовые и количественные характеристики состава кишечной микрофлоры молодняка КРС до/после применения препарата, КОЕ/г
|
№ теленка |
Bifidobacterium spp. |
Lactobacillus spp. |
E. coli |
Staphylococcus spp. |
Proteus spp. |
|||||
|
до |
после |
до |
после |
до |
после |
до |
после |
до |
после |
|
|
Опытная группа |
||||||||||
|
318 |
107 |
108 |
106 |
106 |
4,9 ∙ 105 |
5,1 ∙ 106 |
1 ∙ 103 |
1 ∙ 103 |
1 ∙ 104 |
1 ∙ 102 |
|
316 |
108 |
108 |
107 |
107 |
2,4 ∙ 107 |
2,6 ∙ 107 |
– |
– |
1 ∙ 103 |
1 ∙ 102 |
|
324 |
106 |
108 |
106 |
106 |
1,8 ∙ 106 |
2,6 ∙ 106 |
>1 ∙ 105 |
1 ∙ 102 |
– |
– |
|
23320 |
106 |
106 |
106 |
107 |
1,4 ∙ 105 |
2,1 ∙ 106 |
1 ∙ 102 |
1 ∙ 102 |
1 ∙ 103 |
1 ∙ 102 |
|
317 |
109 |
108 |
107 |
107 |
1,4 ∙ 108 |
1,8 ∙ 108 |
– |
– |
– |
– |
|
Контрольная группа |
||||||||||
|
313 |
108 |
108 |
106 |
106 |
1,3 ∙ 106 |
1,8 ∙ 106 |
>1 ∙ 105 |
1 ∙ 105 |
1 ∙ 104 |
1 ∙ 105 |
|
21316 |
106 |
108 |
106 |
106 |
4,8 ∙ 104 |
4,5 ∙ 104 |
1 ∙ 103 |
1 ∙ 103 |
1 ∙ 103 |
1 ∙ 105 |
|
21329 |
108 |
108 |
106 |
106 |
5,7 ∙ 106 |
5,7 ∙ 106 |
1 ∙ 103 |
1 ∙ 103 |
1 ∙ 103 |
1 ∙ 102 |
|
333 |
106 |
108 |
107 |
107 |
5,1 ∙ 105 |
5,1 ∙ 105 |
– |
– |
1 ∙ 103 |
1 ∙ 102 |
|
21328 |
109 |
109 |
107 |
107 |
4,3 ∙ 106 |
4,6 ∙ 106 |
– |
– |
– |
1 ∙ 102 |
При проведении количественной оценки разных видов микроорганизмов, выделяемых с фекалиями, мы наблюдали, что резидентная микрофлора в кишечнике телят представлена бифидо-, лактобактериями, а факультативная – непатогенными штаммами кишечной палочки, условно патогенными энтеробактериями, сапрофитными стафилококками и протеем.
Vestnik Omsk SAU, 2022, no. 1(45)
VETERINARY AND ZOOTECHNY
Препарат «Гуматэн» (опытная группа) после курса выпаивания не повлиял на количество полезных бактерий ( Bifidobacterium spp. и Lactobacillus spp.) кишечника телят в целом, их количество осталось на прежнем уровне.
Известно, что бифидо- и лактобактерии являются двумя основными бактериями, населяющими кишечник, которые оказывают определяющее влияние на формирование иммунной системы. Бифидобактерии, активно размножаясь и колонизируя поверхность слизистой кишечника, создают биопленку, препятствуя прикреплению и размножению условно патогенных и патогенных бактерий. Антагонистическая активность бифидобактерий связана с образованием лактата, ацетата, лизоцимоподобных и других веществ с антибактериальной активностью. Они способны подавлять токсинообразование и разрушать токсины патогенных бактерий и кормов. Лактобактерии выполняют функцию катализатора в физиологических процессах, происходящих в кишечнике. Важная функция лактобацилл – это синтезирование протеолитических ферментов, которые расщепляют углеводы, белки и жиры. Обусловлена антагонистическая активность лактобактерий синтезом органических кислот и бактериоцинов, которые фиксируются на рецепторах возбудителей, изменяя структуру и проницаемость клеточной стенки бактерий, вызывая ее лизис.
При выпаивании препарата у всех опытных животных отмечено повышение количества штаммов непатогенной Escherichia coli . Непатогенные штаммы кишечной палочки, являясь обычными обитателями кишечника, приносят пользу организму хозяина, например, синтезируя витамин K, а также предотвращая развитие патогенных микроорганизмов.
В контрольной группе изменений в количественном составе Escherichia coli не наблюдали, минимальное содержание – 4,5 ∙ 104 КОЕ/г, при нормативных показателях 1 ∙ 106–1 ∙ 107 КОЕ/г, у одного теленка была выделена патогенная культура Escherichia coli О41.
Количество условно патогенной микрофлоры, а именно Staphylococcus spp ., осталось без существенных изменений в ректальных смывах телят всех групп.
У телят опытной группы количество микроорганизмов рода Proteus в ректальных смывах снизилось в 10–20 раз у 60% (3 гол), а у 40% телят (2 гол) микроорганизмы не были обнаружены. У всех животных контрольной группы увеличилось содержание этих микроорганизмов до максимального – 1 ∙ 105 КОЕ/г.
Заключение
Таким образом, после курса выпаивания препарата «Гуматэн» оказано положительное влияние на микробиоценоз желудочно-кишечного тракта телят. Его применение привело к уменьшению количества условно патогенных микроорганизмов и отсутствию энтеропатогенных Escherichia coli .
Список литературы Динамика микрофлоры желудочно-кишечного тракта телят при применении кормовой добавки
- Люсин, Е.А. Сохраним здоровье телят: лечение и профилактика заболеваний желудочно-кишечного тракта / Е.А. Люсин. - Текст : непосредственный // Молочное и мясное скотоводство. -2017. - № 6. - С. 36-37.
- Этиология возникновения гастроэнтеритов молодняка сельскохозяйственных животных в условиях Амурской области / Е.В. Курятова, М.В. Герасимова, О.Н. Тюкавкина [и др.]. - Текст : электронный // Дальневосточный аграрный вестник. - 2018. - № 1. - С. 45. - URL: https://cyberleninka.ru/article/n/etiologiya-vozniknove-niya-gastroenteritov-molodnyaka-selskohozyaystvennyh-zhivotnyh-v-usloviyah-amurskoy-oblasti (дата обращения: 10.02.2022).
- Леонтьев, Л. Способ профилактики диа-рейных болезней новорожденных телят / Л. Леонтьев, Г. Тихонова. - Текст : непосредственный // Ветеринария сельскохозяйственных животных. -2012. - № 5. - С. 47-51.
- Мищенко, В.А. Структура заболеваний пищеварительной системы новорожденных телят / В.А. Мищенко. - Текст : непосредственный // Ветеринария. - 2005. - № 5. - С. 21-24.
- Конищева, А.С. Микробиом кишечника телят при дисбактериозе / А.С. Конищева, В.И. Плешакова, Н.А. Лещева. - Текст : электронный // Вестник Омского государственного аграрного университета. - 2021. - № 3(43). - С. 70-77. - ULR: https://www.omgau.ru/upload/iblock/835/8_43.pdf (дата обращения: 04.02.2022).
- Zholdasbekova, A.Y., Biyashev, K.V., Biya-shev, B.K. and et al. (2018), "Prevalence of enteric infection pathogens in young cattle in Kazakhstan", Modern science, pp. 20-21.
- Лоренгель, Т.И. Научно-практическое обоснование применения пробиотического препарата при выращивании телят / Т.И. Лоренгель, B.И. Плешакова, А.В. Конев. - Текст : непосредственный // Инновации в научно-техническом обеспечении агропромышленного комплекса России : материалы Всероссийской (национальной) научно-практической конференции. - Курск, 2020. - C. 325-329.
- Панин, А.Н. Пробиотики в животноводстве - состояние и перспективы / А.Н. Панин, Н.И. Малик, О.С. Илаев. - Текст : непосредственный // Ветеринария. - 2012. - № 3. - С. 3-8.
- Выделение и идентификация бактерий желудочно-кишечного тракта животных : методические рекомендации : [утверждены Минсельхоз России от 11.05.2004 г.]. - Москва, 2004. - 81 с. -Текст : электронный. - ULR: https://files.stroyinf.ru/ Data2/1/4293723/4293723844.pdf (дата обращения: 08.02.2022).
- Методические указания по бактериологической диагностике смешанной кишечной инфекции молодняка животных, вызываемой патогенными энтеробактериями : [утверждены Мин-сельхоз России от 11.10.1999 г.]. - Москва, 1999. -21 с. - Текст : электронный. - ULR: http://gov. cap.ru/home/65/aris/bd/vetzac/document/316.html (дата обращения: 08.02.2022).
- Методическим указаниям по бактериологической диагностике колибактериоза (эшерихиоза) животных : [утверждены Минсельхоз России от 27.07.2000 г.]. - Москва, 2000. - 17 с. -Текст : электронный. - ULR: https://files.stroyinf.ru/


