Динамика параметров механики левого желудочка после стентирования коронарных артерий у больных стабильной ишемической болезнью сердца
Автор: Гладких Наталья Николаевна, Павлюкова Елена Николаевна, Баев Андрей Евгеньевич, Карпов Ростислав Сергеевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.31, 2016 года.
Бесплатный доступ
Цель: оценить механику левого желудочка (ЛЖ) у больных стабильной ишемической болезнью сердца (ИБС) после стентирования коронарных артерий (КА). Материал и методы. В исследование включено 52 пациента со стабильной ИБС в возрасте 58,16±8,94 лет с фракцией выброса (ФВ) ЛЖ 55% и более. По показаниям всем пациентам проведено стентирование КА. Syntax Score не превышал 22 усл. ед. До и в течение 1-7 дней (медиана - Ме=4 дня) после стентирования КА всем пациентам выполнены двухмерная эхокардиография (ЭхоКГ), технология “след пятна” для оценки глобальной деформации ЛЖ в продольном направлении (GLSLV), глобальной ротации, скорости глобальной ротации в систолу и в раннюю диастолу на уровне митрального клапана (МК), папиллярных мышц (ПМ) и верхушки ЛЖ, скручивания, раскручивания и поворота по оси ЛЖ. Всем пациентам производилась количественная оценка уровней тропонина I и МВ-фракции креатинфосфокиназы (КФК МВ) до вмешательства, через 6 и 24 ч после стентирования. Результаты. До стентирования КА у 22 больных отмечалась GLSLV в пределах нормы (более -18,0%), у 30 больных наблюдалось снижение GLSLV (менее -18%). У пациентов с исходно сниженной GLSLV отмечалось более позднее наступление пика ротации ЛЖ на уровне ПМ и верхушки ЛЖ. После стентирования КА выявлены пациенты с улучшением и ухудшением GLSLV. По величине ротации, скручивания, раскручивания, поворота по оси ЛЖ пациенты с ухудшением и улучшением GLSLV не различались. В группе исходно сниженной GLSLV у пациентов с ухудшением ее после чрескожного вмешательства (ЧКВ) наблюдалось укорочение времени до пика ротации в раннюю диастолу на уровне МК (509,500±68,288 мс, Ме=505,500 vs 479,889±49,549 мс, Ме=488,000 мс; р=0,04), более позднее наступление пика скорости глобальной апикальной ротации ЛЖ в систолу (246,13±164,19 мс; Ме=189,50 мс vs 126,14±52,31 мс; Ме=126,00; U=9,500, Zadj=2,094; р=0,03) и сниженная скорость глобальной апикальной ротации в раннюю диастолу (-17,70±22,25; Ме=-23,52 vs-52,65±24,11; Ме=-45,94; U=5,000, Zadj=2,604; р=0,009) в сравнении с пациентами с улучшением GLSLV. В группе ухудшения GLSLV обнаружено повышение уровней тропонина I через 24 ч и КФК МВ - через 6 и 24 ч после стентирования КА. Выводы: 1. После стентирования КА у 24 (46,15%) больных выявлено ухудшение глобальной деформации ЛЖ в продольном направлении. 2. Ухудшение глобальной деформации ЛЖ в продольном направлении ассоциировано с повышением уровня кардиоспецифических ферментов у пациентов со стабильной ИБС после стентирования КА, что, по нашему мнению, обусловлено эмболией микрососудистого русла во время проведения стентирования КА. 3. Удлинение времени до пиковой апикальной ротации и ротации на уровне ПМ в систолу является показателем ухудшения механики ЛЖ. 4. У пациентов, имевших нарушение глобальной деформации ЛЖ в продольном направлении и при ее ухудшении после стентирования КА, наблюдается снижение скорости апикальной ротации и увеличение времени до пика верхушечной ротации в систолу и раннюю диастолу.
Ишемическая болезнь сердца, ротация левого желудочка, скручивание левого желудочка, поворот по оси левого желудочка, стентирование коронарных артерий
Короткий адрес: https://sciup.org/14920103
IDR: 14920103
Текст научной статьи Динамика параметров механики левого желудочка после стентирования коронарных артерий у больных стабильной ишемической болезнью сердца
Согласно Европейским рекомендациям [1], технология “след пятна” (Speckle Tracking Imaging – 2D Strain) и оценка глобальной деформации ЛЖ в продольном направлении показаны в рутинной клинической практике. Имеющиеся на сегодняшний день публикации касаются динамики глобальной деформации ЛЖ в продольном направлении у больных острым инфарктом миокарда (ИМ) с подъемом сегмента ST после стентирования КА, тромболитической терапии и в оценке прогноза ремоделирования ЛЖ после эндоваскулярного вмешательства [2]. Практически не освещен вопрос о деформации ЛЖ в продольном направлении после стентирования КА у пациентов со стабильной формой ИБС.
Следует отметить, что с помощью технологии “след пятна” (Speckle Tracking Imaging – 2D Strain) можно оценить не только глобальную деформацию ЛЖ в продольном направлении, но и такие показатели контрактильности ЛЖ, как ротация ЛЖ на уровне базальных и верху- шечных сегментов, ПМ, скручивание и поворот по оси ЛЖ. Кроме того, для оценки диастолической функции ЛЖ возможно определение раскручивания ЛЖ и времени до пика раскручивания ЛЖ [3].
Резюмируя вышеизложенное, необходимо отметить, что данные, касающиеся динамики глобальной деформации ЛЖ в продольном направлении, ротации, скручивания, раскручивания и поворота по оси ЛЖ у больных стабильной ИБС, подвергшихся эндоваскулярной реваскуляризации, отсутствуют.
Цель исследования: оценить механику ЛЖ у больных стабильной ИБС после стентирования КА.
Материал и методы
Исследование выполнено у 52 пациентов со стабильной ИБС (из них 41 мужчина) в возрасте 58,16±8,94 лет (Ме=58 лет). Клиническая характеристика пациентов представлена в таблице.
Таблица
Клиническая характеристика пациентов со стабильной ИБС до стентирования КА
|
Показатели |
M±SD |
Me |
Нижняя -Верхняя квартиль |
|
Возраст, годы |
58,16±8,94 |
58,00 |
56,00–65,00 |
|
Половое соотношение: м./ж. |
41/11 |
||
|
АГ, n (%) |
45 (86,54%) |
||
|
Постинфарктный кардиосклероз, n (%) |
25 (48,07%) |
||
|
Сахарный диабет, 2-й тип, n (%) |
17 (32,69%) |
||
|
Нарушение толерантности к углеводам, n (%) |
12 (23,07%) |
||
|
Syntax score, усл. ед. |
11,17±5,77 |
11,00 |
6,00–15,00 |
|
САД, мм рт. ст. |
129,00±10,45 |
130,00 |
120,00–140,00 |
|
ДАД, мм рт. ст. |
78,86±6,82 |
80,00 |
70,00–80,00 |
|
Общий холестерин, ммоль/л |
5,04±1,40 |
5,10 |
3,92–5,86 |
|
Холестерин ЛПНП, ммоль/л |
3,31±1,33 |
3,22 |
2,47–3,99 |
|
Триглицериды, ммоль/л |
1,75±0,88 |
1,41 |
1,20–1,95 |
|
ЭхоКГ показатели: |
|||
|
КДО (Simpson), мл |
110,09±29,62 |
110,50 |
95,50–126,50 |
|
КСО (Simpson), мл |
35,46±20,09 |
31,50 |
23,00–43,00 |
|
ФВ ЛЖ,% |
68,84±9,98 |
71,00 |
65,000–75,00 |
|
Индекс нарушения локальной сократимости, усл. ед. |
1,12±0,20 |
1,00 |
1,00–1,19 |
|
Emitr, см/с |
57,62±13,64 |
56,00 |
48,00–66,00 |
|
Amitr, см/с |
67,72±13,36 |
67,00 |
60,00–74,00 |
|
E/Amitr, усл. ед. |
0,86±0,22 |
0,82 |
0,71–1,01 |
|
Em см/с |
8,26±2,37 |
9,00 |
7,00–10,00 |
|
Emitr/Em, усл. ед. |
7,35±2,43 |
7,10 |
5,30–8,70 |
|
ЛП (Simpson), мл |
26,06±7,60 |
26,81 |
20,11–29,39 |
Примечание: М – среднее арифметическое, SD – среднеквадратичное отклонение, АГ – артериальная гипертония, САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление, КДО – конечно-диастолический объем, КСО – конечно-систолический объем, ЛП – левое предсердие, Emitr – пик скорости трансмитрального кровотока в раннюю диастолу, см/с; Amitr – пик скорости трансмитрального кровотока в систолу предсердий, см/с; Em – пик скорости движения фиброзного кольца МК на стороне боковой стенки ЛЖ в раннюю диастолу, см/с.
У всех пациентов, включенных в данное исследование, регистрировался синусовый ритм, ФВ ЛЖ была 55% и более. По результатам инвазивной коронарной ангиографии (КАГ), изолированное поражение передней нисходящей артерии (ПНА) было выявлено у 17 больных, правой коронарной артерии (ПКА) – у 16 лиц, огибающей артерии – у 7 пациентов. У 12 (23,07%) из 52 больных выявлен стенозирующий атеросклероз двух КА. Показанием для реваскуляризации миокарда послужило наличие гемодинамически значимого стеноза КА (75% и более) в сочетании с доказанной ишемией миокарда в зоне кровоснабжения стенозированной КА. У всех пациентов был рассчитан Syntax Score, который не превышал 22 усл. ед. (11,17±5,78 усл. ед.) [4]. Стенты с лекарственным покрытием были установлены 49 больным, голометаллические стенты – 4 пациентам. Все пациенты получали оптимальную медикаментозную терапию, которая включала статины, двойную дезагрегантную терапию, β -адреноблокаторы, блокаторы ренин-ангиотензин-аль-достероновой системы.
ЭхоКГ выполнена на ультразвуковой системе Vivid Е9 (GE, Healthcare) с использованием матричного датчика M5S (1,5–4,6 MHz). По двухмерным изображениям из апикальной позиции оценивали КСО, КДО ЛЖ по Simpson с последующей оценкой ФВ ЛЖ и нарушений локальной сократимости. Трансмитральный поток записывали в импульсно-волновом режиме c последующим расчетом скорости потока в период ранней диастолы (Emitr) и си- столы предсердий (Amitr). Скорость движения фиброзного кольца МК на стороне боковой стенки ЛЖ в период ранней диастолы (Em) оценивали с помощью импульсной тканевой допплерографии.
В двухмерном режиме проводилась запись кинопетель в течение одного сердечного цикла из парастернальной (по короткой оси ЛЖ на уровнях фиброзного кольца МК, ПМ и верхушки) и апикальной позиций (на уровне 4, 2 камер и по длинной оси ЛЖ). В режиме on-line была использована технология “след пятна” (Speckle Tracking Imaging – 2D Strain) для оценки глобальной деформации ЛЖ в продольном направлении (Global Longitudinal Strain – GLSLV). За нарушение глобальной деформации ЛЖ в продольном направлении принимали значения менее –18%. Глобальная деформация была ненарушенной при значениях более –18%.
В режиме off-line по двухмерным изображениям ЛЖ из парастернальной позиции по короткой оси ЛЖ оценивали ротацию и скорость ротации ЛЖ в систолу и раннюю диастолу на уровне базальных сегментов (RotMV, RotRMV, RotREMV), ПМ (RotPM, RotRPM, RotREPM) и верхушечных сегментов (Rotapex, RotRapex, RotREapex). Скручивание ЛЖ (Twist) определяли автоматически или рассчитывали как разность значений ротации в конце систолы на уровне верхушечных ЛЖ и базальных сегментов (Rotapex- RotMV). Автоматически оценивали скорость скручивания в период систолы (TwistR) и раскручивание ЛЖ (Untwist). Поворот по оси ЛЖ (Torsion) определяли как скручивание ЛЖ, отнесенное к расстоянию от основания до верхушки ЛЖ на уровне 4 камер (°/см).
ЭхоКГ, деформация ЛЖ в продольном направлении и показатели механики ЛЖ были оценены до и в течение первых семи дней (Ме=4 дня) после стентирования КА.
До, через 6 и 24 ч после стентирования КА количественно оценивали уровни тропонина I и КФК МВ имму-нохемилюминесцентным методом (ACCESS). Пороговое значение тропонина I для острого коронарного синдрома (ОКС) составляло 0,5 нг/мл и выше, для КФК МВ – 25 ед./мл и выше.
Протокол исследования был одобрен этическим комитетом НИИ кардиологии (Томск). До включения в исследование у всех пациентов было получено добровольное письменное информированное согласие на проведение КАГ со стентированием КА и ЭхоКГ. Лучевая нагрузка при проведении рентгенэндоваскулярного лечения не превышала допустимых значений и составила от 1,92 до 2,9 мЗв.
Проверка гипотезы о гаусовском распределении по критериям Колмогорова–Смирнова в форме Лиллиефор-са (Lilliefors) и Шапиро–Уилка (Shapiro–Wilk) отвергала эту гипотезу, поэтому использовались тесты Манна–Уитни (Mann–Whitney U) и Вилкоксона (Wilcoxon). Оценка корреляционных связей между парами количественных признаков осуществлялась при помощи непараметрического рангового коэффициента Спирмена. Во всех процедурах статистического анализа критический уровень значимости p принимался равным 0,05. Результаты представлены в виде M±SD (где М – среднее арифметическое, SD – среднеквадратичное отклонение), медианы и нижней и верхней квартилей.
Результаты
До проведения стентирования КА глобальная деформация ЛЖ в продольном направлении в пределах нормы (–18,0% и более) выявлена у 22 (42,31%) из 52 пациентов, а у 30 (57,69%) было обнаружено снижение глобальной деформации ЛЖ (менее –18%). По возрасту, липидному спектру, уровню глюкозы, КДО, КСО и ФВ ЛЖ, а также по значениям Syntax Score и степени поражения КА больные с нормальной и со сниженной глобальной деформацией ЛЖ в продольном направлении не различались. Не выявлено различий по частоте перенесенного ИМ, наличию сахарного диабета (СД) 2-го типа, нарушениям толерантности к углеводам (НТУ) между пациентами обеих групп.
Глобальная ротация ЛЖ на уровне базальных и верхушечных сегментов, ПМ, скручивание и поворот по оси ЛЖ значимо не различались между пациентами с нормальной и сниженной глобальной деформацией в продольном направлении до ЧКВ. Однако у пациентов со сниженной GLSLV обнаружено удлинение времени до пика ротации ЛЖ на уровне ПМ (428,63±85,97 мс; Ме=389,00 мс vs 341,36±88,86 мс; Ме=343,00; U=57,000, Zadj=2,277; р=0,02) и верхушки (426,75±79,13 мс; Ме=417,00 мс vs 370,75±51,55 мс; Ме=361,00 мс; U=69,000, Zadj= 2,215; р=0,027). Кроме того, у этих больных время до пика скорости ротации в систолу на уровне ПМ было большим по сравнению с пациентами с исходно нормальной деформацией ЛЖ (207,81±80,13 мс; Ме=208,00 мс vs 137,00±51,73 мс; Ме=126,00 мс; U=48,000, Zadj=2,646; р=0,008).
В первые семь дней после ЧКВ у больных не наблюдалось появления стенокардии, отрицательной динамики на электрокардиограмме, появления или усугубления нарушений локальной сократимости, а также не проводилось изменений медикаментозной терапии.
Обнаружено ухудшение GLSLV (с –19,28±0,89%; Me=– 19,70% до –15,15±1,89%; Ме=–15,35%; р=0,017) у 7 (31,81%) из 22 пациентов после ЧКВ. У остальных 15 (68,19%) пациентов этой подгруппы глобальная и региональная деформация ЛЖ в продольном направлении не изменилась. У больных с исходно сниженной GLSLV ухудшение деформации (с–14,43±3,29%; Ме=–15,30% до – 12,74±3,43%; Ме=–13,05%; р<0,001) выявлено у 17 (56,67%) пациентов, а у 13 (43,33%) GLSLV улучшилась (с –14,69±2,38%; Ме=–14,60% до –17,54±3,15%; Ме=–18,70%; р=0,02).
Пациенты с положительной и отрицательной динамикой деформации ЛЖ как в подгруппе с исходно нормальной, так и в подгруппе с исходно сниженной GLSLV не различались по функциональному классу стенокардии, наличию артериальной гипертонии, НТУ, показателям липидного спектра крови, уровню глюкозы натощак, а также по величинам КДО, КСО и ФВ ЛЖ и значению Syntax Score. Не было выявлено взаимосвязей динамики глобальной деформации ЛЖ с количеством установленных стентов и их моделей. Однако следует отметить, что среди больных с исходно сниженной деформацией до ЧКВ пациенты с отрицательной динамикой были старше (62,94±6,07 лет; Ме=64,00 лет) по сравнению с больными с улучшением деформации ЛЖ (56,23±8,96 лет; Ме=57,00 лет; Zadj=–2,17; р=0,02).
У больных с положительной динамикой GLSLV, включая пациентов с исходно нормальной и исходно сниженной GLSLV, после стентирования КА не выявлено значимой динамики глобальных показателей ротации, скручивания, скоростей ротации и скручивания, раскручивания и поворота по оси в первую неделю после ЧКВ.
У больных с исходно нормальной GLSLV и ее ухудшением после ЧКВ обнаружены изменения механики на уровне ПМ: уменьшение ротации заднего сегмента ЛЖ и скорости ротации в систолу заднего и нижнего сегмента ЛЖ. У пациентов с исходно сниженной GLSLV и при ее ухудшении после вмешательства наблюдалось уменьшение времени до пика скорости ротации в раннюю диастолу на уровне МК (509,500±68,288 мс, Ме=505,500 vs 479,889±49,549 мс, Ме=488,000 мс; р=0,04). Кроме того, у этих пациентов отмечалось более позднее наступление пика скорости глобальной апикальной ротации ЛЖ в систолу (246,13±164,19 мс; Ме=189,50 мс vs 126,14±52,31 мс; Ме=126,00; U=9,500, Zadj=2,094; р=0,03) и сниженные значения скорости глобальной апикальной ротации в раннюю диастолу (–17,70±22,25°/с-1; Ме=–23,52°/с-1 vs –52,65±24,11°/с-1; Ме=–45,94°/с-1; U=5,000,Zadj=2,604; р=0,009) в сравнении с больными с улучшением GLSLV.
При оценке динамики уровня кардиоспецифических ферментов было обнаружено повышение уровней тро-
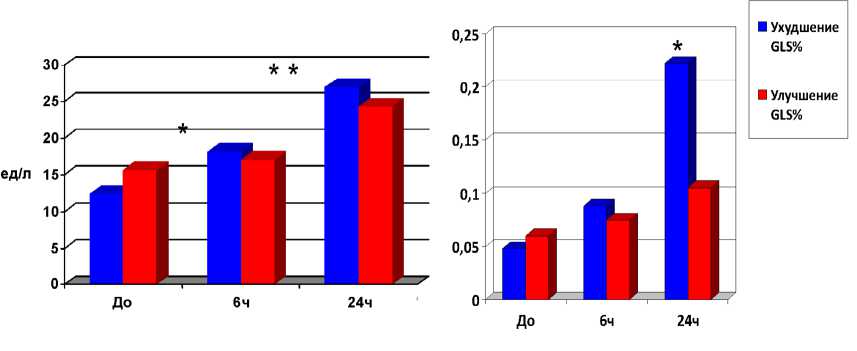
Рис. 1. Динамика уровней КФК МВ и тропонина I после стентирования коронарных артерий: * – p<0,05 по сравнению с периодом до ЧКВ; ** – p<0,05 по сравнению с периодом 6 ч после ЧКВ
понина I через 24 ч и КФК МВ через 6 и 24 ч (рис. 1), не превышающее пороговое значение для ОКС у пациентов с ухудшением глобальной деформации ЛЖ в продольном направлении после стентирования КА.
Необходимо отметить, что повышение уровня кардио-специфических ферментов через 6 и 24 ч наблюдалось в группе ухудшения GLSLV независимо от исходных значений глобальной деформации.
Обсуждение
Согласно данным литературы, деформация ЛЖ в продольном направлении отражает функцию субэндокардиальных волокон миокарда ЛЖ, и ее снижение является чувствительным маркером субклинической систолической дисфункции ЛЖ [5]. В нашем исследовании при оценке GLSLV у части пациентов со стабильной ИБС выявлялись нормальные значения данного параметра механики сердца, а у части больных – ее снижение. По другим клиническим признакам данные пациенты не различались. Таким образом, снижение глобальной деформации ЛЖ в продольном направлении у больных стабильной ИБС, вероятно, обусловлено хронической ишемией субэндокардиального слоя. Вместе с тем механика сердца включает в себя такие процессы, как ротация, скручивание, раскручивание и поворот по оси ЛЖ. Считается, что величина этих параметров определяется в основном субэпикардиальными волокнами миокарда и в большей степени отражает систолическую функцию ЛЖ [6]. Нами было выявлено, что показатели глобальной ротации, скорости ротации в систолу и раннюю диастолу, скручивания и раскручивания ЛЖ и поворота по оси ЛЖ не различались в подгруппах больных с исходно нормальной и сниженной глобальной деформацией ЛЖ в продольном направлении. Наши данные согласуются с результатами I. Paetsch et al. [7], которые показали, что в покое ротационная функция у больных ИБС не нарушена. Тем не менее, у лиц со сниженной продольной деформацией до ЧКВ мы обнаружили увеличение времени до пика глобальной ротации на уровне ПМ и верхушки, а также времени наступления максимальной скорости ротации в систолу ЛЖ на уровне ПМ. По результатам исследования J. Wang et al. [3], у пациентов с диастолической дисфункцией и сохранной ФВ ЛЖ не наблюдалось снижения скручивания ЛЖ, которое в основном определяется апикальной ротацией. Однако в нашем исследовании было обнаружено удлинение времени до пика апикальной ротации и ротации ЛЖ на уровне ПМ у больных ИБС с ФВ ЛЖ 55% и более. Мы полагаем, что временная задержка апикальной ротации и ротации ЛЖ на уровне ПМ, а также снижение пиковой систолической скорости апикальной ротации являются наиболее ранними показателями нарушения контрактильности ЛЖ и механики ЛЖ.
Следует отметить, что в нашем исследовании у больных с ухудшением GLSLV после стентирования КА наблюдалось повышение уровня кардиоспецифических ферментов, тропонина I, КФК МВ, не превышающее пороговое значение для ОКС. Мы полагаем, что ухудшение глобальной деформации ЛЖ в продольном направлении обусловлено микрососудистой эмболией и, следовательно, повреждением миокарда. Подобная гипотеза была высказана S. Cimino et al., которые наблюдали снижение глобальной деформации ЛЖ после стентирования КА у больных острым ИМ [2]. Согласно данным этой публикации, глобальная деформация ЛЖ была значимо ниже (–11,00±1,40% vs –18,00±2,00%; р<0,001) у больных с мик-рососудистой обструкцией, обусловленной реваскуляризацией миокарда. C.A. Kroeker et al. показали, что при развитии субэндокардиальной ишемии миокарда ротация ЛЖ на верхушке увеличивается, и, напротив, при трансмуральной ишемии апикальная ротация уменьшается [8]. Исходя из полученных нами результатов, следует предположить, что повреждение миокарда в ходе ЧКВ приводит к нарушению функции не только субэндокардиальных волокон и снижению продольной деформации, но и субэпикардиальных волокон на уровне ПМ и верхушки, что обусловливает нарушение ротации ЛЖ на уровне верхушечных сегментов и ПМ. Это проявляется снижением скорости апикальной ротации и увеличением времени до пика ее наступления в систолу и раннюю диастолу.
Выводы
-
1. После стентирования КА у 24 (46,15%) больных выявлено ухудшение глобальной деформации ЛЖ в продольном направлении.
-
2. Ухудшение глобальной деформации ЛЖ в продольном направлении ассоциировано с повышением уровня кардиоспецифических ферментов у пациентов со стабильной ИБС после стентирования КА, что, по нашему мнению, обусловлено эмболией микрососудис-того русла во время проведения стентирования КА.
-
3. Удлинение времени до пиковой апикальной ротации и ротации на уровне ПМ в систолу является показателем ухудшения механики ЛЖ.
-
4. У пациентов, имевших нарушение глобальной деформации ЛЖ в продольном направлении и при ее ухудшении после стентирования КА, наблюдается снижение скорости апикальной ротации и увеличение времени до пика верхушечной ротации в систолу и раннюю диастолу.
Список литературы Динамика параметров механики левого желудочка после стентирования коронарных артерий у больных стабильной ишемической болезнью сердца
- Lang R.M., Badano L.P., Mor-Avi V. et al. Recommendations for сardiac сhamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging//J. Am. Soc. Echocardiogr. -2015. -Vol. 28, No. 1. -Р. 1-39.
- Cimino S., Agati L., Lucisano L. et al. Value of two-dimensional longitudinal strains analysis to assess the impact of thrombus aspiration during primary percutaneous coronary intervention on left ventricular function: a speckle tracking imaging substudy of the EXPIRA Trial//Echocardiography. -2014. -Vol. 3, No. 7. -P. 842-847.
- Wang J., Khoury D.S., Yue Yo. et al. Left ventricular untwisting rate by speckle tracking echocardiography//Circulation. -2007. -Vol. 116. -P. 2580-2586.
- Windecker S., Kolh Ph., Alfonso F. et al. 2014 ESC/EACTS Guidelines on myocardial Revascularization The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI)//Eur. Heart J. -2014. -Vol. 35. -P. 2541-2619.
- Hoit B.D. Strain and strain rate echocardiography and coronary artery disease//Circulation. -2011. -Vol. 4. -P. 179-190.
- Mor-Avi V., Lang R.M., Badano L.P. et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography//J. Am. Soc. Echocardiogr. -2011. -Vol. 24. -P. 277-313.
- Paetsch I., Foll D., Kaluza A. et al. Magnetic resonance stress tagging in ischemic heart disease//Am. J. Physiol. Heart Circ. Physiol. -2005. -Vol. 288, Is. 6. -P. H2708-2714.
- Kroeker C.A., Tyberg J.V., Beyar R. Effects of ischemia on left ventricular apex rotation. An experimental study in anesthetized dogs//Circulation. -1995. -Vol. 92. -P. 3539-3548.


