Динамика проявлений кардиальной автономной нейропатии при ишемическом инсульте на фоне вертикализации
Автор: Павлова Виктория Александровна, Павлов Денис Анатольевич, Машин Виктор Владимирович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 1, 2021 года.
Бесплатный доступ
Острые нарушения мозгового кровообращения остаются актуальной проблемой неврологии. Гетерогенные патологии, сопутствующие инсульту, обусловливают особенности его течения, развитие осложнений, что требует своевременной коррекции при составлении реабилитационных программ. Недооценка симптомов кардиальной автономной нейропатии (КАН) на фоне сахарного диабета 2-го типа (СД 2) ухудшает прогноз при ишемическом инсульте. Цель работы - изучить проявления кардиальной автономной нейропатии у пациентов с ишемическим инсультом на фоне СД 2 и оценить их динамику при проведении вертикализации. Материалы и методы. В исследовании участвовали 60 пациентов обоего пола 45-75 лет с ишемическим инсультом (ИИ) в острейшем периоде. Первую группу составили 30 пациентов с СД 2, вторую группу - 30 пациентов без данного заболевания. В начале исследования проводились сбор жалоб, анамнеза, анализ факторов риска КАН, оценка по шкалам NIHSS, Рэнкин, кардиоваскулярные тесты (КВТ) на выявление КАН, электрокардиография, суточное мониторирование артериального давления, электронейромиография. На протяжении 12 дней пациентам осуществлялась пассивная вертикализация. Затем повторно проводились неврологический осмотр, КВТ и ЭКГ. Для статистической обработки данных использовалась описательная (подсчет медианы, 25-го и 75-го квартилей) и непараметрическая статистика (критерии Манна-Уитни, Вилкоксона, Кохрена). Результаты. Исходно у пациентов с СД 2 выявлены выраженные изменения всех КВТ, преобладание прогрессирующей формы КАН. Во второй группе преобладала подтвержденная форма КАН. После курса вертикализации отмечена положительная динамика по неврологическим шкалам, КВТ, степени выраженности КАН в обеих группах при сохранении различий между ними. У пациентов с ИИ на фоне СД 2 уменьшение проявлений КАН в конце исследования было менее выраженным по сравнению с пациентами без СД. Выводы. Пассивная вертикализация способствует уменьшению проявлений КАН у пациентов с ИИ, в т.ч. на фоне СД 2.
Кардиальная автономная нейропатия, вертикализация, ишемический инсульт, сахарный диабет
Короткий адрес: https://sciup.org/14121197
IDR: 14121197 | УДК: 616.8-005 | DOI: 10.34014/2227-1848-2021-1-39-49
Текст научной статьи Динамика проявлений кардиальной автономной нейропатии при ишемическом инсульте на фоне вертикализации
Введение. Острые нарушения мозгового кровообращения остаются актуальной проблемой неврологии ввиду обусловленной ими высокой смертности и инвалидизации. Гетерогенность заболеваний, на фоне которых случается инсульт, обусловливает особенности его течения и исхода, развитие осложнений, что требует своевременной диагностики, оказания помощи и коррекции при составлении реабилитационных мероприятий.
Одним из главных принципов современной нейрореабилитации является ранняя активизация и вертикализация пациентов [1] как лечебная стратегия обеспечения нормального функционирования организма в естественном вертикальном положении, а также как метод профилактики и лечения иммобилизацион-ного синдрома и связанных с ним вегетативных и соматических осложнений у больных любого профиля [2].
Особую актуальность вертикализация приобретает при остром нарушении мозгового кровообращения (ОНМК), сопровождающемся ограничением подвижности, повреждением вегетативных центров, кардиоваскулярными нарушениями, обусловленными как самим инсультом, так и сопутствующими заболеваниями.
Одной из распространенных коморбид-ных патологий при инсульте является сахар- ный диабет (СД). Частота встречаемости СД среди пациентов с ОНМК, по данным разных авторов, составляет 11–43 %, что превышает показатель общей распространенности диабета (4–6 %) [3].
В исследовании R.E. Maser показано, что одним из наиболее игнорируемых серьезных осложнений диабета является кардиальная автономная нейропатия (КАН) [4]. КАН развивается в результате повреждения иннервирующих сердце и сосуды нервных волокон, приводящего в итоге к нарушению контроля сердечного ритма и гемодинамики, обусловливая высокий риск смертности [5]. Несмотря на серьезный прогноз и высокую распространенность, достигающую, по данным некоторых авторов, 90 % [5, 6], осведомленность практических врачей о КАН остается невысокой [7]. Недооценка симптомов КАН приобретает особую опасность при развитии у больных СД острых церебральных событий ввиду усугубления вегетативной дисфункции и кардиоваскулярных нарушений.
Цель исследования. Изучить проявления кардиальной автономной нейропатии у пациентов с ишемическим инсультом на фоне сахарного диабета 2-го типа и оценить их динамику при проведении реабилитационных мероприятий.
Материалы и методы. Обследовано 60 пациентов обоего пола в возрасте 45–75 лет с полушарным ишемическим инсультом (ИИ) в острейшем периоде. Всем пациентам проводились медикаментозная терапия по стандарту помощи при инфаркте мозга (приказ Минздрава России от 29.12.2012 № 1740н «Об утверждении стандарта специализированной медицинской помощи при инфаркте мозга») и курс пассивной вертикализации в течение 12 дней. Первую группу (Г-1) составили 30 пациентов (21 женщина, 9 мужчин), у которых по данным анамнеза был диагностирован сахарный диабет 2-го типа (СД 2), вторую группу (Г-2) – 30 пациентов (18 мужчин, 12 женщин) с ИИ без СД 2.
Критериями исключения служили тяжелый инсульт (по шкале NIHSS >15 баллов, по шкале Рэнкин >4 баллов); нарушения ритма сердца, в частности фибрилляция предсердий; имплантированный электрокардиостимулятор;
инфаркт миокарда или нестабильная стенокардия; ХСН IIБ и выше стадии; гемодинамически значимые пороки сердца; гемодинамически значимые стенозы сонных артерий (>70 %), соматические заболевания в стадии декомпенсации; злокачественные новообразования.
В соответствии с принципами Хельсинкской декларации у всех пациентов было получено информированное письменное согласие на участие в исследовании.
Предварительно у всех пациентов был проведен сбор жалоб, включая специфические для автономной и периферической нейропатии (головокружение в ортостазе, тахикардия покоя, нарушение функции тазовых органов, ночные апноэ, онемение конечностей, сухость кожи, сухость во рту). Анализировались факторы риска КАН: индекс массы тела (ИМТ), курение, уровень холестерина, гипертрофия левого желудочка (ГЛЖ), показатели суточного мониторирования артериального давления (СМАД), а также размер и латерализация очага инсульта.
Обследуемым в начале (1–2-й дни) и конце исследования (12-й день) проводились неврологический осмотр с оценкой по шкалам NIHSS и Рэнкин и диагностические обследования на выявление КАН [8], включающие:
-
– дыхательную пробу (оценка разницы между максимальной и минимальной ЧСС на фоне глубокого медленного дыхания в течение 1 мин);
-
– оценку отношения 15-го R-R-интерва-ла к 30-му с момента начала вставания при ортопробе (тест 30/15);
-
– ортостатическую пробу (оценка разницы между систолическим АД в положении лежа и после вставания на 2, 4, 6, 8, 10-й мин);
-
– тест с изометрической нагрузкой (ТИН) (оценка диастолического АД до и после сжатия динамометра в течение 3 мин до 1/3 максимальной силы руки).
Также оценивался интервал QT на ЭКГ в начале и в конце исследования. Наличие диабетической полинейропатии конечностей (ДПНП) подтверждалось электронейромиографией (ЭНМГ).
Статистическая обработка проводилась пакетом прикладных программ с использованием Statistica 10 (описательная статистика
(подсчет медианы и интерквартильного размаха в виде 25-го и 75-го процентилей) и непараметрические критерии Манна–Уитни, Вил-коксона, Кохрена).
Результаты. Первичное обследование пациентов показало сопоставимость обеих групп по возрасту, тяжести неврологической симптоматики по шкале NIHSS, степени по- вседневной активности по шкале Рэнкин, размеру и латерализации очага ишемии (табл. 1).
Анализ факторов риска развития КАН показал, что ведущее место среди них занимает длительность СД 2. По данному фактору, наряду с фракцией выброса, группы имели статистически значимые различия (p<0,05) (табл. 2).
Таблица 1
Table 1
General characteristics of study groups
|
Группа Group |
NIHSS, баллов NIHSS, points |
Шкала Рэнкин, баллов Rankin scale, points |
Размер очага, см3 Focal area, sm3 |
Латерализация, % Lateralization, % |
Возраст, лет Age, years |
|
Г-1, n=30 Group 1, n=30 |
5 (4; 9) |
4 (3; 4) |
1,6 (0,83; 5,54) |
47 – правосторонняя 53 – левосторонняя 47 – right-sided 53 – left-sided |
65 (61; 71) |
|
Г-2, n=30 Group 2, n=30 |
7 (4; 8) |
4 (3; 4) |
1,92 (0,99; 5,51) |
57 – правосторонняя 43 – левосторонняя 57 – right-sided 43 – left-sided |
60,5 (54; 71) |
Таблица 2
Table 2
Risk factors for cardiac autonomic neuropathy
|
Группа Group |
Уровень холестерина, ммоль/л Cholesterol level, mmol/l |
Индекс массы тела, кг/м2 Body mass index, kg/m2 |
Курение, % Smoking, % |
Гипертрофия левого желудочка, % Left ventricular hypertrophy, % |
Фракция выброса, % Ejection fraction, % |
Стаж СД, лет Diabetes duration, years |
СМАД, % 24-hour blood pressure monitoring, % |
|
Г-1, n=30 Group 1, n=30 |
5,3 |
29,5 (27; 33,7) |
37 |
87 |
58,1 (54; 61)* |
8 (1; 10)* |
22 – nondipper, 67 – nightpeaker |
|
Г-2, n=30 Group 2, n=30 |
4,93 |
28,49 (25,2; 32,1) |
37 |
83 |
61,9 (56; 68) |
0 |
18 – nightpeaker, 45 – nondipper |
Общая характеристика групп исследования
Факторы риска кардиальной автономной нейропатии
Примечание. Здесь и далее: * – статистически значимые различия между группами (р<0,05).
Note. Hereinafter: * – the differences are statistically significant (р<0.05).
Среди специфических жалоб, характерных для диабетической нейропатии, в частности автономной нейропатии, отмечались головокружение в положении стоя, тахикар- дия покоя, апноэ во сне, сухость кожи, сухость во рту, онемение конечностей, значительно преобладающие в первую группу (рис. 1).
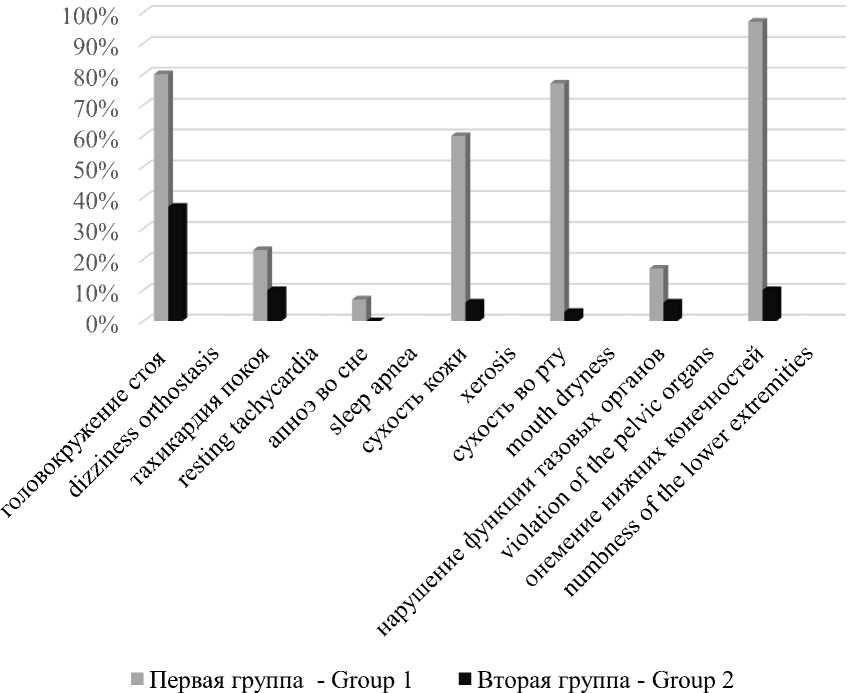
Рис. 1. Жалобы пациентов
Fig. 1. Patient complaints
У 100 % пациентов Г-1 при неврологическом осмотре и проведении ЭНМГ выявлены признаки ДПНП нижних конечностей, что подтверждает данные литературы о сочетании КАН и ДПНП [9, 10]. Изменения ЭНМГ-кар-тины у пациентов Г-2 соответствовали возрастной норме, не были симметричны и потому не свидетельствовали о наличии ПНП.
Результаты кардиоваскулярных тестов (КВТ) на выявление КАН представлены в табл. 3.
В обеих группах получены отличные от нормы показатели всех тестов. Только интер- вал QT у пациентов Г-2 принимал нормальные значения. При этом более выраженные изменения КВТ, особенно результатов ортостатической пробы, наблюдались в Г-1. Падение CАД ≥30 мм рт. ст. в начале госпитализации отмечалось у 25 пациентов Г-1, что более чем в 2 раза превышало аналогичный показатель в Г-2.
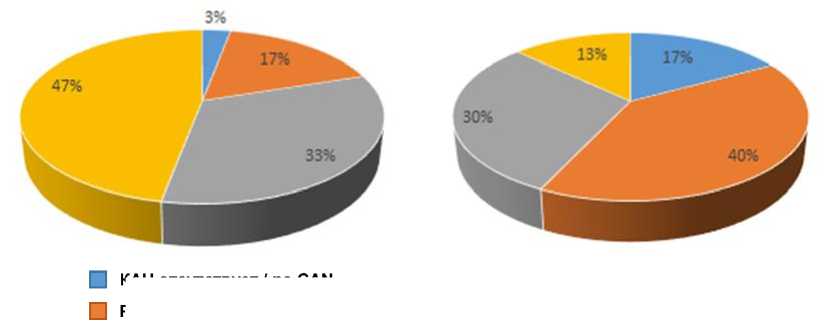
В зависимости от комбинации результатов КВТ и наличия/отсутствия постуральной гипотензии выделяют 3 стадии КАН [11, 12]. Согласно проведенным тестам у пациентов обеих групп исходно выявлены признаки КАН разной степени выраженности (рис. 2).
Таблица 3
Table 3
Результаты кардиоваскулярных тестов, проведенных в начале исследования
Первая группа Group 1 Вторая группа Group 2
0% 6% 0%

□ КАН отсутствует / no CAN
□ Ранняя или возможная КАН / Early or possibie CAN
□ Определенная или подтвержденная КАН / Diagnosed or confirmed CAN
□ Тяжелая, прогрессирующая КАН / Severe, advanced CAN
Results of cardiovascular tests at the beginning of the study
|
Группа Group |
Дыхательная проба, разница уд./мин Respiratory samples, differences in heartbeats/min |
Тест 30/15, RR 30 /RR 15 30-15 Test, RR 30 /RR 15 |
Ортопроба (неадекватная реакция), % Active orthostatic test (inadequate reaction), % |
Тест с изометрической нагрузкой (неадекватная реакция), % Isometric exercise test (inadequate reaction), % |
Длительность интервала QT, с QT interval, sec |
|
Г-1, n=30 Group 1, n=30 |
6 (5; 7)* |
0,95 (0,9; 0,97) |
83* |
93* |
0,42 (0,4; 0,43)* |
|
Г-2, n=30 Group 2, n=30 |
9 (7; 11) |
0,96 (0,94; 1,0) |
37 |
67 |
0,39 (0,36; 0,4) |
Рис. 2. Степень выраженности КАН у пациентов первой и второй групп в начале исследования
Fig. 2. The degree of CAN severity in patients (Group 1 and Group 2) at the beginning of the study
Полученные результаты свидетельствуют о наличии КАН у 100 % обследуемых. Но если в Г-2 у большей части пациентов (18 чел.) выявлена ранняя и подтвержденная КАН, то в Г-1 значительно преобладала прогрессирующая форма КАН (25 чел.), что свидетельствует о необходимости особого внимания к данной группе.
С целью преодоления проблем, связанных с данной вегетативной дисфункцией, пациентам обеих групп был проведен курс медикаментозной терапии и пассивной вертикализа-ции в течение 12 дней и по его окончании оце- нены те же вегетативные тесты, что и в начале исследования. Полученные результаты представлены в табл. 4.
Использование критерия Wilcoxon для оценки динамики изменений по шкалам NIHSS, Рэнкин, тесту с глубоким дыханием, тесту 30/15, интервалу QT показало статистически значимое (p<0,05) улучшение показателей по сравнению с исходными значениями как в Г-1, так и в Г-2. Результаты повторных АД-тестов также значимо положительно отличались от первоначальных (p<0,05, критерий Cochran).
При этом в Г-1 сохранялась значимая доля пациентов с неадекватной реакцией на ортопробу, в то время как в Г-2 снижение АД ≥30 мм рт. ст. отмечалось лишь у 2 чел. Более чем в половине случаев в Г-1 оставалась неадекватной реакция на изометрическую нагрузку. Результаты дыхательной пробы также значимо различались между группами.
При этом в Г-2 медианы показателей теста 30/15 и теста с глубоким дыханием принимали уже не патологические, а пограничные значения.
Таким образом, по совокупности полученных результатов в обеих группах отмечена положительная динамика степени выраженности КАН (рис. 3).
Таблица 4
Table 4
|
Группа Group |
NIHSS, баллов NIHSS, points |
Шкала Рэнкин, баллов Rankin scale, points |
Дыхательная проба, разница уд./мин Respiratory samples, differences in heartbeats/min |
Тест 30/15, RR 30 /RR 15 30-15 Test, RR 30 /RR 15 |
Ортопроба (неадекватная реакция), % Active orthostatic test (inadequate reaction), % |
Тест с изометрической нагрузкой (неадекватная реакция), % Isometric exercise test (inadequate reaction), % |
Длительность интервала QT, с QT interval, sec |
|
Г-1, n=30 First group, n=30 |
4 (3; 6)* |
2 (2; 3)* |
10 (9; 11)* |
1 (1; 1,05) |
23* |
60* |
0,39 (0,36; 0,4)* |
|
Г-2, n=30 Second group, n=30 |
3 (2; 5) |
2 (2; 3) |
12 (10; 15) |
1,02 (1; 1,1) |
7 |
23 |
0,37 (0,36; 0,4) |
Результаты кардиоваскулярных тестов в конце госпитализации Results of cardiovascular tests at the end of hospitalization
Первая группа Group 1
Вторая группа Group 2
КАН отсутствует / no CAN
Ранняя или возможная КАН / Early or possibie CAN
□ Определенная или подтвержденная КАН / Diagnosed or confirmed CAN
Тяжелая, прогрессирующая КАН / Severe, advanced CAN
Рис. 3. Степень выраженности КАН у пациентов первой и второй групп в конце госпитализации
Fig. 3. The degree of CAN severity in patients (Group1 and Group 1) at the end of hospitalization
При этом в Г-1 сохранялась значимая доля пациентов с прогрессирующей КАН, но в 50 % случаев показатели КВТ соответствовали ранней и подтвержденной ее форме.
В Г-2 у 5 пациентов нивелировались проявления КАН, а у большинства пациентов результаты КВТ соответствовали ранней (возможной) ее форме. Признаки прогрессирующей КАН сохранялись лишь у 4 чел.
Обсуждение. Результаты исследования показали, что, несмотря на исходную сопоставимость групп по основным параметрам (тяжесть инсульта, степень активности пациента, размер очага инфаркта, его латерализация, возраст, ИМТ), наличие в анамнезе СД 2 обусловливает значимые различия проявлений вегетативной дисфункции со стороны сердца и сосудов у пациентов.
В первую очередь о поражении нервных волокон как вегетативной, так и периферической нервной системы свидетельствует преобладание специфических жалоб в Г-1: головокружение стоя, тахикардия покоя, апноэ во сне, сухость кожи, сухость во рту, онемение конечностей, нарушение функции тазовых органов. Несмотря на отрицание пациентами некоторых жалоб, клинически и инструментально подтверждалось повреждение нервных окончаний: ЭНМГ конечностей выявила признаки ДПНП у 100 % пациентов. Таким образом, подтверждена распространенность нейропатии вследствие системного влияния СД.
Проведение специфических КВТ в начале исследования способствовало обнаружению признаков вегетативной дисфункции в обеих группах. У пациентов Г-2 такие нарушения могут быть обусловлены инволютивными изменениями в аппарате симпатической иннервации (так называемый феномен ранней де-симпатизации сердца человека), начинающимися с 4-го десятилетия жизни [13, 14]. Кроме того, вегетативные нарушения развиваются вследствие церебрального повреждения при ишемическом инсульте, особенно при правополушарной локализации очага [15] (57 % пациентов Г-2 имели правостороннее поражение головного мозга). Наряду с этим обусловленное инсультом ограничение двигательной и когнитивной активности больного приводит к развитию иммобилизационного синдрома и связанным с ним кардиоваскулярным нарушениям, ведущим в конечном итоге к формированию ортостатической недостаточности и нарушению гравитационного градиента [16].
Имеются также и половые различия в состоянии вегетативного нервного тонуса. Так, у женщин до 55 лет отмечена более низкая активность симпатической нервной системы, чем у мужчин аналогичного возраста [17, 18].
Значительные изменения тестов в Г-1 по сравнению с Г-2 обусловлены сочетанием вышеописанных факторов, имеющих место у пациентов Г-2, с развивающейся денервацией сердца на фоне СД 2 (за счет микрососудистых нарушений и дисметаболических процессов, сопровождающих данное заболевание).
В результате исследования выявлены выраженные ортостатические нарушения у пациентов с СД 2: у 83 % отмечена неадекватная реакция на ортопробу, в половине случаев обусловливающая досрочное завершение теста еще на этапе проведения первичной верти-кализации.
При анализе интервала QT также наблюдались различия между группами. Удлинение интервала QT часто имеет место при КАН ввиду дисбаланса симпатической иннервации и ГЛЖ [19]. В Г-1 на исходной ЭКГ значения интервала QT были статистически значимо выше. Представляется целесообразным проведение холтеровского мониторирования ЭКГ у данной категории больных, так как удлинение QT – предиктор аритмий сердца и внезапной смерти [20, 21].
По значительному преобладанию пациентов с прогрессирующей КАН в Г-1 (у 83 % против 40 % в Г-2) можно сделать вывод об увеличении выраженности изменений вегетативной регуляции сердца и сосудов при сочетании ИИ и СД 2. В связи с этим становится очевидной и обоснованной необходимость кардиоваскулярной тренировки с помощью пассивной вертикализации за счет стимуляции симпатического и парасимпатического контура регуляции вегетативной нервной системы [22], активизации работы сердечно-сосудистой системы и «приучения» ее к вертикальным нагрузкам [23].
Результаты, полученные в конце исследования, это подтверждают. Отмечена положи- тельная динамика по основным неврологическим шкалам (NIHSS, Рэнкин), ЭКГ- и АД-те-стам, степени выраженности КАН в обеих группах, хотя различия между ними сохранялись. У пациентов с ИИ и СД 2 по сравнению с пациентами без СД 2 проявления кардиальной дисфункции после 12-дневного курса вер-тикализации снизились в меньшей степени. Можно предположить, что увеличение количества сеансов вертикализации позволит этим пациентам достичь лучших результатов по преодолению кардиоваскулярных нарушений.
Выводы:
-
1. У пациентов с ишемическим инсультом на фоне сахарного диабета 2-го типа развиваются более выраженные кардиоваскуляр-
- ные нарушения по сравнению с пациентами без сахарного диабета в анамнезе.
-
2. Пассивная вертикализация является эффективным методом вегетативной стимуляции, позволяющим улучшить регуляцию сердечно-сосудистой системы у пациентов с ишемическим инсультом как с наличием сахарного диабетома 2-го типа, так и без него.
-
3. У пациентов с ишемическим инсультом и сахарным диабетом 2-го типа уменьшение степени выраженности кардиальной автономной нейропатии на фоне пассивной верти-кализации происходит медленнее по сравнению с пациентами без сахарного диабета, что делает необходимым продолжение кардиоваскулярной тренировки.
Список литературы Динамика проявлений кардиальной автономной нейропатии при ишемическом инсульте на фоне вертикализации
- Кадыков А.С. Реабилитация после инсульта. Москва: Миклош; 2003. 176.
- Алашеев А.М., Анисимова Л.Н., Белкин А.А. Вертикализация пациентов в процессе реабилитации. Клинические рекомендации (2014). URL: https://rehabrus.ru/Docs/Protokol_Vertikalizaciya.pdf (дата обращения: 14.07.2020).
- АметовА.С. Сахарный диабет 2 типа. Проблемы и решения. Т. 1. 3-е изд., перераб. и доп. Москва: ГЭОТАР-Медиа; 2015. 350.
- Maser R.E., Mitchell B.D., Vinik A.I., Freeman R. The Association Between Cardiovascular Autonomic Neuropathy and Mortality in Individuals With Diabetes. Diabetes Care. 2003; 26 (6): 1895-1901.
- Agashe S., Petak S. Cardiac Autonomic Neuropathy in Diabetes Mellitus. Methodist Debakey Cardiovasc. J. 2018; 14 (4): 251-256. DOI: 10.14797/mdcj-14-4-251.
- Balcioglu A.S., Müderrisoglu H. Diabetes and cardiac autonomic neuropathy: Clinical manifestations, cardiovascular consequences, diagnosis and treatment. World J. Diabetes. 2015; 6 (1): 80-91. DOI: 10.4239/wjd.v6.i1.80.
- Попов К.А., Токмакова А.Ю., Бондаренко И.З. Предикторы и методы диагностики нарушений автономной иннервации миокарда у больных сахарным диабетом 1 и 2 типа. Сахарный диабет. 2017; 20 (3): 185-193.
- Котова О.В. Диабетическая автономная нейропатия. Справочник поликлинического врача. 2014; 08: 34-37.
- Fleischer J., Yderstraede K., Gulichsen E., Jakobsen P.E., Lervang H.H., Eldrup E., Nygaard H., Tar-now L., Ejskjaer N. Cardiovascular autonomic neuropathy is associated with macrovascular risk factors in type 2 diabetes: new technology used for routine large-scale screening adds new insight. J. Diabetes Sci Technol. 2014; 8: 874-880.
- Новиков В.И., Новиков К.Ю. Тиоктовая кислота: точка приложения - диабетическая нейропатия. Эффективная фармакотерапия. 2014; 53: 46-54.
- Spallone V., Ziegler D., Freeman R., Bernardi L., Frontoni S., Pop-Busui R., Stevens M., Kempler P., Hilsted J., Tesfaye S. Cardiovascular autonomic neuropathy in diabetes: clinical impact, assessment, diagnosis, and management. Diabetes Metab. Res. Rev. 2011; 27: 639-653.
- Serhiyenko V.A., Serhiyenko A.A. Cardiac autonomic neuropathy: Risk factors, diagnosis and treatment. World J. Diabetes. 2018; 9 (1): 1-24. DOI: 10.4239/wjd.v9.i1.1.
- Швалев В.Н. Возрастные изменения нервного аппарата сердца и содержания в нем оксида азота в норме и при патологии. Тихоокеанский медицинский журнал. 2012; 2: 94-99.
- Швалев В.Н., Реутов В.П., Сергиенко В.Б., Рогоза А.Н., Масенко В.П., Аншелес А.А. Механизмы развития кардиологических заболеваний при возрастных нарушениях состояния нервной системы. Казанский медицинский журнал. 2016; 97 (4): 598-606.
- Сон А.С., Солодовникова Ю.А. Характер вегетативных расстройств в остром периоде ишемического инсульта. Международный неврологический журнал. 2010; 7 (37): 98-104.
- Белкин А.А. Реабилитация в интенсивной терапии. РеабИТ. Клинические рекомендации; 2015. URL: https://mosgorzdrav.ru (дата обращения: 1.08.2020).
- Voss A., Schroeder R., Heitmann A., Peters A., Perz S. Short-term HRV-influence of gender and age in healthy subjects. PLoS One. 2015; 10 (3): 1-33. e0118308. DOI: 10.1371/journal.pone.0118308.
- Gerritsen J., TenVoorde B.J., Dekker J.M., Kingma R., Kostense P.J., Bouter L.M., Heethaar R.M. Measures of cardiovascular autonomic nervous function: agreement, reproducibility, and reference values in middle age and elderly subjects. Diabetologia. 2003; 46: 330-338.
- Ninkovic V.M., Ninkovic S.M., Miloradovic V. Prevalence and risk factors for prolonged QT interval and QT dispersion in patients with type 2 diabetes. Acta Diabetol. 2016; 53 (5): 737-744.
- AbboudF.M., SinghM.V. Autonomic regulation of the immune system in cardiovascular diseases. Adv. Physiol. Educ. 2017; 41: 578-593.
- Чернышова Т.Е. Диабетическая нейропатия (патогенез, диагностика, лечение). Москва: Медпрак-тика-М; 2005. 108.
- Лукьянов А.Л. Ранняя вертикализация в остром периоде церебрального инсульта: автореф. дис. ... канд. мед. наук. Москва; 2013. 27.
- Черных Н.В. Современный подход к реабилитации пациентов с острым нарушением мозгового кровообращения. Центральный научный вестник. 2016; 1 (13): 52-56.


