Динамика прорастания семян ярового ячменя при воздействии y-излучения и свинца
Автор: Празян А.А., Битаришвили С.В., Гераськин С.А., Макаренко Е.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Зерновые культуры устойчивость и адаптация
Статья в выпуске: 3 т.58, 2023 года.
Бесплатный доступ
Посевы сельскохозяйственных культур испытывают одновременное воздействие факторов разной природы, поэтому актуально изучение раздельного и сочетанного действия техногенных стрессоров на растения. При прорастании семени происходит переход от гетеротрофного к автотрофному типу питания, что во многом определяет дальнейшее развитие растения, величину и качество урожая. Воздействие на семена биотических и абиотических факторов может существенно влиять на прохождение фаз прорастания. В настоящей работе впервые детально изучена динамика прорастания ячменя сорта Нур в условиях раздельного и сочетанного действия гамма-излучения и Pb(NO3)2. Показано, что предварительное облучение смягчает токсический эффект соли свинца во время прорастания. Цель работы - оценка влияния раздельного и сочетанного действия g-излучения и свинца, в том числе возможных синергетических и антагонистических эффектов взаимодействия стрессоров, на динамику прорастания семян ярового ячменя. Использовали семена ярового ячменя ( Hordeum vulgare L.) сорта Нур первой репродукции 2019 года. Процесс прорастания оценивали визуально на протяжении 70 ч, с детальным наблюдением каждые 2 ч с 18-го по 38-й ч и каждые 4 ч с 46-го по 70-й ч. Семена облучали дозой 20 Гр (мощность дозы 60 Гр/ч) на установке ГУР-120 (60Co) (ВНИИРАЭ, г. Обнинск). В работе также использовали соль Pb(NO3)2 в концентрации 2 мг/мл, которая угнетала развитие проростков, но не вела к их гибели. В контрольном варианте необлученные семена проращивали в 7 мл дистиллированной воды. В I опытном варианте в том же объеме воды проращивали облученные в дозе 20 Гр семена. Во II опытном варианте необлученные семена проращивали в воде с добавлением Pb(NO3)2 в концентрации 2 мг/мл, в III опытном варианте семена подвергали сочетанному действию g-излучения и свинца. Всего было исследовано 800 семян, по 200 семян в каждом варианте. Семена проращивали в термостате MIR-254 («Sanyo», Япония) в чашках Петри (по 20 шт. в каждой) на двойном слое фильтровальной бумаги («Белая лента», Россия) в темноте при 20±0,5 °C. Процесс прорастания делили на шесть основных фаз: «точка» - наклевывание, появление зародышевого корешка; корешки 1 (К-1), «вилка» - дифференциация зародышевого корешка на несколько корешков длиной 1-2 мм; корешки 2 (К-2) - начальный рост корешков, их размер менее длины семени; корешки 3 (К-3) - зрелые корешки размером более длины семени, ростка нет; росток - появление колеоптиля, семя имеет несколько корешков и росток размером менее половины длины семени; проросток - становление полноценного проростка, имеющего не менее двух корешков размером более длины семени и ростка размером более половины длины семени. Для сравнения средних значений использовали непараметрический критерий Манна-Уитни. В качестве количественной меры отклонения наблюдаемого эффекта от аддитивного и классификации эффектов комбинированного действия по группам аддитивность, синергизм, антагонизм использовали коэффициент взаимодействия Kw. При g-облучении семян статистически значимые отличия от контроля проявились в фазы К-1 и К-3. В фазы ростка и проростка значимые отличия были отмечены к концу наблюдений. В целом, g-облучение семян в дозе 20 Гр существенно не нарушало прохождение микрофенологических фаз развития. Обработка Pb(NO3)2 в концентрации 2 мг/мл замедляла прорастание семян, что проявлялось в задержке перехода в каждую последующую микрофенологическую фазу, а также в уменьшении доли семян на поздних стадиях развития в сравнении с контролем. Кроме этого, свинец негативно влиял на развитие корня, практически полностью исключив фазу К-3 из становления проростка. Сочетанное действие g-излучения и свинца также вело к замедлению развития, но в этом варианте доля семян, достигших фазы К-3, увеличивалась и приближалась к показателю в контроле, то есть g-излучение в дозе 20 Гр смягчало токсическое действие свинца. Следовательно, доза 2 мг/мл Pb(NO3)2, независимо от наличия воздействия g-облучения, оказывает ингибирующее действие на развитие семян, но не подавляет его полностью, а лишь снижает скорость развития.
Hordeum vulgare, ячмень, семена, фазы прорастания, свинец, γ-излучение, сочетанное действие облучения и свинца
Короткий адрес: https://sciup.org/142238894
IDR: 142238894 | УДК: 633.16:581.1:58.03/.04 | DOI: 10.15389/agrobiology.2023.3.525rus
Текст научной статьи Динамика прорастания семян ярового ячменя при воздействии y-излучения и свинца
В современных условиях техногенное загрязнение ограничивает урожайность и качество продукции сельскохозяйственных растений. Ареалы выбросов промышленных предприятий достигают огромных размеров. Только в Российской Федерации площадь загрязнения тяжелыми металлами (ТМ) составляет более 3,6 млн га (1). Свинец — один из наиболее распространенных загрязнителей агросферы. Он принадлежит к первому классу опасности (1) и способен влиять на морфологию и физиологию растений. Свинец не относится к необходимым для растений элементам, а его токсическое действие в значительной степени связано с разнообразными нарушениями метаболизма клеток и инактивацией ферментов (2). В результате свинец подавляет прорастание, удлинение корней, развитие проростков, продукцию хлорофилла, ингибирует ферменты цикла Кальвина, тем самым влияя на развитие растений (2, 3).
После открытия ионизирующего излучения (ИИ) началось исследование его влияния на живые организмы. В основе биологического действия ИИ лежит прямое взаимодействие квантов излучения с биологическими макромолекулами и формирование активных форм кислорода в процессе радиолиза воды (4). Уже первые эксперименты показали, что при повышении дозы облучения увеличивается поражение биологических структур, наблюдается утрата их функций, угнетение размножения и роста и, как итог, гибель организма. Однако в области малых доз были обнаружены отклонения от монотонного характера зависимости доза-эффект, что связано с качественным различием ответных реакций клеток на облучение в больших и малых дозах (5). Более того, в области малых доз фиксируют радиационный гормезис — эффект, при котором ингибирование физиологических процессов сменяется стимуляцией (6).
В реальных условиях на растения влияют комбинации факторов, различающихся по токсичности и механизмам действия. В связи с этим актуально изучение сочетанного действия факторов разной природы, которое может влиять на биохимические процессы, ускорять или замедлять метаболизм и, соответственно, отражаться на скорости развития растений (2, 7). Качественное различие межу механизмами биологического действия факторов и их мишеней в клетке может вызвать принципиально разные ответные реакции растений, от антагонизма до синергизма (8). В частности, предварительное облучение семян ячменя ( Hordeum vulgare L.), развитухи Таля ( Arabidopsis thaliana L.) и конских бобов ( Vicia faba L.) повышало устойчивость растений к токсическому действию свинца и кадмия (9-11).
При прорастании семени происходит переход от гетеротрофного к автотрофному типу питания, что во многом определяет дальнейшее развитие растения, величину и качество урожая. Воздействие на семена биотических и абиотических факторов может существенно влиять на прохождение фаз прорастания (12, 13). В научной литературе практически отсутствуют данные о детальной динамике процесса прорастания как в отсутствие техногенных факторов, так и в условиях, когда факторы разной природы действуют по отдельности или совместно.
В настоящей работе впервые детально изучена динамика прорастания у ячменя сорта Нур при раздельном и сочетанном действии γ - излучения и Pb(NO 3 ) 2 . Показано, что предварительное облучение смягчает токсический эффект соли свинца во время прорастания.
Цель работы заключалась в оценке влияния каждого из изученных факторов — γ -излучения и соли свинца и их сочетания, в том числе возможных синергетических и антагонистических эффектов взаимодействия стрессоров, на прорастание семян ярового ячменя.
Методика. Использовали семена ярового ячменя ( Hordeum vulgare L.) сорта Нур первой репродукции 2019 года. Процесс прорастания оценивали визуально на протяжении 70 ч, с детальным наблюдением каждые 2 ч с 18го по 38-й ч и каждые 4 ч с 46-го по 70-й ч.
Семена облучали дозой 20 Гр (мощность дозы 60 Гр/ч) на установке ГУР-120 (60Co) (ФГБНУ ВНИИРАЭ, г. Обнинск). В наших предыдущих экспериментах (14) эта доза обеспечивала стимуляцию развития проростков ячменя сортов Нур и Грэйс. Семена помещали в бумажные пакеты с площадью поверхности 25 см2, что гарантирует равномерное распределение дозы. Поглощенную семенами дозу излучения оценивали дозиметром ДКС-101 («Политехформ-M», Россия). В работе также использовали соль Pb(NO 3 ) 2 в концентрации 2 мг/мл, которая угнетала развитие проростков, но не вела к их гибели (15).
В контрольном варианте необлученные семена проращивали в 7 мл дистиллированной воды. В I опытном варианте в том же объеме воды проращивали семена, облученные в дозе 20 Гр. Во II опытном варианте необ-лученные семена проращивали в воде с добавлением Pb(NO 3 ) 2 в концентрации 2 мг/мл, в III опытном варианте семена подвергали сочетанному действию Y -излучения и соли винца. Всего было исследовано 800 семян, по 200 семян в каждом варианте. Семена проращивали в термостате MIR-254 («Sanyo», Япония) в чашках Петри (по 20 шт. в каждой) на двойном слое фильтровальной бумаги («Белая лента», Россия) в темноте при 20±0,5 ° C.
Для оценки микрофенологических фаз прорастания семян использовали методику А.С. Казаковой и С.Ю. Козяевой (16). Процесс прорастания делили на шесть основных фаз: «точка» — наклевывание, появление зародышевого корешка; корешки 1 (К-1), «вилка» — дифференциация зародышевого корешка на несколько корешков длиной 1-2 мм; корешки 2 (К-2) — начальный рост корешков, их размер менее длины семени; корешки 3 (К-3) — зрелые корешки размером более длины семени, ростка нет; росток — появление колеоптиля, семя имеет несколько корешков и росток размером менее половины длины семени; проросток — становление полноценного проростка, имеющего не менее двух корешков размером более длины семени и ростка размером более половины длины семени. Фаза «точка» определяла начало наклевывания зачаточного корешка, длина которого не должна превышать 1 мм. При прорастании семени выделяли фазы роста побега и корня (17), а рост корешков, в свою очередь, делили на три этапа. Шкала согласуется с подходами, заложенными в основу ГОСТа на методы определения всхожести (18).
Для сравнения средних значений использовали непараметрический критерий Манна-Уитни. В качестве количественной меры отклонения наблюдаемого эффекта от аддитивного и классификации эффектов комбинированного действия по группам аддитивность, синергизм, антагонизм использовали коэффициент взаимодействия K w (8), который рассчитывали по формуле:
= AA(y, TM)
,
AA(O, TM) + AA(y, O)
где AA(X,Y) = A^Y - A(O,O) — инкремент (превышение индуцированного стрессорами уровня над спонтанным) при дозе ионизирующего излучения X и концентрации тяжелого металла Y.
Поскольку уровень экспериментально наблюдаемого эффекта — это случайная величина, которая имеет вероятностное распределение, то значение коэффициента взаимодействия K w также случайная величина. Для классификации отклика растений на сочетанное воздействие необходимо проверить статистическую гипотезу о равенстве K w единице. При этом если K w ⁓ 1, то результат классифицируют как аддитивный; если K w статистически значимо меньше 1 — как антагонизм; если K w статистически значимо больше 1 — как синергизм.
Расчеты проводили в программах Microsoft Excel 2010 и Statistica v. 8.0 («StatSoft, Inc.», США). Приведенные различия подтверждены статистически с уровнем значимости p < 0,05.
Результаты. В фазу «точка» (рис. 1) у семян, облученных дозой 20 Гр (I опытный вариант), значимые различия (p < 0,05) с контролем были обнаружены только на 20-й ч. В фазу К-1 отличия от контроля проявлялись на 30-й ч прорастания (рис. 2, А), при этом пик развития обеих групп приходился на 32-й ч. При переходе в фазу К-3 (см. рис. 2, В) статистически значимое превышение контроля у облученных семян наблюдали с 58-го по 62-й ч. В фазу ростка (рис. 3, А) значимые отличия от контроля (p < 0,05) отмечали на 54-й и 66-й ч прорастания. В целом, развитие облученных семян повторяло динамику контрольных семян, а немногочисленные отклонения не носили систематического характера.
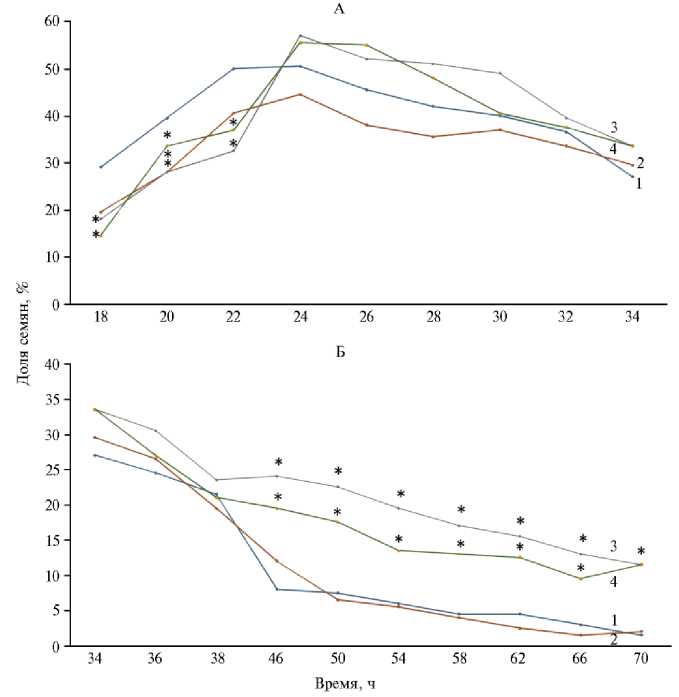
Рис. 1. Доля семян ярового ячменя ( Hordeum vulgare L.) сорта Нур в фазу «точка» с 18-го по 34-й ч (А) и с 34-го по 70-й ч прорастания (Б) : 1 — контроль, 2 — семена, облученные дозой 20 Гр (I опытный вариант), 3 — обработка семян Pb(NO 3 ) 2 (II опытный вариант), 4 — семена, подвергшиеся сочетанному действию у -излучения и свинца (III опытный вариант) (лабораторный опыт). Всего было исследовано 800 семян, по 200 семян в каждом варианте.
* Различия с контролем статистически значимы при p < 0,05.
При обработке свинцом (II опытный вариант) было зафиксировано замедление прохождения всех стадий развития. С первых часов наблюдали замедление набухания, вследствие чего доля семян, вступивших в фазу «точка», была значимо меньше (p < 0,05) по сравнению с контролем (см. рис. 1, А) до 22-го ч включительно. Однако уже к 24-му ч доля обработан-528
ных свинцом семян в фазу «точка» достигала и даже несколько превышала контроль, что свидетельствовало о выравнивании темпов роста. Статистически значимое (p < 0,05) повышение доли обработанных свинцом семян, достигших фазы «точка», в сравнении с контролем было зафиксировано, начиная с 46-го ч и отмечалось до конца наблюдений (см. рис. 1, Б).
Время, ч
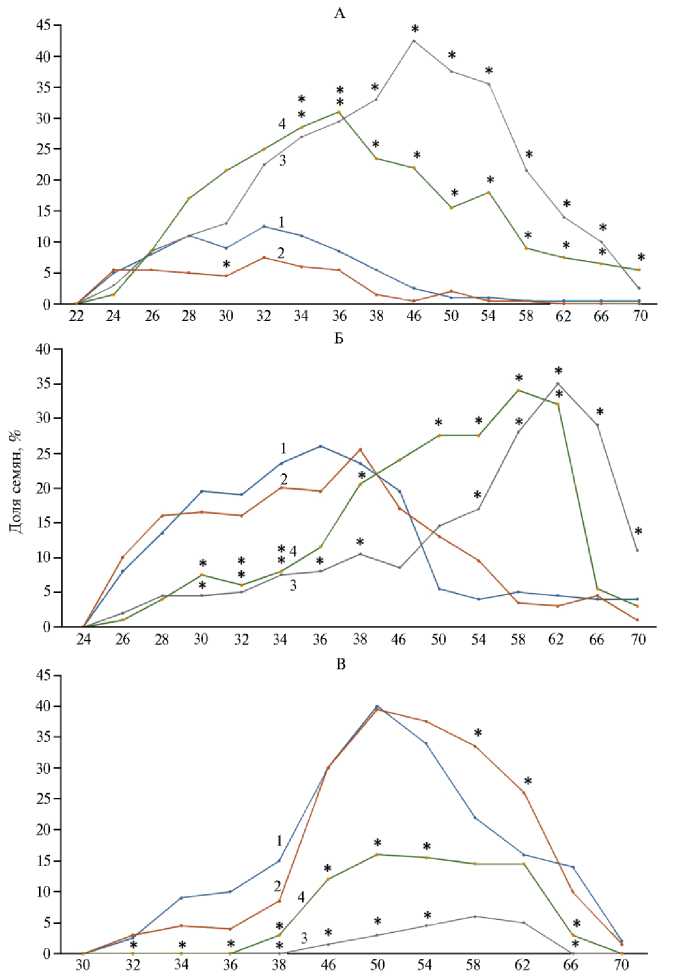
Рис. 2. Доля семян ярового ячменя ( Hordeum vulgare L.) сорта Нур в фазах К-1 (А) , К-2 (Б) и К-3 (В) с 30-го по 70-й ч прорастания: 1 — контроль, 2 — семена, облученные дозой 20 Гр (I опытный вариант), 3 — обработка семян Pb(NO 3 ) 2 (II опытный вариант), 4 — семена, подвергшиеся сочетанному действию γ -излучения и свинца (III опытный вариант) (лабораторный опыт). Всего было исследовано 800 семян, по 200 семян в каждом варианте.
* Различия с контролем статистически значимы при p < 0,05.
На стадии К-1 значимые отличия от контроля (p < 0,05) наблюдали с 34-го по 66-й ч (см. рис. 2, А). Доля семян, достигших фазы К-1 (43 %), во II варианте была наибольшей на 46-й ч. Это значение оказалось выше, чем в III варианте (31 %), в контроле (13 %) и в I опытном варианте (7,5 %), то есть воздействие свинцом существенно замедляло развитие семян на стадии К-1. Основная доля обработанных свинцом семян достигала стадии К-2 (см. рис. 2, Б) к 62-му ч, что на 26 ч позже, чем контрольная группа. При этом значимые различия с контролем отмечали с 30-го ч до завершения наблюдений. С 46-го по 50-й ч было выявлено отсутствие значимых различий по доле семян, вошедших в фазу К-2, поскольку в этом промежутке начинался рост числа таких семян во II варианте и резкое снижение их количества в контроле.
Доля семян в фазе К-3 (см. рис. 2, В) при воздействии свинца существенно уменьшилась по сравнению с контролем с 32-го по 54-й ч. В фазу ростка статистически значимое превышение (p < 0,05) над контролем наблюдалось с 66-го ч (см. рис. 3, А). Поскольку доля семян в стадии проростка во II варианте увеличивалась гораздо медленнее (см. рис. 3, Б), то число таких семян в контроле было статистически значимо больше. В целом, обработанные свинцом семена демонстрировали медленное вхождение в фазу проростка (+1 % за 4 ч, начиная с 62-го ч).
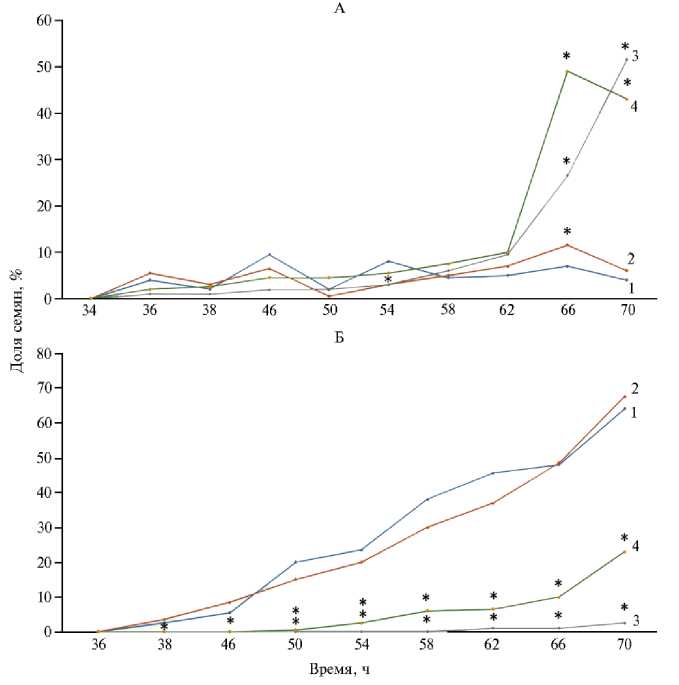
Рис. 3. Доля семян ярового ячменя ( Hordeum vulgare L.) сорта Нур в фазы ростка (А) и проростка (Б) и с 34-го по 70-й ч прорастания: 1 — контроль, 2 — семена, облученные дозой 20 Гр (I опытный вариант), 3 — обработка семян Pb(NO 3 ) 2 (II опытный вариант), 4 — семена, подвергшиеся сочетанному действию Y -излучения и свинца (III опытный вариант) (лабораторный опыт). Всего было исследовано 800 семян, по 200 семян в каждом варианте.
* Различия с контролем статистически значимы при p < 0,05.
При сочетанном воздействии γ -излучения и свинца (III опытный вариант) в стадии «точка» семена развивались аналогично обработанным только свинцом (см. рис. 1 А, Б). Наибольшая доля семян в III группе достигала фазы К-1 на 36-й ч (31 %). Это значение было меньше, чем при обработке свинцом (43 %), но статистически значимо (p < 0,05) больше в сравнении с контролем (13 %) и I вариантом (7,5 %). На стадии К-2 семена, подвергнутые сочетанному воздействию двух факторов, в интервале с 30-го по 38-й ч и с 50-го по 62-й ч демонстрировали значимо меньшую (p < 0,05) активность в сравнении с контрольным вариантом (см. рис. 2, Б).
В фазу К-3 в III варианте наблюдался значительный (p < 0,05), хотя и меньший, чем в контроле и при действии γ-излучения, эффект: прирост приходился на 50-й ч, однако интервал значимых отличий приходился на период с 32-го по 54-й ч (см. рис. 2, В). С 46-го по 62-й ч в III варианте доля семян в фазе К-3 превышала значение во II варианте. При этом с 46-го по 54-й ч коэффициент взаимодействия K w был статистически значимо (p < 0,05) меньше 1, что свидетельствует об антагонистическом взаимодействии факторов и позволяет сделать вывод о том, что γ -облучение частично нивелирует токсическое действие свинца.
В фазу ростка значимые (p < 0,05) расхождения с контролем в III варианте наблюдались с 66-го ч (см. рис. 3, А). Доля семян, достигших фазы проростка в III варианте, достоверно (p < 0,05) отличалась от контроля, начиная с 38-го ч до конца эксперимента ввиду существенного замедления развития. На 70-й ч статистически значимой (p < 0,05) становилась разница между семенами во II и III вариантах, то есть при предварительном воздействии ИИ темп прорастания приходит в норму быстрее, чем при обработке одним свинцом. Кроме того, на основании значений K w в этих группах был показан антагонистический характер взаимодействия факторов.
Время, за которое максимальное число семян ярового ячменя ( Hordeum vulgare L.) сорта Нур достигало определенной фазы развития, в зависимости от действия на семена Y -излучения и свинца (лабораторный опыт)
|
Вид воздействия |
Фаза |
Пик развития, ч |
Число семян, шт. |
|
Контроль |
«Точка» |
24-й |
101 |
|
К-1 |
32-й |
25 |
|
|
К-2 |
36-й |
52 |
|
|
К-3 |
50-й |
80 |
|
|
Росток |
46-й |
19 |
|
|
Проросток |
70-й |
128 |
|
|
I опытный вариант, |
«Точка» |
24-й |
89 |
|
γ -излучение |
К-1 |
32-й |
15 |
|
К-2 |
38-й |
51 |
|
|
К-3 |
50-й |
79 |
|
|
Росток |
46-й |
13 |
|
|
Проросток |
70-й |
135 |
|
|
II опытный вариант, |
«Точка» |
24-й |
114 |
|
Pb(NO 3 ) 2 |
К-1 |
46-й |
85 |
|
К-2 |
62-й |
70 |
|
|
К-3 |
58-й |
12 |
|
|
Росток |
70-й |
103 |
|
|
Проросток |
70-й |
5 |
|
|
III опытный вариант, |
«Точка» |
24-й |
111 |
|
γ -излучение + Pb(NO 3 ) 2 |
К-1 |
36-й |
50 |
|
К-2 |
58-й |
68 |
|
|
К-3 |
50-й |
32 |
|
|
Росток |
66-й |
98 |
|
|
Проросток |
70-й |
46 |
Примечание. Подробное описание вариантов см. в разделе «Методика».
Из представленных результатов следует, что семена, обработанные γ-излучением и свинцом, развивались неравномерно, переход к каждой последующей фазе происходил в разное время. При этом для каждого ва- рианта было определено среднее время, за которое большая часть семян проходила определенную фазу развития (табл.).
В целом, обработанные свинцом семена отставали в развитии от контрольных и γ -облученных семян. При этом они достигали более ранних стадий в большем количестве, чем в контроле и I опытном варианте за одинаковые промежутки времени. Однако число семян, обработанных Pb(NO 3 ) 2 , в более поздних стадиях развития, наоборот, было меньше по сравнению с контролем и I опытным вариантом.
Семя — особое состояние растения, в котором практически полностью подавлен метаболизм (12) с целью сохранения ресурсов для развития ростка. Поступление в семя воды инициирует процесс набухания, и запасные вещества преобразуются в растворимые соединения, используемые для питания зародыша. Запускается каскад событий, направленных на перевод клеток зародыша в активное состояние. Дерепрессия генома, вызванная ионизирующим излучением или тяжелыми металлами, дает начало ключевым процессам метаболизма: усиливается синтез нуклеиновых кислот, белков, увеличивается активность многих ферментов, растет содержание фитогормонов — активаторов роста, управляющих процессами роста и развития растений (14, 19, 20).
Поглощенная семенами энергия ионизирующего излучения преобразуется главным образом в свободные радикалы, длительно существующие в воздушно-сухих семенах. При поступлении в семя воды и кислорода они быстро вступают в реакцию с образованием сильных окислителей-гидроперекисей и радикала гидроксила (21). Активные формы кислорода переводят геном клеток зародыша в активное состояние. В предыдущих исследованиях (14, 19) было показано, что облучения в стимулирующих дозах достаточно для воздействия на регуляторные системы растения и ускорение реализации программы развития.
Разные дозы облучения семян ячменя могут индуцировать качественно разные эффекты — от угнетения (при дозе 50 Гр) до стимуляции (при дозе 20 Гр) развития растений (14). В нашем эксперименте статистически недостоверная стимуляция темпов развития облученных семян наблюдалась на стадии К-1, но вскоре они сравнялись по темпам развития с контрольной группой.
Аналогично действию ионизирующего излучения, воздействие тяжелых металлов на семена может вести (в зависимости от концентрации) как к ингибированию, так и к стимуляции роста (20). Основной барьер для ТМ — ткани корневой системы, способные связывать катионы (22), но это не единственный способ, с помощью которого растение способно снижать поглощение ТМ. Так, клетки эндодермы, выполняющие важную роль в развитии боковых корней, первыми подвергаются воздействию ТМ, что существенно тормозит их функционирование и, соответственно, общее развитие корня. По этой причине при избытке в почве тяжелых металлов в первую очередь нарушается развитие корневой системы (22).
В нашем исследовании явное повреждение корневой системы наблюдалось при оценке стадий развития корня. Согласно использованной нами методике, семена считаются полноценными проростками при достижении стадии К-3 и образовании ростка длиной более половины семени (16). Мы изменили критерий прорастания для семян, обработанных нитратом свинца. Фаза ростка считалась достигнутой в случае прорастания начального колеоптиля, без вступления в фазу К-3. Это было связано с накоплением в корне большего количества свинца по сравнению с другими частями растения (23). У остальных частей проростка при концентрации 2 мг/мл темп развития был близок к нормальному. Прорастание обработанных свинцом семян ячменя происходило с задержкой развития колеоптиля примерно на 16 ч, минуя стадию К-3, что может создавать риск для развития растений в будущем.
Еще одна мишень ТМ — плазмалемма. Воздействие ионами свинца изменяет ее проницаемость и ионный баланс, препятствует работе H+-АТФаз (24). Причиной этих нарушений служат ошибки в синтезе липидов и их повышенное окисление активными формами кислорода (25). Кроме того, свинец может воздействовать на метаболизм ферментов за счет связывания с SH-группами. Как следствие, разрушаются тилакоиды, происходят сбои в цикле Кальвина, возникает водный стресс, ингибируется деление клеток (нарушение цитокинеза из-за падения скорости образования микротрубочек) и повреждаются митохондрии.
По нашему мнению, описанные особенности действия ИИ и ТМ могли привести к полученным в настоящей работе результатам. В обработанных Pb(NO 3 ) 2 семенах пшеницы было отмечено замедление развития корней (26). Представленные в работе А.В. Дикарева с соавт. (15) результаты свидетельствуют о значительной чувствительности корней ячменя к действию свинца. Длина корешков резко уменьшалась уже при концентрации Pb(NO 3 ) 2 1 мг/мл. Обработка тяжелыми металлами привела к значительному замедлению прорастания пшеницы (27). После внесения Cu, Cd, Ni длина ростка уменьшалась соответственно на 51, 48 и 33 %, а корней — на 91, 63 и 72 % (27). Ингибирование роста было связано со значительным накоплением металлов в тканях проростков пшеницы. При воздействии на чечевицу свинцом в концентрациях 0,5 мМ ( ∼ 0,56 мг/мл) и 1000 мМ ( ∼ 1,12 мг/мл) наблюдалось ингибирование всхожести на 2,5 и 10 % (28).
Эффекты отдельно взятых стрессоров и их сочетанного действия заметно различаются (8, 29, 30, 31). Причиной этого может быть повышенное содержание активных форм кислорода (АФК), индуцированное как одним из стрессоров, так и их сочетанным действием. Тяжелый металл свинец и γ -излучение как раздельно, так и совместно вызывают ряд специфических реакций. Например, взаимодействуя с ДНК, каждый из стрессоров может частично подавлять системы репарации или индуцировать мутации (8). Формирование мутаций — протяженный во времени процесс, поэтому внешние воздействия модифицируют долю потенциальных повреждений, фиксируемых в мутации. При этом малые дозы ИИ могут активировать системы репарации и антиоксидантную систему (32).
Мы не наблюдали эффекта γ-излучения в отношении темпа развития семян ячменя, при этом свинец существенно замедлял развитие растения. Сочетанное действие привело к статистически подтвержденным антагонистическим эффектам. Схожие результаты были получены в работе H.I. Mohamed (33), где сочетанное действие ИИ в дозе 25 Гр и ионов свинца в концентрации 300 мкM (∼ 0,6 мг/мл) статистически значимо увеличивало длину корня и ростка у вигны китайской (Vigna sinensis L.). При повышении дозовой нагрузки до 80 Гр статистически значимо замедлялось развитие ростка, а размер корня увеличивался. В то же время при повышении концентрации свинца до 600 мкM (∼ 1,2 мг/мл) и облучении дозой 25 Гр наблюдали статистически значимое увеличение всех показателей проростка. Учитывая, что при обработке семян только свинцом в двух концентрациях происходило статистически значимое уменьшение всех параметров проростка, а при сочетанном действии ситуация была обратной, можно пола- гать, что γ-облучение частично нивелировало токсический эффект, оказываемый свинцом на семена вигны китайской (Vigna sinensis L.). Причиной этого может быть увеличение эффективности использования белков и метаболитов, модуляция количества АФК, а также запуск репарационных механизмов (34). Аналогично предварительная обработка семян горного ячменя дозой γ-излучения 50 Гр повышала толерантность к тяжелым металлам у проростков за счет снижения содержания H2O2 (10). Одновременно повышалась активность антиоксидантных ферментов, что облегчало вызванный тяжелыми металлами окислительный стресс.
Этот феномен также подтверждается в исследовании на Arabidopsis taliana L. (9). В этой работе авторы рассматривали влияние сочетанного действия Pb(NO 3 ) 2 и γ -излучения в дозах 25-150 Гр (9). При дозе 50 Гр наблюдали статистически значимую стимуляцию развития корешка в сравнении с растением, получившим 500 мкM ( ∼ 1,02 мг/мл) Pb(NO 3 ) 2 . При увеличении дозы до 150 Гр происходило угнетение роста корня.
В нашем эксперименте динамика развития растений в контроле и при γ -облучении совпадала (см. табл. 2). В обоих случаях пик фазы К-3 наступал позже, чем пик фазы ростка. Возможно, это связано с полиморфизмом по всхожести семян, а также специфичностью развития некоторых семян, у которых росток начинает развиваться одновременно с корнем, не достигая фазы К-3. В случае сочетанного действия и раздельного воздействия свинцом отмечали смещение пика развития К-2 на более позднее время относительно следующей стадии. В силу специфичности действия свинца на развитие корня (15) лишь малая часть семян достигла стадии К-3. Большая часть семян миновала эту фазу и перешла в стадию ростка. Отметим, что разница между временем достижения пика развития стадий К-2 и К-3 при раздельном действии свинца достигала 4 ч, а при сочетанном — 8 ч, однако в последнем случае росток появлялся раньше. По-види-мому, предварительное γ -облучение активировало антиоксидантные и репарационные системы, что частично нивелировало действие свинца на развитие ростка. Аналогичные результаты были получены в работах других авторов (9-11). Пик стадии проростка для всех растений приходился на 70 ч, поскольку именно до этого времени проводили наблюдения.
Таким образом, γ-облучение семян ярового ячменя (Hordeum vul-gare L.) сорта Нур в дозе 20 Гр существенно не нарушало прохождение микрофенологических фаз развития. Обработка Pb(NO3)2 в концентрации 2 мг/мл замедляла прорастание семян, что проявлялось в задержке перехода в каждую последующую микрофенологическую фазу, а также в уменьшении доли семян на поздних стадиях развития в сравнении с контролем. Кроме этого, свинец негативно влиял на развитие корня, практически полностью исключив фазу К-3 из становления проростка. Сочетанное действие γ-из-лучения и свинца также вело к замедлению развития, но в этом варианте доля семян, достигших фазы К-3, увеличивалась и приближалась к показателю в контроле, то есть γ-излучение в дозе 20 Гр смягчало токсическое действие свинца. Следовательно, доза 2 мг/мл Pb(NO3)2, независимо от наличия воздействия γ-облучения, оказывает ингибирующее действие на развитие семян, но не подавляет его полностью, а лишь снижает скорость развития. Почасовая оценка процессов прорастания семян в условиях раздельного и сочетанного действия свинца и γ-излучения дополняет представления о механизмах адаптации растений к техногенному воздействию на ранних этапах развития. Результаты работы будут использованы в исследованиях по развитию генетических технологий получения высокоурожай- ных сортов ячменя, устойчивых к техногенным факторам.
Список литературы Динамика прорастания семян ярового ячменя при воздействии y-излучения и свинца
- Алексахин Р.М., Фесенко С.В., Гераськин С.А., Филипас А.С., Удалова А.А., Анисимов В.С., Селезнева Е.М., Ульяненко Л.Н., Круглов С.В., Мирзоев Э.Б., Белова Н.В., Бакалова О.Н., Дикарев В.Г., Исамов Н.Н. Методика оценки экологических последствий техногенного загрязнения агроэкосистем. М., 2004.
- Серегин И.В., Иванов В.Б. Физиологические аспекты токсического действия кадмия и свинца на высшие растения. Физиология растений, 2001, 48(4): 606-630.
- Pourrut B., Shahid M., Dumat C., Winterton P., Pinelli E. Lead uptake, toxicity, and detoxifi-cation in plants. In: Reviews of environmental contamination and toxicology, vol. 213 /D. Whitacre (ed.). Springer, New York, NY, 2011: 113-136 (doi: 10.1007/978-1-4419-9860-6_4).
- Gudkov S.V., Grinberg M.A, Sukhov V., Vodeneev V. Effect of ionizing radiation on physiolog-ical and molecular processes in plants. Journal of Environmental Radioactivity, 2019, 202: 8-24 (doi: 10.1016/j.jenvrad.2019.02.001).
- Гераськин С.А. Критический анализ современных концепций и подходов к оценке биологического действия малых доз ионизирующего излучения. Радиационная биология. Радиоэкология, 1995, 35(5): 563-570.
- Calabrese E.J., Blain R.B. Hormesis and plant biology. Environmental Pollution, 2009, 157: 42-48 (doi: 10.1016/j.envpol.2008.07.028).
- Санжарова Н.И., Цыгвинцев П.Н., Анисимов В.С., Гераськин С.А., Кузнецов В.К., Лой Н.Н., Пименов Е.П., Панов А.В., Ратников А.Н., Санжаров А.И., Гончарова Л.И., Свириденко Д.Г., Арышева С.П., Анисимова Л.Н., Дикарев А.В., Попова Г.И., Перево-лоцкая Т.В., Суслов А.А., Фригидова Л.М., Васильев Д.В., Курбаков Д.Н., Спиридо-нов С.И. Тяжелые металлы в агроценозах: миграция, действие, нормирование. Обнинск, 2019.
- Гераськин С.А., Дикарев В.Г., Удалова А.А., Дикарева Н.С. Влияние комбинированного действия ионизирующего излучения и солей тяжелых металлов на частоту хромосомных аберраций в листовой меристеме ярового ячменя. Генетика, 1996, 32(2): 279-288.
- Qi W., Zhang L., Wang L., Xu H., Jin Q., Jiao Z. Pretreatment with low-dose gamma irradiation enhances tolerance to the stress of cadmium and lead in Arabidopsis thaliana seedlings. Ecotoxi-cology and Environmental Safety, 2015, 115: 243-249 (doi: 10.1016/j.ecoenv.2015.02.026).
- Wang X., Ma R., Cui D., Shan Z., Jiao Z. Physio-biochemical and molecular mechanism un-derlying the enhanced heavy metal tolerance in highland barley seedlings pre-treated with low-dose gamma irradiation. Scientific Reports, 2017, 7: 14233 (doi: 10.1038/s41598-017-14601-8).
- El-Shora H.M., Habib H.M., Kamel H.A., Mostafa I.Y. Pretreatment with low-doses of gamma irradiation enhances Vicia faba plant tolerance to lead stress. Bioscience Research, 2019, 16(2): 1528-1537.
- Penfield S., King J. Towards a systems biology approach to understanding seed dormancy and germination. Proceedings of the Royal Society B: Biological Sciences, 2009, 276(1673): 3561-3569 (doi: 10.1098/rspb.2009.0592).
- Sethy S.K., Ghosh S. Effect of heavy metals on germination of seeds. Journal of Natural Science, Biology, and Medicine, 2013, 4(2): 272-275.
- Geras'kin S., Churyukin R., Volkova P. Radiation exposure of barley seeds can modify the early stages of plants' development. Journal of Environmental Radioactivity, 2017, 177: 71-83 (doi: 10.1016/j.jenvrad.2017.06.008).
- Дикарев А.В., Дикарев В.Г., Дикарева Н.С., Гераськин С.А. Внутривидовой полиморфизм ярового ячменя (Hordeum vulage L.) по устойчивости к действию свинца. Сельскохозяйственная биология, 2014, 5: 78-87 (doi: 10.15389/agrobiology.2014.5.78rus).
- Казакова А.С., Козяева С.Ю. Шкала микрофенологических фаз прорастания семян ярового ячменя. Сельскохозяйственная биология, 2009, 3: 88-92.
- Строгина И.Г. Общее семеноведение полевых культур. М., 1966.
- ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести. М., 1985.
- Битаришвили С.В., Волкова П.Ю., Гераськин С.А. Влияние γ-облучения семян на фитогормональный статус проростков ячменя. Физиология растений, 2018, 65(3): 223-231 (doi: 10.7868/S0015330318030065).
- Poschenrieder C., Cabot C., Martos S., Gallego B., Barceló J. Do toxic ions induce hormesis in plants? Plant Science, 2013, 212: 15-25 (doi: 10.1016/j.plantsci.2013.07.012).
- Кузин А.М., Каушанский Д.А. Прикладная радиобиология: (теоретические и технические основы). М., 1981.
- Серегин И.В., Иванов В.Б. Является ли барьерная функция эндодермы единственной причиной устойчивости ветвления корней к солям тяжелых металлов. Физиология растений, 1997, 44: 922-925.
- Nishizono H., Kubota K., Suzuki S., Ishii F. Accumulation of heavy metals in cell walls of Polygonum cuspidatum roots from metalliferous habitats, Plant and Cell Physiology, 1989, 30(4): 595-598 (doi: 10.1093/oxfordjournals.pcp.a077780).
- Ouarity O., Boussama N., Zarrouk M., Cherif A., Ghorbal M.H. Cadmium- and copper-induced changes in tomato membrane lipids. Phytochemistry, 1997, 45(7): 1343-1350 (doi: 10.1016/S0031-9422(97)00159-3).
- Vodnik D., Jentschke G., Fritz E., Denayer F.O., Degen G.H. Root-applied cytokinin reduces lead uptake and affects its distribution in Norway spruce seedlings. Physiol. Plant, 1999, 106: 75-81 (doi: 10.1034/j.1399-3054.1999.106111.x).
- Patra M., Bhowmik N., Bandopadhyay B., Sharma A. Comparison of mercury, lead and arsenic with respect to genotoxic effects on plant systems and the development of genetic tolerance. Environmental and Experimental Botany, 2004, 52(3): 199-223 (doi: 10.1016/j.envexpbot.2004.02.009).
- Gajewska E., Skłodowska M. Differential effect of equal copper, cadmium and nickel concentra-tion on biochemical reactions in wheat seedlings. Ecotoxicology and Environmental Safety, 2010, 73(5): 996-1003 (doi: 10.1016/j.ecoenv.2010.02.013).
- Kiran Y., Sahin A. The effects of the lead on the seed germination, root growth, and root tip cell mitotic divisons of lens culinaris medic. Gazi University Journal of Science, 2005, 18(1): 17-25.
- Zandalinas S.I., Mittler R. Plant responses to multifactorial stress combination. New Phytologist, 2022, 234(4): 1161-1167 (doi: 10.1111/nph.18087).
- Geras’kin S.A., Kim J.K, Dikarev V.G., Oudalova A.A., Dikareva N.S., Spirin Y.V. Cytogenetic effects of combined radioactive (137Cs) and chemical (Cd, Pb, and 2,4-D herbicide) contamina-tion on spring barley intercalar meristem cells. Mutation Research, 2005, 586(2): 147-159 (doi: 10.1016/j.mrgentox.2005.06.004).
- Mittler R. Abiotic stress, the field environment and stress combination. Trends in Plant Science, 2006, 11(1): 15-19 (doi: 10.1016/j.tplants.2005.11.002).
- Geras'kin, S.A., Oudalova A.A., Kim J.K., Dikarev V.G., Dikareva N.S. Cytogenetic effect of low dose -radiation in Hordeum vulgare seedlings: non-linear dose-effect relationship. Radiation & Environmental Biophysics, 2007, 46: 31-41 (doi: 10.1007/s00411-006-0082-z).
- Mohamed H.I. Molecular and biochemical studies on the effect of gamma rays on lead toxicity in cowpea (Vigna sinensis) plants. Biological Trace Element Research, 2011, 144: 1205-1218 (doi: 10.1007/s12011-011-9058-1).
- Volkova P.Y., Duarte G.T., Soubigou-Taconnat L., Kazakova E.A., Pateyron S., Bondarenko V.S., Bitarishvili S. V., Makarenko E.S., Churyukin R.S., Lychenkova M.A., Gor-batova I.V., Meyer C., Geras’kin S.A. Early response of barley embryos to low- and high-dose gamma irradiation of seeds triggers changes in the transcriptional profile and an increase in hy-drogen peroxide content in seedlings. Journal of Agronomy and Crop Science, 2020, 206(2): 277-295 (doi: 10.1111/jac.12381).


