Динамика титра антител к ацетилхолиновым рецепторам при миастении
Автор: Романова Т.В., Повереннова И.Е., Захаров А.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Неврология
Статья в выпуске: 1 т.14, 2018 года.
Бесплатный доступ
Цель: изучить связь между степенью клинической тяжести миастении и титром антител к ацетилхолиновым рецепторам (AT к АХР) для поиска возможных корреляций изменения концентрации AT к АХР с тяжестью заболевания. Материал и методы. Исследование антител проводилось иммуноферментным методом. Международная клиническая классификация (MGFA) использована для оценки тяжести болезни. Проведено сопоставление уровня антител с тяжестью состояния и формой заболевания на этапе постановки диагноза у 65 пациентов, а также при повторных исследованиях у 26 пациентов. Результаты. Титр антител к АХР не коррелировал с тяжестью состояния, однако получена прямая зависимость изменения уровня AT к АХР с изменением клинического состояния в ходе течения заболевания. Заключение. Повторные определения концентрации антител к ацетилхолиновым рецепторам помогают предсказать клиническое состояние пациента и могут быть использованы для коррекции иммуносупрессивной терапии.
Антитела к ацетилхолиновым рецепторам, динамика, иммуноферментный метод, миастения
Короткий адрес: https://sciup.org/149135055
IDR: 149135055
Текст научной статьи Динамика титра антител к ацетилхолиновым рецепторам при миастении
адекватной терапии пациенты с миастенией имеют хорошие шансы для достижения компенсации процесса, ремиссии заболевания и улучшения качества жизни. Наряду с клиническими проявлениями, положительной реакцией на введение антихолинэсте-разных препаратов и электромиографическими феноменами, увеличение титра аутоантител является общепринятым критерием диагностики аутоиммунной миастении [6–8].
У 85-90% больных в патогенезе заболевания ведущую роль играет выработка аутоантител к ацетилхолиновым рецепторам (АХР) постсинаптической мембраны нервно-мышечного соединения [3, 6, 9]. Большинство авторов подчеркивают отсутствие прямых корреляций между уровнем антител (АТ) к АХР и тяжестью клинических проявлений болезни в основном за счет высокой индивидуальной вариабельности данного показателя [2, 3, 8, 10]. Связь между концентрацией АТ к АХР и клиническим состоянием у отдельного пациента остается неясной. Исследования, оценивающие эту ассоциацию, противоречивы, данных недостаточно, и большинство исследований проведено в 80-х годах прошлого столетия. Потребность в прогностическом маркере для решения вопросов, касающихся интенсивности иммуносупрессивной терапии, чрезвычайно высока. В отдельных исследованиях показано, что у одного и того же больного прослеживается зависимость между концентрацией АТ к АХР и особенностями клинической картины болезни [3, 11, 12]. Уровень АТ к АХР уменьшается на фоне иммуносупрессивной терапии, после проведения тимэктомии и плазмафереза [3, 8, 9]. Однако в ряде публикаций отмечена диссоциация между изменением уровня АТ к АХР и колебаниями в состоянии больных [4, 12].
Цель: изучить связь между степенью клинической тяжести миастении и титром антител к ацетилхолиновым рецепторам (АТ к АХР) для поиска возможных корреляций изменения концентрации АТ к АХР с тяжестью заболевания.
Материал и методы. Данное исследование является ретроспективным, основанным на анализе уровня антител к ацетилхолиновым рецепторам у больных миастенией, состоящих на динамическом учете в Самарском областном миастеническом центре, созданном в 1999 г. на базе кафедры неврологии и нейрохирургии Самарского государственного медицинского университета и Самарской областной клинической больницы им. В. Д. Середавина. Исследование титра АТ к АХР проведено 198 пациентам: 141 женщине и 57 мужчинам. Возраст обследованных колебался от 5 до 85 лет.
Повышения титра АТ к АХР не выявлено у 9 человек, хотя во всех случаях диагноз миастении поставлен на основании жалоб, данных клинического обследования, положительной прозериновой пробы, а также подтвержден результатами декремент-теста и положительной реакцией на иммуносупрессивную терапию. Таким образом, серонегативный вариант по АТ к АХР выявлен в 4,5% случаев. При серопозитивном варианте уровень титра АТ к АХР колебался от 0,9 до 31,5 нмоль/л. Длительность болезни к моменту обследования варьировалась от 2 месяцев до 27 лет. У многих больных исследование проводилось на фоне или после иммуносупрессивной терапии и/ или тимэктомии.
Для оценки имеющегося уровня АТ к АХР на диагностическом этапе заболевания до начала патогенетической терапии отобрано 65 больных, обратившихся в Самарский миастенический центр впервые для постановки и уточнения диагноза в 2015–2017 гг. Длительность заболевания к моменту проведения анализа составила от трех недель до полутора лет. В ходе исследования проводилось сопоставление титра АТ к АХР с тяжестью состояния пациента. Тяжесть клинических проявлений миастении оценивали по шкале, разработанной Американским фондом изучения миастении (MGFA) [13]:
I — изолированная слабость наружных мышц глаз любой степени выраженности;
IIа — слабость иных мышц легкой степени выраженности в сочетании или без слабости глазных мышц, без выраженной слабости краниобульбарной мускулатуры;
IIb — преобладание слабости краниобульбарных мышц и/или дыхательных мышц с возможной слабостью иных мышц легкой степени выраженности;
IIIa — слабость мышц туловища и/или конечностей средней степени выраженности в сочетании или без слабости глазных мышц, без выраженной слабости краниобульбарной мускулатуры;
IIIb — преобладание слабости краниобульбарных мышц и/или дыхательных мышц с возможной слабостью иных мышц средней степени выраженности;
IVa — выраженная слабость мышц туловища и/ или конечностей в сочетании или без слабости глазных мышц, без преобладания слабости краниобуль-барной мускулатуры;
IVb — преобладание слабости краниобульбарной и/или дыхательной мускулатуры в сочетании с возможной умеренной слабостью мышц туловища и/или конечностей;
V — кризисные состояния с искусственной вентиляцией легких (ИВЛ) или без нее, зондовое питание.
Исследование титра антител проводили имму-ноферментным методом с использованием набора AChRAb, предназначенного для количественного определения аутоантител к рецептору ацетилхолина в человеческой сыворотке. Пороговым значением уровня антител в сыворотке крови считали 0,45 нмоль/л.
Анализ данных осуществляли с использованием программного обеспечения SPSS для Windows (версия 22.0, SPSS, Chicago IL). Характер распределения данных оценивали графическим методом и методом Шапиро — Уилка. Описание признаков, имеющих нормальное распределение, представлялось в виде M±SD, где М — среднее арифметическое, SD — стандартное отклонение; для признаков с распределением, отличным от нормального, результаты представлялись в виде Ме [Q1; Q3], где Me — медиана, Q1 и Q3 — первый и третий квартили. Для обработки данных с нормальным типом распределения использовали параметрические методы: t-тест для независимых и зависимых группировок, парный t-тест. Для выявления взаимосвязи между значениями в зависимости от характеристики показателя рассчитывали коэффициент сопряженности Пирсона, коэффициент Крамера, коэффициент парной корреляции. Проверку на нормальность осуществляли с помощью критерия Шапиро — Уилка. Для изучения зависимостей в изучаемых группах с нормальным распределением использовали Т-критерий для зависимых выборок. В качестве метода, позволяющего оценить динамику по шкале MGFA, использовали критерий Уилкоксона для связанных выборок. Для выявления корреляции между значениями шкалы MGFA, имеющей номинальные значения, и уровнем антител в крови пациента, имеющим непрерывные значения, использовали критерий Эта. Данный критерий оценивает меру связи между переменными, одна из которых является зависимой, имеющей интервальной значение (балл по шкале MGFA), и независимой переменной (уровень антител). При этом значение 0 для критерия Эта говорит об отсутствии связи, а значение 1 свидетельствует о сильной связи между зависимыми и независимыми переменными.
Результаты. Среди 65 пациентов, обследованных в момент постановки диагноза, было 24 мужчины и 41
женщина в возрасте от 16 до 85 лет. Серонегативная форма выявлена в 4 случаях, что составило 6,1%. В группе пациентов с серонегативной по АТ к АХР миастенией имелось два пациента с глазной формой заболевания и два пациента с генерализованной формой. Степень тяжести генерализованной формы на момент диагностики соответствовала IIIa и IIIb классам по шкале MGFA. Все четыре пациента с серонегативной формой имели прогрессирующее течение заболевания, получали антихолинэстеразные препараты и глюкокортикоидные гормоны. Значительного улучшения состояния удалось добиться в трех из четырех случаев.
Характеристика пациентов с серопозитивной формой миастении, обследованных в момент постановки диагноза, представлена в табл. 1. Среди серопозитивных наблюдений миастении больные с ранним началом заболевания (до 40 лет) составили 19,7% (12 человек), соотношение мужчин и женщин 1:2. Подавляющее большинство пациентов (80,3%) имели позднее начало заболевания (после 40 лет), соотношение мужчин и женщин среди них 1:1. Титр АТ к АХР в группах раннего и позднего начала заболевания существенно не отличался, в связи с чем в дальнейший анализ включена общая когорта больных.
Для анализа факторов, взаимосвязанных с уровнем АТ к АХР, у пациентов данной группы проведен корреляционный анализ путем вычисления коэффициента сопряженности Пирсона, коэффициента Крамера, коэффициента парной корреляции. Корреляции уровня АТ к АХР с полом пациента, с возрастом начала болезни, тяжестью состояния в момент исследования, характером изменений тимуса, симптомами дебюта заболевания получено не было.
На следующем этапе исследования проведен анализ динамики титра АТ к АХР в течение заболевания. Группа из 26 пациентов обследована повторно. В двух наблюдениях имелось трехкратное исследование титра АТ к АХР. Среди обследованных больных было 20 женщин и 6 мужчин, заболевших в возрасте от 16 до 72 лет. Первое исследование титра
АТ к АХР проведено в период от 4 месяцев до 25 лет после начала болезни (в 69,2% наблюдений срок от начала заболевания до первого исследования составил от 6 месяцев до 2 лет). Среди обследованных 14 пациентов имели миастению с ранним началом, а 12 — с поздним началом заболевания. Повторное исследование титра АТ к АХР проведено с интервалом от 9 месяцев до 4 лет.
В период между исследованиями все пациенты получали иммуносупрессивную терапию: 23 пациента глюкокортикоидными гормонами, 3 пациента цитостатиками, 8 больных получали и глюкокортикоидные гормоны, и цитостатики. Тимэктомия в период между обследованиями выполнена у шести больных: у трех по поводу гиперплазии тимуса и у трех по поводу тимомы. Характеристика больных в момент первого и второго исследования титра АТ к АХР представлена в табл. 2.
В целом отмечена положительная динамика клинического состояния пациентов на фоне проводимой терапии. Так, в 65,4% случаев состояние больных к моменту второго исследования улучшилось на 1–4 класса по шкале MGFA, а у 26,9% больных достигнута стадия медикаментозной ремиссии.
Исследование корреляций между номинальными и непрерывными значениями для выявления связи между баллом по шкале MGFA и уровнем антител не показало достоверной корреляции между показателями в изучаемых группах. Для группы первого исследования титра АТ к АХР коэффициент Эта имел значение 0,479. К моменту второго исследования отмечено возрастание коэффициента Эта до значений 0,809, что можно расценить как увеличение связи между баллом по шкале MGFA и уровнем антител при их снижении. Т-критерий для зависимых выборок не показал статистически достоверного различия между двумя группами (первого и второго исследования) в уровне антител, при этом статистическая достоверность различий р = 0,061.
Динамика баллов по шкале MGFA в период от первого до второго исследования представлена на
Характеристика пациентов с серопозитивной формой миастении
Таблица 1
|
Показатель |
Мужчины, N=24 |
Женщины, N=37 |
Все больные, N=61 |
|
Возраст, лет |
60,5 [54,5; 68,0] |
64,0 [56,5; 70,0] |
63,0 [56,5; 69,0] |
|
Титр АТ к АХР, нмоль/л |
13,7 [8,9; 17,2] |
13,3 [8,3; 16,9] |
13,3 [8,3; 17,2] |
|
Степень тяжести по MGFA, абс. (%) |
|||
|
I |
6 (25,0) |
9 (24,3) |
15 (24,6) |
|
IIa |
5 (20,8) |
1 (2,7) |
6 (9,9) |
|
IIb |
5 (20,8) |
6 (16,2) |
11 (18,0) |
|
IIIa |
3 (12,5) |
3 (8,1) |
6 (9,9) |
|
IIIb |
3 (12,5) |
10 (27,0) |
13 (21,3) |
|
IVa |
- |
- |
- |
|
IVb |
2 (8,4) |
7 (19,0) |
9 (14,7) |
|
V |
- |
1 (2,7) |
1 (1,6) |
|
Изменения тимуса, абс. (%) |
|||
|
Без изменений |
17 (70,8) |
25 (67,6) |
42 (68,8) |
|
Гиперплазия тимуса |
- |
4 (10,8) |
4 (6,6) |
|
Тимома |
4 (16,7) |
4 (10,8) |
8 (13,1) |
|
Атрофия тимуса |
3 (12,5) |
4 (10,8) |
7 (11,5) |
Таблица 2
Характеристика больных в момент первого и второго исследования титра АТ к АХР
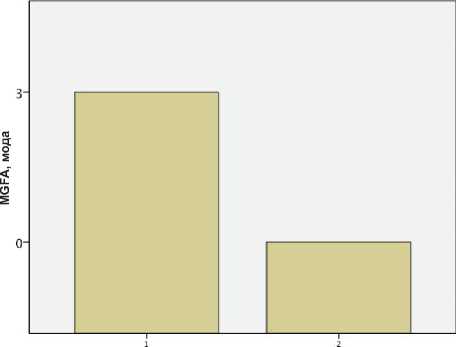
Группа
Рис. 1. Балл по шкале MGFA при первом и втором исследованиях
Критерий Уилкоксона при сравнении балла по шкале MGFA показал снижение показателя теста на значение, примерно равное двум, что является статистически достоверным (р=0,023). Таким образом, выявлено статистически достоверное снижение балла по шкале MGFA при снижении титра АТ к АХР в крови пациентов. При этом статистически значимой связи между баллом по шкале MGFA и уровнем антител не отмечено ни в группе первого исследования, ни в группе повторного исследования. Такая связь выявляется только при оценке степени снижения уровня антител и снижения балла по шкале MGFA.
Обсуждение. Серопозитивная форма миастении по антителам к ацетилхолиновым рецепторам на этапе постановки диагноза выявлена у 93,9% обследованных больных. Корреляций уровня АТ к АХР с полом пациента, с возрастом начала болезни, тяжестью состояния в момент исследования, характером изменений тимуса, симптомами дебюта заболевания не выявлено. Полученные результаты согласуются с данными ранее проведенных исследований о высокой индивидуальной вариабельности уровня АТ к АХР и об отсутствии прямой взаимосвязи между тяжестью клинических проявлений и титром АТ к АХР [10, 11].
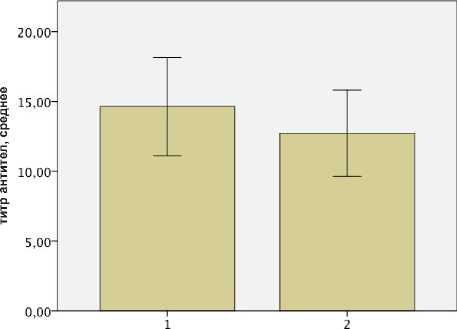
Группа
Столбцы ошибок: 95% дов. инт.
Проверена гипотеза: имеют ли повторные исследования титра АТ к АХР какую-либо прогностическую ценность для принятия терапевтических решений? Отмечена положительная динамика клинического состояния пациентов на фоне проводимой терапии, что соответствует данным предыдущих исследований [3, 11]. Выявлена взаимосвязь степени снижения уровня АТ к АХР и снижения балла по шкале MGFA при повторных исследованиях у пациентов, получавших иммуносупрессивную терапию и прошедших тимэктомию, при этом корреляции уровня АТ к АХР и тяжести состояния по шкале MGFA также не выявлено. Следовательно, повторные определения титра АТ к АХР могут иметь определенное прогностическое значение для больных миастенией.
Заключение. Изменение уровня АТ к АХР у больных миастенией в течение заболевания, вероятно, отражает степень ответа на иммуносупрессию и может помочь в принятии решения о прекращении или продолжении иммуносупрессивной терапии либо ее модификации.
Рис. 2. Титр антител к АХР при первом и втором исследованиях
Список литературы Динамика титра антител к ацетилхолиновым рецепторам при миастении
- Lindstrom J. Acetylcholine receptor and myasthenia. Muscle & Nerve 2000; 23: 453-477
- Romi F, et al. Muscle autoantibodies in subgroups of myasthenia gravis. Neurol 2000; 247: 369-375
- Heldal AT, et al. Repeated Acetylcholine Receptor Antibody-Concentrations and Association to Clinical Myasthenia Gravis Development. Published online 2014 Dec. 2 10.1371/journal.pone. 114060 DOI: 10.1371/journal.pone.114060
- Oosterhuis HJ, Limburg PS, Hummel-Tappel E. Anti-acetylcholine receptor antibodies in myasthenia gravis. Part 2: Clinical and serological follou-up of individual patients. Neurol Sci 1983;58:371-385
- Сиднее Д. В. и др. Антитела к ацетилхолиновому рецептору у больных с различными клиническими формами миастении и миастеническим синдромом Ламберта - Итона. Журнал неврологии и психиатрии им. С. С. Корсакова 2006; 106 (1): 53-55
- Гехт Б. M. и др. Роль антител к ацетилхолиновому рецептору в патогенезе миастении. Неврологический журнал 2002; 6: 18-21
- Leite Ml, Waters Р, VincentA. Diagnostic use of autoantibodies in myasthenia gravis. Autoimmunity 2010; 43: 371-379
- Романова Т. В. Исследование антител к ацетилхолиновым рецепторам у больных миастенией. Бюллетень Восточно-Сибирского научного центра СОР АМН 2013; 2 (1): 82-86
- Vincent A, Newsom-Davis J, Newton Р, Beck N. Acetylcholine receptor autoantibody and clinical resporse to thymectomy in myasthenia gravis. Neurology 1983; 33(10): 1276-1282
- Drachman DB, Adams RN, Josifek LF, Self SG. Functional activities of autoantibodies to acetylcholine receptors and the clinical severety of myasthenia gravis. N Engl J Med 1982;307:769-773
- Сиднее Д. В. и др. Антитела к ацетилхолиновому рецептору в оценке эффективности патогенетической терапии у больных с миастенией. Журнал неврологии и психиатрии им. С. С. Корсакова 2010; 110 (11): 37-40
- Sanders DB, et al. Does change in AChR antibody level correlate with clinical change in MG? Muscle Nerve 2014; 49 (4): 483-486
- Jaretzki A, et al. Myasthenia gravis: recommendations for clinical research standards / Task Force of the Medical Scientific Advisory Board of the Myasthenia Gravis Foundation of America. Ann Thorac Surg 2000; 70: 327-334.


