Динамика уровня противовоспалительных цитокинов и их роль в развитии полимодальных локальных эффектов при прогрессировании рака яичников
Автор: Антонеева Инна Ивановна, Генинг Татьяна Петровна, Абакумова Татьяна Владимировна, Генинг Снежанна Олеговна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 4-3 т.15, 2013 года.
Бесплатный доступ
Оценивается уровень противовоспалительных цитокинов (TNF- , IFN- , IL-1 ) в сыворотке крови при прогрессировании рака яичников у первичных больных раком яичников на I-IV клинической стадии заболевания (по FIGO) и доноров, кроме уровня TNF- , IFN- иIL-1 в сыворотке крови. В ткани первичной опухоли проводили квантиметрию составляющих, а также оценивали уровень экспрессии mtp53 и bcl-2. Установлено, что в процессе прогрессирования рака яичников неоплазма может интегрироваться в основные гомеостатические процессы макроорганизма благодаря использованию региональных и системных функций цитокинов, в том числе и секретируемых опухолью - TNF- , IFN- иIL-1 . Наиболее значимыми для усиления биологического потенциала опухоли являются такие их эффекты, как стимулирование пролиферации опухолевых клеток и образование сосудов в зоне опухолевого роста.
Рак яичников, цитокины, р53
Короткий адрес: https://sciup.org/148202362
IDR: 148202362 | УДК: 61:57:616-006:616-092
Текст научной статьи Динамика уровня противовоспалительных цитокинов и их роль в развитии полимодальных локальных эффектов при прогрессировании рака яичников
При злокачественном росте с цитокинами взаимодействует две системы: неоплазма – цитокины и иммунная система – цитокины [3]. При этом опухолевые клетки могут как экспрессировать соответствующие рецепторы, так и продуцировать цитокины.IL-1 является медиатором как местного так и дистантного действия на разные ткани и обладает широким спектром биологической активности. В опухолевом процессе большую роль играет IL-1 Р . Фактор некроза опухоли (TNF- а ) получил название по основному биологическому эффекту-лизису опухолевых клеток. Точка зрения о безусловном противоопухолевом влиянии TNF- а с середины 90-х годов была опровергнута убедительными дока-
зательствами участия этого цитокина в канцерог-незе и опухолевой прогрессии. Продуцировать TNF- а способны многие опухолевые клетки, в том числе и клетки рака яичников (РЯ). При росте опухоли уровень содержания TNF- а в крови может повышаться как за счет его продукции опухолевыми клетками, так и в результате усиленного выделения макрофагами [8]. Интерфероны (IFN) представляют одну из самых быстро реагирующих систем иммунологической защиты. Точный механизм их противоопухолевого действия не известен. Предполагается прямое и непрямое противоопухолевое действие IFN [9].
Цель исследования – изучить динамику изменений уровня цитокинов (TNF- a , IFN- У , IL-1 Р ) и их роль в развитии полимодальных локальных и дистантных эффектов при прогрессирующих формах рака яичников.
МАТЕРИАЛ И МЕТОДЫ
Обследуемая группа состояла из 83 первичных больных РЯ, находящихся на I-IV клинической стадии заболевания (по FIGO). Контрольную группу составили 40 женщин-доноров. Концентрацию TNF- а , IFN- У иIL-1 Р в сыворотке крови измеряли методом ИФА. Срезы, полученные из блоков биопсийного материала, окрашивались гематоксилином и эозином, по Ван-Гизону, по Малори, альциановым синим. Квантиметрию составляющих опухоли осуществляли в 10 произвольных полях зрения на микроскопе “ReichztPolivar 2” с планообъективом FJAPO 10х0,30, совмещенным с цифровой видео- камерой JVC разрешением 800х600 пикселей. При оценке экспрессии mtp53, bcl-2, Ki-67 и PCNA использовали моноклональные антитела фирм Novocastra и Dako. Статистическую обработку данных проводили с использованием U-критерия Манна-Уитни и коэффициента корреляции Спирмена.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате проведенных исследований установлено существенное и достоверное повышение уровня IL-1 Р , IFN- Y и TNF- а у больных РЯ по сравнению со здоровыми (табл. 1).
Из данных табл.1 следует, что уровниIL-1 Р , TNF- а и IFN- Y статистически значимо повышены по сравнению с контролем уже на I-ой клинической стадии заболевания и продолжали повышаться на II-IV стадии заболевания. Наблюдаемые изменения уровня TNF- а и IFN- Y обнаруживали прямую положительную корреляцию со стадией заболевания (r=0,700 и r=0,120 соответственно).
Источником данных провоспалительных цитокинов, видимо, могут быть как сами опухолевые клетки, так и клетки-эффекторы, круг которых расширяется по мере прогрессирования опухоли, так как организм все в большей степени использует воспалительный тип ответа на новообразование [5]. Кроме того, прирост концентрации, в частности TNF- а , может обеспечиваться, по мнению ряда авторов [2], двумя аддитивными механизмами: селекцией клеток, резистентных к цитотоксическому действию TNF- а и тем, что экспрессируемые опухолевыми клетками антигены также индуцируют повышенную продукцию TNF- а . При этом ограничение чувствительности рецепторов опухолевых клеток к регуляторным молекулам также предопределяет прирост концентрации цитокинов и их выраженное побочное влияние на рецепторы нормальных клеток.
Провоспалительные цитокины, и в частности, IL-1 и TNF- а , обладают системным действием. Так, IL-1, способен проникать через гематоэнцефалический барьер и стимулировать в па-равентрикулярном ядре гипоталамуса секрецию кортикотропинвысвобождающего фактора, который повышает в аденогипофизе выработку АКТГ. Последний инициирует в коре надпочечников выброс глюкокортикоидов [1]. Это ведет к усилению действия факторов стресса на все системы. TNF- а также инициирует активность эндокринных желез, что приводит к увеличению уровня АКТГ, гонадотропина и других гуморальных факторов.Результатом системного действия на организм TNF-а и IL-1 является развитие продромального синдрома, проявляющегося снижением аппетита, сонливостью, лихорадкой, повышением болевой чувствительности.
Иммунная толерантность малигнизированных клеток появляется на мембранном, цитоплазматическом и генетическом уровнях. Клеточная мембрана, цитоплазма и ядро опухолевой клетки защищают ее от эффекторов иммунной системы. При этом к возможностям самой раковой клетки добавляются защитные механизмы микроокружения. Например, инфильтрацию неоплазмы клетками иммунной системы и активность эффекторных молекул ограничивают фибриновый и слизистый барьеры. Непосредственные контакты раковых и стромальных клеток могут приводить и к активной пролиферации фибробластов в пограничной зоне, что особенно заметно в некоторых образцах серозных и муцинозных опухолей яичников (рис. 1).
В этих условиях соединительнотканные клетки, ориентируясь длинной осью параллельно линии паренхима – строма, выстраивают плотный пограничный вал. При этом фибробласты тесно прилегают кдруг другу и одновременно контактируют с раковыми клетками на пограничной линии. Здесь чаще встречаются молодые и средние формы фибробластов, реже обнаруживаются большие типы фибробластов и фиброциты (рис. 2). Фибриновые волокна всегда присутствуют в опухолевой ткани и это особенно характерно для зоны активной пролиферации неоплазмы. Мощный фибриновый барьер образуется в результате стимуляции фибриногенеза исопутствующегофибринолиза. Опухолевые клетки при этом активируют компоненты свертывающей системы и образование фибрина че-
Таблица 1. Уровень цитокинов у больных РЯ на различных клинических стадиях заболевания
|
Группы Показатели |
контроль |
I стадия |
II стадия |
III стадия |
IV стадия |
|
N=48 |
N=12 |
N=12 |
N=40 |
N=40 |
|
|
IL-1β |
36,8±10,74 |
216,7±49,35* |
236,7±24,99* |
248,5±9,00* |
230,9±15,04* |
|
TNF-α |
31,0±2,82 |
55,0±9,53* |
64,4±13,38*` |
104,8±9,90*` |
93,8±9,96*` |
|
IFN-γ |
44,0±7,67 |
95,8±9,49* |
107,1±8,76* |
120,9±10,33*` |
114,4±15,17* |
Примечание: данные статистически значимо отличаются от аналогичных:
*- в контроле; ‘- от соответствующих показателей на предыдущей клинической стадии заболевания.
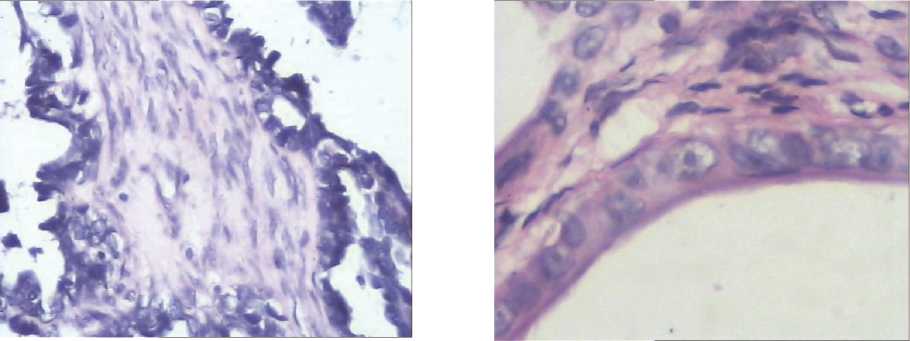
Рис. 2. Фиброциты дегенерирующие, РЯ (окраска гематоксилин-эозином, микрофото. Х1200)
Рис. 1. Фибробласты стромы серозного РЯ, располагающиеся вблизи зоны инвазии раковых клеток в строму
(окраска гематоксилин-эозином, микрофото. Х600) рез присутствующие в зоне опухоли макрофаги. Последние, под влиянием неоплазмы, усиливают продукцию провоспалительных цитокинов IL-1, TNF- a , которые индуцируют на эндотелии и активированных макрофагах экспрессию тканевого фактора свертывания крови. Неоплазма использует фибриновую сетку в качестве преграды для клеток иммунной системы. Кроме того, фибрин повышает устойчивость малигнизированных клеток к химиотерапии. Фибрин также необходим для роста малигнизированных клеток. Его нити формируют тракт для перемещения этих клеток в структуре ткани и защищают их от цитотоксических эффекторов иммунной системы. Кроме того, раковые клетки потребляют фибрин, используя его в качестве основного трофического материала [6]. Нити фибрина стимулируют фибробласты, которые поддерживают в опухоли концентрацию ростовых факторов и секретируют компоненты стромы опухолевой ткани. Кроме того, в структуре опухоли фибрин выполняет функцию внеклеточного матрикса. Неоплазма использует фибрин, благодаря своей способности контролировать систему плазмин-тканевые ингибиторы-активаторы плазминогена. Процесс образования ингибитора активатора плазминогена в зоне малигнизации при этом инициируется провоспалительными цитокинами [7].
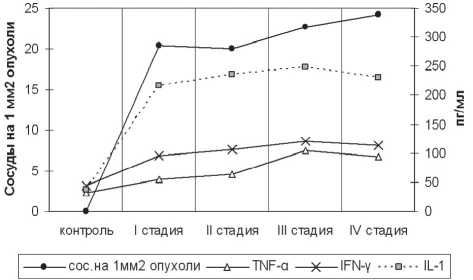
Для усиления биологического потенциала неоплазмы и поддержания ее роста и развития одним из наиболее значимых представляются такие эффекты IL-1 и TNF- a , как образование denovo сосудов в зоне опухолевого роста, расширение и нарушение проницаемости этих сосудов, стимуляция пролиферации и блокирование апоптоза опухолевых клеток. При изучении параметров сосудистого русла первичной опухоли при раке яичников на различных клинических стадиях заболевания нами было установлено, что в процессе опухолевой прогрессии имеется тенденция к возрастанию объема и плотности сосудов на 1 мм2 опухоли (табл. 2).
Как следует из рис. 3 (А, Б) это соответствует возрастанию содержания в крови провоспали-тельных цитокинов IL-1 и TNF- a . Следует, однако, отметить, что данный процесс происходит на фоне возрастающих концентраций IFN- / , который ингибирует ангиогенез в опухоли. Возможно, именно этот фактор определяет то, что возрастание объема и плотности сосудов в опухоли не были статистически значимы.
Также было показано, что основную массу сосудов микроциркуляторного русла первичных раковых опухолей яичников составляют капилляры с диаметром более 10 мкм и с дефектами эндотелиальной выстилки (рис. 4).
Таблица 2. Параметры сосудистого русла первичной опухоли при раке яичников на различных клинических стадиях заболевания
|
Показатели Стадия РЯ |
Объем сосудов, % |
Сосуды на 1 мм2 опухоли |
||||||||
|
М |
m |
к.в. |
Макс. |
Мин. |
М |
m |
к.в. |
Макс. |
Мин. |
|
|
I-II, n=33 |
3,81 |
0,88 |
0,48 |
10,7 |
1,2 |
20,4 |
4,71 |
0,35 |
59,1 |
10,2 |
|
III, n=40 |
4,06 |
0,45 |
0,51 |
11,4 |
1,6 |
22,71 |
2,17 |
0,34 |
61,3 |
11,8 |
|
IV, n=33 |
4,66 |
0,48 |
0,46 |
12,8 |
2,9 |
24,43 |
2,74 |
0,38 |
63,2 |
13,1 |
Примечание: различие показателей по стадиям статистически не значимо (р>0,05)
А
Рис. 3. (А, Б). Изменение параметров сосудистого русла первичной опухоли и содержания провоспалительных цитокинов (IL-1, TNF- а и IFN-г) в крови при РЯ на различных клинических стадиях заболевания
Б
Рис. 4. Синусный сосуд с дефектом эндотелиальной выстилки (окраска гематоксилин-эозином, микрофото. Х600)
Селективное давление со стороны нормоцитов, продуцирующих провоспалительные цитокины (TNF- а , IL-1) может привести к образованию дефектных антионкогенов и их неактивных РНК-продуктов. К их числу относится белок р-53 – один из индукторов апоптоза и ген Bcl-2, продукт которого обладает цитопротекторной активностью [4].
По поводу судьбы р53 – ключевого внутриклеточного белка – супрессора злокачественной трансформации клетки – на сегодня существует несколько точек зрения. Согласно мнения одних авторов, при злокачественной трансформации низкий уровень р53 связан с ускоренной деградацией этого белка. В результате ограничиваются возможности реализации апоптотических сигналов по р53-зави-симому пути. Согласно другой точки зрения [10], в малигнизированных клетках имеют место мутации гена р53, связанные с усиленной экспрессией мРНК отдельных цитокинов. С другой стороны, наличие мутантной формы гена р53 рассматривают как фон, необходимый для развития дисрегуляции цитокинов связь между экспрессией мутантного гена р53 и цитокинами прослеживается при исследовании РЯ. Так, в результате проведенных нами исследований установлено (рис. 5) возрастание процентного содержания атипических эпителиальных клеток яичника, экспрессирующих р53, в динамике раковой прогрессии. Увеличение р53+ клеток яичника коррелировало с экспрессией IL-1 Р и TNF-
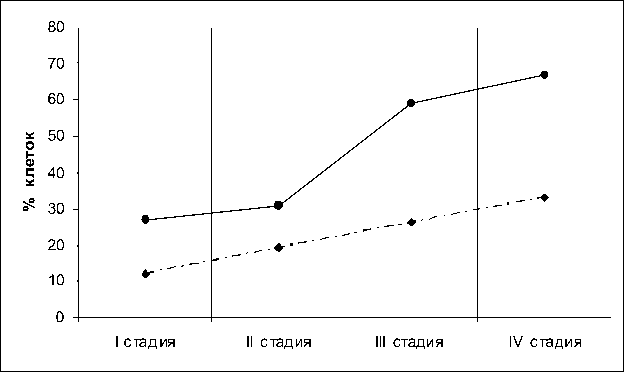
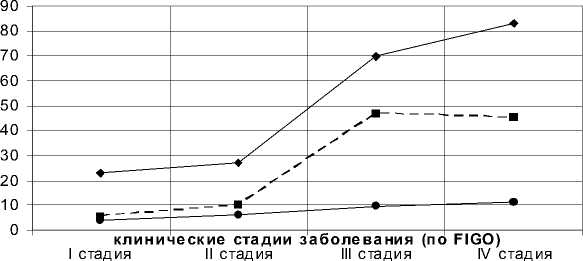
Рис. 5. Динамика процентного содержания атипических эпителиальных клеток яичника, экспрессирующих p53 (-) и Bcl-2 (- · -) на различных клинических стадиях заболевания
a . Корреляционные связи на различных стадиях заболевания: средняя (r=-0,6618) и сильная (r=0,8407) соответственно.
Проапоптотическая активность цитокинов, в частности IFN-г, может быть преодолена в условиях избытка белка с-myc, уровень которого низок в нормальных клетках и высок в опухолевы-х.Развитие апоптоза при действии цитокинов на опухолевые клетки требует мобилизации про-апоптотических факторов митохондрий. Устойчивая компартментализация этих факторов обеспечивается белками семейства Bcl-2, часть из которых индуцируют апоптоз, другая – обладает антиапоптотической активностью. При этом в выживающих малигнизированных клетках экспрессируются антиапоптотические белки этого семейства, но ограничена экспрессия проапопто-генных форм [11]. Белки семейства Bcl-2 необ- ходимы для блокирования митохондриальных пор для проапоптотических факторов.
Результаты наших исследований свидетельствуют об увеличении клеток РЯ, экспрессирующих Bcl-2, при прогрессировании опухоли (корреляция со стадией заболевания положительная высокая, r=0,6255).
К наиболее значимым для усиления потенциала опухоли и поддержания ее роста и развития эффектам цитокинов с системными эффектами (TNF- а и IL-1) относится их способность стимулировать пролиферацию опухолевых клеток. Нами установлено увеличение пролиферативной активности и митотического индекса в неоплазме при прогрессировании РЯ (рис. 6).
Значимая корреляция показателей PCNA, Ki-67 и митотического индекса с уровнем провоспа-лительных цитокинов представлена в табл. 3.
PCNA Ki-67 митотический инд ек с
Рис. 6. Пролиферативная активность и митотический индекс раковых клеток первичного опухолевого узла при прогрессировании РЯ
Таблица 3. Корреляционные связи уровня провоспалительных цитокинов (IL-1 Р , IFN- У и TNF- а ) с показателями пролиферативной активности, апоптоза и параметрами микроциркуляторного русла при прогрессировании РЯ
|
Показатель |
I стадия РЯ |
II стадия РЯ |
III стадия РЯ |
IV стадия РЯ |
||||||||
|
IL- 1 р |
TNF- а |
IFN- У |
IL- 1 Р |
TNF- а |
IFN- У |
IL- 1 Р |
TNF- а |
IFN- У |
IL- 1 Р |
TNF- а |
IFN- У |
|
|
Ki-67 |
- |
-0,95 |
- |
0,40 |
-0,44 |
- |
- |
- |
- |
0,39 |
- |
- |
|
PCNA |
0,80 |
-0,40 |
0,60 |
-0,43 |
- |
- |
- |
- |
- |
- |
-0,35 |
- |
|
Митотич. индекс |
1,00 |
-0,80 |
0,80 |
0,46 |
-0,92 |
-0,43 |
- |
- |
- |
0,44 |
- |
- |
|
Об.сосудов, % |
0,05 |
-0,24 |
-0,60 |
0,05 |
-0,24 |
-0,60 |
0,14 |
0,21 |
0,14 |
0,06 |
-0,08 |
0,07 |
|
Сосуды на 1мм2 опухоли |
- |
- |
-0,32 |
- |
- |
-0,32 |
- |
- |
- |
- |
- |
- |
|
р53 |
- |
0,60 |
0,40 |
-0,67 |
-0,84 |
-0,58 |
- |
-0,40 |
- |
- |
- |
- |
|
Bcl-2 |
0,40 |
-0,80 |
- |
- |
-0,70 |
- |
- |
- |
- |
- |
- |
- |
Таким образом, в процессе прогрессирования неоплазма интегрируется в основные гомеостатические процессы макроорганизма благодаря использованию региональных и системных функций цитокинов. При этом из всего спектра цитокинов, в том числе и секретируемых опухолью, ключевая роль принадлежит цитокинам с системными эффектами - IL-1, TNF- а и IFN- / .
Наиболее значимыми для усиления биологического потенциала опухоли являются такие эффекты этих цитокинов, как стимулирование пролиферации опухолевых клеток, образование сосудов в зоне опухолевого роста.
Работа поддержана грантом ФЦП “Научные и научно-педагогические кадры инновационной России” на 2009-2013гг. и Гос. заданием Министерства образования и науки Российской Федерации.
Список литературы Динамика уровня противовоспалительных цитокинов и их роль в развитии полимодальных локальных эффектов при прогрессировании рака яичников
- Акмаев И.Г., Гриневич В.В. От нейроэндокринологии до нейроиммуноэндокринологии//Бюлл. эксп. биол. и мед. 2001. Т.131. №1. С.22-33.
- Антонов В.Г., Козлов В.К. Патогенез онкологических заболеваний: иммунные и биохимические феномены и механизмы. Внеклеточные и клеточные механизмы общей иммун6одепрессии и иммунной резистентности//Цитокины и воспаление. 2004. №1. С.8-19.
- Бережная Н.М., Чехун В.Ф. Система интерлейкинов и рак (новые аспекты взаимодействия опухоли и организма). Киев: ДИА, 2000. 224 с.
- Красильников М.А. Сигнальные пути, фосфатидилинозит-3-киназой, и их значение для роста, выживаемости и злокачественной трансформации клеток//Биохимия. 2000. Т.65. Вып.1. С. 68-78.
- Лукина Е.А. Система мононуклеарных фагоцитов и биологические эффекты противовоспалительных цитокинов//Росс. журнал гастр., гепат. и колопрокт. 1998. №5. С.7-13.
- Михайлов В.В. Малигнизация клеток. Опухолевая болезнь//Основы патологической физиологии: Руководство для врачей. М.: Медицина, 2001. С.264-281.
- Система активаторов плазминогена в ремоделировании сосудов и ангиогенеза/Е.В. Парфенова, О.С. Плеханова, В.А. Ткачук//Биохимия. 2002. Т.67. Вып.1. С.139-156.
- Рыдловская А.В., Симбирцев А.С. Функциональный полиморфизм гена TNF-и патология//Цитокины и воспаление. 2005. №3. С.28-32.
- Система интерферон -естественные клетки-киллеры у больных с опухолями яичников/А.М. Сорокин, Н.Б. Моисеева, А.Н. Чередеев и др.//Акушерство и гинекология. 1988. №5. С.23-27.
- Expression of macrophage colony-stimulating factor (M-CSF), interleukin-6, (IL-6), interleukin-1 beta (IL-1 beta), interleukin-11 (IL-11) and tumour necrosis factor-alpha (TNF-alpha) in p53-characterised human ovarian carcinomas/J.G. Asschert, E. Vellenga, Hollema H. et al.//Eur. J. Cancer. 1997. Vol.33(13). P.2246-51.
- Kelekar T., Thomson C. Bcl-2-family proteins/T. Kelekar,//Trends Cell Biol. 1998. Vol.8. №3. Р.324-330.


