Дисфункции щитовидной железы, индуцированные приемом амиодарона, у детей
Автор: Балыкова Лариса Александровна, Самошкина Елена Семновна, Ивянский Станислав Александрович, Акашкина Екатерина Юрьевна, Максимова Елена Юрьевна, Чекнайкина Наталья Викторовна, Моторкина Анна Сергеевна
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Педиатрия
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
Введение. На протяжении ряда лет продолжает оставаться актуальной тема выбора эффективной и безопасной антиаритмической терапии у детей и подростков. Сложность выбора терапевтической тактики во многом обусловлена не только разнообразием механизмов формирования аритмий, но и широтой побочных эффектов препаратов. Материалы и методы. Проанализировано состояние тиреоидной системы у 45 детей (20 девочек, 25 мальчиков), страдающих нарушениями ритма на фоне или в течении года после окончания лечения амиодароном. Средний возраст обследуемых составил 8,26 ± 0,9 лет. Всем детям проводилось комплексное клинико-инструмен-тальное обследование, включавшее оценку гормонального профиля (тироксин (Т4), трийодтиронин (Т3), тиреотропный гормон (ТТГ), антитела к тиреоперокисидазе и тиреоглобулину (АТ к ТПО и ТГ)), ультразвуковое исследование (УЗИ) щитовидной железы, стандартную электрокардиографию покоя (ЭКГ) и холтеровское мониторирование (ХМ) до начала, через 3, 6 и 12 мес. терапии. Результаты исследования. Установлено, что назначение амиодарона сопровождалось изменением уровня тиреодиных гормонов, но в большинстве случаев в пределах нормальных значений. Тиреопатии (чаще субклинические) были диагностированы у 3 пациентов. В 4,4 % случаев выявлен гипотиреоз; в 2,2 % - гиреотоксикоз. Обсуждение и заключения. Было показано, что прием препарата приводил к изме-ниям размеров щитовидной железы, однако достаточно редко сопровождался нарушением ее функции.
Амиодарон, гипотиреоз, тиреотоксикоз, дети, дисфункция щитовидной железы
Короткий адрес: https://sciup.org/14720263
IDR: 14720263 | УДК: 616.441-053.2 | DOI: 10.15507/0236-2910.027.201703.382-396
Текст научной статьи Дисфункции щитовидной железы, индуцированные приемом амиодарона, у детей
Нарушения ритма сердца продолжают оставаться одной из наиболее актуальных проблем детской кардиологии. Это объясняется многообразием клинических форм аритмий, отсутствием единого понимания механизмов их возникновения и, следовательно, общепринятых методов лечения [1–3]. Ранний дебют заболевания (вследствие генетически обусловленных причин), склонность к хроническому прогрессирующему течению и нередкое развитие жизнеугрожаемых осложнений диктуют необходимость разработки максимально эффективных и безопасных для педиатрических пациентов методов лечения, которые, несмотря на сходство многих подходов, отличаются от постулатов, принятых в терапевтической практике [4–6].
Одним из антиаритмических препаратов, наиболее востребованных в детской кардиологии, является амиодарон, который зарекомендовал себя препаратом первой линии для лечения различных вариантов острых и хронических тахиаритмий как у детей, так и у взрослых ввиду высокой эффективности и умеренно выраженных побочных реакций [4–8]. Большинство из них (фотосенсибилизация, изменение цвета кожи, повышение активности трансаминаз, периферические нейропатии, мышечная слабость, тремор, атаксия, нарушения зрения, интерстициальные пневмонии, тромбофлебиты) обратимы и исчезают при уменьшении дозы или после отмены препарата [9–10]. Реальную клиническую проблему представляют амиодарон-индуцированные изменения тиреоидной системы (обусловленные в основном содержанием в препарате органического йода, оказывающего выраженное влияние на баланс тиреоидных гормонов), которые, по данным разных авторов, выявляются у 14–45 % больных [11–13]. Причем, учитывая длительный период полувыведения амиодарона и его активного метаболита – дизэтиламиодарона (от 2 нед. до 3 мес.), побочные эффекты могут развиться в отдаленные сроки после лечения [14].
Амиодарон уменьшает конверсию тироксина в трийодтиронин путем подавления активности 5-дейодина-зы [15]. Амиодарон и его активный метаболит ДЭА вследствие схожести строения с молекулой трийодтиронина нарушают транспорт тиреоидных гормонов через плазматическую мембрану и связывание с рецепторами, причем действие ДЭА зависит от его концентрации в различных тканях: при низкой концентрации он выступает как агонист трийодтиронина, при высоких – как антагонист [16]. Кроме вышеописанных эффектов, амиодарон и особенно его метаболит ДЭА оказывают цитотоксическое действие на щитовидную железу, вызывая лизис тирео-цитов, а также нетиреоидной ткани, усиливаемый содержанием йода в молекуле [17–18].
Обзор литературы
Вопрос о влиянии амиодарона на течение аутоиммунных процессов в щитовидной железе является дискуссионным [19]. Выделяют следующие клинические формы тиреопатий, ассоциированных с приемом амиодарона: амиодарон-индуцированный гипотиреоз и амиодарон-индуцированный ти- реотоксикоз. Поступление йода, содержащегося в амиодароне, вызывает подавление образования гормонов щитовидной железы (эффект Wolff-Chaikoff) и развитие гипотиреоза [20] с типичными клиническими проявлениями. Частота зоба у пациентов с амиодарон-инду-цированным гипотиреозом составляет около 20 % при отсутствии дефицита йода в регионе [21–22].
Однако большую клиническую значимость, безусловно, имеет амиодарон-индуцированный тиреотоксикоз [23]. Выделяют 2 типа заболевания [24]:
-
1. Амиодарон-ассоциированный тиреотоксикоз I типа, который, как правило, развивается у лиц с исходной патологией щитовидной железы. Йод, высвобождаемый из препарата (при средней дозе амиодарона ежедневно высвобождается количество йода, превышающее суточную потребность в данном микроэлементе в десятки-сотни раз) приводит к повышению синтеза тиреоидных гормонов в существующих зонах автономии в железе.
-
2. Амиодарон-ассоциированный тиреотоксикоз II типа, описанный у пациентов без предшествующих/сопут-ствующих заболеваний щитовидной железы и связанный с развитием деструктивных процессов в железе с выходом ранее синтезированных гормонов в кровоток, под действием самого амиодарона, а не только йода.
Вопрос о влиянии амиодарона на щитовидную железу у детей в медицинской литературе обсуждается крайне редко, несмотря на довольно длительный опыт применения данного антиа-ритмика в детской кардиологии.
Цель исследования – оценка состояния щитовидной железы и вероятности развития вторичных тиреопатий на фоне лечения амиодароном у детей.
Материалы и методы
Исследование было проведено на базе ГБУЗ РМ «Детская республиканская клиническая больница» (г. Саранск) с одобрения Локального этиче- ского комитета при ФГБОУ ВО «МГУ им. Н. П. Огарёва» за период с 2015 по 2017 гг. Было получено информированное согласие пациентов и/или их родителей. Проанализирован тиреоидный статус 45 детей (20 девочек, 25 мальчиков; средний возраст – 8,26 ± 0,9 лет) с нарушениями ритма сердца, на фоне или в течение 1 года после окончания лечения амиодароном. Препарат назначали в нагрузочной дозе 10–15 (детям раннего возраста – до 20) мг/кг/сут. в 3 приема в течение 5–10 дней с последующим снижением дозы и переходом на поддерживающую – 5–7 мг/кг/сут. в 2 приема 5 дней в неделю.
Критерии включения в исследование: возраст от 1 до 18 лет, наличие нарушений ритма сердца, требующих антиаритмической терапии амиодароном, продолжительность лечения амиодароном не менее 3 недель. Критерии невключения: клинически значимая патология щитовидной железы, требующая лечения тироксином или тирео-статиками до назначения амиодарона, нежелание родителей и/или детей выполнять процедуры исследования, прием дополнительно антиаритмических средств, сердечных гликозидов, противосудорожных и других препаратов, влияющих на кинетику амиодарона.
Из исследования исключались пациенты с клинически значимыми побочными эффектами (нарушениями АВ проводимости, дисфункцией синусового узла, нарушением функции печени, неврологическими и другими расстройствами), вынудившими прекратить дальнейшую терапию амиодароном. Всем детям проводилось комплексное клинико-инструментальное обследование, включавшее оценку гормонального профиля (свободный тироксин (Т4св), общий трийодти-ронин (Т3), тиреотропный гормон (ТТГ), антитела к тиреоперокисидазе и тиреоглобулину (АТ к ТПО и ТГ)), ультразвуковое исследование (УЗИ) щитовидной железы, стандартную электрокардиографию покоя (ЭКГ) и холтеровское мониторирование (ХМ) до начала, через 3, 6 и 12 мес. терапии.
Наиболее часто показанием к назначению амиодарона в исследуемой группе пациентов была желудочковая экстрасистолия высоких градаций по Lown (46,7 %), реже – частая поли-топная, полиморфная, а также парная и групповая наджелудочковая экстрасистолия (11,1 %), WPW синдром с нарушением ритма типа пароксизмальной наджелудочковой тахикардии (6,7 %), непароксизмальная наджелудочковая тахикардия (20 %), трепетание/ фибрилляция предсердий (6,7 %) и желудочковая тахикардия (8,8 %). У каждого третьего ребенка нарушения ритма приводили к развитию дисфункции миокарда, потребовавшей назначения антиаритмической терапии.
Статистическая обработка результатов проводилась общепринятыми методами вариационной статистики (оценивали средние значения и ошибку средней, количественные величины сравнивали с помощью t-критерия Стьюдента для зависимых и независимых выборок, качественные показатели – с помощью критерия χ2). Вероятность различий полученных результатов определяли на уровне p < 0,05.
Результаты исследования
Средняя длительность приема амиодарона составила 7,4 ± 2,72 месяцев, средняя суточная доза в период поддерживающей терапии варьировалась от 150 до 337,5 мг (в среднем – 283 ± 27,3 мг). Эффективность антиаритми-ка достигала 57–83 % в зависимости от варианта аритмии. К 3 мес. лечение амиодароном продолжили 37 детей, к 6 мес. – 30 детей, а к 1 году – 14 из 45 (31,1 %). Препарат был отменен либо по причине достижения полного анти-аритмического эффекта (33,3 %), либо вследствие неэффективности (20 %), либо пациентом (родителями) самостоятельно (11,1 %), либо вследствие развития побочных эффектов (4,4 %).
При анализе уровня ТТГ в среднем по группе в процессе терапии амиодароном было выявлено снижение на
0,5 мкМЕ/мл от исходного уровня к 3 мес. (p < 0,001) и на 0,68 мкМЕ/мл – к 6 мес. терапии (p < 0,001).
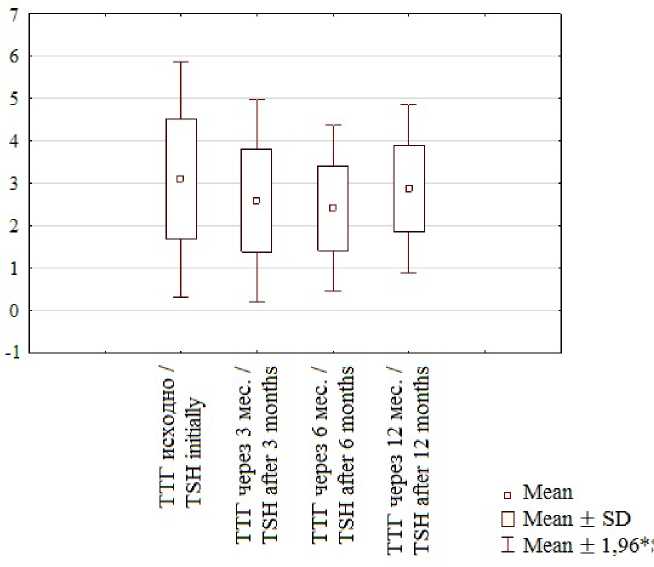
Р и с. 1. Уровень ТТГ на разных сроках лечения F i g. 1 TTG level on different terms of treatment
К концу года содержание ТТГ мало отличалось от исходного уровня. Важно, что к этому времени терапию продолжили лишь 11 пациентов. Однако несмотря на то, что у основной массы больных происходило снижение содержания ТТГ, у 7 детей (15,6 %) на 3–6 мес. лечения отмечено повышение уровня гормона относительно исходных значений, причем у 3 – значительное (на 2,3–3,1 мкМЕ/мл).Следует отметить, что концентрация ТТГ превышала пределы референсных значений у 2 детей и была на нижней границе нормы у 1 ребенка.
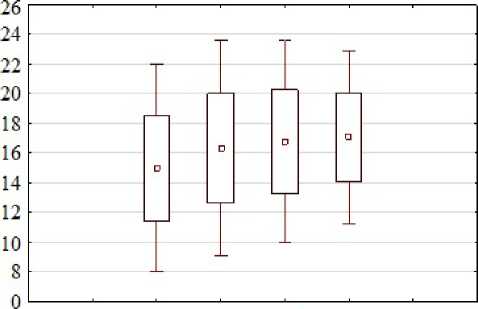
В процессе исследования уровня свободного тироксина было выявле- 386
но повышение показателя в общей группе на 1,33 пмоль/л через 3 мес. (р = 0,013), 1,8 пмоль/л через 6 мес. (р = 0,002) и на 2,1 пмоль/л – к 1 году (p = 0,06), но только у 1 пациента содержание гормона на фоне лечения амиодароном выходило за пределы референсных значений (рис. 1).
У 8 детей (17,7 %), при индивидуальном анализе, напротив, отмечено снижение этого показателя в течение наблюдения (у 2 – значительное), что может свидетельствовать о снижении сывороточного депо тиреоидных гормонов и вероятном нарушении реакции на стрессовые факторы в виде нарушения механизма отрицательной обратной связи (рис. 2).
co
о К I
s
I
и
dJ
OJ
в
ti
dJ
3 ю
1 s
й
8 и
V и
8 у
У и
-
□ Mean
-
□ Mean ± SD
I Mean ± L96*SD
Р и с. 2. Уровень свободного тироксина в процессе лечения
F i g. 2 . Level of a free thyroxin in the course of treatment
При анализе уровня общего трийод-тиронина (Т3) выявлено незначительное снижение показателя в общей группе на 0,08–0,10 нмоль/л (p > 0,05) в течение года от начала лечения амиодароном. У 4 детей отмечено повышение этого показателя, но только у одного – существенное. При исследовании динамики свободного Т3 в процессе терапии амиодароном в среднем по группе было отмечено повышение его уровня на 0,18 нмоль/л к 3 мес., на 0,21 нмоль/л – к 6 мес. и 0,2 нмоль/л – к 1 году наблюдения (p < 0,05), хотя все изменения происходили в рамках допустимых колебаний. У 4 детей было выявлено некоторое снижение этого показателя относительно исходных значений в пределах возрастной нормы в первые полгода от начала терапии амиодароном. Незначительно снижение (пограничный уровень) общего Т3 и/или свободного Т4 в сочетании с повышением содержания ТТГ у 2 детей говорит о развитии у них гипотиреоза. Напротив, повышение концентрации тиреоидных гормонов у 1 ребенка дало основание заподозрить у него ами-одарон-индуцированную гиперфункцию щитовидной железы (рис. 3).
Поскольку амиодароновая тире-опатия может выступать в качестве триггера аутоиммунного тиреоидита, нами были проанализированы показатели, характеризующие аутоиммунные процессы в щитовидной железе. Так, в процессе наблюдения было отмечено повышение уровня АТ к ТГ в среднем по группе на 0,12 ЕД/мл, в пределах референсных значений. При анализе уровня АТ к ТПО в целом по группе было выявлено их снижение на 0,36 ЕД/мл; у 3 детей отмечено повышение, у 1 ребенка данный показатель был несколько выше нормальных значений (с параллельным повышением уровня Т3
и Т4), что дало основание заподозрить у ребенка тиреотоксикоз II типа.
При изучении влияния длительности приема и дозы амиодарона на уро- вень гормонов тиреоидной системы и антител к структурным элементам щитовидной железы корреляционных связей не выявлено.
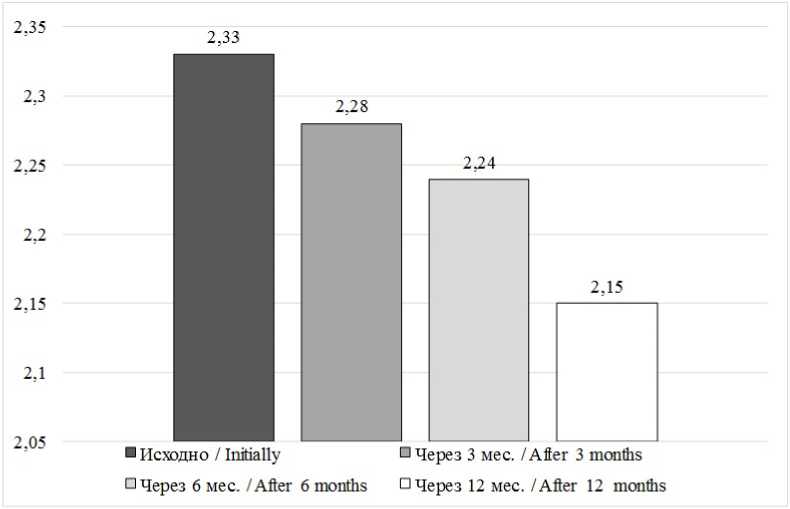
Р и с. 3. Уровень общего Т3 в процессе лечения
F i g. 3. Level of the general T3 in the course of treatment
По данным УЗИ щитовидной железы в обследуемой группе установлено, что спустя год от начала терапии у 83,3 % детей объем щитовидной железы увеличился на 1,33 мл (р = 0,04), а у 16,7 % детей отмечалось его снижение. При этом средние размеры щитовидной железы на фоне и после лечения амиодароном превышали верхнюю границу нормы на 22,5 %.
Таким образом, несмотря на индивидуальные колебания уровня гормонов и увеличение объема щитовидной железы у большинства пациентов, принявших участие в исследовании, клинически значимые тиреопатии развились у 3 из 45 детей: у 2 детей (4,4 %) – гипотиреоз; у 1 – аутоиммунный тиреотоксикоз (2,2 %).
Обсуждение и заключения
Синтезированный как потенциальное антиангинальное средство, амиодарон в настоящее время является одним из самых эффективных и востребованных антиаритмиков, в т. ч. в педиатрии. В современном мире при необходимости назначения антиарит-мической терапии свой выбор в пользу амиодарона делают 24,1 % врачей в США, 34,5 % – в Европе и 73,8 % – в Латинской Америке. В отличие от других антиаритмических препаратов, реальную проблему при использовании амиодарона представляют не кардиальные, а экстракардиальные побочные явления, в частности тирео-патии [26].
p = 0,206 А
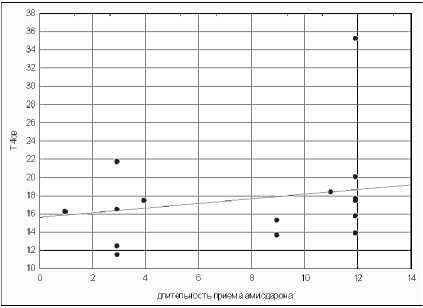
p = 0,224 В
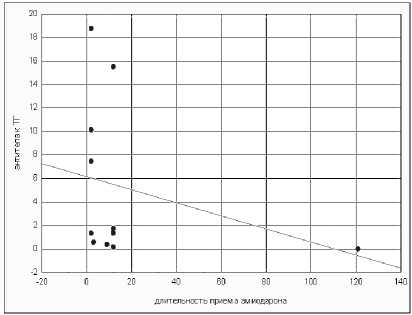
p = 0,228
С
Р и с. 4. Корреляционные связи между длительностью приема амиодарона и уровнем ТТГ (А), уровнем Т4св (B) и уровнем антител к ТГ (C)
F i g. 4. Correlations between duration an amiodaron intake and the TTG (A) level, the T4sv level (B) and level of antibodies to TG (C)
Pediatrics
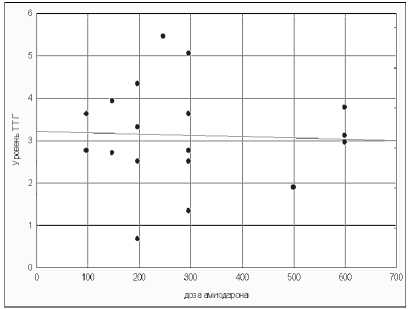
р = -0,035 А
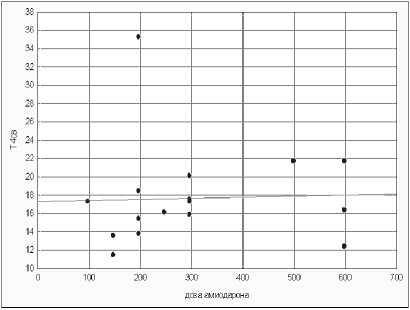
р = -0,263 В
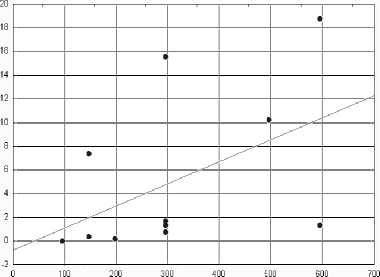
р = -0,247
С
Р и с. 5. Корреляционные связи между дозой амиодарона и уровнем ТТГ (А), уровнем Т4св (Б) и уровнем антител к ТГ (В)
F i g. 5. Correlations between a dose of an amiodaron and the TTG (A) level, the T4sv level (B) and level of antibodies to TG (C) 390
При достаточной концентрации в организме за счет содержания йода амиодарон действует как конкурентный ингибитор трийодтиронина, способствуя, как правило, в первые 18 мес. лечения развитию гипотиреоза [4–6.]. Частота встречаемости последнего зависит от географического региона, распространенности дефицита йода в популяции, особенностей выборки пациентов и других факторов. Так, частота амиодарон-индуцированно-го гипотиреоза составляет около 6 % в странах, характеризующихся низким потреблением йода, и около 18 % – при его достаточном потреблении [2]. Риск развития гипотиреоза выше у пожилых людей и женщин, что, вероятно, связано с более высокой распространеннно-стью заболеваний щитовидной железы в этих выборках пациентов [14].
В нашем небольшом исследовании гипотиреоз, индуцированный приемом амиодарона, был диагностирован у 2 девочек (причем у одной – субклинический с пограничным уровнем тиреоидных гормонов), что составило 4,4 % и согласуется с данными научной литературы о невысокой распространенности данного осложнения в регионах, эндемичных по йододефициту [19]. Увеличение объема щитовидной железы на фоне приема амиодарона («зобогенный эффект») у большинства детей не сопровождалось изменением уровня гормонов и не требовало коррекции терапии.
Частота индуцированного амиодароном тиреотоксикоза составляет 2–20 %, причем он может развиться в любые сроки после начала лечения и даже после прекращения антиаритмической терапии. В отличие от гипотиреоза, он чаще встречается при дефиците йода в популяции (в частности, в Центральной Европе) [2–8]. В нашей работе амиодарон-индуцированный субклини-
MORDOVIA UNIVERSITY BULLETIN ческий тиреотоксикоз (снижение содержания ТТГ и пограничные значения Т4 без глазных симптомов и тахикардии) был выявлен у одного ребенка после прекращения терапии (2,2 %) и сочетался с повышением уровня антитиреоидных антител.
У части пациентов избыток йода, высвобождаемый из амиодарона (до 6 мг свободного йода ежедневно), а также прямой цитотоксический эффект препарата может приводить к индукции или манифестации аутоиммунных изменений в щитовидной железе, хотя у большинства лиц, получающих амиодарон, не отмечается увеличение частоты встречаемости тиреоидных антител [27]. В нашей работе повышенные уровни АТ к ТПО были выявлены у 1 ребенка с пограничным уровнем Т4. По мнению L. Tomisti и соавт., наличие антитиреоидных антител не исключает амиодарон-индуцированного тиреотоксикоза II типа и требует комплексного подхода к диагностике [28].
В ходе исследования не было выявлено взаимосвязи между дозой, длительностью приема амиодарона и вероятностью развития тиреопатий, что в целом подтверждает факт достаточно высокой толерантности к тиреотокси-ческому действию амиодарона в детском возрасте.
Таким образом, сделаем следующие основные выводы.
-
1. У большинства детей, получающих лечение амиодароном, обнаруживается увеличение размеров щитовидной железы, в 6,6 % сочетающееся с нарушением ее функции по типу как гипо- так и гипертиреоза, чаще субклинического характера.
-
2. Вероятность развития амиода-рон-индуцированных тиреопатий у детей не зависит от дозы и длительности приема антиаритмика.
Поступила 28.06.2017; принята к публикации 24.04.2017; опубликована онлайн 29.09.2017
Все авторы прочитали и одобрили окончательный вариант рукописи.
Submitted 28.06.2017; revised 24.07.2017; published online 29.09.2017
All authors have read and approved the final version of the manuscript.
Список литературы Дисфункции щитовидной железы, индуцированные приемом амиодарона, у детей
- The clinical value of regular thyroid function tests during amiodarone treatment/S. Benjamens //Eur. J. Endocrinol. 2017. Vol. 177, no. 1. P. 9-14 DOI: 10.1530/EJE-17-0018
- Zosin I, Balas M. Amiodarone-induced thyroid dysfunction in an iodine-replete area: epidemiological and clinical data//Endokrynol. Pol. 2012. Vol. 63, no. 1. P. 2-9. URL: https://www.ncbi.nlm.nih.gov/pubmed/22378090
- Amiodarone and the thyroid/A. Hybel-Jarobcka //Endokrynol. Pol. 2015. Vol. 66, no. 2. P. 176-186 DOI: 10.5603/EP.2015.0025
- Danzi S., Klein I. Amiodarone-induced thyroid dysfunction//J. Intensive Care Med. 2015. Vol. 30, no. 4. P. 179-185 DOI: 10.1177/0885066613503278
- Dysfunction of the thyroid gland during amiodarone therapy: a study of297 cases/A. Czarnywojtek //The Clin. Risk. Manag. 2016. Vol. 12. P. 505-513 DOI: 10.2147/TCRM.S96606
- Amiodarone and the thyroid function/T. Jukic //Lijec Vjesn. 2015. Vol. 137, no. 5-6. P. 181-188. URL: https://www.ncbi.nlm.nih.gov/pubmed/26380478
- Incidence, clinical course, and risk factors of amiodarone-induced thyroid dysfunction in Japanese adults with congenital heart disease/D. Takeuchi //Circ. J. 2015. Vol. 79, no. 8. P. 1828-1834 DOI: 10.1253/circj.CJ-15-0042
- Barvalia U., Amlani B., Pathak R. Amiodarone-induced thyrotoxic thyroiditis: a diagnostic and therapeutic challenge//Case Rep. Med. 2014 DOI: 10.1155/2014/231651
- Балыкова Л. А., Назарова И. С., Тишина А. Н. Лечение аритмий сердца у детей//Практическая медицина. -Казань.-2011. Т. 5, № 53. С. 30-37.
- Examining the safety of amiodarone/P. Santangeli //Expert. Opin. Drug. Saf. 2012. Vol. 11. P. 191-214. URL: https://www.ncbi.nlm.nih.gov/pubmed/22324910
- Cellular and molecular basis of deiodinase-regulated thyroid hormone signaling/B. Gereben //Endocr. Rev. 2008. Vol. 29. P. 898-938. URL: https://www.ncbi.nlm.nih.gov/pubmed/?term=Ge reben+B%2C+Zavacki+AM%2C+Ribich+S+et+al.+Cellular+and+molecular+basis+of+deiodinase-regul ated+thyroid+hormone+signaling.+Endocr+Rev+2008%3B+29%3A+898-938
- Desethylamiodarone antagonizes the effect of thyroid hormone at the molecular level/F. Bogazzi //Eur. J. Endocrinol. 2001. Vol. 145. P. 59-64. URL: https://www.ncbi.nlm.nih.gov/pubmed/11415853
- Eskes S. A., Wiersinga W. M. Amiodaron eand thyroid//Best Pract. Res. Clin. Endocrinol. Metab. 2009. Vol. 23. P. 735-751. URL: https://www.ncbi.nlm.nih.gov/pubmed/19942150
- Incidence and pattern of thyroid dysfunction in patients on chronic amiodarone therapy: experience at a Tertiary Care Centre in Oman/H. Farhan //Cardiovascular Medicine Journal. 2013. Vol. 7. P. 122-126. URL: https://www.ncbi.nlm.nih.gov/pubmed/?term=Farhan+H.%2C+A.+Albulushi%2C+A.+T aqi%2C+A.+Al-Hashim%2C+K.+Al-Saidi%2C+K.+Al-Rasadi%2C+A.+Al-Mazroui+and+I.+Al-Zakwani
- Piccini J. P., Berger J. S., O'Connor C. M. Amiodarone for the prevention of sudden cardiac death: a meta-analysis of randomized controlled trials//Eur. Heart. J. 2009. Vol. 30, no. 10. P. 1245-1253. https://www.ncbi.nlm.nih.gov/pubmed/?term=Piccini+JP%2C+Berger+JS%2C+O%27Connor+CM
- Amiodarone versus lidocaine for pediatric cardiac arrest due to ventricular arrhythmias: a systematic review/M. E. McBride //Pediatr. Crit. Care Med. 2017. Vol. 18, no. 2. P. 183-189. URL: https://www.ncbi.nlm.nih.gov/
- El-Shmaa N. S., El-Amrousy D., Feky W. The efficacy of pre-emptive dexmedetomidine versus amiodarone in preventing postoperative junctional ectopic tachycardia in pediatric cardiac surgery//Ann. Card. Anaesth. 2016. Vol. 19, no. 4. P. 614-620 DOI: 10.4103/0971-9784.191564
- Kakavand B., Di Sessa T. G. Unusual amiodarone toxicity in a child//J. Pediatr. Pharmacol. Ther. 2008. Vol. 13, no. 2. P. 93-95 DOI: 10.5863/1551-6776-13.2.93
- Amiodarone iodine-induced hypothyroidism: risk factors and follow-up in 28 cases/E. Martino //Clin. Endocrinol. (Oxf). 1987. Vol. 26, no. 2. P. 227-37. URL: https://www.ncbi.nlm.nih.gov/pubmed/3665117
- Moffett B. S., Salvin J. W., Kim J. J. Pediatric cardiac intensive care society 2014 consensus statement: pharmacotherapies in cardiac critical care antiarrhythmics//Pediatr. Crit. Care Med. 2016. Vol. 17, no. 3. Suppl 1. P. 49-58 DOI: 10.1097/PCC.0000000000000620
- 2015 ACC/AHA/HRS guideline for the management of adult patients with supraventricular tachycardia: a report of the american college of cardiology/american heart association task force on clinical practice guidelines and the Heart Rhythm Society/R. L. Page //Circulation. 2016. Vol. 133, no. 14. P. 506-574 DOI: 10.1161/CIR.0000000000000311
- 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: the task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC)/S. G. Priori //Eur. Heart. J. 2015. Vol. 36, no. 41. P. 2793-2867. URL: https://www.ncbi.nlm.nih.gov/pubmed/26318695
- Макаров Л. M. Фармакотерапия нарушений ритма сердца у детей//Лечащий врач (The Practitioner). 2000. № 10. С. 48-51. https://www.lvrach.ru/2000/10/4526400
- Mazzanti A. L., Maragna R., Priori S. G. Genetic causes of sudden cardiac death in the young//Curr. Opin. Cardiol. 2017 DOI: 10.1097/HCO.0000000000000391
- Cardenas G. A., Cabral J. M., Leslie C. A. Amiodarone-induced thyrotoxicosis: diagnostic and therapeutic strategies//Clev. Clin. J. Med. 2003. Vol. 70. P. 624-631. URL: https://www.ncbi.nlm.nih.gov/pubmed/?term=Cardenas+GA%2C+Cabral+J+M%2C+Leslie+C+A
- Голицын С. П. Амиодарон десятилетия спустя//Терапевтический архив. 2011. Т. 83, № 8. С. 25-33. URL: http://www.fesmu.ru/elib/Article.aspx?id=245466
- Determinants and outcome of amiodarone-associated thyroid dysfunction/S. Ahmed //Clin. Endocrinol. (Oxf). 2011. Vol. 75, no. 3. P. 388-394 DOI: 10.1111/j.1365-2265.2011.04087.x
- The presence of anti-thyroglobulin (TgAb) and/or anti-thyroperoxidase antibodies (TPOAb) does not exclude the diagnosis of type 2 amiodarone-induced thyrotoxicosis/L. Tomisti //J. Endocrinol. Investigation. 2016. Vol. 39, no. 5. P. 585-591 DOI: 10.1007/s40618-015-0426-0


