Дисфункция синусового узла у пациентов с длительно персистирующей фибрилляцией предсердий: клинико-лабораторные параллели
Автор: Евтушенко В.В., Евтушенко А.В., Павлюкова Е.Н., Суслова Т.Е., Гусакова А.М., Жилина А.Н., Курлов И.О., Попов С.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.36, 2021 года.
Бесплатный доступ
Актуальность. В данной статье приводится обзор по проблеме дисфункции синусового узла (ДСУ) после хирургического лечения длительно персистирующей фибрилляции предсердий (ФП), а также методам диагностики исходного состояния активности и проводимости сердца.Цель: выявить предикторы исходной ДСУ у пациентов с длительно персистирующей ФП.Материал и методы. Исследование выполнено на 65 пациентах с длительно персистирующей ФП, осложняющей пороки митрального клапана. Проведен анализ состояния вегетативной нервной системы у пациентов с длительно персистирующей ФП, данные которого сопоставлены с электрофизиологическими показателями.Результаты. На основании проведенного исследования выявлена точка разделения содержания нейрогуморальных факторов в коронарном русле сердца у пациентов с сохраненной функцией синусового узла и ДСУ. Предложены и внедрены в клиническую практику прогностические критерии развития брадиаритмий в послеоперационном периоде с необходимостью имплантации электрокардиостимулятора (ЭКС).
Длительно персистирующая фибрилляция предсердий, радиочастотная процедура
Короткий адрес: https://sciup.org/149136631
IDR: 149136631 | УДК: 616.12-008.313.2-06:616.125.4-008.14 | DOI: 10.29001/2073-8552-2021-36-1-123-128
Текст научной статьи Дисфункция синусового узла у пациентов с длительно персистирующей фибрилляцией предсердий: клинико-лабораторные параллели
Introduction. This article provides an overview of the problem of sinus node dysfunction after surgical treatment for longstanding persistent atrial fibrillation and the methods for diagnosing the initial states of cardiac activity and conduction.
Purpose. To identify predictors of initial sinus node dysfunction in patients with long-standing persistent atrial fibrillation.
Material and Methods: The study comprised a total of 65 patients with long-standing persistent atrial fibrillation complicating mitral valve disease. The state of autonomic nervous system was analyzed in patients with long-standing persistent atrial fibrillation. The associations between the analyzed data and electrophysiological parameters were investigated.
Results. The study allowed to identify the cutoff points for the contents of neurohumoral factors in the coronary circulation in patients with intact sinus node function and sinus node dysfunction. Prognostic criteria for the development of bradyarrhythmias in the postoperative period requiring pacemaker implantation were proposed and introduced into clinical practice.
Актуальность
Наджелудочковые аритмии в раннем послеоперационном периоде существенно ухудшают показатели гемодинамики пациентов, приводя к пролонгированию нахождения этих пациентов в палате интенсивной терапии, увеличивают риск тромбоэмболических осложнений. Повышение качества радиочастотной фрагментации предсердий по схеме «Лабиринт» за счет восстановления синусового ритма достаточной частоты (градация 4 по шкале Santa Cruz) [1–6], а также предотвращение пароксизмов наджелудочковых тахикардий и дисфункции синусового узла (ДСУ) в раннем послеоперационном периоде являются актуальными проблемами современной хирургической аритмологии. ДСУ способна привести к асистолии, она требует проведения временной электрокардиостимуляции в течение длительного периода, и в ряде случаев возникает необходимость в имплантации электрокардиостимулятора (ЭКС). Оценка функции синусового узла у пациентов с длительно персистирующей фибрилляцией предсердий (ФП) крайне затруднительна и может не дать окончательного ответа на вопрос, имеется ли ДСУ у пациента с длительно персистирующей ФП или нет. В связи с этим актуальным является выявление предикторов сохраненной функции синусового узла, которые можно оценить, невзирая на вышеописанные ограничения.
Цель работы: выявить предикторы исходной ДСУ у пациентов с длительно персистирующей ФП.
Материал и методы
В исследование включены 65 пациентов с длительно персистирующей ФП. По разработанному нами алгоритму отбора на хирургическое лечение пациентов с длительно персистирующей ФП, базирующемуся на электрофизиологическом изучении функции синусового узла, пациенты разделены на 2 группы. В основе алгоритма лежит определение у пациентов с длительно персистирующей ФП времени восстановления функции синусового узла (ВВФСУ) и корригированного времени восстановления функции синусового узла (КВВФСУ) после предшествующей электрической кардиоверсии, выполняемой интраоперационно [3, 4]. При сохраненной функции синусового узла (ВВФСУ – менее 1500 мс, КВВФСУ – менее 900 мс) таким пациентам проводилось хирургическое лечение ФП (радиочастотная фрагментация предсердий по схеме «Лабиринт IV»). В случае диагностирования ДСУ (ВВФСУ – более 1500 мс, КВВФСУ – более 900 мс) хирур- гическая коррекция ФП не выполнялась. После окончания основного этапа операции всем пациентам повторно проводилось электрофизиологическое исследование. Для снижения воздействия сторонних факторов пациентам за 7 дней до операции по возможности отменялись все препараты, которые могли оказать влияние на симпатический тонус сердца. Интраоперационно после подключения искусственного кровообращения устанавливались катетеры в восходящую аорту и коронарный синус, из которых брались пробы крови. В пробах проводилось количественное определение содержания норадреналина (Noradrenalin ELISA, фирма IBL, Гамбург, Германия), а также свободного метанефрина и норметанефрина (MetCombi ELISA, фирма IBL, Гамбург, Германия). Также во время вмешательства до забора всех необходимых проб крови на гормоны и их метаболиты полностью исключалось введение каких-либо симпатомиметических препаратов и ганглиоблокаторов (таблица).
Таблица. Клинико-инструментальные показатели пациентов с пороками митрального клапана и длительно персистирующей фибрилляцией предсердий ( n = 65), Ме ( Q 1; Q 3)
Table 1. Clinical and instrumental parameters in patients with mitral valve diseases and long-standing persistent atrial fibrillation ( n = 65), Ме ( Q 1; Q 3)
|
Показатели Parameters |
Первая группа (сохраненная функция синусового узла), n = 53 Group 1 (with normal sinus node function), n = 53 |
Вторая группа (с ДСУ), n = 12 Group 2 (with sinus node dysfunction), n = 12 |
p |
|
Возраст, лет Age, years |
60,0 (54; 63) |
66,0 (63; 73) |
0,001 |
|
Размер левого предсердия, мм Left atrial diameter, mm |
52,0 (46; 54) |
54,0 (51; 58) |
0,4 |
|
Размер правого желудочка, мм Right ventricular size, mm |
24,0 (22; 27) |
24,0 (21; 26) |
0,7 |
|
Конечный диастолический размер левого желудочка, мм Left ventricular end diastolic diameter, mm |
54,0 (52; 57) |
54,0 (51; 59) |
0,8 |
|
Конечный систолический размер левого желудочка, мм Left ventricular end systolic diameter, mm |
34,0 (31; 38) |
36,0 (31; 40) |
0,7 |
|
Фракция выброса левого желудочка (М-режим), % Left ventricular ejection fraction (M), % |
61,0 (55; 69) |
63,0 (59; 66) |
0,8 |
|
Фракция выброса левого желудочка (B-режим), % Left ventricular ejection fraction (B), % |
66,0 (60; 68) |
65,0 (61; 67) |
0,7 |
|
Конечный диастолический объем левого желудочка, мл Left ventricular end diastolic volume, mL |
133,0 (105; 193) |
124,0 (105; 160) |
0,8 |
|
Конечный систолический объем левого желудочка, мл Left ventricular end systolic volume, mL |
46,0 (34; 70) |
44,0 (36; 66) |
0,7 |
|
Систолическое давление в правом желудочке, мм рт. ст. Right ventricular systolic pressure, mmHg |
44,0 (41; 51) |
53,0 (44; 64) |
0,08 |
|
Риск по EuroSCORE, % EuroSCORE, % |
3,0 (2,0; 4,7) |
6,4 (4,0; 8,0) |
0,04 |
|
Риск по EuroSCORE, баллы EuroSCORE, points |
4,0 (3,0; 6,0) |
6,0 (5,0; 8,0) |
0,02 |
|
Тест с 6-минутной ходьбой, м Six-minute walk test, m |
250,0 (230; 276) |
279,0 (257; 290) |
0,3 |
Данный способ изучения функции синусового узла и основанный на его принципе алгоритм отбора пациентов с ФП на хирургическое лечение хорошо себя зарекомендовали, так как позволили статистически значимо снизить количество имплантированных искусственных водителей ритма в послеоперационном периоде, однако они имеют существенные ограничения для применения у пациентов с внутрисердечными тромбозами. Эта категория пациентов имеет противопоказание к восстановлению ритма, что не позволяет провести электрофизиологическое исследование функции синусового узла.
Статистическую обработку полученных данных осуществляли с применением пакета программ STATISTICA
10 for Windows (StatSoft). Для проверки выборок на соответствие нормальному закону распределения использовали критерий Шапиро – Уилка (Shapiro – Wilk). Равенство дисперсий проверяли по критерию Левена. Данные описывали с помощью среднего и стандартного отклонения M ± StD (в случае нормальности распределения данных), медианы, верхнего и нижнего квартилей (при отсутствии нормального распределения). Для оценки степени значимости межгрупповых различий использовали t-критерий Стьюдента и U-критерий Манна – Уитни. Для оценки степени значимости внутригрупповых различий (динамика показателей до/после воздействия внутри одной группы) применяли тест Вилкоксона. При сравнении в динамике трех и более показателей использовали метод попарных сравнений с поправкой Бонферрони. Для исследования связей качественных показателей применяли критерий χ2 (при ожидаемой частоте событий более 5) либо точный критерий Фишера – в случае меньшего количества частоты встречаемости. Уровень статистической значимости р принимали равным 0,05; соответственно, доверительная вероятность Pдов. = 0,95. Предикторы исходной ДСУ выявляли с помощью моделей логистической регрессии с последующим ROC-анализом в пакете SPSS STATISTICS 17 (IBM).
Результаты
После основного этапа операции синусовый ритм с частотой более 60 в минуту определялся у 51 пациента первой группы (96%). У 12 пациентов (100%) второй группы сохранялась ДСУ, что было подтверждено результатами электрофизиологического исследования. Нами была выдвинута гипотеза о возможных нейрогуморальных факторах, способных по принципу как прямого воздействия на клетки проводящей системы сердца, так и отрицательной обратной связи оказывать влияние на функцию синусового узла. Объектами изучения стали катехоламины (адреналин, норадреналин) и их метаболиты, содержащиеся в плазме крови восходящей аорты и коронарного синуса. По результатам анализа наиболее чувствительным показателем в оценке функции синусового узла является содержание норадреналина в коронарном синусе, а также метанефрина и норметанефрина в восходящей аорте до вмешательства.
В качестве диагностического критерия исходной ДСУ нами были построены модели бинарной логистической регрессии, в которой зависимая переменная была равна 1, когда синусовый ритм имел достаточную частоту в послеоперационном периоде (градация 4 по шкале Santa Cruz), и равна 0 в противном случае. [1]. При построении моделей было выявлено, что предикторами сохраненной функции синусового узла являются уровни норадреналина в коронарном синусе, а также метанефрина и норме-танефрина в восходящей аорте (рис. 1).
ROC Curve
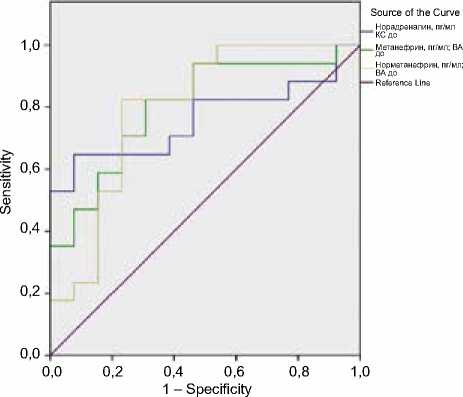
Рис. 1. ROC-кривые нейрогуморальных диагностических показателей до основного этапа операции
Fig. 1. ROC curves of neurohumoral diagnostic indicators before the main stage of operation
Точки пересечения кривых чувствительности и специфичности были определены как пороговые значения уровней катехоламинов. Так, пороговыми явились значения: для норадреналина в коронарном синусе – более 819,9 пг/мл; для метанефрина в восходящей аорте – более 18,83 пг/мл; для норметанефрина в восходящей аорте – более 15,27 пг/мл. При этом ROC-анализ показал площадь под кривой (AUC) для норадреналина 0,8, для метанефрина – 0,8, для норметанефрина – 0,82. Значение p во всех случаях было менее 0,05, что говорит о хорошем качестве модели.
Обсуждение
Важным критерием, влияющим на исходы хирургического вмешательства при ФП, является функция синусового узла. Связь между ДСУ и ФП была установлена в 1960 г. M.I. Ferrer [7]. Было показано, что ДСУ считается одной из многих причин ФП [8, 9]. При подавлении активности синусового узла во время медленного предсердного цикла формируются предсердные экстрасистолы, сопровождающиеся компенсаторной паузой [8, 9]. Наличие ДСУ ведет к увеличению количества и продолжительности пауз, что дает возможность генерировать импульсы для других источников, которые могут вызвать нарушения ритма сердца [10]. Ряд исследователей продемонстрировали, что у некоторых пациентов предсердные экстрасистолии имеют решающее значение для инициации ФП [8]. Также было показано, что если структура синусового узла повреждена только частично, то вероятность ее восстановления после электрической кардиоверсии выше, чем при полном повреждении, даже если ФП сохраняется в течение многих лет [11]. После купирования ФП у ряда пациентов обнаруживалась ДСУ, что позволило высказать версию о ФП как о компенсаторном механизме, возникающем при дисфункции узла. При этом после купирования аритмии нарушение ритмовождения может иметь ведущее значение. Считается, что аритмия не всегда необратимо повреждает синусовый узел, однако длительное существование ФП и ремоделирование предсердий способны вызывать необратимые структурные изменения в элементах проводящей системы. [10]. Кроме того, хирургическое, интервенционное лечение или медикаментозная терапия ФП могут значительно ухудшить уже скомпрометированную функцию синусового узла, что вызовет его необратимые структурные изменения [10]. Несмотря на это, до сих пор не было однозначного ответа на вопрос, как оценить автоматизм сердца при отсутствии нормального ритма. Наше исследование позволяет дать ответ на этот вопрос и сделать прогноз о течении послеоперационного периода у пациентов с ФП после хирургического лечения. Технология исследования функции синусового узла, основанная на данных его электрофизиологических показателей, а также разработанный на ее основе алгоритм отбора пациентов с ФП для хирургического лечения являются очень эффективными, они снижают количество брадиаритмий и зависимость от ЭКС после операции. Но применение этой технологии и алгоритма невозможно у пациентов, у которых выявляется тромбоз полостей сердца как осложнение ФП. Это является противопоказанием к восстановлению синусового ритма и не позволяет провести исследование функции синусового узла. Именно поэтому разработанная новая технология выявления ДСУ, основанная на анализе нейрогуморальных показателей, дает возможность провести отбор пациентов с длительно персистирующей ФП на хирургическое лечение, не прибегая к кардиоверсии.
Несомненно, термическое и волновое поражение элементов проводящей системы сердца также может вносить негативный вклад в развитие брадиаритмий в послеоперационном периоде, но зная исходное состояние синусового узла, можно с уверенностью говорить о необходимости ЭКС в случае первичной компрометации естественного водителя ритма.
Заключение
Представленная модель сохраненной функции синусового узла позволяет выявлять ДСУ у пациентов с длительно персистирующей ФП на дооперационном этапе, не прибегая к выполнению кардиоверсии и электрофизиологического исследования, что является актуальным у больных, у которых существование аритмии осложнилось тромбозом полостей сердца. Результатом данного исследования стала возможность выбора тактики хирургического лечения, предотвращающей развитие брадиаритмий у пациентов с пороками сердца, осложненными длительно персистирующей ФП.
Определение уровней нейрогуморальных факторов, таких как метанефрин, норметанефрин и норэпинефрин в системном и коронарном кровотоках может дать ответ на вопрос о наличии ДСУ, что может стать решающим при определении стратегии лечения пациентов с ФП.
Список литературы Дисфункция синусового узла у пациентов с длительно персистирующей фибрилляцией предсердий: клинико-лабораторные параллели
- Melo J.Q., Neves J., Adragao P., Ribeiras R., Ferreira M.M., Bruges L. et al. When and how to report results of surgery on atrial fibrillation. Eur. J. Cardiothorac. Surg. 1997;12(5):739-744. DOI: 10.1016/s1010-7940(97)00252-2.
- Greenberg J.W., Lancaster T.S., Schuessler R.B., Melby S.J. Postoperative atrial fibrillation following cardiac surgery: А persistent complication. Eur. J. Cardiothorac. Surg. 2017;52(4):665-672. DOI: 10.1093/ejcts/ezx039.
- Евтушенко А.В., Евтушенко В.В., Петлин К.А., Смышляев К.А., Ва-изов В.Х. и др. Перспективы восстановления функции синусового узла у пациентов после хирургического лечения длительно персистирующей фибрилляции предсердий. Сибирский журнал клинической и экспериментальной медицины. 2014;29(3):73-80. DOI: 10.29001/2073-8552-2014-29-3-73-80.
- Евтушенко В.В., Макогончук И.С., Евтушенко А.В. Правила и принципы отбора пациентов на хирургическое лечение приобретенных пороков сердца, осложненных фибрилляцией предсердий. Сибирский журнал клинической и экспериментальной медицины. 2017;32(3):29-34. DOI: 10.29001/2073-8552-2017-32-329-34.
- Pecha S., Hakmi S., Subbotina I., Willems S., Reichenspurner H., Wagner F.M. Concomitant surgical ablation for atrial fibrillation (AF) in patients with significant atrial dilation >55 mm. Worth the effort? J. Cardiothorac. Surg. 2015;10:165. DOI: 10.1186/s13019-015-0337-3.
- Cox J.L., Schuessler B.R., D'Agostino J.H. Jr., Stone C.M., Chang B.C., Cain M.E. et al. The surgical treatment of atrial fibrillation III. Development of a definitive surgical procedure. J. Thorac. Cardiovasc. Surg.1991;101(4):569-583.
- Ferrer M.I. The sick sinus syndrome. New York: Futura Publishing Company; 1974.
- Hudson R.E.B. Cardiovascular pathology. London: Edward Arnold; 1965.
- Lippestad C.T., Marton P.F. Sinus arrest in proximal right coronary artery occlusion. Am. Heart J. 1967;74(4):551-556. DOI: 10.1016/0002-8703(67)90015-4.
- Kezerashvili A., Krumerman A.K., Fisher J.D. Sinus node dysfunction in atrial fibrillation: Cause or effect? J. Atr. Fibrillation. 2008;1(3):30. DOI: 10.4022/jafib.30.
- Waris E., Kreus K.E., Salokannel J. Factors influencing persistence of sinus rhythm after DC shock treatment of atrial fibrillation. Acta Med. Scand. 1971;189(3):161-166. DOI: 10.1111/j.0954-6820.1971. tb04358.x.


