Диссеминированный перитонеальный лейомиоматоз у пациентки с анамнезом лапароскопической миомэктомии: клиническое наблюдение
Автор: Сидакова З.А., Баранова А.А., Чернавина К.М., Алдушкина Ю.В., Грицай А.Н., Любченко Л.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.24, 2025 года.
Бесплатный доступ
Актуальность. Диссеминированный перитонеальный лейомиоматоз (ДПЛ) – редкое заболевание мезенхимального происхождения, характеризующееся наличием множества доброкачественных миоматозных опухолевых узлов, рассеянных по поверхности брюшины, сальнику и другим мягким тканям брюшной полости и/или малого таза. Несмотря на доброкачественные морфологические характеристики, ДПЛ отличается склонностью к рецидивированию, а также возможным риском злокачественной трансформации. Кроме того, клинические проявления опухоли напоминают канцероматоз брюшины, что требует проведения тщательного дифференциально-диагностического поиска для постановки верного диагноза и обеспечения надлежащего лечения пациентов. В настоящее время вследствие редкости ДПЛ отсутствуют стандарты диагностики и лечения данного заболевания. Цель исследования – описание клинического наблюдения пациентки с гормонально-чувствительным рецидивирующим ДПЛ и анамнезом лапароскопической миомэктомии для совершенствования алгоритмов ведения подобных пациентов. Материал и методы. Материалом для статьи послужили данные НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиала ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, где пациентка проходила лечение по поводу ДПЛ. Для определения тактики лечения пациентки в описанном клиническом наблюдении выполнен развернутый дифференциально-диагностический поиск, включающий различные визуализирующие техники для оценки распространенности опухолевого процесса, а также методики забора опухолевого материала для его морфологической оценки, в частности, была проведена диагностическая лапароскопия со срочным морфологическим исследованием, позволившим окончательно определить объем оперативного вмешательства и достичь максимально возможной циторедукции. При последующем плановом морфологическом исследовании в опухоли выявлена экспрессия рецепторов эстрогена и прогестерона, что послужило поводом для назначения гормональной терапии совместно с тщательным динамическим наблюдением с целью улучшения возможности контроля заболевания. Заключение. Изучение и демонстрация редких клинических случаев расширяют кругозор и понимание природы заболевания. Клиническое наблюдение и проведенный обзор литературы продемонстрировали, что клетки лейомиомы склонны к имплантационной диссеминации.
Диссеминированный перитонеальный лейомиоматоз, миома матки, лейомиома, морцелляция, мезенхимальные опухоли, гинекология, малоинвазивные вмешательства
Короткий адрес: https://sciup.org/140310585
IDR: 140310585 | УДК: 616-006.363.03 | DOI: 10.21294/1814-4861-2025-24-3-180-189
Текст научной статьи Диссеминированный перитонеальный лейомиоматоз у пациентки с анамнезом лапароскопической миомэктомии: клиническое наблюдение
Диссеминированный перитонеальный лейомио-матоз (ДПЛ) – редкое заболевание мезенхимального происхождения, характеризующееся наличием множества миоматозных опухолевых узлов, рассеянных по поверхности брюшины, сальнику и другим мягким тканям брюшной полости и/или малого таза [1, 2]. При патоморфологическом и иммуногистохимическом исследовании опухолевые узлы при ДПЛ демонстрируют классические признаки типичной доброкачественной лейомиомы, представленной переплетающимися пучками веретеновидных клеток со слабовыраженной атипией или без нее, с низкой митотической активностью и положительной экспрессией виментина, гладкомышечного актина, десмина и кальдесмона [1, 3, 4]. Впервые диссеминация миоматозных опухолевых узлов по брюшине описана в 1952 г. Wilson et Peale, а термин «ДПЛ» введен Taubert et al. в 1965 г. [1].
Этиопатогенетические основы ДПЛ до конца не изучены. Выдвинуты гормональная, ятрогенная и генетическая теории развития и прогрессирования ДПЛ. Согласно гормональной теории, ведущим фактором в развитии ДПЛ является повышенный уровень женских половых гормонов. В исследованиях на животных установлено, что гиперэстроге-ния в течение длительного времени может вызывать метаплазию мезенхимальных стволовых клеток в фибробласты, лейомиоциты или эндометриальную строму. В подобных случаях у животных развивались узелковые опухолевые образования из клеток мезенхимы, сходные с таковыми у людей при ДПЛ. Кроме того, по данным иммуногистохимического окрашивания опухолевые клетки при ДПЛ в большинстве описанных случаев экспрессируют высокие уровни рецепторов эстрогена и прогестерона [1]. Гормональная теория также подтверждается опубликованными клиническими наблюдениями, где ДПЛ преимущественно обнаруживается у женщин в пременопаузе с нарушением гормонального статуса (например, с анамнезом длительной заместительной гормональной терапии, наличием гормон-продуцирующей опухоли и др.).
Согласно ятрогенной теории, развитие ДПЛ обусловлено диссеминацией или имплантацией опухолевых клеток при миомэктомии или гистерэктомии с морцелляцией [5, 6]. В зарубежной литературе опубликовано 28 статей, описывающих 41 случай ятрогенного ДПЛ [4]. Доказательством ятрогенной теории являются исследования, установившие, что у одного и того же пациента клетки опухолевых узлов при ДПЛ и лейомиоме матки имеют идентичные хромосомные аберрации. Цитогенетические анализы также демонстрируют, что опухолевые образования при ДПЛ могут быть продуктами клонального развития или потенциальными метастатическими отложениями уни-центрического заболевания и следовать сходным патогенетическим путям [7, 8].
Однако до сих пор отсутствует четкая корреляционная связь между ДПЛ и миомой матки, поскольку также описаны клинические случаи ДПЛ без ее наличия в анамнезе, в частности у мужчин. Кроме того, описаны ДПЛ, при которых отсутствует экспрессия опухолевыми клетками рецепторов к эстрогену и прогестерону [1, 3, 5]. Согласно генетической теории, ДПЛ возникает вследствие наследственной предрасположенности к независимой метаплазии подбрюшинных мезенхимальных клеток. Данная теория доказывается наличием ряда случаев диагностирования ДПЛ у родственников. Так, N. Halama et al. [1] описана семья с ДПЛ как у женщин, так и у мужчин. Экспериментальный анализ R. Vaishnavi et al. [9] обнаружил потенциальную связь между генетической предрасположенностью, гормональным дисбалансом и ятрогенными факторами в патогенезе развития ДПЛ. Однако следует учитывать, что в патогенезе ДПЛ могут участвовать не только герминальные изменения, но и спонтанные генетические поломки, возникающие в течение жизни. На основании вышеописанного к факторам риска ДПЛ можно отнести: женский пол (особенно репродуктивного возраста, чаще 30–40 лет), нарушения гормонального статуса (наличие гормон-продуцирующей опухоли, беременность, длительный прием оральных контрацептивов и др.), наличие миомы матки, лапароскопическую миоэктомию по поводу миомы матки с использованием морцелляции в анамнезе, а также семейный анамнез [10–12].
В настоящее время в мировой литературе описано около 200 случаев ДПЛ, большинство из которых приходится на женщин пременопаузального возраста с анамнезом длительной гиперэстрогении и/или лейомиомой матки, реже ДПЛ регистрировался у мужчин или женщин в постменопаузе [1–5]. ДПЛ, вероятно, имеет большую распространенность вследствие часто бессимптомного течения заболевания, а также все большего использования малоинвазивных хирургических техник лечения лейомиом [10]. Так, лейомиомы матки являются наиболее распространенными доброкачественными гинекологическими опухолями, склонными к рецидивированию у женщин в пременопаузе: к 50-летнему возрасту они диагностируются у 70 % женщин. Согласно эпидемиологическому исследованию, в России заболеваемость миомой матки высокая: в 2019 г. глобальный стандартизи- рованный по возрасту показатель заболеваемости лейомиомой составил 586,64 на 100 тыс., уступив место только Латвии, а общемировая заболеваемость лейомиомой оценена авторами в 0,25 на 100 тыс. женщин [13].
Несмотря на относительную редкость, ДПЛ представляет большой интерес с практической точки зрения. Так, согласно классификации ВОЗ (2020), ДПЛ, как и паразитарная лейомиома, внутривенный лейомиоматоз, доброкачественная метастазирующая лейомиома, относится к гладкомышечным опухолям неопределенного злокачественного потенциала (smooth muscle tumors of uncertain malignant potential, STUMP), т. е. к опухолям, которые не могут быть однозначно отнесены к доброкачественным или злокачественным из-за особенностей своих поведенческих характеристик, в частности, из-за высокой частоты рецидивов и риска злокачественной малигнизации [14].
Согласно критическому обзору 62 случаев рецидивирующей или метастатической лейомиомы матки S. Sanada et al. [15], лапароскопическая операция с использованием неограниченной морцел-ляции выполнена в 23 (37,0 %) случаях, при этом исходно злокачественный потенциал опухоли был недооценен у 14 (24,2 %) пациенток, а истинная злокачественная трансформация наблюдалась в 7 (11,3 %) случаях. По мнению авторов, рецидиви-рование лейомиом наблюдалось преимущественно в областях, прилежащих к интраоперационному полю, а медиана времени до рецидива составляла в среднем 51,5 мес.
Злокачественная трансформация ДПЛ чаще наблюдается у мужчин, женщин в постменопаузе, у лиц без анамнеза лапароскопической хирургии с морцелляцией, а также в случаях отсутствия экспрессии опухолевыми клетками гормональных рецепторов [3]. Время между инициальной диагностикой ДПЛ и злокачественной трансформацией, по данным ряда авторов, может варьировать от 1 мес до 8 лет [1, 3, 4, 6]. Знания клиницистов о ДПЛ необходимы для постановки верного диагноза и обеспечения надлежащего лечения.
Целью исследования является изложение клинического наблюдения пациентки с гормональночувствительным рецидивирующим ДПЛ и анамнезом лапароскопической консервативной миомэктомии.
Материалом для статьи послужили данные НИИ урологии и интервенционной радиологии им. Н.В. Лопаткина – филиала ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, где пациентка проходила лечение по поводу ДПЛ.
Клиническое наблюдение
Пациентка, 40 лет, обратилась к онкогинекологу в НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина в октябре 2022 г. с жалобами на пальпируемое образование в правой подвздошной области. Из анамнеза установлено, что в 2015 г. по поводу множественных миом матки выполнена лапароскопическая консервативная миомэктомия с морцелляцией узлов. В 2020 г. при динамическом наблюдении, по данным УЗИ, в правой подвздошной области выявлено опухолевое образование, размерами до 2,5 см. В течение 2 мес опухолевое образование в правой подвздошной области стало пальпироваться, по поводу чего в октябре 2022 г. пациентка самостоятельно обратилась в НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина Из гинекологического анамнеза: реализованная репродуктивная функция: в анамнезе 2 родов, менструации регулярные, по 6–7 дней через 28 дней. Семейный анамнез отягощен миомами матки.
В НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина пациентке рекомендовано комплексное обследование. По данным МРТ с контрастным усилением от октября 2022 г.: в полости малого таза выявлены множественные узловые образования по брюшине, асцит, кистозно-солидное образование в проекции левого яичника, эндометриоз.
С целью морфологической верификации диагноза в октябре 2022 г. выполнена чрескожная трепан-биопсия опухолевого образования правой подвздошной области под ультразвуковой навигацией. По данным гистологического исследования от ноября 2022 г.: столбики опухолевого узла представлены разнонаправленными пучками гладкомышечных клеток без признаков ядер-ной атипии, с очаговым гиалинозом стромы и многочисленными сосудистыми полостями без митозов и некрозов. При иммуногистохимическом исследовании в клетках опухоли отмечена диффузная экспрессия гладкомышечного актина и кальдесмона, без экспрессии CD34 и десмина. На основании вышеописанного морфологическая картина и иммунофенотип полученного биопсионного материала соответствовали лейомиоме. Также произведена пункция заднего свода влагалища для забора асцитической жидкости. По данным цитологического исследования от октября 2022 г.: в асцитической жидкости отсутствовали клетки с опухолевой атипией. По данным неинвазивных визуализирующих методик исследования в других органах и системах признаков опухолевого роста не выявлено.
В отделении реконструктивно-пластической гинекологии и онкологии НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина в декабре 2022 г. выполнено раздельно-диагностическое выскабливание полости матки и цервикального канала. По данным гистологического заключения полученного материала выявлены железистофиброзный полип эндометрия и субмукозная лейомиома тела матки.
Для оценки распространенности опухолевого процесса и уточнения диагноза в январе 2023 г. выполнена диагностическая лапароскопия с целью срочного интраоперационного исследования левого придатка матки и пораженных участков брюшины. При интраоперационной ревизии в полости малого таза имелась асцитическая жидкость, до 1 л, в области правого яичника – опухолевый узел, размером до 3,5 см, а также множественные опухолевые узлы по париетальной брюшине (2 опухолевых узла с четкими ровными контурами в левой подвздошной области; единичный опухолевый узел в правом боковом фланге живота; множественные мелкие опухолевые узлы по париетальной брюшине малого таза слева; опухолевый узел, размером до 5 см, по париетальной брюшине передней брюшной стенки по срединной линии) (рис. 1). Произведен забор асцитической жидкости для цитологического исследования (признаки клеточной атипии не выявлены). Выполнены удаление левого придатка матки и биопсия патологических участков брюшины. Полученный материал отправлен на срочное гистологическое исследование, по данным которого опухолевый материал из левого яичника и узловых образований брюшины соответствовал лейомиоме. Интраоперационно установлен диагноз ДПЛ. Произведена конверсия и дополнительно выполнена экстирпация матки с левым придатком и правой маточной трубой, парциальная перитонэктомия пораженных участков брюшины малого таза.
По данным планового патоморфологического исследования от января 2023 г.: макроскопически в срезах тела матки выявлены участки множественных субсерозных и интрамуральных лейомиом с вторичными дегенеративными изменениями и признаками расстройства кровообращения в виде некроза, кровоизлияний в ткань узлов. Шейка матки обычного строения, с очагами гипер-, паракератоза многослойного плоского эпителия покрова экзоцервикса, фокусами плоскоклеточной метаплазии желез, ретенционными кистами. Маточные трубы с очаговым фиброзом складок эндосаль-пинкса. В срезах ткани левого яичника определялся прилежащий опухолевый узел, имеющий строение лейомиомы. Морфологическая картина узловых образований брюшины также соответствовала лейомиоме (рис. 2). При иммуногистохимическом исследовании наблюдалась позитивная реакция опухолевых клеток с гладкомышечным актином и кальдесмоном, а также с рецепторами эстрогенов и прогестерона (рис. 3). Реакция с CD34 и десмином была отрицательная.
В послеоперационном периоде рекомендована длительная терапия синтетическим агонистом гонадотропин-рилизинг-гормона – бусерелином 3,75 мг каждые 28 дней длительно. Пациентка не придерживалась назначенного лечения. Через 6 мес, в июне 2023 г., при контрольной МРТ ор-
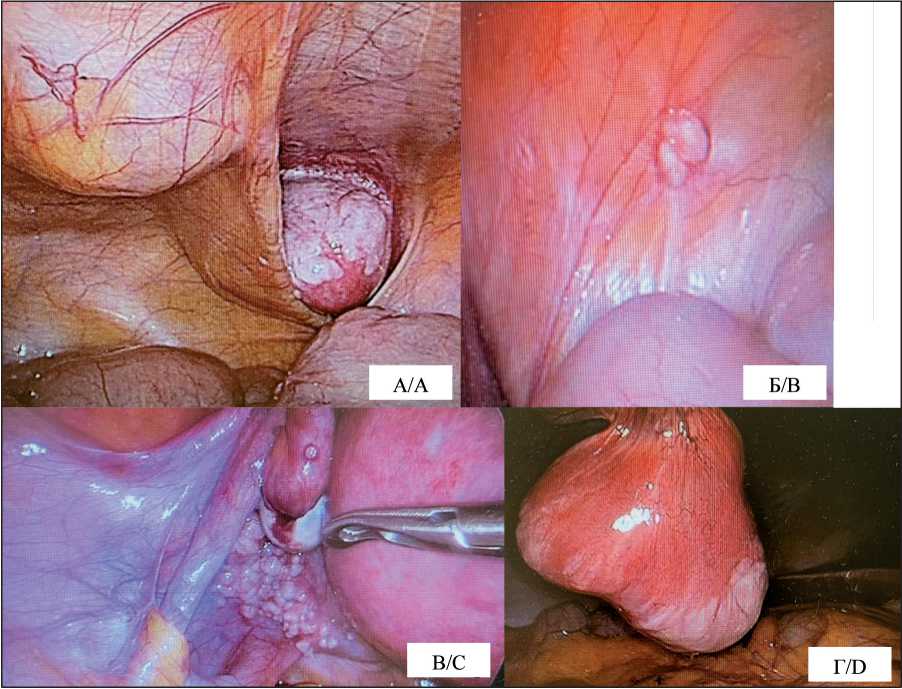
Рис. 1. Диагностическая лапароскопия от января 2023 г.: А – опухолевый узел, размером до 3,5 см, исходящий из левого яичника; Б – опухолевый узел в правом боковом фланге живота; В – множественные мелкие опухолевые узлы по париетальной брюшине малого таза слева;
Г – опухолевый узел, размером до 5 см, по париетальной брюшине передней брюшной стенки, по срединной линии. Примечание: рисунок выполнен авторами
Fig. 1. Diagnostic laparoscopy (January 2023): A – tumor originating from the left ovary of up to 3.5 cm in size; B – tumor in the right lateral flank of the abdomen; C – multiple small tumors along the parietal peritoneum of the pelvis on the left;
D – tumor of up to 5 cm in size along the parietal peritoneum of the anterior abdominal wall along the midline.
Note: created by the authors
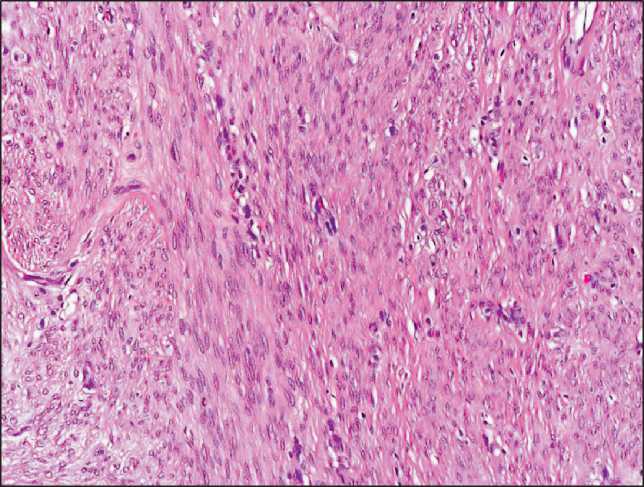
Рис. 2. Микрофото. Типичная лейомиома: разнонаправленные переплетающиеся пучки опухолевых клеток без признаков ядерной, клеточной атипии и выраженной митотической активности, окраска гематоксилином и эозином, ×20. Примечание: рисунок выполнен авторами
Fig. 2. Microphoto. Typical leiomyoma: interlacing bundles of smooth muscle cells without signs of nuclear, cellular atypia and pronounced mitotic activity, hematoxylin and eosin staining, ×20. Note: created by the authors
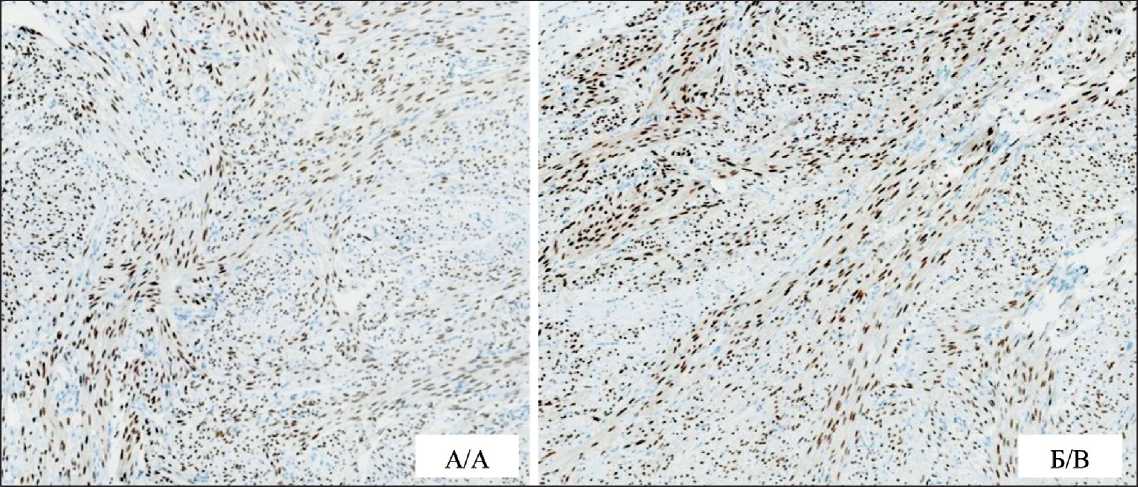
Рис. 3. Микрофото. Иммуногистохимическое исследование:
А – положительная реакция с антителами к рецепторам эстрогенов, ×20;
Б – положительная реакция с антителами к рецепторам прогестерона, ×20. Примечание: рисунок выполнен авторами Fig. 3. Microphoto. Immunohistochemistry: A – positive reaction with antibodies to estrogen receptors, ×20; B – positive reaction with antibodies to progesterone receptors, ×20. Note: created by the authors
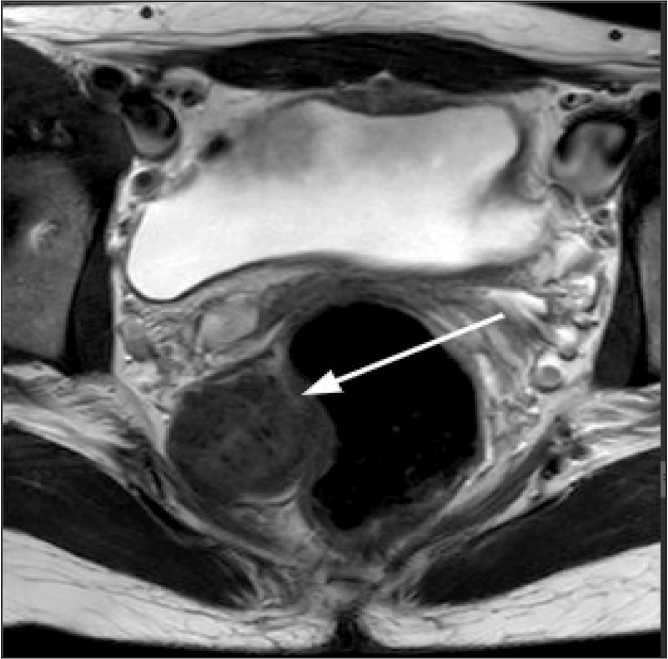
Рис. 4. МРТ органов малого таза: стрелкой указан опухолевый узел с ровными контурами, размерами 4,0×2,4 см, находящийся в параректальной клетчатке справа, деформирующий контур прямой кишки, без признаков инвазии в ее стенку. Примечание: рисунок выполнен авторами Fig. 4. MRI of the pelvic organs: the arrow indicates a tumor with smooth contours measuring 4.0×2.4 cm in the pararectal tissue to the right of the rectum, deforming the contour of the intestine, without signs of invasion into its wall. Note: created by the authors ганов малого таза с контрастным усилением: в параректальной клетчатке справа от прямой кишки, деформируя ее контур, без признаков инвазии в стенку, выявлено мягкотканое опухолевое образование с четкими ровными контурами, размерами 4,0×2,4 см, с ограничением диффузии и равномерным активным накоплением контрастного препарата (рис. 4). Также при МРТ выявлено опухолевое образование в большом сальнике, до 4 см в диаметре.
В августе 2023 г. по поводу рецидива опухолевого процесса выполнено повторное хирургическое вмешательство. При интраоперационной ревизии: в малом тазу 30 мл свободной жидкости, в пара-
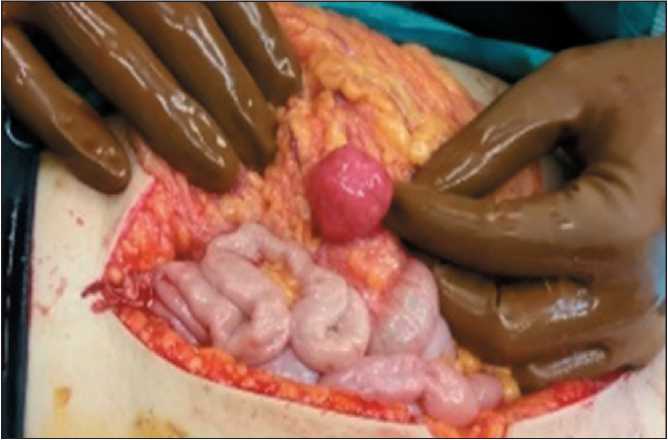
Рис. 5. Данные интраоперационной ревизии: опухолевое образование в большом сальнике, диаметром до 4 см. Примечание: рисунок выполнен авторами
Fig. 5. Intraoperative revision: tumor in the omentum up to 4 cm in diameter. Note: created by the authors ректальной клетчатке справа – миоматозный узел, размерами до 4 см, в большом сальнике опухолевый узел, также до 4 см в диаметре (рис. 5), по париетальной брюшине левого латерального канала 2 миоматозных узла, размерами до 0,5 см. Выполнены оментэктомия и удаление рецидивных опухолевых узлов. При цитологическом исследовании в асцитической жидкости клетки без признаков опухолевой атипии. По данным планового морфологического исследования удаленные опухолевые узлы соответствовали лейомиоме.
Пациентке настоятельно рекомендована гормональная терапия бусерелином. При динамическом наблюдении в январе 2024 г. по данным МРТ выявлен очередной рецидив опухоли по передней брюшной стенке живота справа, а также участок измененного контрастирования по нижнему краю послеоперационного рубца (рис. 6). Выполнена диагностическая биопсия опухолевого узла по передней брюшной стенке под ультразвуковой навигацией. По данным морфологического заключения – лейомиома. Учитывая молодой возраст манифестации заболевания и рецидивирующее течение опухолевого процесса, пациентка консультирована врачом-генетиком. Семейный анамнез отягощен миомой
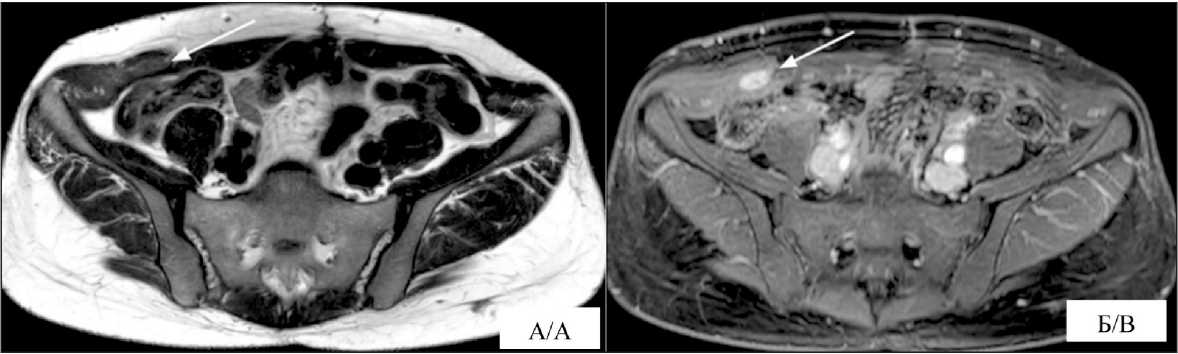
Рис. 6. МРТ органов малого таза от января 2024 г.: А – Т2-взвешенное изображение; Б – Т2-взвешенное изображение с жироподавлением (стрелкой указан опухолевый узел по передней брюшной стенке справа). Примечание: рисунок выполнен авторами Fig. 6. MRI of the pelvis (January 2024) (A – T2-weighted image; B – T2-weighted image with fat suppression): the arrow indicates a tumor on the anterior abdominal wall on the right. Note: created by the authors
матки. Рекомендовано выполнение молекулярногенетического исследования. При исследовании ДНК, выделенной из образца опухолевой ткани под контролем патоморфолога, мутаций в генах BRCA1/2, BRAF, PIK3CA, NRAS, KRAS не обнаружено. Фенотип опухоли со стабильной системой репарации неспаренных оснований ДНК (MSS-статус). Герминальных мутаций в гене CHEK2, ассоциированных с синдромом предрасположенности к раку 4 (ранее CHEK2-ассоциированный синдром Ли–Фраумени), не выявлено.
С учетом малых размеров рецидивного опухолевого узла пациентке рекомендованы строгое динамическое наблюдение, а также ранее назначенная гормональная терапия бусерелином. По данным МРТ от апреля 2024 г. опухолевые узлы в передней брюшной стенке, а также участок измененного контрастирования по нижнему краю рубца стабильны. Пациентка продолжает гормональную терапию и находится под строгим динамическим наблюдением по месту жительства, а также в НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина.
Обсуждение
Описанное клиническое наблюдение продемонстрировало, что клетки доброкачественной лейомиомы склонны к имплантационной диссе-минации, а морцелляция миоматозных узлов при консервативной миомэктомии может играть важную роль в патогенезе развития ДПЛ у пациенток репродуктивного возраста. Впервые морцеллятор для интракорпорального фрагментирования и возможности извлечения удаленных макропрепаратов через небольшие троакарные отверстия был предложен в 1977 г. K. Semm. С совершенствованием методики интракорпорального фрагментирования и широким внедрением морцелляции в хирургическую практику в литературе стали появляться работы, посвященные осложнениям и побочным эффектам данного метода [12]. В частности, в литературе описывались случаи перитонеальной диссеминации лейомиосаркомы, не диагностированной на предоперационном этапе, у пациенток, оперированных по поводу доброкачественных опухолей матки с использованием морцелляции [6]. В связи с чем, к примеру, в США, после долгих дискуссий и запретов, в настоящее время при малоинвазивных вмешательствах в гинекологической практике рекомендуется использовать технику «замкнутой» морцелляции – миому или матку перед непосредственным извлечением из полости малого таза следует помещать в специальный мешок и уже там морцеллировать [11, 16]. Согласно национальным клиническим рекомендациям (2024), при выполнении лапароскопической миомэктомии с целью исключения опухолевой диссеминации использование морцелляции также рекомендовано только в специальном контейнере [17].
В плане диагностики и лечения пациентов с ДПЛ отсутствуют установленные клинические стандарты ввиду редкости заболевания [1, 4]. Дифференциальная диагностика ДПЛ затруднена, поскольку клинические проявления заболевания напоминают карциноматоз брюшины [18]. Для определения тактики лечения пациентки в вышеописанном клиническом наблюдении выполнен развернутый дифференциально-диагностический поиск, включающий различные визуализирующие техники для оценки распространенности опухолевого процесса, а также методики извлечения опухолевого материала для его морфологической оценки (забор асцитической жидкости на цитологическое исследование, чрескожная трепан-биопсия новообразования с последующим гистологическим и иммуногистохимическим исследованием, а также диагностическая лапароскопия со срочным морфологическим исследованием).
Лечение ДПЛ, по данным авторов, проводится в основном в трех направлениях: динамический мониторинг, хирургическое вмешательство и гормональная терапия. При нераспространенных бессимптомных формах ДПЛ ряд экспертов предлагают ограничиться динамическим наблюдением с/без назначением гормональной терапии с целью снижения гиперэстрогении [6, 10, 12]. Данный подход считается особенно оправданным при наблюдаемой спонтанной регрессии ДПЛ, как и лейомиом матки, в послеродовом периоде, в период перименопаузы, а также после отмены гормональных контрацептивов и удаления гормон-продуцирующей опухоли [6]. Хирургическое лечение обоснованно при распространенных формах ДПЛ с выраженной симптоматикой. Оно должно преследовать цель обеспечения максимальной циторедукции и зависеть от желания пациентки сохранить фертильность и может включать гистерэктомию, двустороннюю аднексэктомию, оментэктомию, а также удаление всех видимых опухолевых узлов [10]. В послеоперационном периоде при гормон-позитивных опухолях для контроля заболевания, особенно при наличии остаточных опухолей, может быть рекомендована гормональная терапия. Также гормональная терапия показана пациентам с неоперабельной опухолью для повышения ее резектабельности в предоперационном периоде.
Необходимо учитывать, что больным ДПЛ рекомендуется долгосрочный мониторинг с целью ранней диагностики рецидива. В случае рециди-вирования заболевания перед выбором тактики лечения обязательно необходимо морфологическое подтверждение диагноза, в частности для исключения наличия злокачественного процесса. При рецидиве в зависимости от клинической ситуации пациенту также может быть рекомендовано динамическое наблюдение, хирургическое вмешательство и/или длительная гормональная терапия [19].
В представленном клиническом наблюдении срочное интраоперационное морфологическое исследование позволило окончательно определить объем оперативного вмешательства и достичь максимально возможной циторедукции. При последующем плановом морфологическом исследовании в опухоли выявлена экспрессия рецепторов эстрогена и прогестерона, что послужило поводом к назначению гормональной терапии совместно с тщательным динамическим наблюдением для улучшения возможности контроля заболевания. Ввиду особенностей течения ДПЛ и некомплаент-ности пациентки при последующем динамическом наблюдении был выявлен рецидив заболевания, потребовавший повторного оперативного вмешательства по причине наличия симптоматики. Последующее соблюдение гормональной терапии пациенткой позволило достичь стабилизации заболевания с учетом его местного рецидива.
Заключение
Диссеминированный перитонеальный лейо-миоматоз – редкое, сложно диагностируемое заболевание, зачастую протекающее бессимптомно. Несмотря на доброкачественные морфологические характеристики, ДПЛ отличается склонностью к рецидивированию, а также возможным риском


