Диссинхрония миокарда и ответ на сердечную ресинхронизирующую терапию
Автор: Лебедева Виктория Кимовна, Любимцева Тамара Алексеевна, Трукшина Мария Александровна, Лясникова Елена Александровна, Лебедев Дмитрий Сергеевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.30, 2015 года.
Бесплатный доступ
Цель исследования: дать сравнительную оценку зон максимальной внутрижелудочковой диссинхронии (ВЖД) миокарда и локализации желудочковых электродов у пациентов с различным ответом на сердечную ресинхронизирующую терапию (СРТ). Материал и методы. Ретроспективное исследование, включающее пациентов (n=40) с синусовым ритмом, полной блокадой левой ножки пучка Гиса (ПБЛНПГ), фракцией выброса левого желудочка (ФВ) 15%, относительный прирост ФВ ЛЖ ≥10%); 2-я группа, n=20 - недостаточный ответ на СРТ (отсутствие динамики размеров, объемов, ФВ ЛЖ). Для топической оценки зоны стимуляции желудочковых электродов использовался векторный анализ ЭКГ в начале и в конце периода наблюдения (разделение ЛЖ на 12 условных сегментов, ПЖ - на 3 сегмента). Межжелудочковая (МЖД) и внутрижелудочковая диссинхрония миокарда определялись при помощи эхокардиографии (ЭхоКГ) с тканевой допплерографией. Результаты. Исходно группы не различались по полу, возрасту и параметрам ЭхоКГ с тканевой допплерографией. Отсутствие исходной ВЖД наблюдалось у 7 пациентов 1-й группы и 8 пациентов 2-й группы, р=0,503; КМП ишемического генеза значимо превалировала во 2-й группе (75%, n=15, р=0,014). Дислокаций электродов за весь период наблюдения выявлено не было, имело место смещение ЛЖ электрода в пределах вены коронарного синуса в 3 случаях. Конечные размеры, объемы и ФВ ЛЖ между группами были различны (р
Сердечная ресинхронизирующая терапия, диссинхрония миокарда, анализ экг
Короткий адрес: https://sciup.org/14920012
IDR: 14920012
Текст научной статьи Диссинхрония миокарда и ответ на сердечную ресинхронизирующую терапию
На сегодняшний день СРТ вносит значительный вклад в комплексное лечение ХСН – улучшает функциональный статус и качество жизни пациентов, способствует обратному ремоделированию миокарда, а также снижает уровень смертности и госпитализаций вследствие ХСН [1, 2, 3]. СРТ направлена на снижение выраженности предсердно-желудочковой, меж- и внутрижелудочковой дис-синхронии миокарда. Однако около 30% пациентов не отвечают на данный вид терапии [4]. Рубцовые поля, отсутствие диссинхронии ЛЖ, неоптимальная позиция желудочковых электродов, а также неадекватно подобранные параметры программирования – факторы, связанные с низким ответом на СРТ [5, 6]. Итоговое расположение ЛЖ электрода зависит от анатомии вен коронарного синуса, наличия или отсутствия диафрагмальной стимуляции, а также свойств и стабильности положения самого электрода [7, 8].
При блокаде левой ножки пучка Гиса (БЛНПГ) имеет место достаточно обширная область поздней активации миокарда ЛЖ – свободная стенка, где анатомически располагаются боковая и заднебоковая вены коронарного синуса. Ответ на СРТ с позиционированием электродов в данные вены наблюдается в 90% случаев [9]. Однако зоны активации ЛЖ и, соответственно, механической диссин-хронии могут различаться, несмотря на одну и ту же ширину комплекса QRS [10]. Нередко степень ответа на СРТ сложно предсказуема из-за локальных свойств миокарда – местных функциональных блокад и рубцовых зон. Незначительные изменения позиции электродов и/или их взаимной ориентации могут серьезно влиять на ход возбуждения миокарда [11]. Влияние ПЖ стимуляции на распространение фронта возбуждения исследовано недостаточно; показано, что при стимуляции различных зон ПЖ изменяется пространственный ход волны возбуждения между ПЖ и ЛЖ электродами, что, в свою очередь, отражается на диссинхронии миокарда. Общепринятая практика имплантации ЛЖ электрода заключается в позиционировании его как можно дальше от кончика ПЖ электрода – в область латеральной или заднелатеральной стенки ЛЖ, однако выбор между целевой анатомической зоной, зоной наибольшей механической диссинхронии или зоной максимальной электрической задержки остается предметом научных споров [12].
Влияние межжелудочкового расстояния на ответ СРТ впервые было продемонстрировано в работах Heist et al., где, по данным рентгенограмм, в прямой и боковой проекциях больший отрезок между дистальными частями ПЖ и ЛЖ электродов коррелировал с более выраженным гемодинамическим ответом на ресинхронизирующую те- рапию [13]. Для стандартизации позиционирования ЛЖ электрода было предложено деление ЛЖ на сегменты [14]. В проспективном исследовании Merchant et al. было показано достоверное снижение выживаемости, менее выраженные степень обратного ремоделирования ЛЖ и снижение ФК ХСН в группе с апикальной позицией ЛЖ электрода по сравнению с группой базальной/срединной зоны имплантации за период наблюдения 15 мес. [8]. Сходные результаты были продемонстрированы в субанализе исследования MADIT-CRT [15].
Имплантация ЛЖ электрода относительно зон максимальной механической диссинхронии миокарда рассматривалась в работах Ypenburg et al. По данным тканевой допплерографии, самыми частыми зонами наибольшей внутрижелудочковой задержки являлись задняя (36%) и боковая (33%) стенки ЛЖ; стимуляция в зоне максимальной ВЖД ассоциировалась с большим эхокардиографическим ответом СРТ и лучшим прогнозом спустя 6 мес. наблюдения [16]. В исследовании Stankoviс et al. наличие ВЖД исходно, до имплантации СРТ, приводило к лучшему гемодинамическому ответу и выживаемости по сравнению с пациентами без ВЖД [17].
Цель работы: разработать предикторы ответа на СРТ путем сравнительной оценки зон максимальной внутрижелудочковой диссинхронии миокарда и локализации желудочковых электродов.
Материал и методы
Ретроспективное исследование, включающее 40 пациентов с синусовым ритмом, которым была имплантирована система СРТ по стандартным показаниям (полная БЛНПГ, комплекс QRS >120 мс, ФВ ЛЖ ≤ 35%, III и IV ФК ХСН на оптимальной медикаментозной терапии). Все пациенты были проинформированы и дали согласие на анализ данных в соответствии с целью настоящего исследования. Средний возраст составил 60,91±11,43 лет, 65% мужчин (n=26), 35% женщин (n=14), ишемический генез кардиомиопатии был выявлен в 48% случаев по результатам проведенной коронарографии и/или анамнезу документированного инфаркта миокарда. Пациенты, имеющие значимую патологию клапанного аппарата (клапанная регургитация >2-й степени, клапанный стеноз), а также легочную гипертензию выше 1-й степени не включались в исследование.
Пациенты были разделены на 2 группы: 1-я группа, n=20 – высокий ответ на СРТ. Критериями ответа на СРТ считалось уменьшение конечно-систолического объема ЛЖ (КСО) ≥15%, относительный прирост ФВ ЛЖ ≥10%, снижение ФК ХСН ≥1 [18, 19]. 2-я группа, n=20 – пациенты с недостаточным ответом на СРТ (отсутствие поло- жительной динамики размеров, объемов, ФВ ЛЖ, либо она была отрицательной). Общая характеристика пациентов представлена в таблице 1.
Имплантация системы СРТ проводилась под рентгеноскопическим контролем с применением стандартных рентгенологических проекций (прямая, левая косая, правая косая). Правопредсердный (ПП) электрод позиционировался в ушко ПП, ПЖ электрод – в область МЖП, ее базальный или срединный отделы, или верхушку ПЖ. ЛЖ электрод имплантировался в одну из ветвей коронарного синуса. Осложнений при имплантации системы СРТ в обеих группах выявлено не было. Период наблюдения составил 12,0±1,7 мес.
В рамках стандартного протокола программирования устройства СРТ проводилась регулярная оценка параметров детекции и стимуляции по схеме 0–3–6–12 мес. Атриовентрикулярная задержка (АВЗ) подбиралась на основании ЭКГ по продолжительности атриовентрикулярного интервала, форме детектированного/стимулиро-ванного зубца P, ширине бивентрикулярно-го комплекса QRS. За конечный результат АВЗ принимался интервал P-St (от начала зубца Р до спайка желудочкового стимула) в виде симметричного законченного зубца Р в выбранном отведении с наилучшей визуализацией. Параметры межжелудочковой задержки на протяжении данного периода наблюдения сохранялись на номинальных значениях. Выраженность сердечной недостаточности определялась по клиническим критериям 4 ФК ХСН (NYHA).
Электрокардиографический и эхокардиографический методы . Для анализа ЭКГ использовалась система для неинвазивных электрофизиологических исследований Astrocard (Медитек, Россия) со стандартными и усиленными однополюсными отведениями. Скорость записи 100 мм/с (максимум до 400 мм/с), амплитуда сигнала 10 мм/ 10 мВ, точность измерений 1 мс.
Трансторакальное ЭхоКГ-исследование на аппарате Vivid 7 с датчиком 2,5 MHz (GE, Vingmed Dimensions, Norway) осуществлялось по схеме 0 (до имплантации СРТ) – 6–12 мес. с оценкой параметров гемодинамики (КДД, КСД, КДО, КСО, ФВ ЛЖ) и диссинхронии миокарда в режиме тканевой допплерографии. Анализ МЖД и ВЖД проводился по методу C.M. Yu [20]. Межжелудочковую дис-синхронию оценивали по разнице во времени между началом систолических потоков в аорту и легочный ствол, измеряемых импульсно-волновым допплером, за норму МЖД принимали значение менее 40 мс. Внутрижелудочковую диссинхронию оценивали по двум показателям: индекс диссинхронии (Tsmax–Tsmin); стандартное отклонение по 12 сегментам ЛЖ (SD-12). Tsmax–Tsmin – показатель, отражающий максимальную временную разницу пиковых систолических скоростей между 12 сегментами ЛЖ, за норму принималось значение до 105 мс. Для опреде-
Таблица 1
Исходная характеристика пациентов
|
Параметры, единицы измерения |
Группа 1 |
Группа 2 |
p |
|
Возраст, годы |
59,8±10,4 |
62,1±8,2 |
0,264 |
|
Мужской пол, n (%) |
15 (75) |
18 (90) |
0,142 |
|
СРТ-Р/ СРТ-Д, n |
9/11 |
7/13 |
0,468 |
|
Ишемическая болезнь сердца, n (%) |
6 (30) |
15 (75) |
0,014 |
|
Анамнез инфаркта миокарда, n (%) |
2 (10) |
12 (60) |
0,009 |
|
Анамнез реваскуляризации миокарда, n (%) |
5 (25) |
10 (50) |
0,042 |
|
III ФК (NYHA), n (%) |
19 (95) |
19 (95) |
|
|
IV ФК (NYHA), n (%) |
1 (5) |
1 (5) |
|
|
Ширина QRS, мс |
158±21 |
154±33 |
0,307 |
|
Ширина QRS ≥ 150 мс, n (%) |
15 (75) |
17 (85) |
0,285 |
|
%) Эхокардиографические данные: |
|||
|
КДД ЛЖ, мм |
75,8±7,1 |
72,9±7,6 |
0,229 |
|
КСД ЛЖ, мм |
65,4±7,5 |
62,5±8,9 |
0,291 |
|
КДО ЛЖ, мл |
294,1±63,4 |
277,7±84,8 |
0,498 |
|
КСО ЛЖ, мл |
213,0±62,1 |
206,5±78,4 |
0,776 |
|
ФВ ЛЖ, % |
24,4±6,9 |
25,6±6,5 |
0,565 |
|
Межжелудочковая механическая задержка, мс |
49,2±23,7 |
51,5±19,8 |
0,346 |
|
Отсутствие внутрижелудочковой диссинхронии, n (%) |
7 (35) |
8 (40) |
0,503 |
|
Электроды: |
|||
|
ПЖ электрод – МЖП, базальный отдел, n (%) |
7 (35) |
5 (25) |
0,204 |
|
ПЖ электрод – МЖП срединный отдел, n (%) |
2 (10) |
2 (10) |
|
|
ПЖ электрод – верхушка ПЖ |
11 (55) |
13 (65) |
0,492 |
ления пиковых систолических скоростей использовали методику цветной тканевой допплерографии. SD-12 – статистический показатель, определяемый по значениям пиковых систолических скоростей 12 сегментов ЛЖ, значение SD-12 до 34 принималось за норму.
Совпадение зоны максимальной ВЖД с местом имплантации ЛЖ электрода оценивалось при помощи векторного анализа ЭКГ по 12 стандартным отведениям во время изолированной стимуляции ЛЖ с применением 12 условных сегментов: 3 задних, 3 заднебоковых, 3 боковых, 3 переднебоковых с разделением на базальный, срединный и апикальный уровни. Локализация ПЖ электрода определялась во время изолированной стимуляции ПЖ с применением 3 условных сегментов (базальный отдел МЖП, срединный отдел МЖП, верхушка ПЖ) [21, 22]. Анализ данных проводился дважды: после имплантации СРТ и в конце периода наблюдения.
Статистический анализ. Статистическая обработка данных осуществлялась при помощи пакета статистических программ Statistica 10 (StatSoft Inc., version 10.0.228.8, Oklahoma, USA) с использованием непараметрических математических критериев – U-критерия Манна–Уитни, двухвыборочного критерия Колмогорова–Смирнова – для независимых выборок, и критерия Вилкоксона парных сравнений, а также критерия хи-квадрат Макнемара (категориальные переменные) – для зависимых выборок. Для определения зависимости между переменными применялись критерии хи-квадрат и точный критерий Фишера. Ассоциации между несколькими переменными рассчитывалась при помощи коэффициента конкордации
Зоны стимуляции левого желудочка
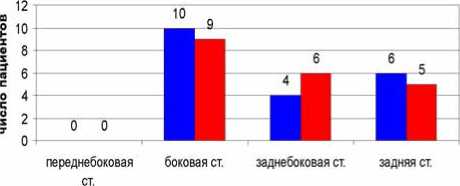
■ группа 1 ■группа 2
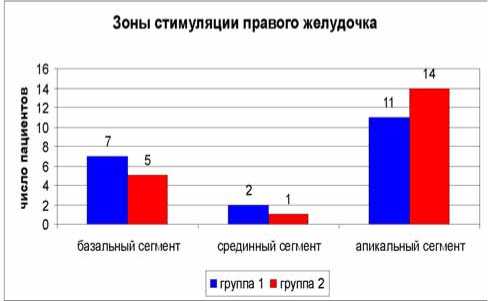
Рис. 1. Зоны стимуляции желудочковых электродов
Кендалла. Значения р менее 0,05 принимались статистически значимыми.
Результаты
Исходно группы не различались по полу, возрасту, параметрам ЭКГ и ЭхоКГ. Отсутствие ВЖД до имплантации СРТ было выявлено у 7 пациентов 1-й группы и 8 пациентов 2-й группы, р=0,503. У трети пациентов – 32,5% от общего количества – встречалось более 1 зоны ВЖД: в 1-й группе – у 8 человек, во 2-й – у 5 человек. Наиболее частыми зонами ВЖД являлись базальные и срединные сегменты боковой, задней и нижней стенок ЛЖ (табл. 2). Достоверных различий в локализациях и количестве исходных зон ВЖД между группами получено не было, однако в группе с высоким ответом на СРТ наблюдалась тенденция к большему преобладанию ВЖД, р=0,09.
Этиология КМП ишемического генеза значимо превалировала во 2-й группе, n=15, 75%, р=0,014. Анамнез перенесенного инфаркта миокарда (3 мес. и более до имплантации СРТ) и проведенная реваскуляризация миокарда также преобладали во 2-й группе (табл. 1). Дислокаций электродов за время наблюдения выявлено не было. По данным векторного анализа ЭКГ, имело место смещение ЛЖ электрода в пределах вены коронарного синуса в 3 случаях: 2 в 1-й группе, 1 – во 2-й. Смещение ЛЖ электрода в 1-й группе представляло собой изменение зоны стимуляции с базальных отделов на апикальные отделы боковой и заднебоковой стенок ЛЖ соответственно; во 2-й группе – с базальных отделов боковой стенки ЛЖ на ее срединные отделы. Доля бивентрикулярной стимуляции в обеих группах составляла 95% и более в течение всего периода наблюдения. Зоны стимуляции желудочковых электродов приведены в таблице 3, а также рисунке 1. Достоверных различий расположения ПЖ и ЛЖ электродов между группами получено не было.
Спустя 12 мес. наблюдения конечные размеры, объемы и ФВ ЛЖ значимо различались между группами ( ≤ 0,001); средняя ФВ ЛЖ в 1-й группе составила 44,9±5,9%, во 2-й группе – 26,9±6,4%. ФК ХСН был ниже в 1-й груп-
Таблица 2
Зоны внутрижелудочковой диссинхронии до имплантации СРТ
|
Группа |
Задняя стенка |
Передне-перегородочная |
Передняя стенка |
Нижняя стенка |
Перегородочная |
Боковая стенка |
Всего зон |
|
1 (n=13) |
5 |
0 |
0 |
6 |
1 |
11 |
23 |
|
2 (n=12) |
5 |
2 |
0 |
2 |
0 1 |
6 |
16 |
|
Всего зон |
10 |
2 |
0 |
8 |
2 |
17 |
Таблица 3
Зоны стимуляции желудочковых электродов
|
Группа |
Задняя стенка родочная |
Передне-перего- |
Передняя стенка |
Нижняя стенка |
Перегородочная |
Боковая стенка |
Всего зон |
|
1 (n=13) |
5 |
0 |
0 |
6 |
1 |
11 |
23 |
|
2 (n=12) |
5 |
2 |
0 |
2 |
1 |
6 |
16 |
|
Всего зон |
10 |
2 |
0 |
8 |
2 |
17 |
пе: n=15 против n=6 во 2-й группе с II ФК (NYHA), р=0,043 (табл. 4).
Конечные значения МЖД не различались между группами, и были в пределах нормальных значений: 36,2±16,1 мс, 39,2±11,8 мс соответственно, р=0,346. Отсутствие ВЖД спустя 12 мес. наблюдалось у 19 пациентов 1-й группы и 16 пациентов 2-й группы, р=0,493. Причем среди пациентов с исходной ВЖД (n=13 в 1-й группе, n=12 во 2-й) внутрижелудочковая диссинхрония спустя 12 мес. наблюдения была только у одного человека 1-й группы и у 4 человек 2-й группы. Таким образом, ВЖД нормализовалась в 91,7% случаев в 1-й группе и в 66,7% – во 2-й, р=0,068. Совпадение зоны максимальной ВЖД с зоной имплантации ЛЖ электрода, по данным ЭКГ, отмечено в большей степени в 1-й группе, р=0,028 (рис. 2).
Условный топический анализ взаимного расположения ПЖ и ЛЖ электродов представлен схемой межэлектродного соотношения (рис. 3). Максимальная дистанция – отрезок в виде 3 сегментов ЛЖ: а) ПЖ электрод в верхушке ПЖ, ЛЖ электрод – в базальном/срединном отделе боковой стенки ЛЖ, б) ПЖ электрод в базальном отделе МЖП, ЛЖ электрод в апикальной зоне боковой стенки ЛЖ. Минимальная дистанция характеризовалась нахож- дением электродов в соседних сегментах миокарда. Другие варианты взаимного расположения желудочковых электродов принимались за промежуточные дистанции. Сводная характеристика межэлектродных соотношений представлена в таблице 5 (передняя стенка ЛЖ не учитывалась ввиду отсутствия имплантации ЛЖ электродов в данную область).
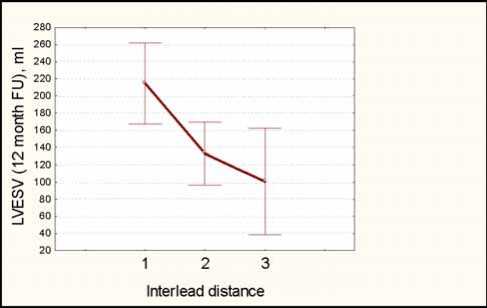
При сравнении 3 условных схем межэлектродного соотношения – минимальной (1), промежуточной (2), максимальной дистанции (3) – с динамикой размеров, объемов и ФВ ЛЖ была получена следующая зависимость: чем больше межэлектродное соотношение, тем меньше размеры, объемы ЛЖ и больше ФВ ЛЖ; коэффициент корреляции r=0,49 (ФВ/ди-станция), r=0,41 (КСО/дистанция), р<0,05, (рис. 4).
Обсуждение
В данном ретроспективном исследовании показано, что лучший ответ на СРТ связан как с совпадением зон ВЖД и места имплантации ЛЖ электрода, так и с отсутствием анамнеза ишемической болезни сердца. В исследовании C. Ypenburg et al. было отмечено, что лица с недостаточным ответом на СРТ помимо неоптимальной позиции ЛЖ электрода, расцененной как несовпадение с зоной ВЖД, имели достоверно чаще анамнез ишемической болезни сердца в сравнении с пациентами с высоким ответом на СРТ [16]. Тем не менее, однозначную связь между низким ответом на СРТ и ишемическим генезом КМП в рамках данной работы указать не представляется возможным. Нельзя исключить, что пациенты с ишемической болезнью сердца хуже отвечают на ресинхронизирующую терапию ввиду наличия обширных рубцовых зон миокарда; однако при КМП неишемического генеза наличие фиброзных полей также может влиять на степень ответа на данный вид терапии [23].
Существование исходной ВЖД может способствовать более выраженному улучшению гемодинамики в отдаленные сроки наблюдения. Подтверждение этому заключению было сделано в работе I. Stankovic et al., где ВЖД рассматривалась как независимый предиктор ответа на СРТ и была связана с большей выживаемостью пациентов в отдаленные сроки наблюдения [17]. В недавнем исследовании TARGET (Targeted Left Ventricular Lead Placement to Guide Cardiac Resynchronization Therapy
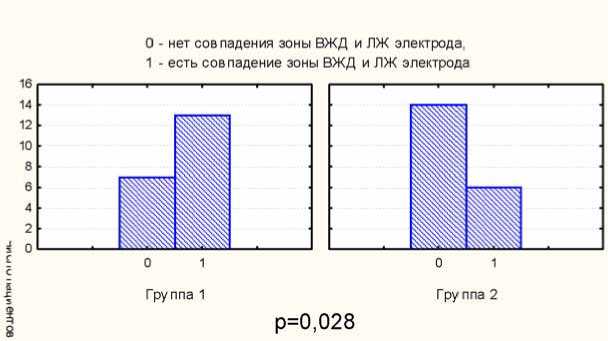
Рис. 2. Совпадение зон внутрижелудочковой диссинхронии и локализации ЛЖ электрода
Таблица 4
Характеристика пациентов спустя 12 мес. наблюдения
|
Параметры, единицы измерения |
Группа 1 |
Группа 2 |
p |
|
I ФК (NYHA), n (%) |
5 (25) |
||
|
II ФК (NYHA), n (%) |
15 (75) |
6 (30) |
0,043 |
|
III ФК (NYHA), n (%) |
14 (70) |
||
|
Ширина QRS, мс |
147±38 |
164±22 |
0,216 |
|
Эхокардиографические данные: |
|||
|
КДД ЛЖ, мм |
56,2±5,1 |
71,7±8,1 |
<0,001 |
|
КСД ЛЖ, мм |
42,9±4,4 |
60,8±8,6 |
<0,001 |
|
КДО ЛЖ, мл м |
153,4±70,4 |
292,1±84,9 |
<0,001 |
|
КСО ЛЖ, мл |
85,9±40,8 |
214,9±71,1 |
<0,001 |
|
ФВ ЛЖ, % |
44,9±5,9 |
26,9±6,4 |
<0,001 |
|
Межжелудочковая механическая задержка, мс |
36,2±16,1 |
39,2±11,8 |
0,346 |
|
Отсутствие внутрижелудочковой диссинхронии, n (%) |
19 (95) |
16 (80) |
0,493 |
|
Электроды: |
|||
|
Совпадение зоны ВЖД и ЛЖ электрода, n (%) |
12 |
6 |
0,028 |
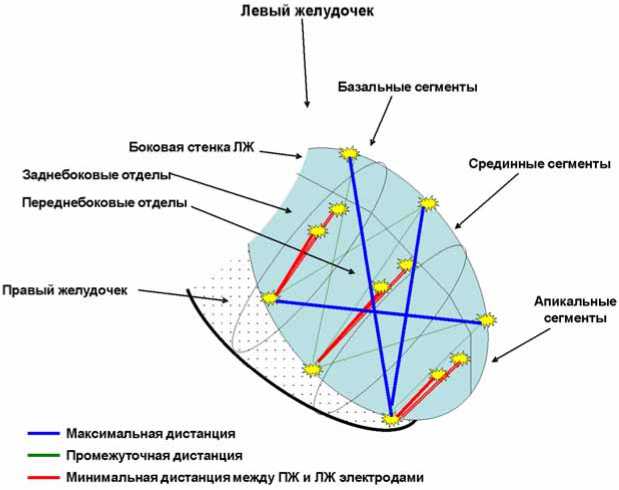
Рис. 3. Топический анализ взаимного расположения ПЖ и ЛЖ электродов
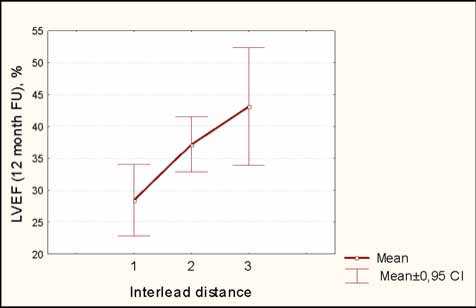
Рис. 4. Корреляция: а) между ФВ ЛЖ и условной межэлектродной дистанцией; б) между КСО ЛЖ и условной межэлектродной дистанцией
Study) было выявлено более значимое улучшение Таблица 5
клинических и гемодинамических параметров, а также снижение смертности и уровня госпитализаций вследствие ХСН у пациентов с СРТ, где имплантация ЛЖ электрода проводилась с учетом зоны максимальной ВЖД [24].
Выявленная зависимость между степенью ответа на СРТ и расчетным соотношением между желудочковыми электродами отражает патофизиологический принцип работы ресинхронизирующей системы в миокарде – необходимо достаточное расстояние между ПЖ и ЛЖ электродами для осуществления эффективной бивентрикулярной стимуляции с повышением насосной функции миокарда [25]. Расположение ПЖ электрода в верхушке ПЖ, а ЛЖ электрода в базальных или срединных отделах боковой стенки ЛЖ ассоциировалось с наилучшим гемодинамическим ответом в отдаленные сроки наблюдения [26].
В большинстве работ, посвященных данной теме, определение локализации желудочковых электродов осуществлялось прямым – рентгенологическим методом диагностики [27]. В настоящем исследовании с целью локализации зоны стимуляции применялся векторный анализ ЭКГ. При этом с учетом корректной интерпретации данных определяется зона стимуляции желудочкового электрода, а также ее изменение с течением времени. Полученные ЭКГ-данные в сравнении с зонами ВЖД представляются удобными инструментами для динамического наблюдения за пациентами с СРТ без привлечения дополнительных временных затрат.
Выводы
СРТ представляет собой сложный процесс, включающий правильный отбор пациентов, непосредственно процедуру имплантации устройства и электродов, а также послеоперационное долгосрочное наблюдение с коррекцией параметров СРТ и медикаментозной терапии. Предикторами лучшего ответа на СРТ можно считать наличие исходной ВЖД, совпадение зоны ВЖД с местом имплантации ЛЖ электрода и степень расстояния между желудочковыми электродами, что следует учитывать при
Характеристика межэлектродных условных дистанций: минимальной (1), промежуточной (2), максимальной (3)
|
Сегменты миокарда |
Базальный отдел МЖП |
Срединный отдел МЖП |
Апикальный отдел ПЖ |
|
Боковая ст. ЛЖ, базальный отдел |
2 |
2 |
3 |
|
Боковая ст. ЛЖ, срединный отдел |
2 |
2 |
3 |
|
Боковая ст. ЛЖ, апикальный отдел |
3 |
2 |
2 |
|
Заднебоковая ст. ЛЖ, базальный отдел |
1 |
2 |
2 |
|
Заднебоковая ст. ЛЖ, срединный отдел |
2 |
1 |
2 |
|
Заднебоковая ст. ЛЖ, апикальный отдел |
2 |
2 |
1 |
|
Задняя ст. ЛЖ, базальный отдела |
1 2 |
2 |
2 |
|
Задняя ст. ЛЖ, срединный отдел |
2 |
1 |
2 |
|
Задняя ст. ЛЖ, апикальный отдел |
2 |
2 |
1 |
|
Переднебоковая ст. ЛЖ, базальный отдел |
1 |
2 |
2 |
|
Переднебоковая ст. ЛЖ, срединный отдел |
2 |
1 |
2 |
|
Переднебоковая ст. ЛЖ, апикальный отдел |
2 |
2 |
1 |
имплантации. Совпадение зоны максимальной ВЖД с местом имплантации ЛЖ электрода ассоциировано со значимым улучшением гемодинамики пациентов с ресинхронизирующей терапией в отдаленные сроки наблюдения.
Список литературы Диссинхрония миокарда и ответ на сердечную ресинхронизирующую терапию
- Linde C., Leclercq C., Rex S. et al. Long-term benefits of biventricular pacing in congestive heart failure: results from the MUltisite STimulation in cardiomyopathy (MUSTIC) study//J. Am. Coll. of Cardiol. -2002. -Vol. 40. -P. 111-118.
- Chung E.S., Leon A.R., Tavazzi L. et al. Results of the Predictors of Response to CRT (PROSPECT) trial//Circulation. -2008. -Vol. 117(20). -P. 2608-2616.
- Moss A.J., Hall W.J., Cannom D.S. et al. Cardiac-resynchronization therapy for the prevention of heart-failure events//N. Engl. J. Med. -2009. -Vol. 361. -P. 1329-1338.
- Abraham W.T., Fisher W.G., Smith A.L. et al. Cardiac resynchronization in chronic heart failure//N. Engl. J. Med. -2002. -Vol. 346(24). -P. 1845-1853.
- Ypenburg C., Van De Veire N., Westenberg J.J. et al. Noninvasive imaging in cardiac resynchronization therapy. Part 2: Follow-up and optimization of settings//Pacing Clin. Electrophysiol. -2008. -Vol. 31(12). -P. 1628-1639.
- Bleeker G.B., Schalij M.J., Van der Wall E.E. et al. Postero-lateral scar tissue resulting in non-response to cardiac resynchronization therapy//J. Cardiovasc. Electrophysiol. -2006. -Vol. 17(8). -P. 899-901.
- Wilton S.B., Shibata M.A., Sondergaard R. et al. Relationship between left ventricular lead position using a simple radiographic classification scheme and long-term outcome with resynchronization therapy//J. Interv. Card. Electrophysiol. -2008. -Vol. 23(3). -P. 219-227.
- Merchant F.M., Heist E.K., McCarty D. et al. Impact of segmental left ventricle lead position on cardiac resynchronization therapy outcomes//Heart Rhythm. -2010. -Vol. 7(5). -P. 639-644.
- Fung J.W., Yu C.M., Yip G. et al. Variable left ventricular activation pattern in patients with Heart failure and left bundle branch block//Heart. -2004. -Vol. 90(1). -P. 17-19.
- Leclercq C., Faris O., Tunin R. et al. Systolic improvement and mechanical resynchronization does not require electrical synchrony in the dilated failing heart with left bundle-branch block//Circulation. -2002. -Vol. 106(14). -P. 1760-1763.
- Blendea D., Singh J.P. Lead positioning strategies to enhance response to cardiac resynchronization therapy//Heart Fail. Rev. -2011. -Vol. 16. -P. 291-303.
- Singh J.P., Heist E.K., Ruskin J.N. et al. “Dialing-in” cardiac resynchronization therapy: overcoming constraints of the coronary venous anatomy//J. Interv. Card. Electrophysiol. -2006. -Vol. 17(1). -P. 51-58.
- Heist E.K., Fan D., Mela T. et al. Radiographic left ventricular-right ventricular interlead distance predicts the acute hemodynamic response to cardiac resynchronization therapy//Am. J. Cardiol. -2005. -Vol. 96(5). -P. 685-690.
- Singh J.P., Houser S., Heist E.K. et al. The coronary venous anatomy: a segmental approach to aid cardiac resynchronization therapy//J. Am. Coll. Cardiol. -2005. -Vol. 46(1). -P. 68-74.
- Singh J.P. A sub-study of MADIT-CRT on left ventricular lead position/Heart Rhythm. Society Scientific Sessions. -2010.
- Ypenburg C., van Bommel R.J., Delgado V. et al. Optimal left ventricular lead position predicts reverse remodeling and survival after cardiac resynchronization therapy//J. Am. Coll. Cardiol. -2008. -Vol. 52(17). -P. 1402-1409.
- Stankovic I., Aarones M., Smith H.J. et al. Dynamic relationship of left-ventricular dyssynchrony and contractile reserve in patients undergoing cardiac resynchronization therapy//Eur. Heart J. -2014. -Vol. 35(1). -P. 48-55.
- Foley P.W., Leyva F., Frenneaux M.P. What is treatment success in cardiac resynchronization therapy?//Europace. -2009. -Vol. 11, Suppl. 5. -P. 58-65.
- Bleeker G.B., Bax J.J., Fung J.W. et al. Clinical versus echocardiographic parameters to assess response to cardiac resynchronization therapy//Am. J. Cardiol. -2006. -Vol. 97(2). -P. 260-263.
- Gorcsan J., Abraham T. et al. Echocardiograrhy for cardiac resynchronization therapy: recommendations for performance and reporting -a report from the American Society of Echocardiography Dyssynchrony Writing Group. ASE expert consensus statement//J. Am. Soc. Echocardiogr. -2008. -Vol. 21(3). -P. 191-213.
- Wellens H.J.J., Conover M. The ECG in emergency decision making. -2nd edition. -Saunders: Elsevier, 2006. -284 p.
- Barold S.S., Stroobandt R.X., Sinnaeve A.F. Cardiac pacemakers and resynchronization step by step: an illustrated guide. -2nd edition. -Oxford: Wiley-Blackwell, 2010. -452 p.
- Rahmouni H.W., Kirkpatrick J.N., St John Sutton M.G. Effects of cardiac resynchronization therapy on ventricular remodeling//Curr. Heart Fail. Rep. -2008. -Vol. 5(1). -P. 25-30.
- Khan F.Z., Virdee M.S., Palmer C.R. et al. Targeted left ventricular lead placement to guide cardiac resynchronization therapy: the TARGET study: a randomized, controlled trial//J. Am. Coll. Cardiol. -2012. -Vol. 59(17). -P. 1509-1518.
- Kirk J.A., Kass D.A. Electromechanical dyssynchrony and resynchronization of the failing heart//Circ. Res. -2001. -Vol. 113(6). -P. 765-776.
- Doring M., Braunschweig F., Eitel C. et al. Individually tailored left ventricular lead placement: lessons from multimodality integration between three-dimensional echocardiography and coronary sinus angiogram//Europace. -2013. -Vol. 15(5). -P. 718-727.
- Duckett S.G., Ginks M., Shetty A.K. et al. Invasive acute hemodynamic response to guide left ventricular lead implantation predicts chronic remodeling in patients undergoing cardiac resynchronization therapy//J. Am. Coll. Cardiol. -2011. -Vol. 58(11). -P. 1128-1136.


