Длительная общая и безрецидивная выживаемость у пациента с метастатическим НМРЛ на фоне иммунотерапевтического лечения. Клинический случай
Автор: Афонин Г.В., Скоропад В.Ю., Глухарева А.Е., Куприянова Е.И., Агабабян Т.А., Иванов С.А., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 6 т.23, 2024 года.
Бесплатный доступ
Актуальность. Рак легкого является одной из самых распространенных онкологических патологий, по данным отечественной и мировой статистики. Большинство случаев впервые диагностированного рака легкого ассоциировано с отдаленным метастазированием. Высокая заболеваемость и смертность, а также частота развития рецидивов у пациентов с немелкоклеточным раком легкого (НМРЛ) I-III стадий даже после радикального хирургического лечения обусловливают актуальность разработки новых подходов к лекарственной терапии. Цель исследования - демонстрация успешного клинического случая, отображающего длительную, более чем 8-летнюю, общую и безрецидивную выживаемость у пациента с метастатическим НМРЛ на фоне терапии ингибитором иммунных контрольных точек. Описание клинического случая. У пациента П., 80 лет диагностирована аденокарцинома легкого IB стадии. В августе 2014 г. проведено радикальное хирургическое лечение. При контрольном обследовании в апреле 2016 г. диагностировано прогрессирование заболевания в виде метастатического поражения печени, лимфоузлов средостения и солитарного метастаза в грудную стенку справа. С учетом отсутствия драйверных мутаций больному в рамках международного многоцентрового открытого рандомизированного исследования III фазы проведено 102 цикла терапии препаратом дурвалумаб в монорежиме. На момент публикации достигнут период наблюдения 96 мес без признаков прогрессирования заболевания, у больного отсутствуют серьезные нежелательные явления, связанные с лечением.
Рак легкого, лекарственная терапия, ингибиторы контрольных точек иммунного ответа, статус pd-l1
Короткий адрес: https://sciup.org/140308733
IDR: 140308733 | УДК: 616.24-006.6-08:615.37 | DOI: 10.21294/1814-4861-2024-23-6-176-184
Текст научной статьи Длительная общая и безрецидивная выживаемость у пациента с метастатическим НМРЛ на фоне иммунотерапевтического лечения. Клинический случай
Background. Lung cancer is one of the most common cancers worldwide. Most cases of newly diagnosed lung cancer are associated with distant metastasis. High incidence and mortality rates as well as high rates of recurrence in patients with stage I–III non-small cell lung cancer (NSCLC), even after radical surgical treatment, determine the relevance of developing new approaches to drug therapy. the aim of the study was to demonstrate a successful clinical case showing a long–term, more than 8-year overall and relapse-free survival in a patient with metastatic NSCLC treated with an immune checkpoint inhibitor. Case presentation. An 80-year-old patient with stage IB lung adenocarcinoma underwent radical surgery in August 2014. A follow-up examination in April 2016 revealed disease progression (liver metastases and mediastinal lymph node metastases, and solitary metastasis to the chest wall on the right). Taking into account the absence of driver mutations, 102 cycles of durvalumab monotherapy were administered as a phase III multicenter open randomized trial. At a follow-up period of 96 months, no signs of disease progression and treatment-related serious adverse events were observed. Conclusion. Drug therapy of metastatic NSCLC remains challenging and should take into account the clinical, molecular, genetic, and immunohistochemical characteristics of the tumor. Further in-depth studies of new approaches and treatment options for NSCLC patients are required.
Рак легкого (РЛ) занимает лидирующие позиции в структуре онкологической заболеваемости и смертности как в мире, так и в Российской Федерации. В 2022 г. в мире зарегистрировано около 20 млн новых случаев злокачественных новообразований, из которых 12,4 % составил рак легкого. По данным мировой статистики за 2022 г., смертность от РЛ составила более 1,8 млн случаев (18,7 % от общего числа смертей от рака) [1]. В Российской Федерации распространенность рака легкого в 2022 г. составила 96,3 на 100 тыс. населения. Обращает на себя внимание тот факт, что 42,2 % от всех впервые выявленных случаев РЛ – это пациенты с IV стадией заболевания, что определяет высокий показатель летальности [2]. В связи с этим актуальной проблемой являются выбор оптимальной схемы лекарственного лечения пациентов с первично диссеминированным немелкоклеточным раком легкого (НМРЛ) и поиск биомаркеров для определения прогноза и выбора терапии.
В то же время более чем у половины пациентов с НМРЛ I–III стадий в течение 5 лет после операции развивается рецидив, несмотря на радикальность хирургического вмешательства [3, 4]. И уже при первом рецидиве более чем в 80 % случаев обнаруживаются отдаленные метастазы [5–7]. Лечение этой категории пациентов также является предметом поиска предикторов ответа на терапию.
Подходы к лечению метастатического НМРЛ прошли путь от назначения стандартной химиотерапии до выбора персонифицированного лечения на основе анализа мутаций и биомаркеров [8]. В современной онкологической практике широко применяется терапия ингибиторами контрольных точек иммунного ответа, доказавшая свою эффективность в ряде клинических исследований при различных локализациях опухолевого процесса и вошедшая в стандарты лечения. Данный вид терапии ассоциируется со значительным преимуществом в показателях выживаемости, однако не у всех пациентов удается добиться необходимого ответа. Поэтому в последние годы все больше внимания уделяется идентификации и разработке прогностических биомаркеров ответа на проведение иммунотерапии [9].
Одной из активно изучаемых в клинических исследованиях комбинаций является терапия препаратами тремелимумаб и дурвалумаб. Дур-валумаб (MEDI4736) представляет собой человеческое моноклональное антитело из семейства иммуноглобулинов G, ингибирующее связывание PD-L1. В свою очередь, тремелимумаб относится к иммуномодулирующим препаратам анти-CTLA-4. Научная гипотеза состоит в том, что механизмы действия препаратов не повторяют друг друга и можно предполагать адаптивное или синергическое противоопухолевое действие. Проведенное многоцентровое исследование IВ фазы показало, что дурвалумаб в дозе 20 мг/кг каждые 4 нед в сочетании с тремелимумабом в дозе 1 мг/кг имеет лучший профиль токсичности и обладает противоопухолевой активностью независимо от статуса PD-L1. Полученные данные явились основой для инициации исследований III фазы [10].
Международное многоцентровое открытое рандомизированное исследование III фазы «MYSTIC» направлено на изучение результатов терапии препаратом Дурвалумаб (MEDI4736) в комбинации с тремелимумабом или монотерапии препаратом Дурвалумаб (MEDI4736) в сравнении со стандартной химиотерапией на основе препаратов платины в первой линии при местнораспространенном или метастатическом НМРЛ [11]. В исследование включено 1 118 пациентов, которые рандомизированы (1:1:1) и получили лечение в следующих режимах: дурвалумаб (20 мг/кг каждые 4 нед), дурвалумаб (20 мг/кг каждые 4 нед) + тремелимумаб (1 мг/кг каждые 4 нед, 4 введения) или стандартная двойная химиотерапия на основе препаратов платины. Первичными конечными точками были общая выживаемость (ОВ) для дурвалумаба по сравнению с химиотерапией, а также ОВ и выживаемость без прогрессирования (ВБП) для дурвалумаба в комбинации с тремелимумабом против химиотерапии у пациентов с PD-L1≥25 %. По демографическим и клиническим показателям сравниваемые группы сбалансированы [12].
Одним из исследовательских центров, принимающих участие в открытом рандомизированном многоцентровом международном исследовании III фазы «MYSTIC», является МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Клинический случай описывает наш опыт длительного успешного применения дурвалумаба при лечении метастатического НМРЛ в рамках данного исследования.
Клинический случай
Пациент П., 80 лет. Из анамнеза известно, что в июле 2014 г. у пациента появились жалобы на сухой кашель, одышку. При обследовании по данным СКТ выявлено периферическое опухолевое образование в третьем сегменте верхней доли левого легкого, размерами 40×30×37 мм. Медиастинальные лимфоузлы не увеличены. Пациент не является курильщиком. В настоящее время пенсионер, трудовая деятельность не была связана с факторами риска возникновения онкологических заболеваний.
В рамках дальнейшего дообследования выполнена трансторакальная биопсия опухоли легкого под контролем компьютерной томографии. По результатам морфологического и ИГХ иссле-дований диагностирована аденокарцинома G2. Результаты остеосцинтиграфии, МРТ головного мозга, СКТ органов брюшной полости и малого таза свидетельствовали об отсутствии отдаленного метастазирования. Пациенту выставлен клинический диагноз: рак верхней доли левого легкого сT2aN0M0, IB стадия. С учетом гистологического заключения и распространенности опухолевого процесса предложено хирургическое лечение, в рамках которого 04.08.14 выполнена ви-деоторакоскопическая верхняя лобэктомия слева, систематическая медиастинальная лимфаденэктомия. При исследовании послеоперационного материала данных за метастатическое поражение удаленных лимфоузлов не получено. По данным морфологического (рис. 1) и ИГХ (рис. 2) исследо-ваний верифицирована аденокарцинома легкого с преимущественно солидным паттерном роста без признаков инвазии в висцеральную плевру.
Таким образом, сформулирован следующий патоморфологический диагноз: рак верхней доли левого легкого pT2aN0M0, IB стадия. Ви-деоассистированная верхняя лобэктомия слева,
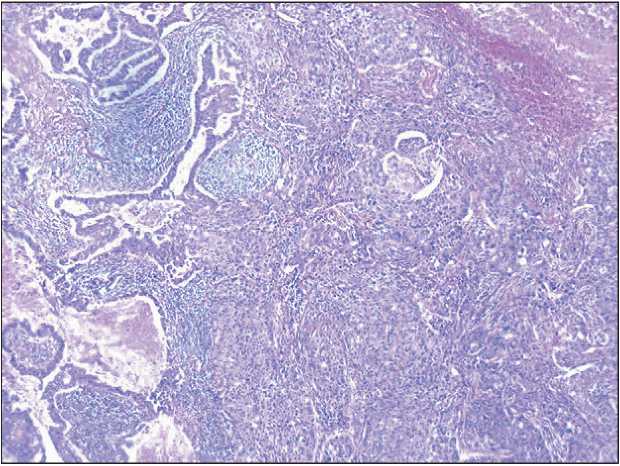
Рис. 1. Микрофото.В ткани легкого инвазивный рост опухоли солидного с участками ацинарного строения из клеток с узким ободком эозинофильной цитоплазмы и крупными полиморфными ядрами, очаги некроза. Окраска гематоксилином и эозином, ×4. Примечание: рисунок выполнен авторами
Fig. 1. Microphoto. In the lung tissue, invasive tumor growth is solid with areas of acinar cell content with a narrow rim of eosinophilic cytoplasm and large polymorphic nuclei, foci of necrosis.
Hematoxylin-eosin staining, ×4.
Note: created by the authors систематическая медиастинальная лимфаденэктомия. Адъювантная терапия не проводилась. В дальнейшем больной находился под динамическим наблюдением.
При контрольном обследованим в апреле 2016 г. по данным КТ диагностировано прогрессирование заболевания в виде метастатического поражения печени, лимфоузлов средостения и солитарного метастаза в грудную стенку справа. Выполнена трепан-биопсия очагов печени под УЗ-навигацией. По данным гистологического и ИГХ исследований верифицированы метастазы низкодифференциро-ванной аденокарциномы легкого в печень.
Дальнейшая тактика лечения пациента принята на мультидисциплинарном консилиуме. Проведенное молекулярно-генетическое исследование не выявило мутаций рецепторов эпидермального фактора роста (EGFR) и гиперэкспрессии киназы анапластической лимфомы (ALK). С учетом результатов обследования, гистологического типа опухоли, общего соматического статуса (ECOG 1) и распространенности опухолевого процесса пациенту было предложено участие в многоцентровом открытом рандомизированном исследовании III фазы «MYSTIC» [13]. В исследование включались пациенты с метастатическим НМРЛ, не получавшие противоопухолевого лечения, у которых не выявлено мутации гена EGFR или транслокации гена ALK. Пациенты рандомизированы (1:1:1) для получения лечения препаратом дурвалумаб, дурва-лумаб плюс тремелимумаб или двухкомпонентной химиотерапии на основе платины.
После получения информированного добровольного согласия (16.05.2016) пациент включен в исследование и после успешно пройденных процедур скрининга рандомизирован в группу монотерапии препаратом Дурвалумаб (MEDI4736). С июня 2016 г. по настоящее время пациент получает иммунотерапию препаратом Дурвалу-маб (MEDI4736) с интервалом в 28 дней. Всего проведено 102 цикла терапии. Оценка объективного ответа опухолевого процесса на проведенное лечение проводилась на основании данных мультиспиральной компьютерной томографии с внутривенным контрастированием, согласно критериям iRECIST (immune Response Evaluation Criteria In Solid Tumors). На фоне проводимого лечения отмечается частичный ответ опухоли в виде исчезновения метастаза в грудной стенке справа (рис. 3), уменьшения размеров метастазов в печени (рис. 4) и лимфоузлов средостения (рис. 5). Уменьшение суммы наибольших диаметров очагов-мишеней сотавляет 83 %. Серьезных нежелательных явлений, связанных с проводимой иммунотерапией, не было. За весь период лечения отмечена дерматологическая токсичность первой степени в виде зуда и сухости кожи предплечий. После симптоматического лечения в дальней-шем нежелательных явлений не отмечалось. С учетом выраженной положительной динамики и хорошей переносимости терапия дурвалумабом в монорежиме была продолжена и проводится по настоящее время; признаков прогрессирования заболевания не отмечено. В январе 2020 г. у пациента был диагностирован метахронный рак предстательной железы сТ2N0M0, стадия II, по поводу которого он получает гормонотерапию в интермитирующем режиме. На фоне проводимой
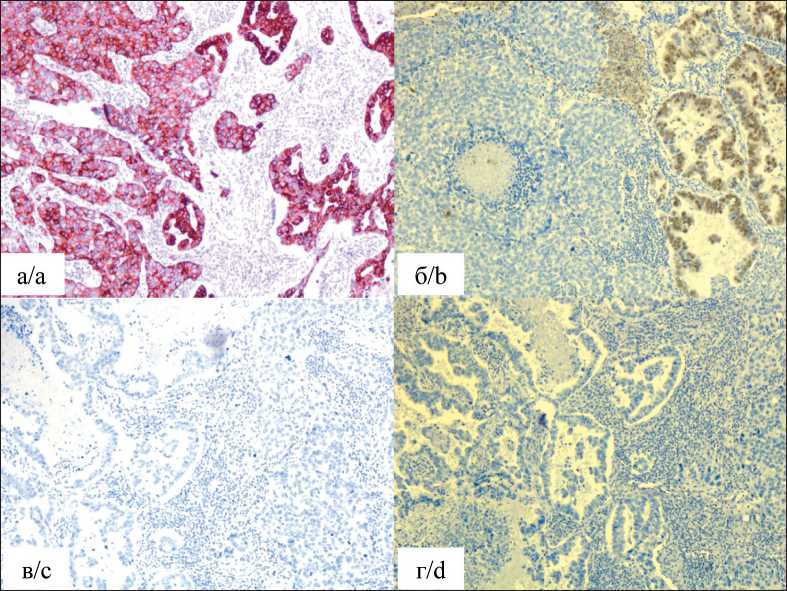
Рис. 2. Микрофото. При иммуногистохимическом исследовании: a) выявлена диффузная яркая мембранная экспрессия цитокератина 7, ×10; б) выявлена очаговая умеренная ядерная экспрессия TTF-1, ×10; в) не выявлено экспрессии р63; г) не выявлено экспрессии цитокератина 5/6. Примечание: рисунок выполнен авторами
Fig. 2. Microphoto.
Immunohistochemical examination revealed (a) diffuse bright membranous expression of cytokeratin 7, ×10; (b) focal moderate nuclear expression of TTF-1, ×10; (c) no expression of p63; (d) no expression of cytokeratin 5/6. Note: created by the authors
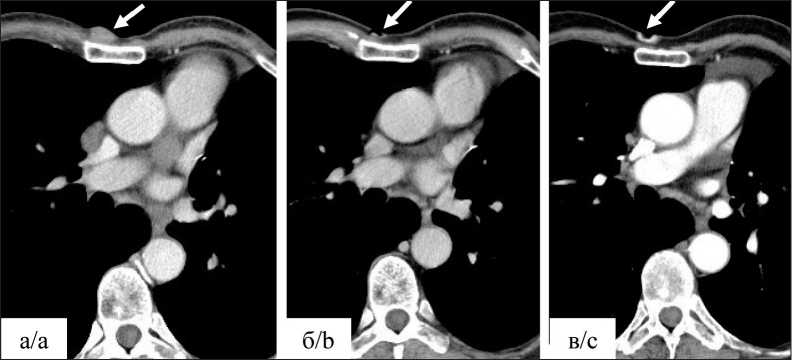
Рис. 3. КТ органов грудной клетки в динамике. Состояние после верхней лобэктомии слева. Метастаз в грудную стенку справа (стрелки). Примечания: а) метастаз в грудную стенку справа (стрелка) до лечения; б) через 7 мес после начала лечения отмечается изъязвление на месте метастатического очага (стрелка); в) через 64 мес после начала лечения сохраняется изъязвление на месте метастатического очага (стрелка); рисунок выполнен авторами
Fig. 3. CT scan of the chest organs in dynamics. After upper lobectomy on the left. Metastasis to the chest wall on the right (arrows). Notes: a) metastasis to the chest wall on the right (arrow) before treatment; b) ulceration at the site of the metastatic lesion 7 months after starting treatment (arrow); c) ulceration at the site of the metastatic lesion remains 64 months after starting treatment (arrow); created by the authors
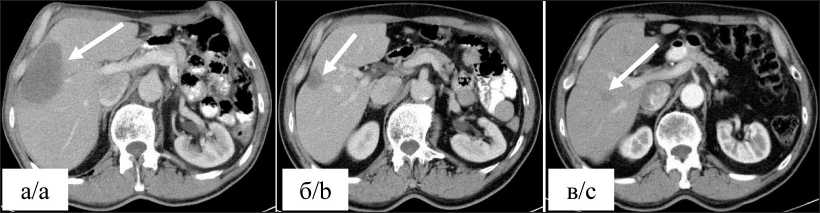
Рис. 4. КТ органов грудной клетки и брюшной полости в динамике. Состояние после верхней лобэктомии слева. Метастатическое поражение печени (стрелки). Примечания: а) метастатический очаг в правой доле печени наибольшим диаметром 76 мм до лечения; б) через 7 мес после начала лечения наибольший диаметр метастатического очага в печени 26 мм; в) через 64 мес после начала лечения наибольший диаметр метастатического очага в печени 10 мм; рисунок выполнен авторами
Fig. 4. CT scan of the chest and abdominal organs in dynamics. After upper lobectomy on the left. Metastatic liver lesion (arrows). Notes: a) metastatic lesion in the right lobe of the liver with the largest diameter of 76 mm before treatment; b) 7 months after starting treatment, the largest diameter of the metastatic lesion in the liver is 26 mm; c) 64 months after starting treatment, the largest diameter of the metastatic lesion in the liver is 10 mm; created by the authors
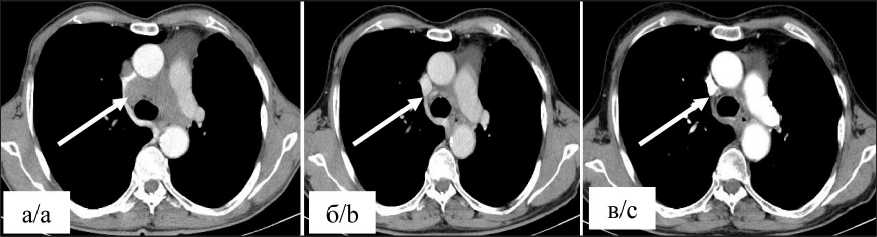
Рис. 5. КТ органов грудной клетки в динамике. Состояние после верхней лобэктомии слева. Метастатическое поражение лимфатических узлов средостения (стрелки). Примечания: а) конгломерат паратрахеальных лимфатических узлов диаметром 35 мм по короткой оси до лечения; б) через 7 мес после начала лечения диаметр остаточного конгломерата лимфоузлов средостения до 13 мм по короткой оси; в) через 64 мес после начала лечения диаметр остаточного конгломерата лимфоузлов средостения до 10 мм по короткой оси; рисунок выполнен авторами
Fig. 5. CT scan of the chest organs in dynamics. After upper lobectomy on the left. Metastatic lesion of the mediastinal lymph nodes (arrows). Notes: a) conglomerate of paratracheal lymph nodes with a diameter of 35 mm along the short axis before treatment;
b) 7 months after starting treatment, the diameter of the residual conglomerate of mediastinal lymph nodes is up to 13 mm along the short axis; c) 64 months after starting treatment, the diameter of the residual conglomerate of mediastinal lymph nodes is up to 10 mm along the short axis; created by the authors терапии отмечается стабилизация опухолевого процесса.
Таким образом, по поводу верифицированного метастатического НМРЛ пациент получает терапию препаратом дурвалумаб на протяжении 96 мес без признаков прогрессирования заболевания, у него отсутствуют серьезные нежелательные явления, связанные с лечением.
Обсуждение
Несмотря на современные возможности лекарственной терапии, лечение метастатического НМРЛ остается сложной задачей. Ежегодно на основании результатов международных рандомизированных исследований регистрируются и входят в клинические рекомендации новые схемы лекарственного лечения данной категории больных. Однако смертность остается на высоком уровне. Необходимо дальнейшее углубленное изучение новых подходов и опций лечения с учетом индивидуальных характеристик опухолевого процесса.
Терапия ингибиторами контрольных точек иммунного надзора стала прорывом в лечении НМРЛ. Иммунотерапия метастатического рака легкого вариабельна и может применяться в различных линиях лечения в виде моноиммунотерапии, а также в сочетании с цитостатиками и в качестве двойной иммунологической блокады. В настоящее время исследуются различные комбинации иммунологических препаратов, особенно в популяции пациентов с низким и негативным PD-L1-статусом.
В отечественной и зарубежной литературе широко представлены данные исследований, направленных на изучение эффективности различных подходов в терапии диссеминированного и неоперабельного НМРЛ. В одном из отечественных ретроспективных исследований проведена оценка клинической эффективности различных методов лекарственной терапии неоперабельного рака легкого в реальной клинической практике. В исследование было включено 287 пациентов, у 230 из которых оценена эффективность I линии лекарственной терапии. В зависимости от схемы лекарственной терапии все клинические случаи разделены на 4 группы: монохимиотера- пия (n=62), комбинированная цитостатическая терапия на основе препаратов платины (n=104), химиоиммунотерапия (n=39) и монотерапия ингибиторами контрольных точек (n=25). Также проведено исследование эффективности II линии терапии (n=100). Лекарственная терапия II линии представлена двумя группами пациентов, получавших химиотерапию (n=47) или иммунотерапию (n=53). По результатам статистического анализа показатели эффективности лечения (ЧОО и ВБП) были значимо выше при применении ингибиторов контрольных точек. Авторы делают вывод о том, что достоверных различий в эффективности моноиммунотерапии и комбинированной химиоиммунотерапии выявлено не было, что подтверждает оправданность стратификации больных на основании статуса экспрессии PD-L1 [14]. Необходимо дальнейшее, углубленное изучение подходов в лечении данной категории больных.
Список литературы Длительная общая и безрецидивная выживаемость у пациента с метастатическим НМРЛ на фоне иммунотерапевтического лечения. Клинический случай
- Bray F., Laversanne M., Sung H., Ferlay J., Siegel R.L., Soerjomataram I., Jemal A. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024; 74(3): 229-63. https://doi.org/10.3322/caac.21834.
- Sostoyanie onkologicheskoĭ pomoshchi naseleniyu Rossii v 2022 godu. Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2023. 252 s.
- Douillard J.Y., Rosell R., De Lena M., Carpagnano F., Ramlau R., Gonzáles-Larriba J.L., Grodzki T., Pereira J.R., Le Groumellec A., Lorusso V., Clary C., Torres A.J., Dahabreh J., Souquet P.J., Astudillo J., Fournel P., Artal-Cortes A., Jassem J., Koubkova L., His P., Riggi M., Hurteloup P. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomized controlled trial. Lancet Oncol. 2006; 7(9): 719-27. https://doi.org/10.1016/S1470-2045(06)70804-X. Erratum in: Lancet Oncol. 2006; 7(10): 797.
- McMurry T.L., Stukenborg G.J., Kessler L.G., Colditz G.A., Wong M.L., Francescatti A.B., Jones D.R., Schumacher J.R., Greenberg C.C., Chang G.J., Winchester D.P., McKellar D.P., Kozower B.D. More Frequent Surveillance Following Lung Cancer Resection Is Not Associated With Improved Survival: A Nationally Representative Cohort Study. Ann Surg. 2018; 268(4): 632-39. https://doi.org/10.1097/SLA.0000000000002955.
- Boyd J.A., Hubbs J.L., Kim D.W., Hollis D., Marks L.B., Kelsey C.R. Timing of local and distant failure in resected lung cancer: implications for reported rates of local failure. J Thorac Oncol. 2010; 5(2): 211-14. https://doi.org/10.1097/JTO.0b013e3181c20080.
- Choi P.J., Jeong S.S., Yoon S.S. Prediction and prognostic factors of post-recurrence survival in recurred patients with early-stage NSCLC who underwent complete resection. J Thorac Dis. 2016; 8(1): 152-60. https://doi.org/10.3978/j.issn.2072-1439.2016.01.10.
- Sekihara K., Hishida T., Yoshida J., Oki T., Omori T., Katsumata S., Ueda T., Miyoshi T., Goto M., Nakasone S., Ichikawa T., Matsuzawa R., Aokage K., Goto K., Tsuboi M. Long-term survival outcome after postoperative recurrence of non-small-cell lung cancer: who is ‘cured’ from postoperative recurrence? Eur J Cardiothorac Surg. 2017; 52(3): 522-28. https://doi.org/10.1093/ejcts/ezx127.
- Tan W.L., Jain A., Takano A., Newell E.W., Iyer N.G., Lim W.T., Tan E.H., Zhai W., Hillmer A.M., Tam W.L., Tan D.S.W. Novel therapeutic targets on the horizon for lung cancer. Lancet Oncol. 2016; 17(8): 347-62. https://doi.org/10.1016/S1470-2045(16)30123-1.
- Bai R., Lv Z., Xu D., Cui J. Predictive biomarkers for cancer immunotherapy with immune checkpoint inhibitors. Biomark Res. 2020; 8: 34. https://doi.org/10.1186/s40364-020-00209-0.
- Antonia S., Goldberg S.B., Balmanoukian A., Chaft J.E., Sanborn R.E., Gupta A., Narwal R., Steele K., Gu Y., Karakunnel J.J., Rizvi N.A. Safety and antitumour activity of durvalumab plus tremelimumab in non-small cell lung cancer: a multicentre, phase 1b study. Lancet Oncol. 2016; 17(3): 299-308. https://doi.org/10.1016/S1470-2045(15)00544-6.
- Rizvi N.A., Cho B.C., Reinmuth N., Lee K.H., Luft A., Ahn M.J., van den Heuvel M.M., Cobo M., Vicente D., Smolin A., Moiseyenko V., Antonia S.J., Le Moulec S., Robinet G., Natale R., Schneider J., Shepherd F.A., Geater S.L., Garon E.B., Kim E.S., Goldberg S.B., Nakagawa K., Raja R., Higgs B.W., Boothman A.M., Zhao L., Scheuring U., Stockman P.K., Chand V.K., Peters S.; MYSTIC Investigators. Durvalumab With or Without Tremelimumab vs Standard Chemotherapy in First-line Treatment of Metastatic Non-Small Cell Lung Cancer: The MYSTIC Phase 3 Randomized Clinical Trial. JAMA Oncol. 2020; 6(5): 661-74. https://doi.org/10.1001/jamaoncol.2020.0237. Erratum in: JAMA Oncol. 2020; 6(11): 1815.
- Si H., Kuziora M., Quinn K.J., Helman E., Ye J., Liu F., Scheuring U., Peters S., Rizvi N.A., Brohawn P.Z., Ranade K., Higgs B.W., Banks K.C., Chand V.K., Raja R. A Blood-based Assay for Assessment of Tumor Mutational Burden in First-line Metastatic NSCLC Treatment: Results from the MYSTIC Study. Clin Cancer Res. 2021; 27(6): 1631-40. https://doi.org/10.1158/1078-0432.CCR-20-3771.
- Phase III Open Label First Line Therapy Study of MEDI 4736 (Durvalumab) With or Without Tremelimumab Versus SOC in Non Small-Cell Lung Cancer (NSCLC) (MYSTIC) [Internet]. Clinical Trials.gov. URL: https://clinicaltrials.gov/study/NCT02453282 [cited 10.09.2024].
- Moiseenko F.V., Volkov N.M., Abduloeva N.Kh., Levchenko N.V., Chubenko V.A., Zhabina A.S., Chernobrivtseva V.V., Shuginova T.N., Shelekhova K.V., Khenshteĭn V.A., Stepanova M.L., Kramchaninov M.M., Belukhin S.A., Khabicheva A.M., Artem'eva E.V., Nosova M.V., Tuleĭko V.M., Moiseenko V.M. Rezul'taty primeneniya immunoterapevticheskikh preparatov pri nemelkokletochnom rake legkogo v real'noi klinicheskoi praktike. Zlokachestvennye opukholi. 2020; 10(1): 5-20. https://doi.org/10.18027/2224-5057-2020-10-1-5-20.


