ДНК-анализ полиморфизма генов миостатина, лептина и кальпаина 1 у российской популяции крупного рогатого скота абердин-ангусской породы
Автор: Коновалова Е.Н., Селионова М.И., Гладырь Е.А., Романенкова О.С., Евстафьева Л.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетическая структура популяций
Статья в выпуске: 4 т.58, 2023 года.
Бесплатный доступ
Расширить производство говядины, которая имеет высокую питательную ценность и уникальный аминокислотный состав (В.С. Колодязная с соавт., 2011; D. Pighin с соавт., 2016), можно за счет использования специализированных мясных пород крупного рогатого скота, в частности абердин-ангусской. Эта порода положительно зарекомендовала себя при разведении как за рубежом, так и в России благодаря хорошей акклиматизационной способности и высокой продуктивности (R. Toušová с соавт., 2015; V.M. Gabidulin с соавт., 2018; А.И. Отаров с соавт., 2021). Современные стратегии повышения эффективности мясного скотоводства включают анализ ДНК животных, который позволяет устанавливать генетические детерминанты высокой продуктивности для целенаправленного отбора носителей экономически значимых аллелей (В.Ф. Федоренко с соавт., 2018; S.A. Terry с соавт., 2020). В настоящей работе впервые созданы тест-системы на основе метода ПЦР-ПДРФ для выявления аллельных вариантов полиморфизмов Arg4Cys LEP и CAPN1 _316, при помощи которых провели генотипирование популяции крупного рогатого скота абердин-ангусской породы. Были подсчитаны частоты встречаемости различных генотипов изучаемых полиморфизмов, а также определено влияние полиморфизмов генов лептина и кальпаина 1 на откормочные качества животных. Цель исследований заключалась в разработке тест-систем для выявления полиморфизма генов лептина ( LEP ) в позиции c.466 C→T и кальпаина 1 ( CAPN1 ) в позиции rs17872000, исследовании популяции крупного рогатого скота абердин-ангусской породы по этим генам и гену миостатина ( MSTN ), а также в определении связи различных аллельных вариантов с откормочными качествами животных. Объектом исследования была популяция молодняка крупного рогатого скота ( Bos taurus ) абердин-ангусской породы ООО «КФХ «Хэппи Фарм» (Калужская обл., Медынский р-н) ( n = 145), представленная группами бычков ( n = 64) и телок ( n = 81), рожденных в период с марта 2020 года по май 2021 года. Отъем телят от матерей проводили в возрасте 6-9 мес в зависимости от развития теленка. Живую массу определяли в возрасте 6, 8, 12 и 15 мес. Для генотипирования из образцов крови выделяли ДНК с использованием набора ДНК-Экстран 1 (ЗАО «Синтол», Россия). При разработке тест-систем применяли метод полимеразной цепной реакции с последующим анализом полиморфизма длин рестрикционных фрагментов (ПЦР-ПДРФ). ПЦР-амплификацию осуществляли на термоциклере Bio-Rad T100 («Bio-Rad Laboratories», Сингапур). При успешной амплификации дальнейший ПДРФ-анализ, позволяющий дифференцировать различные аллели изучаемых SNPs, проводили при помощи эндонуклеаз рестрикции, для которых в ДНК-последовательностях мутантных аллелей обнаружены сайты узнавания. Эндонуклеазы подбирали в программе NEBcutter v2.0. (https://nc2.neb.com/NEBcutter2/). Анализ продуктов ПЦР-ПДРФ проводили методом гель-электрофореза в 2 % агарозном геле. Тест-система для анализа полиморфизма F94L MSTN была разработана ранее (E.N. Konovalova с соавт., 2021). Для верификации корректности ПЦР по полиморфизму гена кальпаина 1 CAPN1 _316 амплификаты трех возможных генотипов были секвенированы по Сэнгеру. При разработке тест-системы для диагностики полиморфизмов Arg4Cys LEP и CAPN1 _316 использовали последовательности NM_174259 и AJ512638.1 из Национального центра биотехнологической информации (National Center for Biotechnology Information, NCBI, https://www.ncbi.nlm.nih.gov/). Установлено, что по полиморфизму F94L MSTN генотип CC встречался у 98,77 % исследованных животных. По полиморфизму Arg4Cys LEP наиболее часто встречался генотип СТ , частота которого в группе бычков составила 42,19 %, телок - 45,68 %. По полиморфизму CAPN1 _316 таковым оказался генотип GG , который выявляли у 51,56 % бычков и 69,14 % телочек. Частоты желательных с точки зрения продуктивности аллелей в группах бычков и телок составили: А F94L MSTN - 0,00 и 0,01, С Arg4Cys LEP - 0,49 и 0,51, C CAPN1 _316 - 0,20 и 0,28. Бычки с генотипом ТТ Arg4Cys LEP демонстрировали наибольшую эффективность набора живой массы в период от рождения до 8 мес, среднесуточный прирост их массы составил 778 г и был достоверно выше ( t = 2,18) по сравнению с СС (748 г). В отношении полиморфизма CAPN1 _316 в группе телок от рождения до 8 мес была отмечена тенденция к более высоким приростам массы у животных с генотипом СС : они набирали 770 г/сут, тогда как особи c генотипами GC и GG - соответственно 720 и 730 г/сут. Однако в послеотъемный период наблюдаемые тенденции поменялись: у бычков в возрасте 12 мес с генотипом СС Arg4Cys LEP наблюдалась значительно большая живая масса по сравнению с СТ , а телки с GG CAPN1 _316 в период от 8 до 15 мес имели достоверно более высокий прирост живой массы по сравнению с СС (790 г против 740 г). Разработанные нами тест-системы для ДНК-диаг-ностики полиморфизмов Arg4Cys LEP и CAPN1 _316 могут быть использованы при генотипировании мясного скота и отборе животных - носителей желательных генотипов.
Крупный рогатый скот, абердин-ангусская порода, маркеры продуктивности, миостатин, лептин, кальпаин 1
Короткий адрес: https://sciup.org/142239842
IDR: 142239842 | УДК: 636.2.033:575.174 | DOI: 10.15389/agrobiology.2023.4.622rus
Текст научной статьи ДНК-анализ полиморфизма генов миостатина, лептина и кальпаина 1 у российской популяции крупного рогатого скота абердин-ангусской породы
Наблюдаемый в настоящее время в Российской Федерации дефицит потребления говядины — проблема, которая требует решения. Во-первых, этот вид мяса характеризуется высоким содержанием белков, сбалансированных по шести незаменимым аминокислотам, и наличием двух лимитирующих аминокислот — лейцина и треонина, что делает его наиболее подходящим для диетического питания (1). Во-вторых, говядина служит важным источником линолевой кислоты, обладающей антиканцерогенной активностью, а также содержит транcизомеры жирных кислот, способствующих профилактике ишемической болезни сердца (2).
В настоящее время в мире насчитывается около 1 млрд гол. крупного рогатого скота (КРС) мясного направления. По сравнению с птицей и свиньями мясной скот имеет значительно более низкую эффективность преобразования корма в мышечную ткань. Однако следует учитывать, что мясной скот производит высококачественный белок в основном из тех кормов, которые или не используются, или составляют незначительную долю в рационе свиней и птицы (3).
Современные стратегии повышения эффективности мясного скотоводства сосредоточены не только на вопросах кормления, содержания и разведения, но также учитывают генетические характеристики животных, которые оказывают достаточно весомое влияние на здоровье и продуктивность (3). Генотипирование, ставшее возможным благодаря современным достижениям молекулярной биологии, позволит устанавливать генетические детерминанты высокой продуктивности животных для целенаправленного отбора носителей экономически значимых аллелей и их интенсивного использования в селекции (4).
Специализированное мясное скотоводство в России получило динамичное развитие в последнее десятилетие благодаря принятию отраслевой программы и значительной государственной поддержке (5). Ввиду высокой пищевой ценности увеличение доли говядины от специализированных мясных пород скота важно для улучшения качества питания населения нашей страны (3).
Абердин-ангусы — высокопродуктивная порода мясного скота, которая получила широкое распространение во всем мире (5). Животные этой породы отличаются высокой энергией роста: среднесуточные приросты живой массы составляют более 1000 г, а у лучших особей могут достигать 13001500 г (6). Также к характерным признакам абердин-ангусской породы, передающимися и при скрещивании с другими породами, относятся комолость, нежное тонковолокнистое мясо с хорошо выраженной мраморностью (7, 8).
В Калужской области, как и во многих регионах Российской Федерации, мясное скотоводство — одно из приоритетных направлений развития племенного животноводства. Благодаря наличию необходимой инфраструктуры, благоприятным природно-климатическим условиям, стабильному рынку сбыта, а также грантовой поддержке сельхозпроизводителей, произошел существенный прирост поголовья специализированного мясного скота — с 24411 гол. в 2016 году до 104 459 гол. к 2020 году, или на 427,9 % (9). Динамичное развитие отрасли в этом регионе, в частности в ООО «КФХ «Хэппи Фарм» (Калужская обл., Медынский р-н), которое в настоящее время специализируется на разведении КРС абердин-ангусской породы, требует использования в селекции современных генетических методов, в том числе генотипирования по генам, ассоциированным с продуктивными признаками. К таким генам у мясного скота относятся миостатин (MSTN), лептин (LEP) и кальпаин 1 (CAPN1).
Миостатин играет ключевую роль в развитии скелетных мышц. После рождения животных ген миостатина отрицательно регулирует рост и развитие скелетных мышц, ограничивая число и размер мышечных волокон (10). Миостатин и его влияние на выход мяса интенсивно изучаются, главным образом в связи с мутациями потери функции, приводящими к увеличению массы скелетных мышц и фенотипу двойной обмускуленности, который описан у многих видов, включая КРС, овец, свиней, кроликов и человека (11).
У КРС ген MSTN , известный также как фактор дифференциации 8 ( GDF8 ), расположен на хромосоме 2 (BTA2), и в настоящее время из девяти известных у Bos taurus мутаций MSTN (12) у абердин-ангусской породы были обнаружены две: делеция 11 п.н. (nt821del11), служащая причиной генетического дефекта двойной обмускуленности (М1), и однонуклеотидный полиморфизм F94L (c.282C>A) , обусловливающий аминокислотную замену фенилаланина на лейцин. Обе мутации имеют сходное влияние на интенсивный рост мускулатуры, однако F94L, в отличие от nt821del11, не связана с повышенной живой массой теленка при рождении, что позволило зарубежным специалистам рекомендовать включать ее в селекционные программы для повышения точности геномного прогноза (13-15). Ранее была показана достаточно высокая частота встречаемости желательного аллеля А (0,97-1,00) в российских популяциях КРС породы лимузин (16). Этот полиморфизм можно считать перспективным генетическим маркером для отбора животных с повышенной мышечной массой.
Достаточно интересен ген лептина ( LEP ), который также называют геном ожирения. Ген LEP продуцирует одноименный гормон, который секретируется адипоцитами. Установлена его связь с потреблением корма и энергетическим балансом у мышей и людей (17). У КРС этот ген расположен на хромосоме 4 (BTA 4), а непосредственный интерес представляет полиморфизм Arg4Cys LEP с.466 С→Т (обозначаемый также как LEP73, R4C и R25C), который локализован на расстоянии 73 п.н. от начала экзона 2 и представляет собой причину аминокислотной замены аргинина на цистеин в позиции 4 зрелого лептина (18-20). Аллель Т этого SNP связан с повышенной экспрессией мРНК гормона лептина, непосредственно влияющего на пищевое поведение, а также обусловливающего наибольшую эффективность потребления корма и, как следствие, получение туш с высоким содержанием жира (21). В то же время аллель C связан с меньшим отложением жира в туше, благодаря чему от животных-носителей этого генотипа получают туши с более постным мясом (22).
Известно, что гидролиз белка тесно связан с ростом мышц во время развития и нежностью мяса после убоя. Кальпаин 1 (CAPN1) — важная протеаза, которая гидролизует белки в миофибриллах (23). В связи с этим рассматривается один из полиморфизмов гена кальпаина 1 — CAPN1 _316, расположенный на BTA29 и представляющий собой однонуклеотидную замене c.947G>C. В результате этого SNP образуется вариант белка кальпа-ина 1, действие которого обусловливает ослабление связей между мышечными волокнами, вследствие чего создаются условия для равномерного распределения внутримышечного жира, что обеспечивает большую мрамор-ность, нежность и сочность мяса (24-27).
Изучение генов, ассоциированных с мясной продуктивностью, и разработка тест-систем для идентификации предпочтительных аллельных вариантов остаются актуальными. При этом необходимо учитывать, что для массового использования в селекции мясного скота важна доступность и простота генотипирования животных.
В настоящей работе впервые созданы тест-системы на основе метода ПЦР-ПДРФ (PCR-RFLP, polymerase chain reaction—restriction fragment length polymorphism) для выявления аллельных вариантов полиморфизмов Arg4Cys LEP и CAPN1 _316, при помощи которых было проведено генотипирование популяции крупного рогатого скота абердин-ангусской породы. Подсчитаны частоты встречаемости различных генотипов изучаемых полиморфизмов, а также определено влияние полиморфизмов генов лептина и кальпа-ина 1 на откормочные качества животных.
Наша цель заключалась в разработке тест-систем для выявления полиморфизма генов лептина ( LEP ) в позиции c.466 C→T и кальпаина 1 ( CAPN1 ) в позиции rs17872000, в исследовании популяции крупного рогатого скота абердин-ангусской породы по этим генам и гену миостатина ( MSTN ), а также в определении связи различных аллельных вариантов с откормочными качествами животных.
Методика. Работу проводили на базе ФГБНУ ФИЦ животноводства — ВИЖ им. Л.К. Эрнста в 2021-2022 годах в рамках научного сотрудничества с РГАУ МСХА им. К.А. Тимирязева. Объектом исследования была чистопородная популяция молодняка крупного рогатого скота ( Bos taurus ) абердин-ангусской породы ООО «КФХ «Хэппи Фарм» (Калужская обл., Медынский р-н) ( n = 145), представленная группами бычков ( n = 64) и телок ( n = 81), рожденных в период с марта 2020 года по май 2021 года.
Содержание животных было беспривязным групповым, на открытых выгульных площадках с легкими ветрозащитными навесами и кормовыми столами. Для двухразовой раздачи полнорационной кормосмеси, обеспечивающей животных необходимыми питательными веществами в соответствии с нормами для каждой полновозрастной группы, использовали миксер-кормораздатчик. На площадках были установлены автоматические поилки с подогревом. Отъем телят от матерей проводили в возрасте 6-9 мес в зависимости от развития теленка.
Молодняк взвешивали на электронных весах с фиксацией РЕУС-А-У (ООО «Тензосила», Россия) в возрасте 6, 8, 12 и 15 мес.
Для генотипирования использовали препараты ДНК, полученные из образцов крови животных. Кровь брали 12 сентября 2021 года и 21 ноября 2021 года при помощи системы для взятия крови Vacuette (пробирки К2Е Sep с EDTA и разделительным гелем) («Greiner Bio-One», Австрия). ДНК выделяли с помощью набора ДНК-Экстран 1 (ЗАО «Синтол», Россия) в соответствии с протоколом производителя. Поскольку полиморфизм исследуемых генов обусловлен простыми однонуклеотидными заменами (single nucleotide polymorphisms, SNPs), для разработки тест-систем применяли метод полимеразной цепной реакции с последующим анализом полиморфизма длин рестрикционных фрагментов (ПЦР-ПДРФ).
Для амплификации областей мутации исследуемых генов при помощи программного обеспечения Primer3Plus подобрали олигонуклеотидные праймеры:
Полиморфизм J Последовательность праймеров (5 ′ → 3 ′ ) J Эндонуклеаза рестрикции (сайт узнавания) Arg4Cys LEP LPN_F: TGATAGCCATGGCAGACAGC HpyCH4V (TG↓CA)
LPN_R: CCTCCCTACCGTGTGTGAGA
CAPN1 _316 CAPN316_F: TGAACTACCAGGGCCAGATG BstDSI (C↓CRYGG)
CAPN316_R: ACAGGGTGGTGTTCCAGTTG
ПЦР проводили в следующем режиме: 3 мин при 95 °С (начальная денатурация); 30 с при 95 °С (денатурация), 40 с при 61 °С (отжиг) и 30 с при 72 °С (элонгация) (35 циклов); 4 мин при 72 °С (финальная элонгация) (термоциклер Bio-Rad T100, «Bio-Rad Laboratories», Сингапур). При успешной амплификации аллели изучаемых SNPs детектировали. Для этого использовали ПДРФ-анализ с эндонуклеазами рестрикции, имеющими сайты узнавания в ДНК-последовательностях мутантных аллелей. Эндонуклеазы рестрикции подбирали в программе NEBcutter v2.0. . К образцу добавляли фермент (1 е.а.) и инкубировали в течение 8 ч. Использовали ферменты HpyCH4V и BstDSI (ООО «СибЭнзайм», Россия) в соответствии с рекомендациями производителя.
Продукты ПЦР-ПДРФ анализировали методом электрофореза в 2 % агарозном геле в течение 30 мин при 125 В. Использовали маркер молекулярной массы с шагом 100 п.н. (ЗАО «Синтол», Россия).
Тест-система для анализа полиморфизма F94L MSTN была разработана ранее (16).
Для верификации корректного прохождения ПЦР по полиморфизму гена кальпаина 1 CAPN1_316 выполнили секвенирование амплифи-катов трех возможных генотипов по методу Сэнгера (использовано оборудование и протокол ЗАО «Евроген», Россия). Полученные сиквенсы обрабатывали при помощи программного обеспечения UGENE Pro V.38.1 9 .
Частоту генотипов и среднесуточные приросты живой массы рассчитывали согласно общепринятым методикам (28, 29).
Статистический анализ полученных результатов проводили по стандартным методикам при помощи программного пакета Microsoft Excel 2013 (30, 31). Статистическую значимость различий оценивали в t -тесте Стьюдента. Разница считалась статистически значимой при t > 1,96 и p < 0,05.
Результаты. В результате дизайна праймеров, оптимизации температурно-временного режима ПЦР и подбора ферментов рестрикции были разработаны тест-системы для анализа полиморфизмов генов лептина (Arg4Cys LEP ) и кальпаина 1 ( CAPN1 _316) (рис. 1, 2).
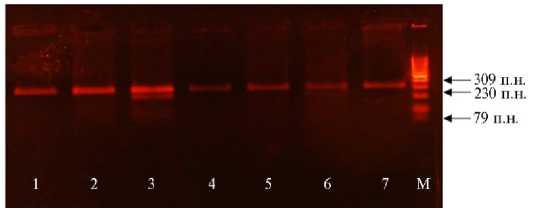
Рис. 1. Генотипирование молодняка крупного рогатого скота ( Bos taurus ) абердин-ангусской породы по полиморфизму гена лептина Arg4Cys LEP . Верхний фрагмент длиной 309 п.н. соответствует аллелю дикого типа C , нижние 230 и 79 п.н. — мутантному аллелю T . Дорожки 1, 2, 4-7 — животные с генотипом CC , 3 — с генотипом СТ . М — маркер молекулярной массы с шагом 100 п.н. (ЗАО «Синтол», Россия) (ООО «КФХ «Хэппи Фарм», Калужская обл., 20202021 годы).
При разработке тест-системы для диагностики полиморфизма CAPN1_316 мы использовали последовательность NM_174259.2 (National Center for Biotechnology Information, NCBI, . Ожидалось, что для мутантного аллеля будет амплифицирован фрагмент ДНК длиной 267 п.н., который при рестрикции даст фрагменты 164 и 103 п.н.
Однако полученные фрагменты ДНК оказались гораздо большего размера, что побудило нас провести сравнительный BLAST-анализ последовательности NM_174259.2 с полногеномной сборкой (NCBI >281661-UMD3.1.1) . Анализ показал 100 % идентичность сравниваемых последовательностей, а размеры полученных ампликонов соответствовали последовательности >281661-UMD3.1.1. То есть при анализе CAPN1_316 амплифицировался фрагмент ДНК размером 757 п.н., который при наличии мутантного аллеля разрезался на два фрагмента размером 465 и 292 п.н. (см. рис. 2).
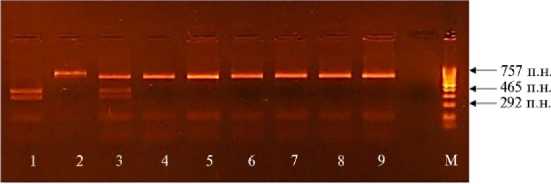
Рис. 2. Генотипирование молодняка крупного рогатого скота ( Bos taurus ) абердин-ангусской породы по полиморфизму гена кальпаина 1 CAPN1 _316. Верхний фрагмент длиной 757 п.н. соответствует аллелю дикого типа G , нижние фрагменты 465 и 292 п.н. — мутантному аллелю С . Дорожка 1 — животное с генотипом СС , 3 — с генотипом GC , 2, 4-9 — с генотипом GG . М — маркер молекулярной массы с шагом 100 п.н. (ЗАО «Синтол», Россия) (ООО «КФХ «Хэппи Фарм», Калужская обл., 2020-2021 годы).
Секвенирование по Сэнгеру амплифицированного фрагмента области мутации CAPN1 _316 выявило искомую последовательность ДНК и три возможных генотипа по этому полиморфизму (рис. 3), окончательно исключив получение ложных результатов.
А
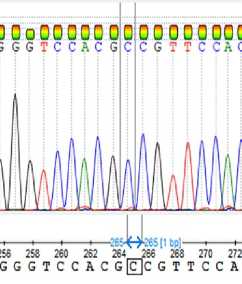
Б
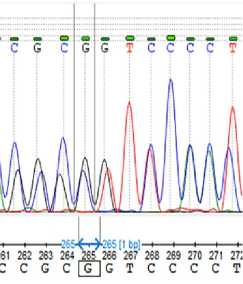
В
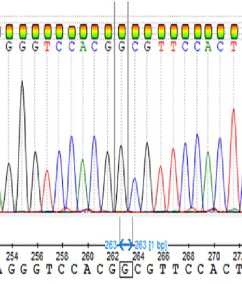
Рис. 3. Результаты секвенирования по Сэнгеру ПЦР-фрагмента области мутации гена кальпаина 1 CAPN1 _316 у молодняка крупного рогатого скота ( Bos taurus ) абердин-ангусской породы: А — генотип СС , Б — генотип GC , В — генотип GG (ООО «КФХ «Хэппи Фарм», Калужская обл., 2020-2021 годы).
При разработке тест-системы для диагностики полиморфизма Arg4Cys LEP использовали последовательность NCBI AJ512638.1. Как и предполагалось, при ПЦР амплифицировался фрагмент ДНК размером 309 п.н., который при наличии мутации разрезался соответствующей эндонуклеазой рестрикции на два фрагмента длиной 230 и 79 п.н. Таким образом, разработанная тест-система позволила четко идентифицировать генотипы ТТ , СТ и СС Arg4Cys LEP .
При генотипировании молодняка абердин-ангусской породы мы установили, что все исследованные гены были полиморфны, однако частота гомозиготных и гетерозиготных генотипов среди бычков и телочек варьировала в широких пределах (табл. 1).
1. Результаты генотипирования молодняка крупного рогатого скота ( Bos taurus ) абердин-ангусской породы по полиморфизмам F94L MSTN , Arg4Cys LEP и CAPN1 _316 (ООО «КФХ «Хэппи Фарм», 2021-2022 годы)
|
Полиморфизм |
Генотип/аллель |
Частота встречаемости |
|
|
бычки ( n /%) телки ( n /%) |
|||
|
F94L MSTN |
CC |
64/100 |
80/98,77 |
|
CA |
0/0,0 |
1/1,23 |
|
|
AA * |
0/0,0 |
0/0,0 |
|
|
С |
1,00 |
0,99 |
|
|
А * |
0,00 |
0,01 |
|
|
Arg4Cys LEP |
TT |
23/35,93 |
23/28,39 |
|
CT |
27/42,19 |
37/45,68 |
|
|
CC |
14/21,88 |
21/25,93 |
|
|
Т |
0,51 |
0,49 |
|
|
С |
0,49 |
0,51 |
|
|
CAPN1 _316 |
GG |
33/51,56 |
56/69,14 |
|
GC |
26/40,63 |
18/22,22 |
|
|
CC * |
5/7,81 |
7/8,64 |
|
|
G |
0,80 |
0,72 |
|
|
C * |
0,20 |
0,28 |
|
|
Примечание. |
Звездочкой отмечены желательные для селекции аллель и генотип. |
||
Так, по полиморфизму F94L MSTN выявили два из трех возможных генотипов: гомозиготный по аллелю дикого типа ( СС ) и гетерозиготный ( СА ), который обнаружили лишь у одной телки (1,23 %). Генотип АА среди исследованных животных не встречался.
По Arg4Cys LEP были установлены все три возможных генотипа, при этом СС и CT в группах бычков и телок выявляли с близкой частотой — соответственно 21,88 и 25,93 %; 42,19 и 45,68 %. Носителями генотипа ТТ были 35,93 % бычков и 28,39 % телочек.
По CAPN1 _316 также обнаружили все три возможных генотипа, но частота встречаемости желательного с точки зрения селекции генотипа СС среди бычков и телок оказалась относительно невысокой — соответственно 7,81 и 8,64 %. Большинство животных были гомозиготными по аллелю G . Доля гетерозигот среди бычков составила 40,63 %, тогда как среди телок почти в 2 раза ниже — 22,22 %.
Частота желательного аллеля А по F94L MSTN среди бычков и телочек составляла соответственно 0,00 и 0,01, С по Arg4Cys LEP — 0,49 и 0,51, С по CAPN1 _316 — 0,20 и 0,28 (см. табл. 1).
Анализ динамики живой массы позволил сделать заключение, что исследуемые животные относятся к высокопродуктивным, при этом живая масса бычков в 8 мес соответствовала минимальным требованиям по породе, предъявляемым к животным класса элита, а телки превосходили требования I класса на 8,7 % (32). Так, средняя живая масса при рождении составляла 23,73±0,51 кг у бычков и 22,18±0,38 кг у телок; в возрасте 6 мес достигала 181,18±1,98 кг у бычков и 168,38±1,47 кг у телок; в возрасте 8 мес — 220,69±2,85 и 201,14±1,89 кг; 12 мес — 334,11±4,25 и 317,00±13,4 кг; 15 мес – 409,38±4,81 и 368,89±4,48 кг. Среднесуточный прирост живой массы составил в среднем за период от рождения до 8 мес 803 г у бычков и 733 г у телок, от 8 до 15 мес — 886 и 784 г. Проведенный анализ продуктивности молодняка свидетельствовал о том, что в хозяйстве были созданы благоприятные условия для реализации потенциала продуктивности и возможности получения репрезентативных данных при сопоставлении показателей у животных с разным генотипом по генам MSTN , LEP и CAPN1.
Исследование динамики живой массы следует разделить на два периода (до отъема — от рождения до 8 мес и после отъема — 12-15 мес), связанных с технологией выращивания телят (табл. 2).
2. Динамика живой массы (кг) молодняка крупного рогатого скота ( Bos taurus ) абердин-ангусской породы в зависимости от генотипов по полиморфизмам Arg4Cys LEP и CAPN1 _316 ( М ±SEM, ООО «КФХ «Хэппи Фарм», 2021-2022 годы)
|
SNP |
Генотип |
Возраст, мес |
||||
|
0 |
6 1 |
8 1 |
12 |
] 15 |
||
|
Arg4Cys LEP |
TT ( n = 23) |
22,74±0,70 |
Бычки 185,36±3,26 |
225,79±4,77 |
337,52±3,70 |
414,83±4,88 |
|
СТ ( n = 27) |
24,59±0,86 |
179,13±2,85 |
214,45±3,80 |
327,33±2,36 |
403,37±3,72 |
|
|
CC ( n = 14) |
23,71±1,31 |
179,95±4,86 |
219,79±7,20 |
341,57±6,19 |
417,57±7,55 |
|
|
t |
СС и СТ |
0,62 |
0,15 |
0,66 |
2,13* |
1,69 |
|
СТ и ТТ |
1,67 |
1,21 |
1,86 |
2,27* |
1,87 |
|
|
СС и ТТ |
0,73 |
0,75 |
0,69 |
0,56 |
0,31 |
|
|
CAPN1 _316 |
GG ( n = 33) |
23,79±0,71 |
179,66±2,64 |
218,06±3,98 |
334,79±2,63 |
412,18±3,58 |
|
GC ( n = 26) |
23,73±0,79 |
184,75±3,27 |
224,04±4,57 |
337,19±3,61 |
413,35±4,56 |
|
|
CC ( n = 5) |
23,40±2,72 |
172,73±5,69 |
207,86±7,63 |
313,60±11,29 |
358,80±14,46 |
|
|
t |
CC и CG |
0,14 |
1,83 |
1,82 |
1,99* |
1,82 |
|
CG и GG |
0,05 |
1,21 |
0,99 |
0,54 |
0,20 |
|
|
СС и GG |
0,16 |
1,10 |
1,18 |
1,83 |
1,77 |
|
|
Arg4Cys LEP |
TT ( n = 23) |
21,16±0,51 |
Телки 171,18±2,62 |
205,42±3,26 |
313,90±3,44 |
368,84±5,27 |
|
СТ ( n = 37) |
22,13±0,53 |
166,56±2,21 |
199,01±2,73 |
316,28±2,53 |
370,28±2,53 |
|
|
CC ( n = 21) |
23,48±0,90 |
167,00±3,62 |
199,08±4,86 |
320,57±2,83 |
367,81±4,51 |
|
|
t |
СС и СТ |
1,29 |
0,10 |
0,01 |
1,13 |
0,48 |
|
СТ и ТТ |
1,31 |
1,35 |
1,51 |
0,56 |
0,25 |
|
|
СС и ТТ |
2,23 |
0,94 |
1,08 |
1,50 |
0,15 |
|
|
CAPN1 _316 |
GG ( n = 56) |
22,39±0,48 |
168,03±1,94 |
200,92±2,49 |
318,37±1,87 |
369,80±2,94 |
|
GC ( n = 18) |
22,88±0,80 |
164,64±3,54 |
197,85±4,58 |
312,65±4,43 |
368,53±5,18 |
|
|
CC ( n = 7) |
19,50±0,50 |
176,14±2,07 |
207,24±5,55 |
317,00±2,77 |
366,00±6,42 |
|
|
t |
CC и CG |
3,60* |
2,80* |
1,30 |
0,83 |
0,31 |
|
CG и GG |
0,53 |
0,84 |
0,59 |
1,19 |
0,21 |
|
|
СС и GG |
4,18* |
2,86* |
1,04 |
0,41 |
0,54 |
|
* Различия статистически значимы при t ≥ 1,96 и p < 0,05.
По полиморфизму Arg4Cys LEP в группе бычков до 8 мес наибольшая тенденция к увеличению живой массы наблюдалась у животных с генотипом ТТ , которые при этом имели наименьшую массу при рождении. Так, бычки с генотипом ТТ в 6 мес были тяжелее аналогов с генотипом СС на 5,41 кг, в 8 мес — на 6,00 кг. Аналогичную тенденцию выявили у телок с генотипом ТТ : в возрасте 6 мес они весили на 4,18 кг больше, чем СС -аналоги, а в 8 мес разница составила 6,34 кг. При этом при рождении телки с генотипом ТТ весили на 2,32 кг меньше по сравнению с носителями генотипа СС ( t = 2,23).
В послеотъемный период (см. табл. 2) наблюдаемая тенденция менялась: в возрасте 12 мес бычки с генотипом ТТ уступали по живой массе гомозиготным по аллелю С на 4,05 кг, однако были тяжелее аналогов с генотипом СТ на 10,19 кг ( t = 2,27). В 15 мес разница между носителями ТТ - и СС -генотипов составила 2,74 кг в пользу гомозигот по аллелю С . При этом минимальные показатели живой массы были отмечены у гетерозиготных животных. В группе телок в 12 мес также наблюдалось преимущество животных с генотипом СС перед ТТ на 6,67 кг. В 15 мес телки с генотипом ТТ снова весили больше СС -аналогов на 1,03 кг.
Примечательно, что наименьшие значения живой массы от рождения до 15 мес в обеих половозрастных группах имели животные, гетерозиготные по полиморфизму гена LEP .
В отношении полиморфизма CAPN1_316 в группе бычков наибольшая живая масса наблюдалась у гетерозиготных животных: в возрасте 6 и 15 мес она составляла соответственно 172,73±5,69 и 358,80±14,46 кг (см. табл. 2). Однако это превосходство не было статистически значимым и указывало лишь на тенденцию. Наименьшие показатели отмечали у животных с генотипом СС: их живая масса в возрасте 12 мес была на 21,18 кг ниже по сравнению с носителями GG-генотипа (t = 1,99). В группе телок наблюдалось статистически значимое преимущество животных с аллелем С по CAPN1_316 по показателям живой массы при рождении и в возрасте 6 мес. Так, животные с генотипом СС, несмотря на достоверно более низкую живую массу при рождении (на 2,89 кг меньше по сравнению с GC, t = 3,60; на 3,38 кг — по сравнению с GG, t = 4,18), в возрасте 6 мес имели большую массу по сравнению с GG на 8,11 кг (t = 2,86), по сравнению с GC — на 11,5 кг (t = 2,80).
В локусе Arg4Cys LEP наиболее выраженное влияние на среднесуточные приросты живой массы от рождения до 8 мес оказывал аллель Т в гомозиготном состоянии. Так, среди бычков особи с генотипом ТТ прибавляли ежедневно 778 г, что было на 50 г больше по сравнению с СТ ( t = 2,18) и на 30 г по сравнению с СС . В группе телок до 8 мес наблюдалась аналогичная тенденция: животные с генотипом ТТ прибавляли 755 г против 725 г у особей с генотипом СТ и 720 г — с СС .
В локусе CAPN1_316 наблюдалось положительное влияние аллеля С в гомозиготном состоянии среди телок: СС -особи в возрасте до 8 мес имели превосходство по среднесуточным приростам живой массы над особями GG и GC соответственно на 40 и 50 г.
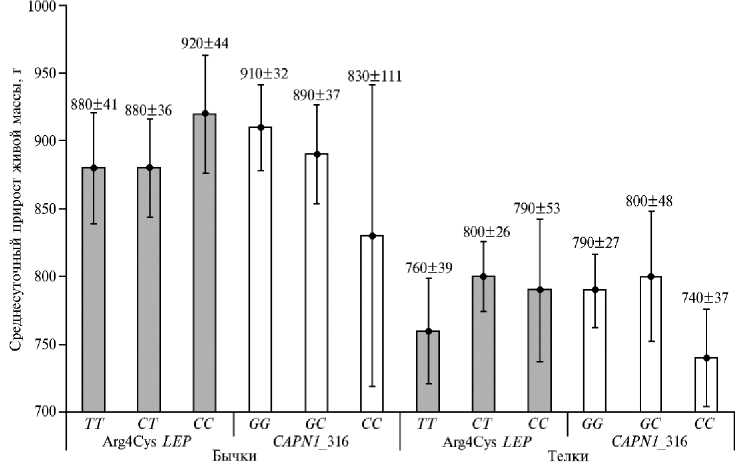
Рис. 4. Среднесуточный прирост живой массы у молодняка крупного рогатого скота ( Bos taurus ) абердин-ангусской породы в зависимости от генотипов по полиморфизмам генов лептина Arg4Cys LEP и кальпаина 1 CAPN1 _316 ( М ±SEM, ООО «КФХ «Хэппи Фарм», 2021-2022 годы). Размеры выборок см. в таблице 2.
Однако в послеотъемный период (8-15 мес) наблюдаемые тенденции изменились. По Arg4Cys LEP преимущество по среднесуточным приростам массы демонстрировали бычки с генотипом СС : они прибавляли на 40 г/сут больше по сравнению с генотипами СТ и ТТ . В группе телок наибольшие среднесуточные прибавки в живой массе наблюдались у гетерозиготных животных. По CAPN1 _316 максимальные показатели среди телочек регистрировали у животных с генотипом GC , среди бычков — с GG (рис. 4).
Разработанные тест-системы, базирующиеся на использовании технически относительно простого и наименее затратного метода ПЦР-ПДРФ- анализа, представляют собой наиболее доступные средства генетической идентификации животных, которые могут применяться в любой российской или зарубежной молекулярно-генетической лаборатории без каких-либо ограничений. Следует отметить, что с каждым годом растет число систем идентификации генотипов с помощью флюоресцентной детекции. И если для диагностики полиморфизма Arg4Cys LEP применялся метод ПЦР-ПДРФ (23), то для диагностики полиморфизма CAPN1_316, наряду с ПЦР-ПДРФ (27), использовались методы ПЦР в режиме реального времени (realtime PCR) или масс-спектрометрии, основанной на матрично-активированной лазерной десорбции/ионизации с времяпролетным разделением (matrix-assisted laser desorption/ionization time-of-flight, MALDI-TOF) (24-26). Основные преимущества флюоресцентных методов заключаются в отсутствии этапа детекции методом электрофореза в агарозном геле и возможности автоматизации, за счет чего сокращается время анализа, что удобно при высокопоточном генотипировании большого числа образцов. Также снижается риск перекрестной контаминации в ПЦР-лаборатории (33). Однако нельзя не отметить, что при проведении количественного ПЦР-анализа различие в эффективности амплификации может внести существенную ошибку, поэтому с распространением количественного анализа повышаются требования к чистоте получаемой ДНК. В связи с этим полный отказ от более простых методик на основе традиционной ПЦР-ПДРФ представляется нецелесообразным (33).
Мы провели генотипирование российской популяции КРС абердин-ангусской породы по генам миостатина, лептина и кальпаина 1 с использованием разработанных нами ДНК-тестов. Было показано наличие в генотипах животных как аллелей дикого типа, так и мутантных, ассоциированных с продуктивностью мясного скота. По полиморфизму F94L MSTN практически все животные были гомозиготными по аллелю дикого типаю По полиморфизмам Arg4Cys LEP и CAPN1 _316 аллеи дикого типа встречались с достаточно высокой частотой.
Анализ данных литературы позволяет заключить, что полиморфизм F94L MSTN по свойствам сходен с мутацией, служащей причиной генетического дефекта двойной обмускуленности (М1), но без влияния на массу тела при рождении (13-15). Также было обнаружено, что аллель А ассоциирован с увеличением на 5,5 % площади наружной плоской части бедра (silverside) — достаточно ценного отруба туши и с увеличением на 2,3 % площади мышечного глазка — поперечного разреза длиннейшей мышцы спины в области 10-11-го ребер, последнего ребра или между первым и вторым поясничными позвонками, которая косвенно связана с увеличенным содержанием мяса в туше (13).
Фенотипические эффекты аллеля А F94L MSTN были частично рецессивными. Следовательно, генотип АА F94L MSTN может давать промежуточный (не двойной) фенотип по мускулатуре, представляющий значительную ценность для мясного скотоводства (13). Поэтому указанный SNP рассматривается как весьма перспективный генетический маркер мясной продуктивности (13-15).
В отношении полиморфизма Arg4Cys LEP сложно однозначно ответить, какой аллель более предпочтителен для селекции. С одной стороны, наличие в генотипе мутантного аллеля Т, связанного с более высокой экспрессией гормона лептина, обусловливает лучший прирост живой массы и откормочные качества, чем, вероятно, объясняется высокая живая масса молодняка абердин-ангусской породы в нашем исследовании, с другой — аллель С связан с получением более постного мяса, что может быть полезно, когда речь идет о диетическом питании (22).
Наши данные в отношении частоты встречаемости аллеля Т согласуются с результатами других авторов. Частота встречаемости аллеля Т в изученной нами популяции оказалась относительно высокой и составила 0,49-0,51 в зависимости от пола животных. В работе F.C. Buchanan с соавт. (23) в популяции абердин-ангусов этот показатель составил 0,58, что было выше по сравнению с породами шароле (0,34), герефордская (0,55) и симментальская (0,32). Научной группой Н.П. Герасимова (19) в исследованной ими популяции, как и нами, была обнаружена значительная доля гетерозиготных животных: частота носителей генотипа СТ составила 50,0 % в группе молодняка и 53,3 % у полновозрастных особей маточного стада, при этом телки с генотипом СТ Arg4Cys LEP выделялись более высокой мясной продуктивностью и показали тенденцию к повышению предубойной массы (на 1,67-2,63 %) и массы туши (на 0,76-0,85 %) по сравнению с генотипами СС и ТТ (19). В противоположность нашим результатам, полученным при анализе животных в период от рождения до 8 мес, коровы с генотипом ТТ Arg4Cys LEP характеризовались минимальными показателями продуктивности (19), однако в послеотъемный период у животных из ООО «КФХ «Хэппи Фарм» наблюдалась аналогичная тенденция.
В отношении полиморфизма CAPN1 _316 уже сформировалось достаточно четкое представление о том, что аллель С , связанный с повышенной нежностью мяса, более предпочтителен с точки зрения селекции (23, 25, 26). В нашей работе при изучении полиморфизма CAPN1 _316 амплифи-цировался ДНК-фрагмент значительно большего размера. Секвенирование полученного ПЦР-продукта по Сэнгеру выявило нуклеотидную последовательность NM_174259.2. В указанном случае есть вероятность альтернативного сплайсинга, в результате которого не происходит вырезания некодирующих интронных последовательностей (34, 35), что, по-видимому, обусловило больший размер амплифируемого участка. Этот факт требует дальнейшего изучения с точки зрения генетических особенностей популяции и связи с продуктивными качествами животных. Интерес представляют наши результаты, показавшие положительное влияние генотипа TT Arg4Cys LEP на прирост живой массы КРС в период от рождения до 8 мес.
Известно, что живая масса молодняка в возрасте 205 сут служит характеристикой молочности коров-матерей (36). В то же время нельзя исключать влияния собственных генотипов телят на их живую массу. Так, было установлено, что у носителей СС генотипа по гену лептина чувство насыщения наступает позже, при этом выше усвояемость корма, чем в конечном итоге определяется большая живая масса (17, 21, 22). По-видимому, полученные в нашей работе данные также указывают на влияние генотипа Arg4Cys LEP на среднесуточные приросты живой массы телят в период от рождения до отъема.
Изучение полиморфизма CAPN1 _316 дало противоречивые результаты: если телки с генотипом СС в возрасте 6 мес имели статистически значимо большую по массу по сравнению с телками с генотипом GG и в возрасте 12 мес эта тенденция сохранялась, то бычки с СС в 12 мес уступали по массе сверстникам с GG . E. Casas с соавт. (25) и S.N. White с соавт. (26) также не обнаружили зависимости откормочных признаков от генотипа по CAPN1 _316. Вероятно, этот полиморфизм больше влияет на качественные показатели мяса, и для выявления желательного генотипа абердин-ангус-ской породы необходимо дальнейшее изучение убойных показателей, в частности гистологических и физико-технологических характеристик мышечной ткани.
Дискуссионным остается изменение влияния аллеля Т Arg4Cys LEP на среднесуточный прирост живой массы в период от 8 до 15 мес. Для объяснения таких различий в откормочных показателях, по нашему мнению, следует рассмотреть роль лептина как гормона с множественными эффектами. Лептин участвует в регуляции пищевого поведения, влияет на усвояемость корма, на репродуктивные функции и иммунную систему (37). Есть мнение, что экспрессия лептина и его содержание в крови подвержены циркадным ритмам и варьируют в зависимости от условий кормления (37). Лептин передает сигналы через специфические лептиновые рецепторы (LepR), которые располагаются на мембранах клеток-мишеней и бывают двух видов — экспрессируемые и секретируемые. Последние конкурентно связывают лептин, снижая его взаимодействие с экспрессируемыми изоформами и, соответственно, опосредуемые им эффекты (38). У человека установлено важное значение такого механизма, обеспечивающего изменение биодоступности лептина, особенно в первые годы жизни: до наступления полового созревания концентрация растворимых LepR непрерывно снижалась (39). По нашему мнению, у КРС по мере достижения половой зрелости основной функцией лептина становится регулирование воспроизводительных качеств и иммунной системы. Для проверки такого предположения требуются дальнейшие исследования. В этой связи представляет интерес сообщение M. Zhang с соавт. (40). В их работе корреляционный анализ сложных генотипов и проявления хозяйственно ценных признаков у лис позволил установить взаимодействие между генами лептина и его рецептора, вызывающее синергический эффект (40).
Продолжение исследований позволит получить инструменты для генотипирования популяций КРС по полиморфизмам продуктивности и выявлять генетические маркеры, имющие наиболее сильные ассоциации с желательными признаками. Это поможет повысить точность прогноза при геномной селекции и ускорить селекционное улучшение в стадах (41, 42). Для повышения рентабельности мясного скотоводства также важен отбор перспективного молодняка с лучшим откормочным потенциалом.
Итак, на примере абердин-ангусской породы нами разработаны тест-системы для ДНК-диагностики полиморфизмов Arg4Cys LEP и CAPN1 _316, которые могут быть использованы для генотипирования мясного скота и отбора носителей желательных генотипов. Среди животных абердин-ангус-ской породы по F94L MSTN наиболее распространенным был генотип CC , по Arg4Cys LEP и CAPN1_ 316 — соответственно генотипы ТС и GG . Для быстрого откорма молодняка в возрасте до одного года целесообразен отбор животных с генотипом ТТ Arg4Cys LEP, которые достоверно превосходили сверстников по среднесуточному приросту живой массы. В разработанных ДНК-тестах использованы невысокие по стоимости доступные реактивы, что упрощает тестирование в молекулярно-генетических лабораториях с целью выявления особей с желательными генотипами по продуктивности.
Список литературы ДНК-анализ полиморфизма генов миостатина, лептина и кальпаина 1 у российской популяции крупного рогатого скота абердин-ангусской породы
- Колодязная В.С., Бараненко Д.А, Бройко Ю.В. Биологическая ценность белков молочной телятины. Процессы и аппараты пищевых производств, 2011, 1: 232-237.
- Pighin D., Pazos A., Chamorro V., Paschetta F., Cunzolo S., Godoy F., Messina V., Por-domingo A., Grigioni G. A contribution of beef to human health: a review of the role of the animal production systems. The Scientific World Journal, 2016, 2016: 8681491 (doi: 10.1155/2016/8681491).
- Terry S.A., Basarab J.A., Guan L.L., McAllister T.A. Strategies to improve the efficiency of beef cattle production. Canadian Journal of Animal Science, 2020, 101(1): 1-19 (doi: 10.1139/cjas-2020-0022).
- Федоренко В.Ф., Мишуров Н.П., Кузьмина Т.Н., Тихомиров А.И., Гуськова С.В., Свина-рев И.Ю., Бекенев В.А., Колосов Ю.А., Фролова В.И., Большакова И.В. Передовые прак-тики в отечественном племенном животноводстве: научный аналитический обзор. М., 2018.
- Дунин И.М., Тяпугин С.Е., Мещеров Р.К., Ходыков В.П., Аджибеков В.К., Тяпугин Е.Е., Дюльдина А.В. Состояние мясного скотоводства в Российской Федерации: реалии и перспективы. Молочное и мясное скотоводство, 2020, 2: 2-7 (doi: 10.33943/MMS.2020.40.30.001).
- Toušová R., Ducháček J., Stádník L., Ptáček M., Beran J. The selected factors influenced growth ability to weaning of Aberdeen Angus cattle. Acta Universitatis Agriculturae et Silviculturae Men-delianae Brunensis, 2015, 63(2): 457-461 (doi: 10.11118/actaun201563020457).
- Отаров А.И., Каюмов Ф.Г., Третьякова Р.Ф. Оценка мясной продуктивности и качества мяса бычков разных генотипов в предгорной и горной зонах Кабардино-Балкарской Республики. Животноводство и кормопроизводство, 2021, 104 (2): 56-64 (doi: 10.33284/2658-3135-104-2-56).
- Габидулин В.М., Алимова С.А. Генотипические, биологические, физиологические особенности скота абердин-ангусской породы. Вестник мясного скотоводства, 2017, 4(100): 18-24.
- Дунин И.М., Бутусов Д.В., Шичкин Г.И., Сафина Г.Ф., Чернов В.В., Ласточкина О.В., Тяпугин С.Е., Боголюбова Л.П., Никитина С.В., Матвеева Е.А., Тяпугин Е.Е. Состояние мясного скотоводства в Российской Федерации. В сб.: Ежегодник по племенной работе в мясном скотоводстве в хозяйствах Российской Федерации (2019 год). Лесные Поляны, 2020: 3-16.
- Chen M.-M., Zhao Y.-P., Zhao Y., Deng S.-L., Yu K. Regulation of myostatin on the growth and development of skeletal muscle. Frontiers in Cell and Developmental Biology, 2021, 9: 785712 (doi: 10.3389/fcell.2021.785712).
- Grobet L., Martin L.J.R., Poncelet D., Pirottin D., Brouwers B., Riquet J., Schoeberlein A., Dunner S., Ménissier F., Massabanda J., Fries R., Hanset R., Georges M. A deletion in the bovine myostatin gene causes the double—muscled phenotype in cattle. Nature Genetics, 1997, 17(1): 71-74 (doi: 10.1038/ng0997-71).
- Dunner S., Miranda M.E., Amigues Y., Canon J., Georges M., Hanset R., Williams J., Menis-sier F. Haplotype diversity of the myostatin gene among beef cattle breeds. Genetics, Selection, Evolution, 2003, 35: 103-118 (doi: 10.1186/1297-9686-35-1-103).
- Sellick G.S., Pitchford W.S., Morris C.A., Cullen N.G., Crawford A.M., Raadsma H.W., Bottema C.D.K. Effect of myostatin F94L on carcass yield in cattle: MSTN effects on beef yield. Animal Genetics, 2007, 38(5): 440-446 (doi: 10.1111/j.1365-2052.2007.01623.x).
- Esmailizadeh A.K., Bottema C.D.K, Sellick G.S., Verbyla A.P., Morris C.A., Cullen N.G., Pitch-ford W.S. Effects of the myostatin F94L substitution on beef traits. Journal of Animal Science, 2008, 86(5): 1038-1046 (doi: 10.2527/jas.2007-0589).
- Lee J., Kim J.-M., Garrick D.J. Increasing the accuracy of genomic prediction in pure-bred Limousin beef cattle by including cross-bred Limousin data and accounting for an F94L variant in MSTN. Animal Genetics, 2019, 50(6): 621-633 (doi: 10.1111/age.12846).
- Konovalova E.N., Romanenkova O.S., Zimina A.A., Volkova V.V., Sermyagin A.A. Genetic var-iations and haplotypic diversity in the myostatin gene of different cattle breeds in Russia. Animals, 2021, 11(10): 2810 (doi: 10.3390/ani11102810).
- Eduardo Casas E., Kehrli Jr.M.E. A review of selected genes with known effects on performance and health of cattle. Frontiers Veterinary Science, 2016, 3: 113 (doi: 10.3389/fvets.2016.00113).
- Komisarek J., Szyda J., Michalak A., Dorynek Z. Impact of leptin gene polymorphisms on breed-ing value for milk production traits in cattle. Journal of Animal and Feed Sciences, 2005, 14(3): 491-500 (doi: 10.22358/JAFS/67042/2005).
- Герасимов Н.П., Колпаков В.И., Косян Д.Б., Сыромятников М.Ю., Кван О.В., Руса-кова Е.А. Оценка взаимосвязи послеубойных качеств животных крупного рогатого скота с наличием полиморфизмов LEP 528С/T и LEP 73С/T. Животноводство и кормопроизвод-ство, 2020, 103(3): 114-126 (doi: 10.33284/2658-3135-103-3-114).
- Liefers S., Pas M.T., Veerkamp R., Chilliard Y., Delavaud C., Gerritsen R., van der Lende T. Association of leptin gene polymorphisms with serum leptin concentration in dairy cows. Mam-malian Genome, 2003, 14: 657-663 (doi: 10.1007/s00335-003-2275-y).
- Kovalyuk N.V., Machulskaya E.V., Satsuk V.F., Shakhnazarova Yu.Yu. Influence of polymor-phism of R25C and Y7F loci of the leptin gene on the duration of economic use of the Ayrshire cattle. Russian Agricultural Sciences, 2017, 43(6): 494-496 (doi: 10.3103/S1068367417060064).
- Mota L.F.M., Bonafé C.M., Alexandre P.A., Santana M.H., Novais F.J, Toriyama E., Pires A.V., Silva S.L., Leme P.R., Ferraz J.B.S., Fukumasu H. Circulating leptin and its muscle gene ex-pression in Nellore cattle with divergent feed efficiency. Journal of Animal Science and Biotech-nology, 2017, 8: 71 (doi: 10.1186/s40104-017-0203-3).
- Buchanan F.C., Fitzsimmons C.J., Van Kessel A.G., Thue T.D., Winkelman-Sim D.C., Schmutz S.M. Association of a missense mutation in the bovine leptin gene with carcass fat content and leptin mRNA levels. Genetics, Selection, Evolution, 2002, 34: 105-116 (doi: 10.1186/1297-9686-34-1-105).
- Hou G., Huang M., Gao X., Li J., Gao H., Ren H., Xu S. Association of calpain 1 (CAPN1) and HRSP12 allelic variants in beef cattle with carcass traits. African Journal of Biotechnology, 2011, 10(63): 13714-8 (doi: 10.5897/AJB11.338).
- Casas E., White S.N., Wheeler T.L., Shackelford S.D., Koohmaraie M., Riley D.G., Chase C.C. Jr., Johnson D.D., Smith T.P. Effects of calpastatin and micro-calpain markers in beef cattle on tenderness traits. Journal of Animal Science, 2006, 84(3): 520-525 (doi: 10.2527/2006.843520x).
- White S.N., Casas E., Wheeler T.L., Shackelford S.D., Koohmaraie M., Riley D.G., Chase C.C. Jr., Johnson D.D., Keele J.W., Smith T.P.L. A new single nucleotide polymorphism in CAPN1 extends the current tenderness marker test to include cattle of Bos indicus, Bos taurus, and cross-bred descent. Journal of Animal Science, 2005, 83(9): 2001-2008 (doi: 10.2527/2005.8392001x).
- Brooker R.J., Widmaier E.P., Graham L.E., Stiling P.D. Biology. Fourth edition. McGraw-Hill Education, 2017.
- Основы животноводства /Под ред. А.И. Солдатова. М., 1988.
- Leal-Gutiérrez J.D, Elzo M.A., Johnson D.D., Scheffler T.L., Scheffler J.M., Mateescu R.G. Association of μ-calpain and calpastatin polymorphisms with meat tenderness in a Brahman-Angus population. Frontiers in Genetics, 2018, 9: 56 (doi: 10.3389/fgene.2018.00056).
- Rodriguez S., Gaunt T.R., Day I.N.M. Hardy-Weinberg Equilibrium Testing of Biological As-certainment for Mendelian Randomization Studies. American Journal of Epidemiology, 2009, 169(4): 505-514 (doi: 10.1093/aje/kwn359).
- Glantz S.A. Primer of biostatistics. 4th ed.; Health Professions Division, McGraw-Hill, New York, 1997.
- Методическое рекомендации по порядку и условиям проведения бонитировки племенного крупного рогатого скота мясного направления продуктивности /Под ред. И.М. Дудина. Лесные Поляны, 2020. Режим доступа: https://files.stroyinf.ru/Data2/1/4293721/4293721853.pdf. Без даты.
- Ребриков Д.В., Саматов Г.А., Трофимов Д.Ю., Семёнов П.А., Савилова А.М., Ко-фиади И.А., Абрамов Д.Д. ПЦР в реальном времени: практическое руководство. 8-е изд. /Под ред. Д.В. Ребрикова. М., 2020.
- Chacko E., Ranganathan S. Genome-wide analysis of alternative splicing in cow: implications in bovine as a model for human diseases. BMC Genomics, 2009, 10(3): S11 (doi: 10.1186/1471-2164-10-S3-S11).
- Скачкова О.А., Васильев А.А., Бригида А.В. Изучение альтернативного сплайсинга в генах LEPR, PRLR, GHR крупного рогатого скота в аспекте молочной продуктивности. Аграрный научный журнал, 2022, 2: 61-64 (doi: 10.28983/asj.y2022i2pp61-64).
- Габидуллин В.М., Алимова С.А. Метод прогнозирования продуктивности абердин-ангус-ского скота с учетом результатов полиморфизма генов. Вестник мясного скотоводства, 2016, 4(96): 30-35.
- Алипкина С.И., Налобин Д.С., Галиакберова А.А., Трошев Д.В., Краснов М.С., Богуславский Д.В., Глазко Т.Т., Глазко В.И., Косовский Г.Ю. Лептин и его рецептор в норме и при патоло-гии. Успехи современной биологии, 2019, 139(4): 352-364 (doi: 10.1134/S0042132419040033).
- Zhang J., Scarpace P.J. The soluble leptin receptor neutralizes leptin-mediated STAT3 signalling and anorexic responses in vivo. British Journal of Pharmacology, 2009, 158(2): 475-482 (doi: 10.1111/j.1476-5381.2009.00246.x).
- Kratzsch J., Lammert A., Bottner A., Seidel B., Mueller G., Thiery J., Hebebrand J., Kiess W. Circulating soluble leptin receptor and free leptin index during childhood, puberty, and adoles-cence. The Journal of Clinical Endocrinology and Metabolism, 2002, 87(10): 4587-4594 (doi: 10.1210/jc.2002-020001).
- Zhang M., Bai X.J. Leptin and leptin receptor gene polymorphisms are correlated with production performance in the Arctic fox. Genetics and Molecular Research, 2015, 14(2): 5560-5570 (doi: 10.4238/2015.May.25.7).
- Mrode R., Ojango J.M.K., Okeyo A.M., Mwacharo J.M. Genomic selection and use of molecular tools in breeding programs for indigenous and crossbred cattle in developing countries: current status and future prospects (review article). Frontiers Genetics, 2019, 9: 694 (doi: 10.3389/fgene.2018.00694).
- Moravčíková N., Kasarda R., Vostrý L., Krupová Z., Krupa E., Lehocká K., Olšanská B., Tra-kovická A., Nádaský R., Židek R., Belej L., Golian J. Analysis of selection signatures in the beef cattle genome. Czech Journal of Animal Science, 2019, 64(12): 491-503 (doi: 10.17221/226/2019-CJAS).


