EPCAM+CD45+ клетки в асцитической жидкости больных новообразованиями яичников: связь с уровнями онкомаркеров и степенью злокачественности
Автор: Козик А.В., Кайгородова Е.В., Грищенко М.Ю., Вторушин С.В., Чернышова А.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.21, 2022 года.
Бесплатный доступ
Цель исследования - оценить особенности взаимосвязи атипичных/гибридных форм EpCAM+CD45+ клеток в асцитической жидкости у больных новообразованиями яичников с уровнем онкомаркеров СА125, HE4 и степенью злокачественности опухоли. Материал и методы. В клиническое исследование NCT04817501 включены 48 больных с впервые диагностированными новообразованиями яичников, из которых 42 пациентки с впервые диагностированным раком яичников Ic-IV стадии по FIGO, а также 6 женщин с пограничными новообразованиями яичников (ПОЯ), в возрасте от 36 до 76 лет. Материалом для исследования служили образцы асцитической жидкости и венозной стабилизированной крови. Наличие атипичных/гибридных форм EpCAM+CD45+ клеток в асцитической жидкости определяли методом многоцветной проточной цитометрии. Уровень онкомаркеров СА125 и HE4 в сыворотке крови определяли методом ИФА. Результаты. Количество EpCAM+CD45+ клеток в асцитической жидкости больных серозной карциномой яичников составило 1,02 (0,30; 2,68) клеток/мкл, при этом в группе больных Low-grade серозной карциномы яичников (LGSC) их уровень составил 0,55 (0,03; 4,51) клеток/мкл, а в группе High-grade (HGSC) - 1,36 (0,41; 2,68) клеток/мкл. Показано, что количество EpCAM+CD45+ клеток в асцитической жидкости у больных с новообразованиями яичников имеет прямую корреляционную связь с уровнем CA125 и HE4 в сыворотке крови (R=0,60; р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак яичников, асцитическая жидкость, атипичные/гибридные формы опухолевых клеток, epoam+od45+ клетки, ca125, he4, hgso, lgsc, пограничные опухоли яичников
Короткий адрес: https://sciup.org/140296677
IDR: 140296677 | УДК: 618.11-006-091:616.381-003.217 | DOI: 10.21294/1814-4861-2022-21-5-44-51
Текст научной статьи EPCAM+CD45+ клетки в асцитической жидкости больных новообразованиями яичников: связь с уровнями онкомаркеров и степенью злокачественности
В терминальных стадиях рак яичников приводит к асциту [1, 2]. Значительный интерес среди злокачественных клеток, определяемых в асцитической жидкости, вызывает недавно открытая группа атипичных/гибридных клеток, образующихся в результате слияния раковой клетки и лейкоцитов. Такие клетки экспрессируют маркер CD45, характерный для всех видов лейкоцитов человека [3] и EpCAM – молекулу клеточной адгезии эпителия, обнаруживающуюся у большинства раковых эпителиальных клеток [4, 5] и в 70 % случаев рака яичников [6, 7].
Группа EpCAM+CD45+ клеток неоднородна, и на данный момент представлена, как минимум, двумя популяциями – Cancer-Associated Macrophage-Like cell (CAML) и Circulating Hybrid Cells (CHC) [8]. Морфологически первая популяция отличается
увеличенными размерами, неправильной формой и многоядерностью [9], тогда как вторая сохраняет относительное сходство с родительским лейкоцитом [10]. Функционально же, судя по имеющимся данным, все популяции гибридов схожи – комбинация из способностей к активному движению и к бесконтрольному росту и размножению делает гибридные клетки потенциальной причиной метастазирования опухоли [11]. При этом их значительные концентрации в большинстве биологических жидкостей, включая асцитическую [7, 12], даже на самых ранних этапах заболевания [13] открывают возможности для подсчета EpCAM+CD45+клеток в качестве предиктивных маркеров онкологических заболеваний [14].
Цель исследования – оценить особенности взаимосвязи атипичных/гибридных форм EpCAM+CD45+ клеток в асцитической жидкости
Таблица /table
Уровень атипичных/гибридных форм epcaM+cd45+ клеток и онкомаркеров ca125, He4 у больных с новообразованиями яичников atypical/hybrid forms of epcaM+cd45+ cell and the levels of СА125 and He4 markers in patients with ovarian neoplasms
|
Показатель/Parameter |
LGSC |
Группа исследования/Study group HGSC |
ПОЯ/BOT |
|
CD45+EpCAM+, кл/мкл/ D45+EpCAM+, cells/ µl |
0,55 (0,03; 4,51) |
1,36 (0,41; 2,68) p1=0,29 |
0,04 (0; 0,66) p2=0,17; p3=0,01 |
|
CA125, ед/мл/ CA125, U/ml |
170 (42,06; 489,05) |
71,3 (51; 544) p1=0,63 |
6,39 (4,75; 9,5) p2=0,02; p3<0,01 |
|
HE4, пМ/л/ HE4, pmol/l |
239,5 (181,55; 501,7) |
130 (82; 335) p1=0,30 |
26,25 (0; 44,3) p2<0,01; p3<0,01 |
Примечание: p1 – значение p, полученное в результате применения критерия Манна–Уитни для сравнения двух независимых выборок групп HGSC и LGSC; p2– для LGSC и ПОЯ; p3 – для HGSC и ПОЯ.
у больных новообразованиями яичников с уровнем онкомаркеров СА125, HE4 и степенью злокачественности опухоли.
Материал и методы
В клиническое исследование NCT04817501 были включены 42 пациентки с впервые диагностированным раком яичников Ic CA–IV стадии по FIGO, из которых 13 человек – с Low-grade серозной карциномой яичников (LGSC), 29 – с High-grade серозной карциномой яичников (HGSC). Группу сравнения составили 6 женщин с пограничными новообразованиями яичников (ПОЯ). Все пациентки получали лечение в НИИ онкологии Томского НИМЦ и/или Томском областном онкологическом диспансере. Возраст больных ‒ от 36 до 76 лет.
Материалом для исследования служили 5 мл стабилизированной ЭДТА асцитической жидкости, взятой во время лапароскопии, а также 5 мл крови. Наличие атипичных/гибридных форм EpCAM+CD45+ клеток в асцитической жидкости определяли методом многоцветной проточной цитометрии на проточном цитофлюориметре No-voCyte (Agilent Technologies, США) с помощью меченных различными флюорохромами моноклональных антител к CD45 (CD45-APC-Cy7, Biolegend, США) и EpCAM (EpCAM-BV605, Biolegend, США), а также витального красителя NucBlue Live Cell Stain Ready Probes reagent (Invitrogen, США). Методом ИФА определялся уровень онкомаркеров СА125 и HE4 в сыворотке крови с помощью наборов фирмы «Вектор Бест» (Россия).
Результаты исследования обрабатывали с использованием программ Microsoft Excel 2019 (Microsoft, США) и STATISTICA 13.5 (TIBCO Software Inc., США). Проверка на соответствие выборок нормальному закону распределения проводилась критерием Шапиро–Вилка. Связь между двумя выборками, не подчиняющимися
нормальному закону распределения, оценивали с помощью корреляции Спирмена. Статистическую значимость различий независимых выборок оценивали с помощью непараметрического критерия Манна–Уитни. Различия считались статистически значимыми при достигнутом уровне значимости p<0,05. Результаты представлены в виде медианы и межквартильного размаха Ме (Q1; Q3).
Результаты
В результате проведенного исследования в асцитической жидкости больных раком яичников были выявлены атипичные/гибридные формы EpCAM+CD45+ в концентрации 1,02 (0,3–2,68) клеток/мкл. Средние уровни онкомаркеров СА125 и HE4 составили 129 (51; 544) ед/мл и 209 (82; 472) пМ/л соответственно (таблица). В подавляющем большинстве случаев по результатам проточной цитометрии асцитической жидкости больных раком яичников мы наблюдали не одно, а два облака EpCAM+CD45+ клеток (рис. 1).
При статистической обработке данных установлены прямые корреляции между уровнями СА125 и HE4 в крови среди всех пациенток (R=0,60; p<0,01), больных LGSC (R=0,79; p<0,01) и HGSC (R=0,52; p<0,01). Обнаружены достаточно сильные корреляции между концентрациями EpCAM+CD45+ клеток в образцах асцитической жидкости больных LGSC и уровнями СА125 (R=0,93; p<0,01) и HE4 (R=0,68; p=0,03) крови. У пациенток с HGSC зависимости между концентрацией гибридных клеток и HE4 не обнаружено (R=-0,16; p=0,51), а в случае СА125 – только на уровне статистической тенденции (R=0,38; p=0,08) Корреляция между этими параметрами в общей группе исследования обнаружена с уровнем СА125 (R=0,51; p<0,01), но не в случае HE4 (R=0,08; p=0,69) (рис. 2).
Проведенное исследование показало, что значимых различий между количеством EpCAM+CD45+ клеток у пациенток с LGSC и HGSC обнаружено
Note: p1 – p value obtained after Mann–Whitney U test to compare two independent distributions of HGSC and LGSC groups; p2 – for LGSC and BOT groups; p3– for HGSC and BOT groups.
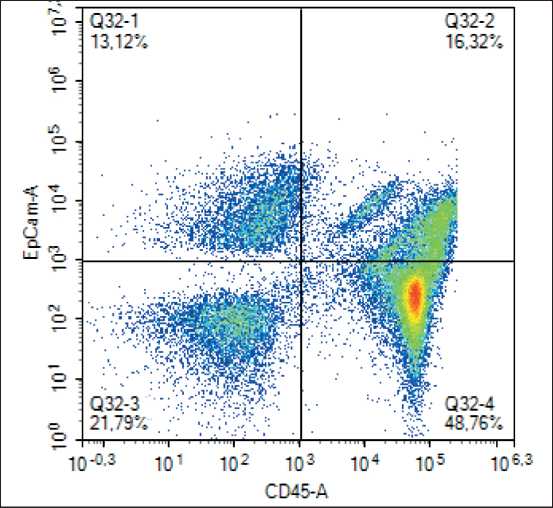
Рис. 1. Типичная скаттерограмма, полученная в ходе цитоф-луориметрического исследования асцитической жидкости Fig. 1. Typical scatterplot acquired after flow cytometry of an ascitic fluid sample
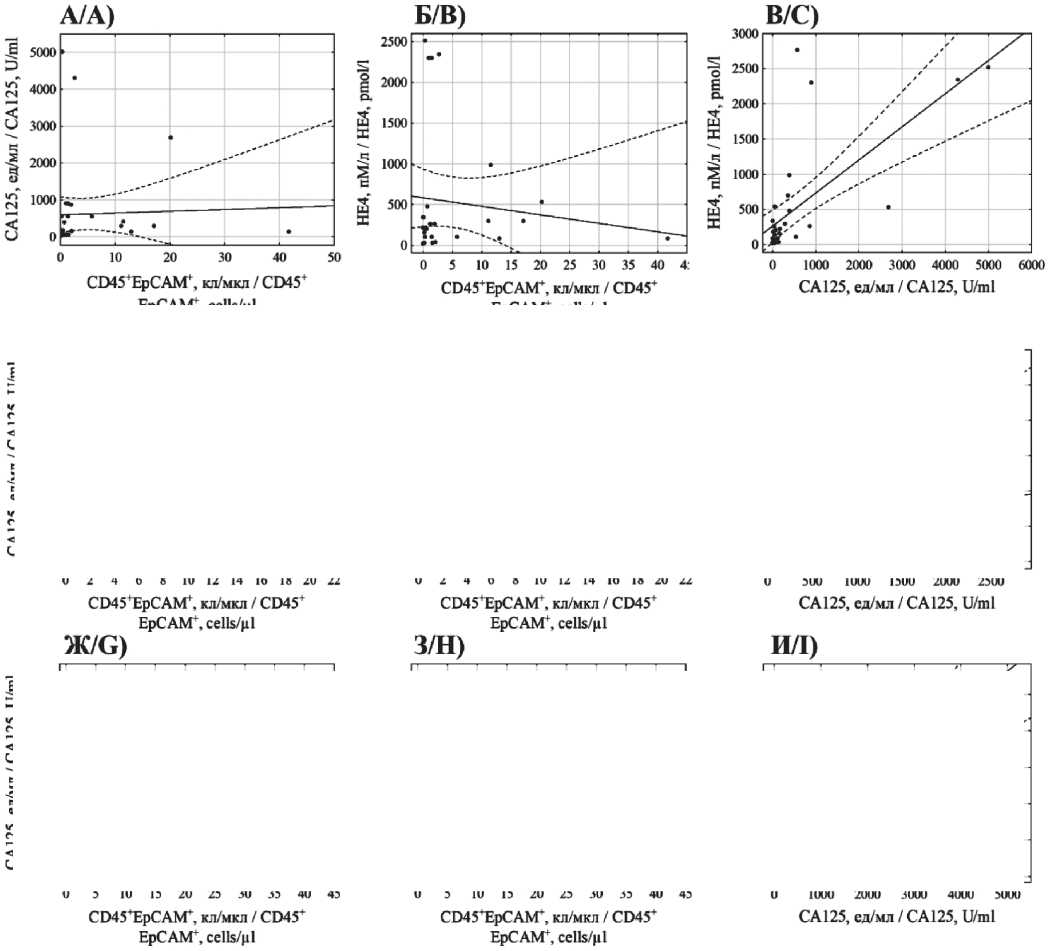
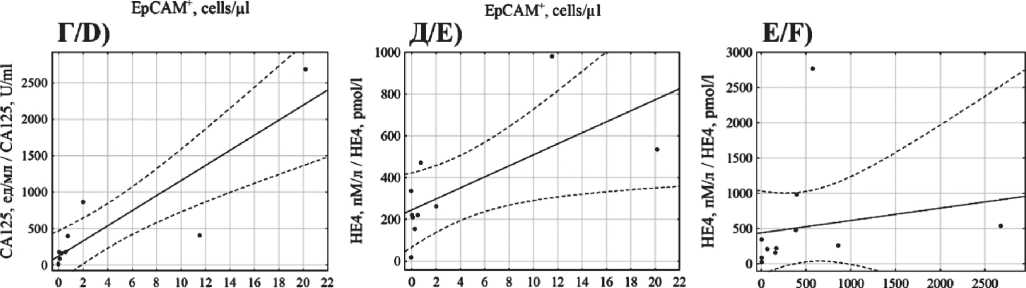
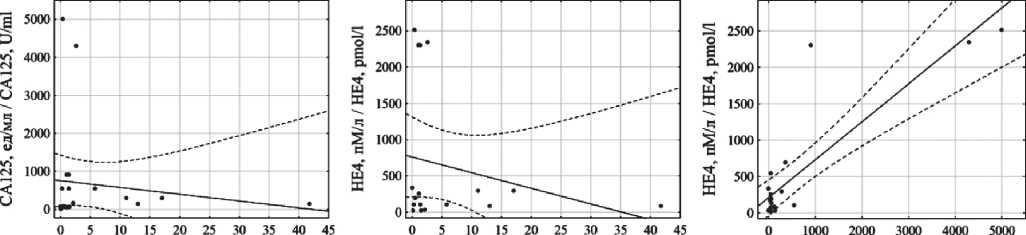
Рис. 2. А–В) ‒ cкаттерограммы значений EpCAM+CD45+ клеток асцитической жидкости, CA-125 и HE4 крови в общей группе пациенток;
Г–Е) – для группы LGSC; Ж–И) – для группы HGSC
Fig. 2. A–C) Scatterplots of EpCAM+CD45+ cells in ascitic fluid, blood CA-125 and HE4 values of all patients; D–F) – of LGSC patients; G–I) – of HGSC patients
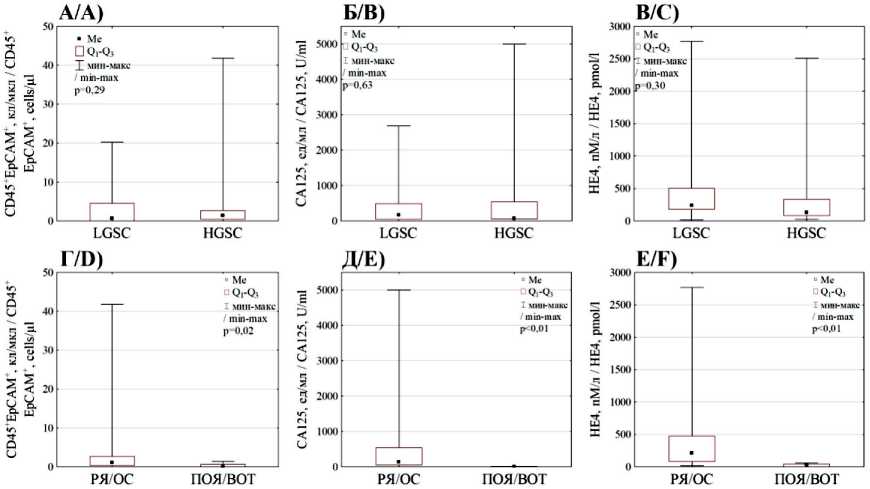
Рис. 3. А–В) ‒ диаграммы размаха значений EpCAM+CD45+ клеток асцитической жидкости, CA-125 и HE4 крови между пациентками с LGSC и HGSC; Г–Е) – между пациентками с серозными карциномами яичников (РЯ) и пограничными новообразованиями (ПОЯ)
Fig. 3. A–C) Boxplot of EpCAM+CD45+ cells in ascitic fluid, blood CA-125 and HE4 values between the LGSC and HGSC patients; D–F) Boxplot of EpCAM+CD45+ cells in ascitic fluid, blood CA-125 and HE4 values between the ovarian cancer patients and borderline ovarian tumors
не было (p=0,29), как и для концентрации СА125 (p=0,63) и HE4 (p=0,30) (рис. 3 А–В). По сравнению с пациентками, у которых выявлена серозная карцинома яичников, концентрации гибридных клеток, СА125 и HE4 у больных ПОЯ снижены в разы (p=0,02; p<0,01 и p<0,01 соответственно) (рис. 3 Г–Е).
Обсуждение
Основным достижением представленного исследования стало обнаружение сильной связи между количеством EpCAM+CD45+ клеток и концентрацией онкомаркеров в группе больных LGSC. Роль гибридных клеток в патогенезе рака до конца не изучена. Большинство авторов склоняются к мнению, что появление EpCAM+CD45+ клеток в больших количествах является плохим прогностическим фактором, прямо связанным со стадией заболевания и выживаемостью. Ряд работ показывает их способность к быстрому делению, активной инфильтрации тканей и к образованию метастазов [11, 13, 15, 16]. Однако описание различных популяций гибридных клеток наводит на мысль, что не все гибриды могут участвовать в метастазировании. Более того, в настоящем исследовании вполне могли быть обнаружены здоровые макрофаги с поглощенным содержимым раковых клеток вместе с их маркерами. В пользу этого свидетельствует отсутствие корреляции между концентрациями гибридов и онкомаркеров в случаях HGSC. Активный рост опухоли вызван быстрым делением раковых клеток. В условиях ограниченного объема среди них неизбежно начинается «естественный отбор», приводящий к гибели множества наименее приспособленных клеток [17]. Их компоненты выходят в кровь и асцитическую жидкость, где и поглощаются макрофагами. Однако процесс отбора наиболее жизнеспособного клона случаен. В одном случае может происходить активная наработка клонов, когда в другом первоначальный клон уже максимально приспособлен к существованию, и отбор нового не происходит. Поэтому концентрация EpCAM+CD45+ клеток в случае HGSC подвержена сильным флуктуациям. На данный процесс также влияют и внешние факторы в виде недостатка питательных веществ, гипоксии и активности противоопухолевого иммунитета [17], которые также подвержены частым, случайным изменениям в условиях активно растущей опухолевой массы. В случае же LGSC опухоль растет медленнее, активность деления клеток ниже, а случаи клеточной гибели – реже. Поэтому здесь гибридные клетки в большей степени представлены структурами, образованными в результате непосредственного клеточного слияния, количество которых прямо зависит от размера опухолевой массы, как и уровни онкомаркеров. Теорию присутствия нескольких популяций атипичных/гибридных клеток также подкрепляет факт наличия нескольких облаков сигналов EpCAM+CD45+ клеток на скаттерограм-мах проточного цитофлуориметра (рис. 1). Из этого также можно сделать вывод, что популяции гибридов отличаются по степени экспрессии Ep-CAM и CD45.
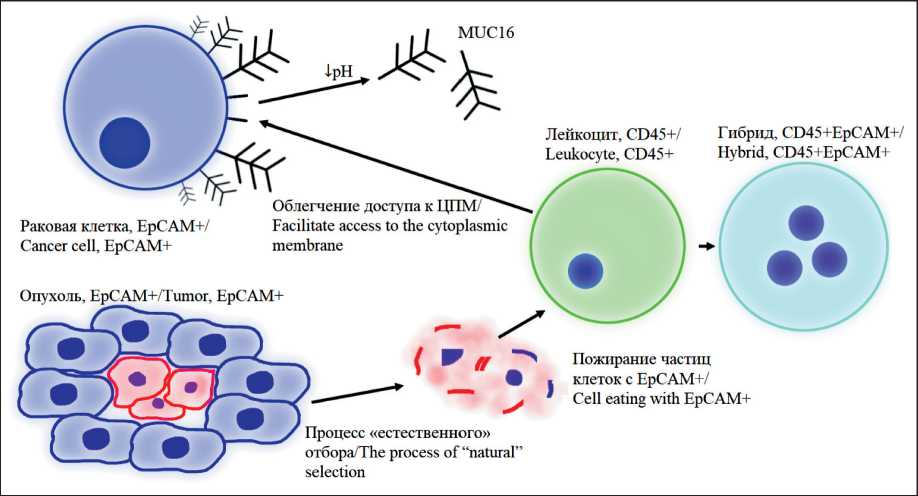
Рис. 4. Схематическое представление теории образования гибридных клеток, предложенных в данной работе Fig. 4. Schematic representation of hybrid formation theories proposed in this work
В настоящем исследовании корреляция между количеством EpCAM+CD45+ клеток в асцитической жидкости и уровнем HE4 в крови больных HGSC не найдена. Однако обнаружена корреляция между гибридами и СА125 в общей группе больных и в группе HGSC на уровне тенденции. Структура MUC16 включает в себя домены SEA, способные разрушаться в кислой среде. При этом муцин отсоединяется от поверхности клетки, после чего способен попасть в кровоток [18]. Поскольку концентрация СА125 линейно зависит от количества EpCAM+CD45+ клеток, можно предположить, что кислая среда, создаваемая опухолевой массой, является фактором, стимулирующим процесс клеточного слияния [19]. Прямое повреждение элементов гликокаликса (такого как MUC16) при низком pH открывает билипидный слой мембраны раковой клетки для прямого контакта с макрофагом [19]. Кроме того, отсутствие MUC16 на поверхности клетки стимулирует EMT, что повышает доступность раковых клеток для лейкоцитов [20]. Кислая среда активирует MMP9, положительное влияние которой на процесс гибридизации доказано на клетках рака молочной железы [21]. Другим доказанным фактором клеточного слияния является гипоксия [22], неразрывно связанная со снижением pH внеклеточной среды. Для точного установления роли кислой среды опухоли в механизме клеточного слияния требуется провести дополнительные исследования. Схемы обеих теорий представлены на рис. 4.
Обнаруженные нами корреляции между количеством EpCAM+CD45+ клеток асцитической
Список литературы EPCAM+CD45+ клетки в асцитической жидкости больных новообразованиями яичников: связь с уровнями онкомаркеров и степенью злокачественности
- Penet M.F., Krishnamachary B., Wildes F.B., Mironchik Y., Hung C.F., Wu T.C., Bhujwallan Z.M. Ascites Volumes and the Ovarian Cancer Microenvironment. Front Oncol. 2018; 8: 595. https://doi.org/10.3389/fonc.2018.00595.
- Stepanov I.V., Paderov Yu.M., Afanas'ev S.G. Peritoneal'nyi kantseromatoz. Sibirskii onkologicheskii zhurnal. 2014; 5: 45-53.
- Rheinländer A., Schraven B., Bommhardt U. CD45 in human physiology and clinical medicine. Immunol Lett. 2018; 196: 22-32. https://doi.org/10.1016/j.imlet.2018.01.009.
- Huang L., Yang Y., Yang F., Liu S., Zhu Z., Lei Z., Guo J. Functions of EpCAM in physiological processes and diseases (Review). Int J Mol Med. 2018; 42(4): 1771-85. https://doi.org/10.3892/ijmm.2018.3764.
- Kaigorodova E.V., Savelieva O.E., Tashireva L.A., Tarabanovskaya N.A., Simolina E.I., Denisov E.V., Slonimskaya E.M., Choynzonov E.L., Perelmuter V.M. Heterogeneity of Circulating Tumor Cells in Neoadjuvant Chemotherapy of Breast Cancer. Molecules. 2018; 23(4): 727. https://doi.org/10.3390/molecules23040727.
- Kaigorodova E.V., Kovalev O.V., Chernyshova A.L., Vtorushin S.V., Shpileva O.V. Geterogennost' EpCAM-polozhitel'nykh kletok v astsiticheskoi zhidkosti low-grade seroznoi kartsinomy yaichnikov: klinicheskii sluchai. Opukholi zhenskoi reproduktivnoi sistemy. 2021; 17(4): 90-5. https://doi.org/10.17650/1994-4098-2021-17-4-90-95.
- Kaigorodova E.V., Fedulova N.V., Ochirov M.O., Dyakov D.A., Molchanov S.V., Chasovskikh N.Yu. Dissimilar tumor cell populations in ascitic fluid of ovarian cancer patients. Bulletin of Siberian Medicine. 2020; 19(1): 50-8. https://doi.org/10.20538/1682-0363-2020-1-50-58.
- Kaigorodova E.V., Kozik A.V., Zavaruev I.S., Grishchenko M.Y. Hybrid/Atypical Forms of Circulating Tumor Cells: Current State of the Art. Biochemistry (Moscow). 2022; 87(4): 380-90. https://doi.org/10.1134/S0006297922040071.
- Adams D.L., Martin S.S., Alpaugh R.K., Charpentier M., Tsai S., Bergan R.C., Ogden I.M., Catalona W., Chumsri S., Tang C.M., Cristofanilli M. Circulating giant macrophages as a potential biomarker of solid tumors. Proc Natl Acad Sci USA. 2014; 111(9): 3514-9. https://doi.org/10.1073/pnas.1320198111.
- Dietz M.S., Sutton T.L., Walker B.S., Gast C.E., Zarour L., Sengup-ta S.K., Swain J.R., Eng J., Parappilly M., Limbach K., Sattler A., Burlingame E., Chin Y., Gower A., Mira J.L.M., Sapre A., Chiu Y.J., Clayburgh D.R., Pommier S.J., Cetnar J.P., Fischer J.M., Jaboin J.J., Pommier R.F., Sheppard B.C., Tsikitis V.L., Skalet A.H., Mayo S.C., Lopez C.D., Gray J.W., Mills G.B., Mitri Z., Chang Y.H., Chin K., Wong M.H. Relevance of circulating hybrid cells as a non-invasive biomarker for myriad solid tumors. Sci Rep. 2021; 11(1). https://doi.org/10.1038/s41598-021-93053-7.
- Gast C.E., Silk A.D., Zarour L., Riegler L., Burkhart J.G., Gustafson K.T., Parappilly M.S., Roh-Johnson M., Goodman J.R., Olson B., Schmidt M., Swain J.R., Davies P.S., Shasthri V., Iizuka S., Flynn P., Watson S., Korkola J., Courtneidge S.A., Fischer J.M., Jaboin J., Billingsley K.G., Lopez C.D., Burchard J., Gray J., Coussens L.M., Sheppard B.C., Wong M.H. Cell fusion potentiates tumor heterogeneity and reveals circulating hybrid cells that correlate with stage and survival. Sci Adv. 2018; 4(9). https://doi.org/10.1126/sciadv.aat7828.
- Adams D., Adams D.K., Lin S.H., Cristofanilli M., Bergan R.C., Marks J.R., Martin S.S., Chumsri S., Ho T.H., Lapidus R.G., Tsai S., Tang Ch.M., Alpaugh R.K. Cancer-associated macrophage-like cells as prognostic indicators of overall survival in a variety of solid malignancies. J Clin Oncol. 2017; 35(15): 11503. https://doi.org/10.1200/JCO.2017.35.15_suppl.11503.
- Manjunath Y., Porciani D., Mitchem J.B., Suvilesh K.N., Avella D.M., Kimchi E.T., Staveley-O’Carroll K.F., Burke D.H., Li G., Kaifi J.T. Tumor-Cell-Macrophage Fusion Cells as Liquid Biomarkers and Tumor Enhancers in Cancer. Int J Mol Sci. 2020; 21(5): 1872. https://doi.org/10.3390/ijms21051872.
- Kaigorodova E.V., Ochirov M.O., Molchanov S.V., Rogachev R.R., D'yakov D.D., Chernyshova A.L., Shpileva O.V., Kovalev O.V., Vtorushin S.V. Razlichnye populyatsii EpSam-polozhitel'nykh kletok v astsiticheskoi zhidkosti u bol'nykh rakom yaichnikov: svyaz' so stepen'yu kantseromatoza. Byulleten' sibirskoi meditsiny. 2021; 20(2): 44-53. https://doi.org/10.20538/1682-0363-2021-2-44-53.
- Hass R., von der Ohe J., Dittmar T. Hybrid Formation and Fusion of Cancer Cells In Vitro and In Vivo. Cancers (Basel). 2021; 13(17): 4496. https://doi.org/10.3390/cancers13174496.
- Reduzzi C., Vismara M., Gerratana L., Silvestri M., De Braud F., Raspagliesi F., Verzoni E., Di Cosimo S., Locati L.D., Cristofanilli M., Daidone M.G., Cappelletti V. The curious phenomenon of dual-positive circulating cells: Longtime overlooked tumor cells. Semin Cancer Biol. 2020; 60: 344-50. https://doi.org/10.1016/j.semcancer.2019.10.008.
- McGranahan N., Swanton C. Clonal heterogeneity and tumor evolution: past, present, and the future. Cell. 2017; 168(4): 613-28. https://doi.org/10.1016/j.cell.2017.01.018.
- Aithal A., Rauth S., Kshirsagar P., Shah A., Lakshmanan I., Junker W.M., Jain M., Ponnusamy M.P., Batra S.K. MUC16 as a novel target for cancer therapy. Expert Opin Ther Targets. 2018; 22(8): 675-86. https://doi.org/10.1080/14728222.2018.1498845.
- Kato Y., Ozawa S., Miyamoto C., Maehata Y., Suzuki A., Maeda T., Baba Y. Acidic extracellular microenvironment and cancer. Cancer Cell Int. 2013; 13(1): 89. https://doi.org/10.1186/1475-2867-13-89.
- Bastida-Ruiz D., Van Hoesen K., Cohen M. The dark side of cell fusion. Int J Mol Sci. 2016; 17(5): 638. https://doi.org/10.3390/ijms17050638.
- Weiler J., Mohr M., Zänker K.S., Dittmar T. Matrix metalloproteinase-9 (MMP9) is involved in the TNF-α-induced fusion of human M13SV1-Cre breast epithelial cells and human MDA-MB-435-pFDR1 cancer cells. Cell Commun Signal. 2018; 16(1): 14. https://doi.org/10.1186/s12964-018-0226-1.
- Jiang E., Yan T., Xu Z., Shang Z. Tumor Microenvironment and Cell Fusion. Biomed Res Int. 2019. https://doi.org/10.1155/2019/5013592.
- Melzer C., von der Ohe J., Hass R. MSC stimulate ovarian tumor growth during intercellular communication but reduce tumorigenicity after fusion with ovarian cancer cells. Cell Commun Signal. 2018; 16(1): 1-9. https://doi.org/10.1186/s12964-018-0279-1.
- Ramakrishnan M., Mathur S.R., Mukhopadhyay A. Fusion-Derived Epithelial Cancer Cells Express Hematopoietic Markers and Contribute to Stem Cell and Migratory Phenotype in Ovarian Carcinoma. Significance of Hemato-Epithelial Ovarian Cancer Compartment. Cancer Res. 2013; 73(17): 5360-70. https://doi.org/10.1158/0008-5472.CAN-13-0896.
- Akhter M.Z., Sharawat S.K., Kumar V., Kochat V., Equbal Z., Ramakrishnan M., Kumar U., Mathur S., Kumar L., Mukhopadhyay A. Aggressive serous epithelial ovarian cancer is potentially propagated by EpCAM+ CD45+ phenotype. Oncogene. 2018; 37(16): 2089-103. https://doi.org/10.1038/s41388-017-0106-y.
- Gershenson D.M. Management of borderline ovarian tumours. Best Pract Res Clin Obstet Gynaecol. 2017; 41: 49-59. https://doi.org/10.1016/j.bpobgyn.2016.09.012.
- Gizzo S., Berretta R., Di Gangi S., Guido M., Zanni G.C., Franceschetti I., Quaranta M., Plebani M., Nardelli G.B., Patrelli T.S. Borderline ovarian tumors and diagnostic dilemma of intraoperative diagnosis: could preoperative He4 assay and ROMA score assessment increase the frozen section accuracy? A multicenter case-control study. BioMed Research International. 2014. https://doi.org/10.1155/2014/803598.
- Messalli E.M., Grauso F., Balbi G., Napolitano A., Seguino E., Torella M. Borderline ovarian tumors: features and controversial aspects. Eur J Obstet Gynecol Reprod Biol. 2013; 167(1): 86-9. https://doi.org/10.1016/j.ejogrb.2012.11.002.


