Ермохимические исследования гидрофобного взаимодействия в системе вода — ПАВ — наполнитель
Автор: Нифталиев Сабухи Ильич, Прокофьева Лариса Анатольевна, Лыгина Лариса Валерьевна, Перегудов Юрий Семенович
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Фундаментальная и прикладная химия, химическая технология
Статья в выпуске: 3 (53), 2012 года.
Бесплатный доступ
Проведены калориметрические исследования тепловых эффектов взаимодействия гидрофобных карбонатных наполнителей на основе природного и химически осажденного мела с водой. Показано, что энтальпия взаимодействия и время процесса зависят от количества и природы гидрофобного агента. Определен наполнитель, который в меньшей степени взаимодействует с водой.
Гидрофобный карбонатный наполнитель, мел химически осажденный
Короткий адрес: https://sciup.org/14039865
IDR: 14039865 | УДК: 541.115
Текст научной статьи Ермохимические исследования гидрофобного взаимодействия в системе вода — ПАВ — наполнитель
Для улучшения эксплуатационных характеристик строительных и лакокрасочных материалов, сохранения устойчивости покрытий к атмосферным воздействиям и технологических параметров переработки полимеров широко используются гидрофобные наполнители. Модифицирование поверхности с помощью ПАВ позволяет качественно менять характер контактного взаимодействия воды с твердым телом. В связи с этим представляет интерес изучение взаимодействия гидрофобных карбонатных наполнителей с водой.
Объектами исследования являлись карбонатные гидрофобные наполнители марок Hydro-cal-2 — натуральный измельченный каль цит, полученный из известняка, и Omyacarb 1T-KA — природный тонкоизмельченный карбонат кальция на основе белого мрамора (производство Турция), обработанные стеариновой кислотой ( ω = 1 %). Также в исследовании использовались образцы наполнителей на основе мела химического осажденного (МХО), полученного как побочный продукт при производстве нитроаммофоски (ОАО «Минудобрения» г. Россошь, Воронежская область). В качестве гидрофоби-зующих агентов МХО использовались кислоты
Прокофьева Л.А., 2012
стеариновая ( ω = 1, 2; 3; 5 %), пальмитиновая ( ω = 1 %), олеиновая ( ω = 1 %) и стеарат цинка ( ω = 1 %).
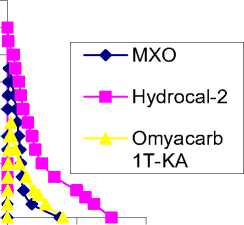
В работе использовался калориметрический метод, который является весьма информативным при изучении процессов в водных системах [1]. Исследования проводились на диф-фер енциальном теплопроводящем микрокалориметр е МИД-200 при 298 К [2]. Методика эксперимента заключалась в следующем. В калориметрический стакан помещали 50 см3 воды, а в лодочку, плавающую на поверхности, 0,5 г гидрофобного наполнителя. После термостатирования в течение 24 ч наполнитель и вода смешивались и регистрировались тепловые эффекты их взаимодействия. Погрешность калориметрических измерений не превышала 2 %. Получены термокинетические кривые, представляющие собой энергию процесса как функцию от времени W = f(T) с ярко выраженным максимумом (рис. 1).
0,016
0,014
0,012
0,01
0,008
0,006
0,004
0,002
0 2?0 g 0 4000
Рис. 1. Термокинетические кривые взаимодействия гидрофобных карбонатных наполнителей с водой
Время достижения максимума тепловыделения (теплопоглощения) возрастает в следующей последовательности наполнителей с массовой долей гидрофобного агента 1 %: MХО((C 17 H 35 COO) 2 Zn) < Hydrocal-2 < MХО(С 17 Н 35 СООН) < MХО(С 17 Н 33 СООН) < MХО(С 15 Н 31 СООН) < Omyacarb 1T-KA. Общее время процесса увеличивается в другой последовательности наполнителей: MХО (С 17 Н 35 СООН) < Omyacarb 1T-KA< MХО ((C 17 H 35 COO) 2 Zn) < Hydrocal-2 < MХО (С 17 Н 33 СООН) < MХО(С 15 Н 31 СООН). Самое большое время взаимодействия с водой наблюдается для образцов наполнителей на основе МХО, обработанного С 17 Н 33 СООН и С 15 Н 31 СООН, 53 и 65 мин (таблица).
Установлено, что взаимодействие с водой наполнителей Hydrocal-2, Omyacarb 1T-KA, MХО с массовыми долями стеариновой кислоты 1, 2, 3, 5 % и стеарата цинка 1 % сопровождается выделением тепла, а MХО, модифицированный пальмитиновой и олеиновой кислотой, — поглощением. При увеличении массовой доли С 17 Н 35 СООН в MХО с 1 до 2 % тепловой эффект резко увеличивается, затем происходит уменьшение его значения с 3 до 5 %. При смешении полярного дисперсного мела с С 17 Н 35 СООН происходит образование адсорбционных слоев, в которых полярные группы – СООН расположены на поверхности твердой фазы, а углеводородные цепи находятся в слое стеариновой кислоты [3]. С ростом массовой доли С 17 Н 35 СООН образуются плотные адсорбционные слои , существенно меняющие свойства поверхности карбоната кальция.
Таблица
Результаты калориметрических измерений
|
Наполнитель - ΠAB |
Mас-совая доля ПАВ в напо лни-теле, % |
Время достижения максимума тепло-выделения, с |
Общее время про-цес-са, с |
Энталь таль-пия процесса, Дж\г |
|
МХО - C 15 H 31 COOH |
1 |
65 |
3900 |
485 |
|
MХО - С 17 Н 33 СООН |
1 |
50 |
3200 |
359 |
|
МХО – (C 17 H 35 COO) 2 Zn |
1 |
9 |
1890 |
-128 |
|
Hydrocal-2 - С 17 Н 35 СООН |
1 |
17 |
3000 |
-374 |
|
Omyacarb1T-KA -С 17 Н 35 СООН |
1 |
73 |
1600 |
-179 |
|
MХО - С 17 Н 35 СООН |
1 |
44 |
1500 |
-114 |
|
MХО - С 17 Н 35 СООН |
2 |
134 |
4300 |
-1258 |
|
MХО - С 17 Н 35 СООН |
3 |
108 |
3600 |
-880 |
|
MХО - С 17 Н 35 СООН |
5 |
137 |
3640 |
-807 |
При ω стеариновой кислоты 2, 3, 5 % на поверхности мела, уже покрытой монослоем, начинается образование противоположно ориентированного второго слоя, т.е. углеводородные радикалы С 17 Н 35 СООН ориентированы к таким же радикалам, а полярные группы находятся в воде. Увеличение полярных групп –СООН приводит к росту числа их взаимодействия с водой, что сопровождается выделением тепла.
Суммарный тепловой эффект взаимодействия (Δ m H 298 ) наполнителей с водой складывается из тепловых эффектов нескольких параллельно протекающих процессов: растворения, гидратации, взаимодействия частиц с водой и энергетической составляющей того, что гидрофобные частицы наполнителей в растворителе нарушают образуемую молекулами воды пространственную сетку прочных водородных связей и др.
Было проведено калориметрическое из-мер ение теплового эффекта взаимодействия
ФестникФГУИТ, № 3, 2012
негидрофобного карбоната кальция с водой, значение которого было сравнимо с погрешностью прибора. Поэтому величиной вклада этого взаимодействия в суммарный эффект можно пренебречь.
Причиной гидрофобного взаимодействия является большая энергия водородной связи между молекулами воды, которая превосходит энергию их взаимодействия с неполярными молекулами жирных кислот. Термодинамическая невыгодность контакта воды с жирными кислотами и обусловливает сильное притяжение их молекул друг к другу. Внедрение неполярной молекулы ПАВ в воду невозможно без нарушения образуемой молекулами воды пространственной сетки прочных водородных связей. Для этого требуется значительная затрата работы, т.е. повышается свободная энергия системы. В результате неполярные молекулы жирных кислот в воде начинают притягиваться, поскольку при их сближении термодинамически невыгодный контакт с водой в той или иной степени устраняется, и свободная энергия системы понижается [4] .
На энтальпию взаимодействия наполнителя с водой влияет природа ПАВ: молярная масса, строение молекулы, плотность, температура плавления, растворимость в воде и т.д. Как видно из рис. 2, с увеличением молярной массы гидрофобного агента энтальпия процесса уменьшается. При этом наблюдается переход из эндотермической области в экзотермическую. Поглощение тепла можно объяснить тем, что олеиновая и пальмитиновая кислота образует более плотные слои, которые полностью экранируют поверхность мела, а также что их молекулы разупорядочивают структурированную воду в большей степени, чем стеариновая кислота и стеарат цинка. С уменьшением величины (AmH298) гидрофобность понижается. Высшее значение гидрофобности проявляется у пальмитиновой кислоты, так как она имеет самую маленькую молярную массу 256 г/моль, а меньшее - у стеарата цинка (молярная масса 632 г/моль).
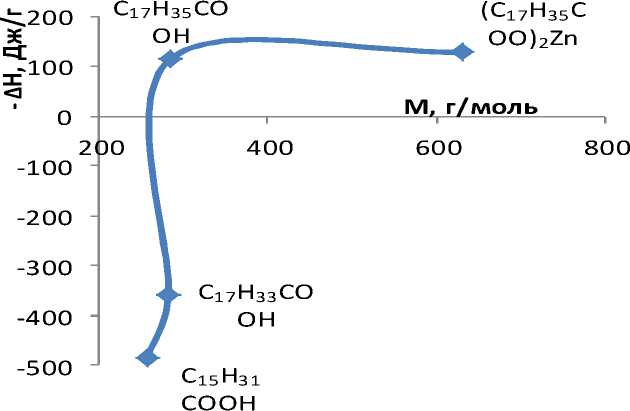
Рис. 2. Зависимость энтальпии процесса от молярной массы гидрофобного агента
Строение молекул насыщенных и ненасыщенных жирных кислот также должно влиять на величину (A mH298). В молекуле стеариновой кислоты двойные связи между соседними ато мами углерода отсутствуют, что является следствием подвижности углеводородной цепи. Молекула стеариновой кислоты может вытянуться в ленту, а может свернуться в компактный клубок. В молекуле олеиновой кислоты имеется одна двойная связь, что заметно влияет на ее форму (рис.3). Поскольку свободное вращение вокруг двойной связи невозможно, углеводородная цепь менее подвижна, чем цепь молекулы стеариновой кислоты и не может скручиваться в клубок [5]. Это говорит о том, что олеиновая кислота наиболее плотно прилегает к частице мела и препятствует взаимодействию воды с ней. Различная структура молекул жирных кислот образует разные по величине и плотности поверхностные слои на частицах карбоната кальция.

Рис. 3. Структурные формулы стеариновой и олеиновой кислот
Проведенные калориметрич еские исследования показали, что природа мела и гидрофобного агента влияют на величину и знак энтальпии процесса взаимодействия наполнителя с водой. Мел синтетического происхождения (МХО), обработанный ПАВ, по величине (Δ m H 298 ), меньше взаимодействует с водой , чем мел природного происхождения (Hydrocal-2, Omyacarb 1T-KA) (таблица), что позволяет его использовать в качестве дешевого гидрофобного наполнителя, превосходящего по водоотталкивающим свойствам природные аналоги.
Химич еское модифицирование поверхности карбонатного наполнителя за счет введения в систему ПАВ изменяет характер взаимодействия на межфазной поверхности. В зависимости от пр ироды и количества ПАВ возможна частичная или полная гидрофобизация наполнителей. Регулирование гидрофобности позволяет управлять свойствами поверхностей и дисперсных систем, что широко используется во многих областях техники и технологии.


