Есть ли место для минимально инвазивных технологий лечения рака предстательной железы?
Автор: Лепор Герберт
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Рак предстательной железы, рак почки
Статья в выпуске: 2-3, 2011 года.
Бесплатный доступ
Рак простаты, скрининг, малоинвазивные технологии
Короткий адрес: https://sciup.org/142187825
IDR: 142187825
Текст статьи Есть ли место для минимально инвазивных технологий лечения рака предстательной железы?
Есть ли место для минимально инвазивных технологий лечения рака предстательной железы?
Герберт Лепор профессор медицинского центра Langone (Нью-Йорк, США)
ема минимально инвазивных технологий звучит необычно из уст хирурга, который выполнил более 4000 оперативных вмешательств по поводу рака предстательной железы (РПЖ). Однако, несмотря на имеющийся «золотой стандарт» в виде радикальной простатэктомии, нельзя отрицать появления новых эффективных методов лечения РПЖ. Сегодня, с одной стороны, у нас есть хирургия и лучевая терапия, а с другой – растущий интерес к активному наблюдению. Но уже сейчас понятно, что между ними появилась новая, третья группа альтернативных методов.
Итак, что подразумевается под минимально инвазивными абля-тивными технологиями (МИАТ)? Прежде всего, это методы, использующие для лечения злокачествен-
Таблица 1. Аблятивные технологии лечения РПЖ
|
Технология |
Производитель |
|
Криоабляция |
HealthTronics |
|
Galil |
|
|
Высокоинтенсивный фокусированный ультразвук (HIFU) |
USHIFU |
|
EDAP |
|
|
Фотодинамическая терапия |
Steba |
|
LightSciences |
|
|
Лазерная терапия |
Visualase |
|
Биполярная радиочастотная абляция |
Trod |
ного процесса физические свойства энергии. Аблятивная технология предполагает доставку того или иного вида воздействия к очагу как, например, при HIFU и криоабляции. Во-вторых, эти методы могут быть выполнены в амбулаторных условиях. В-третьих, у них должно быть меньше осложнений, чем у стандартных видов лечения.
Потенциальные преимущества малоинвазивных технологий совершенно ясны. Они определяются следующими характеристиками:
-
• таргетное, в том числе фокальное лечение опухолей;
-
• возможность повторения процедуры при наличии признаков недостаточной успешности предыдущей;
-
• амбулаторное лечение и, следовательно, снижение его стоимости;
-
• меньшая травма, в том числе близлежащих органов;
Is there а place for minimally invasive treatment option in prostate cancer management?
Herbert Lepor
-
• стимуляция противоопухолевого иммунного ответа после абля-тивных вмешательств.
В таблице 1 представлены доступные в настоящее время абля-тивные технологии лечения РПЖ.
Когда мы говорим о месте минимально инвазивных технологий при лечении РПЖ, можно выделить следующие направления.
-
1. Альтернатива активному наблюдению для пациентов низкого риска (например, в США таких пациентов больше всего). По мнению многих американских урологов, это наилучший шанс для минимально инвазивных технологий проявить себя.
-
2. Минимально инвазивные аблятивные технологии как альтернатива хирургии или лучевой терапии.
-
3. Минимально инвазивные аблятивные технологии как альтернатива спасительной простатэктомии, которая сопряжена с большим количеством осложнений.
В настоящее время в арсенале урологов есть много различных методов лечения РПЖ: активное
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №2-3 2011 наблюдение, РПЭ, лучевая терапия (дистанционная и брахитерапия), а теперь и МИАТ – как имеющие право на существование. Задача уролога, занимающегося проблемой РПЖ, состоит в том, чтобы вылечить заболевание, снизить количество осложнений и сохранить пациенту качество жизни. Перед пациентом также стоит нелегкая дилемма – или умереть от рака, или страдать от осложнений и побочных эффектов лечения. Наша задача – найти такой вид лечения, который позволит вылечить рак с минимальным количеством побочных эффектов.
Результаты масштабного исследования скрининга РПЖ (PLCO) показали, что скрининг не улучшает выживаемость (Salomon L., 2010). Этот главный вывод был представлен широкой общественности (Studer U.E., 2010). Тем не менее, у этого исследования есть обсуждаемые недостатки: короткий (7 лет) период наблюдения, не совсем адекватные критерии включения и исключения. К тому же, многие из участвовавших в исследовании мужчин не получали никакого лечения. Еще в нескольких работах можно встретить выводы о том, что люди не умирают от РПЖ низкого риска. Однако все они основаны лишь на 5-7 летних наблюдениях. Станете ли вы отговаривать от лечения 55-летнего пациента, у которого ожидаемая продолжительность жизни еще 25 лет? С другой стороны, порой мы слишком активно лечим РПЖ, но делаем это для того, чтобы не допустить «недолечивания».
С 90-х годов прошлого века, после введения ПСА-скрининга, смертность от РПЖ снизилась. В отличие от PLCO, европейское исследование ESRPC (с более продуманным дизайном) показало 31% снижение смертности от РПЖ благодаря скринингу (Djavan B., 2011). В то же время, частота осложнений РПЭ у опытных хирургов в настоящее время действительно низка. Самым распространенным из них
Таблица 2. Ожидаемая продолжительность жизни американских мужчин
|
Точка отсчета возраст (лет) |
Вероятность выживания (%) |
|||
|
5 лет |
10 лет |
15 лет |
20 лет |
|
|
50 |
96 |
90 |
82 |
71 |
|
55 |
94 |
85 |
74 |
60 |
|
60 |
91 |
79 |
64 |
46 |
|
65 |
87 |
70 |
50 |
29 |
|
70 |
81 |
58 |
34 |
15 |
|
75 |
72 |
42 |
18 |
5 |
является эректильная дисфункция. Также, надо понимать, что смертность – не единственный критерий. Нельзя забывать о системном воздействии злокачественного новообразования на организм, о побочных эффектах, вызываемых консервативной терапией, которые иногда оказывают даже большее влияние на общее состояние пациента, чем РПЭ. Поэтому, когда мы сравниваем разные тактики ведения пациентов с РПЖ, надо думать не только о смертности, но и об осложнениях неизлеченного заболевания.
Я признаю, что из всех прооперированных мною пациентов, половина, возможно, и не умерла бы от рака; у 20% пациентов произошло прогрессирование заболевания; но для 30% больных лечение было успешным и полностью обоснованным. Таким образом, для пациентов, которые получили избыточное лечение в объеме РПЭ, мы могли бы применить МИАТ с меньшим количеством осложнений. В то же время, мы могли бы использовать МИАТ и для тех, кому радикальная простатэктомия была действительно показана. Принципиально важно четко соблюдать критерии отбора пациентов (Callea A., 2010). Это не означает, что для всех пациентов с показаниями к РПЭ можно применять МИАТ, но если методы визуализации позволят четко локализовать опухоль, а патоморфологическое исследование – определить ее агрессивность, можно получить хорошие результаты (Lindner U., 2010).
Малоинвазивные технологии могут применяться при РПЖ низкого риска (Crawford E.D., 2007):
-
• уровне ПСА менее 10 нг/мл;
-
• стадии заболевания T1c-T2a;
-
• показателе Глисона 6 и менее баллов.
После введения скрининга ПСА мы наблюдали увеличение числа случаев РПЖ именно низкого риска.
В США биопсия предстательной железы выполняется пациентам с ПСА более 2,5 нг/мл и не менее чем из 12 точек. Эти пациенты сейчас получают агрессивное лечение, а ведь именно для них могут применяться МИАТ с неменьшим успехом, но меньшим количеством осложнений, чем при стандартных методах лечения. В то же время, если у пациента имеется РПЖ низкого риска, но ожидаемая продолжительность жизни менее 10 лет, его не надо лечить вообще. Я бы рекомендовал агрессивное лечение пациентам только с 15-20-тилетней ожидаемой продолжительностью жизни.
Из 70-летних американцев, 60% имеют 10-летнюю общую продолжительность жизни, а 34% – 15-летнюю (таблица 2). Поэтому нам не стоит сбрасывать со счетов 70-летних пациентов, оставляя их без лечения. Ведь РПЖ даже низкого риска может оказать отрицательное воздействие на сопутствующие заболевания и усугубить их. Не стоит воспринимать РПЖ низкого риска как заболевание без последствий. По данным D`Amico, рецидив заболевания развился у 20% пациентов, перенесших РПЭ по поводу РПЖ низкого риска (таблица 3).
Приведу собственные данные. Опираясь на критерии Carter и Klotz (рисунок 1), по данным первичной биопсии мы ретроспективно
Таблица 3. Результаты РПЭ у пациентов различных категорий риска
|
Риск, категория |
PSA ng/ml |
Глисон |
Клиническая стадия |
10 лет без рецидивов |
|
Низкий |
≤10 |
≤6 |
T1c/T2a |
80 |
|
Средний |
>10 и <20 |
7 |
T2b |
50 |
|
Высокий |
≥20 |
≥8 |
T2c |
33 |
|
D’Amico, Oncology 15;1049, 2001 |
отобрали из всех пациентов перенесших РПЭ тех, которым подошло бы активное наблюдение в качестве тактики лечения, и проанализировали результаты. При патоморфоло-гическом исследовании после РПЭ было выявлено:
-
• показатель Глисона более 7 баллов – в 51% случаев;
-
• объем опухоли, занимающий более 20% органа – у 28,8% пациентов;
-
• экстракапсулярная инвазия опухоли – у 11% мужчин.
Биохимический рецидив в течение 5 лет развился у 17% больных.
Таким образом, представленные данные не дают нам права убеждать пациента в том, что у него действительно заболевание низкого риска и, соответственно, мы не можем предлагать всем пациентам с РПЖ низ-
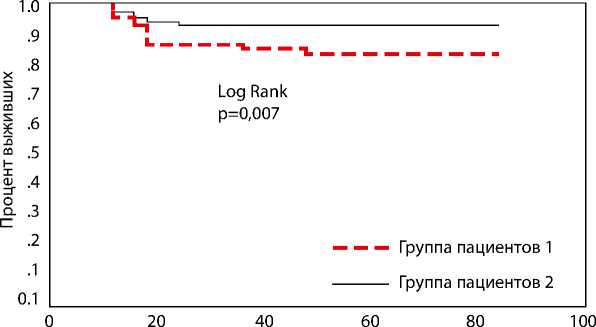
Время наблюдения (мес.)
Рисунок 1. Процент выживших пациентов РПЖ, рандомизированных согласно критериям Klotza (1 группа) и Carter (2 группа)
Таблица 4. Патогистологическое исследование препаратов предстательной железы у пациентов, которые подходили под динамическое наблюдение
|
# at Risk |
12 |
24 |
36 |
48 |
60 |
72 |
84 |
|
Группа 1 |
637 |
407 |
325 |
175 |
116 |
72 |
28 |
|
Группа 2 |
178 |
138 |
107 |
87 |
50 |
27 |
10 |
кого риска активное наблюдение – они будут умирать от РПЖ. Это и происходило до того, как мы начали программу скрининга. С другой стороны, мы не можем лечить их всех агрессивно – у части пациентов это приведет к осложнениям и значительно повлияет на качество жизни. Минимально инвазивные абля-тивные технологии могут проявить себя именно в группе РПЖ низкого риска, так как часть пациентов избегает агрессивного лечения именно из-за боязни осложнений (Callea A., 2010). Также, МИАТ могут быть оптимальным выбором для пациентов желающих сохранить сексуальную функцию.
Канадские ученые провели исследования по сравнению тотальной криоабляции предстательной железы и дистанционной лучевой тера- пии, которые продемонстрировали одинаковую эффективность этих методов лечения РПЖ. Опираясь на эти данные, мы можем рассматривать малоинвазивные технологии как альтернативу лучевой терапии. А в том, что касается спасительных операций пациентам с рецидивом после лучевой терапии, МИАТ так же эффективны, как и РПЭ, но при этом сопряжены с меньшим числом осложнений.
Сложно сказать, какой малоинвазивный метод лучше – фотодинамическая терапия, криоабляция, РЧА или HIFU. Для этого нужно провести, как минимум, 15-летние исследования, результаты которых могут оказаться неоднозначными. Поэтому я не отдаю предпочтение какому-то конкретному методу абляции ткани. Для меня гораздо важнее, что мы уничтожаем, а не как . Я проанализировал все свои простатэктомии, сравнивал вторую, третью и четвертую тысячи операций и сделал вывод, что результаты не отличаются. Опираясь на свой опыт, могу утверждать, что и робот-асисстированные операции не привнесли ничего принципиально нового в лечение РПЖ, кроме прибыли своим разработчикам, не улучшили результаты операций и качество жизни пациентов.
Успех развития и внедрения новых малоинвазивных методик во многом будет зависеть от прогресса технологий визуализации злокачественного процесса и их точности. Также необходимо развивать методики биопсии с применением молекулярного анализа ткани для оценки риска развития заболевания и его прогрессии. Визуализация, малоинвазивные технологии МИАТ, молекулярные стратификаторы риска – очень перспективные направления, которыми необходимо заниматься в ближайшее время во имя достижения единой цели – излечения больных РПЖ с наименьшими осложнениями.


