Фактор роста эндотелия сосудов в качестве потенциального маркера субклинического поражения органов, опосредованного артериальной гипертонией
Автор: Губарева Е.Ю., Губарева И.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 3 т.34, 2019 года.
Бесплатный доступ
Сообщение содержит краткий обзор ключевых исследований, аргументирующий возможность использования васкулоэндотелиального фактора роста в качестве маркера с целью стратификации риска сердечно-сосудистых осложнений (ССО) у больных гипертонической болезнью (ГБ).
Гипертоническая болезнь, сердечно-сосудистый риск, маркеры, фактор роста эндотелия сосудов
Короткий адрес: https://sciup.org/149125321
IDR: 149125321 | УДК: 616.12-008.331.1-06:616.1-018.74-07:616.1/.8 | DOI: 10.29001/2073-8552-2019-34-3-40-44
Текст научной статьи Фактор роста эндотелия сосудов в качестве потенциального маркера субклинического поражения органов, опосредованного артериальной гипертонией
Бессимптомно протекающая гипертоническая болезнь (ГБ) - ключевой фактор риска развития и прогрессирования сердечно-сосудистых осложнений (ССО) [1, 2]. Европейским обществом кардиологов (ESC) и Европейским обществом по гипертонии (ESH) в Рекомендациях по лечению пациентов с артериальной гипертонией (АГ) 2007 г.
был предложен термин «субклиническое поражение органов-мишеней», раннее выявление и своевременная коррекция которого предотвращают прогрессирование заболевания и подвергают его обратному развитию, обеспечивая снижение риска осложнений, преждевременной инвалидизации и смертности у больных ГБ [3].
Эндотелиальная дисфункция, представляющая собой хронический дисбаланс между факторами вазоконстрикции и вазодилатации, играет роль ведущего патогенетического механизма ГБ [1, 4, 5]. Истощение и извращение дилатирующей способности эндотелия с преимущественным ответом на обычные стимулы вазоконстрикцией и пролиферацией сопровождаются ремоделированием сосудистой стенки и нарушением процессов ангиогенеза [1, 5-7], ускоряя развитие атеросклероза и ишемическо-го/реперфузионного поражения [1, 5].
Атеросклероз и ишемическое/реперфузионное повреждение относят к процессам патологического ангиогенеза [4, 8, 9]. Фактор роста эндотелия сосудов, или VEGF-A, в литературе и далее упоминаемый как VEGF, входит в наиболее изученную группу проангиогенных факторов [4, 5, 10-12]. Среди многочисленных представителей семейства VEGF он является наиболее изученным и сильным стимулятором ангиогенеза [4, 8, 10, 13–18], что позволяет рассматривать его в качестве потенциального маркера субклинического поражения органов, опосредованного гипертонией (ПООГ), у больных ГБ.
Пептид семейства белков с цистеиновой петлей VEGF был выделен N. Ferrara и соавт. в 1989 г. [8, 13, 16, 19, 20]. Он стимулирует миграцию, пролиферацию и адгезию эндотелиальных клеток, формирует капилляроподобные структуры в трехмерных гелях [4, 5, 8, 13, 21]. Указанный пептид секретируется эндотелиальными, гладкомышечными, макрофагальными, фибробластными, тромбоцитарными, нейтрофильными и опухолевыми клетками [8, 11, 18].
Ген VEGF локализуется на коротком плече шестой хромосомы и состоит из восьми экзонов, в результате сплайсинга которых VEGF образует изоформы с разным числом аминокислот, составляющих белок [4, 13, 17, 22–24]: VEGF121 и VEGF165 считаются наиболее распространенными [4, 13, 24].
К рецепторам VEGF относят IV класс рецепторных киназ: VEGFR1 (Flt-1), VEGFR2 (KDR, Flk-1) и VEGFR3 (Fit-4) [4, 5,8,10,11], локализующихся преимущественно в эндотелиальных клетках, в меньшем количестве - в мегакариоцитах, моноцитах, нейронах, стволовых гемопоэтических и опухолевых клетках [4, 11, 25].
VEGFR1 связывается с лигандом и димеризуется. Он не оказывает стимулирующего действия на пролиферацию эндотелия [4]. Его функция мало изучена: предполагается, что он, как и его растворимая форма sVEGFR1, препятствует соединению VEGF и VEGFR2, блокирует каскад внутриклеточных реакций, снижает сосудистую проницаемость, уменьшает воспаление и ангиогенез [4, 10, 11, 25, 26].
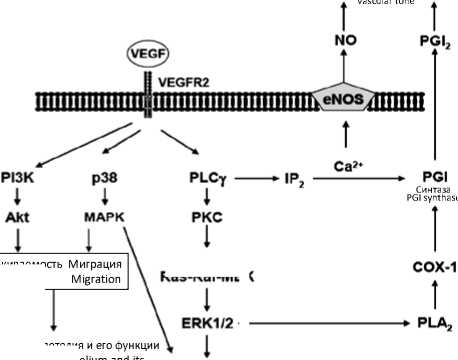
VEGFR2 - основной рецептор, осуществляющий передачу активационного сигнала [5, 10, 25, 26]. Взаимодействуя с VEGF, он фосфорилируется и стимулирует протеин-киназные сигнальные пути внутри клетки [5], рисунок 1.
Активация VEGFR2 увеличивает пролиферацию, миграцию и дифференциацию эндотелиальных клеток, повышает сосудистую проницаемость, поддерживает провоспалительные сдвиги, ассоциированные с неоангиогенезом и атеросклерозом, мобилизует эндотелиальные клетки-предшественницы костного мозга [4, 5, 8, 11,
Сосудистый тонус Vascular tone
PGI synthase
Синтез ДНК DNA synthesis
Целостность эндотелия
Integrity of the endothelium and its function
Ангиогенез
Angiogenesis хххххх
Экспрессия генов Gene expression
Выживаемость Survival
Ras-Raf-MEK
Рис. 1. Взаимодействие рецепторов VEGFR2 с лигандом и сигнальные пути, реализуемые им
Примечание: NO - оксид азота, PGI2 - простациклин, PGI-cин-таза – простациклин синтаза, eNOS – эндотелиальная синтаза оксида азота, PLCγ – фосфолипаза Cγ, IP2 – инозитолтрифосфат, PKC - протеинкиназа C, ERK1/2 - киназа, регулируемая внеклеточными стимулами, p38, MAPK – митоген-активируемая протеинкиназа, PI3-K фосфоинозитид-3-киназа, Akt – протеинкиназа B, СОХ-1 - циклооксигеназа 1, PLA2 - фосфолипаза-2, Ras-; Raf cигнальные белки, MEK – киназа MAPK/ERK. Fig. 1. Interaction of VEGFR-2 with ligand and the associated signaling pathways
Note: NO - nitric oxide; PGI2 - prostacycline; PGI synthase - prostacycline synthase; eNOS – endothelial nitric oxide synthase; PLCγ – phospholipase Cγ; IP2 – inositoltriphosphate; PKC – protein kinase C; ERK1/2 - extracellular signal-regulated kinase; p38, MAPK - mitogen-activated protein kinase; PI3-K – phosphoinositide-3-kinase;
Akt - protein kinase B; СОХ-1 - cyclooxygenase 1; PLA2 - phospholipase-2; Ras, Raf – signaling proteins; MEK – mitogen-activated protein kinase (MAPK/ERK).
-
23, 25, 27, 28]. VEGFR3 участвует в стимуляции лимфоге-неза и является рецептором других изоформ семейства VEGF: VEGF-C и VEGF-D [4, 10, 11]. VEGF и его рецепторы участвуют в формировании сердечно-сосудистой системы в эмбриогенезе и раннем постнатальном периоде: гомозиготные мутации рецепторов, избыток/недостаток VEGF приводят к смерти эмбриона в результате нарушения процессов ангиогенеза и васкулогенеза, что было доказано экспериментальными исследованиями на животных [4].
Во взрослом организме VEGF экспрессируется практически всеми васкуляризованными тканями, что предполагает его участие в поддержании общего сосудистого гомеостаза [5]. Считается, что VEGF необходим для осуществления васкулопротективных эффектов: выживания и формирования эндотелиальных клеток; продукции оксида азота и простациклина, выражаемых вазодилатацией, антитромбозом и подавлением пролиферации гладкомышечных клеток; активизации хемотаксиса и поддержания провоспалительных сдвигов, включая атеросклероз [4, 5, 8, 12, 13, 22, 29, 30].
Гипоксия, воспаление, трансформация структуры клеток под действием механических сил, действие вазоактивных гормонов ангиотензина II и вазопрессина – основные инициирующие продукцию VEGF факторы [4, 5, 8, 18, 25, 28].
Гипоксия стабилизирует фактор, индуцируемый гипоксией (HIF-1α) и образующий с HIF-1βb комплекс, который связывается с регионом гена VEGF и повышает его экспрессию: стимуляция образования VEGF сопровождается независимым повышением экспрессии VEGFR1 и VEGFR2 [4, 28]. Хроническая гипоксия вызывает не только повышение экспрессии VEGF, но и способствует росту плотности капилляров и снижению артериального давления (АД) [4].
Физическая нагрузка усиливает кровоток, напряжение сдвига и трансформацию эндотелиальных клеток. Повышение напряжения сдвига, или силы, прикладываемой к верхнему слою ламинарно текущей жидкости, вызывающей смещение нижележащих слоев относительно друг друга в направлении прикладываемой силы, запускает инвагина-ционный ангиогенез: экстрацеллюлярный матрикс внедряется в просвет микрососуда и расщепляется по его длине. Миграция эндотелиальных клеток в экстраваскулярное пространство при тканевой гипоксии способствует формированию новых капилляров со своей мембраной и перицитами путем почкования [11]. Обе формы ангиогенеза сопровождаются повышением концентрации VEGF и VEGFR2.
VEGF участвует не только в формировании нормальных сосудов, но и в их созревании и выживании, а также регуляции АД. Длительное снижение концентрации или блокада взаимодействия VEGF с рецепторами сопровождаются ухудшением выживаемости эндотелиальных клеток, уменьшением терминальных артериол и капилляров тканей, повышением АД [4, 5]. Инфузия VEGF за счет вазодилатации и рефлекторного повышения частоты сердечных сокращений снижает АД [4, 5, 31, 32].
Генетические исследования подтверждают участие VEGF в патогенезе ГБ и ПООГ [4, 5, 32–34]: носительство аллеля 116A в области промотора гена VEGF взаимосвязано с развитием ГБ, микроальбуминурии и микрососу-дистых осложнений [5, 33, 34].
У больных ГБ отмечается снижение плотности микрососудов и их недостаточный рост [4, 5, 12, 35–37], что может быть связано с их деструкцией или недостаточным ангиогенезом. Учитывая cтимулирующую ангиогенез роль VEGF, можно предположить уменьшение его экспрессии или увеличение концентрации его антагониста sVEGFR1. Однако клиническими и экспериментальными исследованиями выявлено повышение концентраций VEGF, коррелирующее с величиной АД, шкалой сердечно-сосудистого риска, ранним микрососудистым поражением и ПООГ [4, 5, 12, 37].
-
У больных ГБ увеличение концентрации VEGF взаимосвязано с механическим воздействием на мезангиальные клетки и взаимодействием ангиотензина II с
Список литературы Фактор роста эндотелия сосудов в качестве потенциального маркера субклинического поражения органов, опосредованного артериальной гипертонией
- Кобалава Ж.Д., Котовская Ю.В., Моисеев В.С. Артериальная гипертония. Ключи к диагностике и лечению. М.: ГЭОТАР-Медиа; 2009:864.
- Кобякова О.С., Несветайло Н.Я., Ефимова Е.В., Бойков В.А. Электронный регистр больных артериальной гипертонией в Томской 40-44 области. Бюллетень сибирской медицины. 2012;3:154-160.
- Mancia G., de Backer G., Dominiczak A., Cifkova R., Fagard R., Germano G. et al. 2007 Guidelines for the management of arterial hypertension: the task force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J. Hypertens. 2007;25(6):1105-1187.
- Мангилёва Т.А. Система сосудистого эндотелиального фактора роста и артериальная гипертензия. Серце i судини. 2012;4:107-115.
- Ferroni P., Della-Morte D., Palmirotta R., Rundek T., Guadagni F., Roselli M. Angiogenesis and hypertension: the dual role of anti-hypertensive and anti-angiogenic therapies. Curr. Vasc. Pharmacol. 2012;10(4):479-493.
- Хаишева Л.А., Шлык С.В., Плескачев А.С., Макаренко Е.С. Сосудистое ремоделирование при артериальной гипертонии: особенности ангиогенеза. Клиницист. 2012;1:26-30.
- Недогода С.В., Чаляби Т.А., Цома В.В., Барыкина И.Н., Мазина Г.В., Ледяева А.А. и др. Возможности препарата Эксфорж и его комбинации с флувастатином в улучшении сосудистой эластичности у пациентов с артериальной гипертензией и высоким риском развития сердечно-сосудистых осложнений. Consilium Medicum. 2009;11(5):37-42.
- Peach C.J., Mignone V.W., Arruda M.A., Alcobia D.C., Hill S.J., Kilpatrick L.E. et al. Molecular pharmacology of VEGF-A isoforms: binding and signalling at VEGFR2. Int. J. Mol. Sci. 2018;19(4):E1264.
- DOI: 10.3390/ijms19041264
- Iruela-Arispe M.L., Zovein A. Angiogenesis. Fetal and Neonatal Physiology. 2017;85-89:e2.
- DOI: 10.1016/b978-0-323-35214-7.00008-1
- Shibuya M. VEGFR and type-V RTK activation and signaling. Cold Spring Harb. Perspect. Biol. 2013;5:a009092.
- DOI: 10.1101/cshperspect.a009092
- Wu F.T., Stefanini M.O., Mac Gabhann F., Kontos C.D., Annex B.H., Popel A.S. A systemic biology perspective on sVEGFR1: its biological function, pathogenic role & therapeutic use. Journal of Cellular and Molecular Medicine. 2010;14:528-552.
- Stumpf C., Jukic J., Yilmaz A., Raaz D., Schmieder R.E., Daniel W.G. et al. Elevated VEGF-plasma levels in young patients with mild essential hypertension. Eur. J. Clin. Invest. 2009;39(1):31-36.
- DOI: 10.1111/j.1365-2362.2008.02056.x
- Коваль С.Н., Снегурская И.А., Мысниченко О.В. Cемейство васкулоэндотелиального фактора роста и его возможная роль в патогенезе артериальных гипертензий. Артериальная гипертензия. 2012;4(24):36-41.
- Fearnley G.W., Odell A.F., Latham A.M., Mughal N.A., Bruns A.F., Burgoyne N.J. et al. VEGF-A isoforms differentially regulate ATF-2-dependent VCAM-1 gene expression and endothelial-leukocyte interactions. Mol. Biol. Cell. 2014;25:2509-2521.
- Yamazaki Y., Matsunaga Y., Tokunaga Y., Obayashi S., Saito M., Morita T. Snake venom vascular endothelial growth factors (VEGF-Fs) exclusively vary their structures and functions among species. J. Biol. Chem. 2009;284:9885-9891.
- Iyer S., Acharya K.R. Tying the knot: The cystine signature and molecular-recognition processes of the vascular endothelial growth factor family of angiogenic cytokines. FEBS Journal. 2011;278:4304-4322.
- Kennedy C.R.J. What type of VEGF do you need? JASN. 2010;21:1410- 1412.
- Schneider B.P., Radovich M., Miller K.D. The role of vascular endothelial growth factor genetic variability in cancer. Clinical Cancer Research. 2009;15:5297-5301.
- Ferrara N. From the discovery of vascular endothelial growth factor to the introduction of avastin in clinical trials - an interview with Napoleone Ferrara by Domenico Ribatti. Int. J. Dev. Biol. 2011;55(4-5):383- 388.
- DOI: 10.1387/ijdb.103216dr
- Ferrara N., Adamis A.P. Ten years of anti-vascular endothelial growth factor therapy. Nature Reviews Drug Discovery. 2016;15:385-403.
- Гавриленко Т.И., Рыжкова Н.А., Пархоменко А.Н. Сосудистый эндотелиальный фактор роста в клинике внутренних заболеваний и его патогенетическое значение. Украинский кардиологический журнал. 2011;4:87-95.
- Pallet N., Thervet E., Timsit M.O. Angiogenic response following renal ischemia reperfusion injury: New players. Prog. Urol. 2014:24:S20-S25.
- Fiedler L. Methods in molecular biology series - VEGF signaling (Springer Protocols). Springer, Humana Press; 2015.
- DOI: 10.1007/978-1-4939-2917-7
- Xu D., Fuster M.M., Lawrence R., Esko J.D. Heparan sulfat regulates VEGF165- and VEGF121- mediated vascular hyperpermeability. J. Biol. Chem. 2011;286:737-745.
- Koch S., Tugues S., Li X., Gualandi L., Claesson-Welsh L. Signal transduction by vascular endothelial growth factor receptors. Biochem. J. 2011;437:169-183.
- Smith G.A., Fearnley G.W., Tomlinson D.C., Harrison M.A., Ponnambalam S. The cellular response to vascular endothelial growth factors requires co-ordinated signal transduction, trafficking and proteolysis. Biosci. Rep. 2015;35:e00253.
- Mac Gabhann F., Qutub A.A., Annex B.H., Popel A.S. Systems biology of pro-angiogenic therapies targeting the VEGF system. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 2010;2:694-707.
- Potente M., Gerhardt H., Carmeliet P. Basic and therapeutic aspects of angiogenesis. Cell. 2011;146(6):873-887.
- DOI: 10.1016/j.cell.2011.08.039
- De Falko S. The discovery of placental growth factor and its biological activity. Expert Reviews in Molecular Medicine. 2012;44:1-9.
- Facemire C.S., Nixon A.B., Griffiths R., Hurwitz H., Coffman T.M. Vascular endothelial growth factor receptor 2 controls blood pressure by regulating nitric oxide synthase expression. Hypertension. 2009;54:652-658.
- Granger J.P. Vascular endothelial growth factor inhibitors and hypertension: a central role for the kidney and endothelial factors? hypertension. 2009;54(3):465-467.
- Palmirotta R., Ferroni P., Ludovici G., Martini F., Savonarola A., D'Alessandro R. et al. VEGF-A gene promoter polymorphisms and microvascular complications in patients with essential hypertension. Clin. Biochem. 2010;43:1090-1095.
- Sobti R.C., Maithil N., Thakur H., Sharma Y., Talwar K.K. VEGF and IL-4 gene variability and its association with the risk of coronary heart disease in north Indian population. Mol. Cell. Biochem. 2010;341:139-148.
- Cheng C., Daskalakis C., Falkner B. Alteration in capillary morphology are found in mild blood pressure elevation. J. Hypertens. 2010;28:2258-2266.
- Prior S.D., Mckenzie M.J., Joseph L.J., Ivey F.M., Macko R.F., Hafer-Macko C.E. et al. Reduced skeletal muscle capillarization and glucose intolerance. Microcirculation. 2009;16:203-212.
- Feihl F., Liaudet L., Waeber B. The macrocirculation and microcirculation of hypertension. Curr. Hypertens. Rep. 2009;11(3):182-189.
- Tsai W.C., Li Y.H., Huang Y.Y., Lin C.C., Chao T.H., Chen J.H. Plasma vascular endothelial growth factor as a marker for early vascular damage in hypertension. Clin. Sci. 2005;109:39-43.
- Haq I.U., Ramsay L.E., Yeo W.W., Jackson P.R., Wallis E.J. Is the Framingham risk unction valid for northern European populations? A comparison of methods for estimating absolute coronary risk in high risk men. Heart. 1999;81:40-46.
- Simons M., Gordon E., Claesson-Welsh L. Mechanisms and regulation of endothelial VEGF receptor signalling. Nature Reviews Molecular Cell Biology. 2016;17:611-625.


