Факторы прогноза у пациентов с гепатоцеллюлярным раком, прогрессирующим после трансплантации печени
Автор: Джанян И.А., Новрузбеков М.С., Олисов О.Д., Бредер В.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Донорство и трансплантация органов и тканей
Статья в выпуске: 2 т.14, 2024 года.
Бесплатный доступ
Введение. Гепатоцеллюлярный рак является наиболее частым первичным злокачественным новообразованием печени, развивающимся на фоне вирусных гепатитов, злоупотребления алкоголем, метаболических нарушений, цирроза печени. Чаще всего гепатоцеллюлярный рак диагностируют на поздних стадиях заболевания, когда пациенты уже не подлежат специфическому лечению. Приоритетным методом лечения ранних стадий остаётся хирургический. При отсутствии цирроза печени или с компенсированным циррозом лучшим вариантом является резекция печени, в остальных случаях проводят ортотопическую трансплантацию печени. Однако при постановке диагноза «гепатоцеллюлярный рак» большинство пациентов выходят за рамки миланских критериев, и мостом к проведению ортотопической трансплантации печени является down-stage терапия. Bridge-терапия используется для лечения гепатоцеллюлярного рака в период ожидания трансплантации печени и направлена на предотвращение прогрессирования стадии. Вероятность прогрессирования гепатоцеллюлярного рака после ортотопической трансплантации печени в течение первых двух лет составляет около 75 % и около 10 % выявляется после четвертого года. Прогрессирование гепатоцеллюлярного рака остаётся главным фактором, ограничивающим продолжительность жизни пациентов после ортотопической трансплантации печени.Цель исследования: оценить результаты противоопухолевого лечения пациентов с прогрессированием гепатоцеллюлярного рака после трансплантации печени.Материалы и методы. Мы оценили результаты лечения 50 пациентов с прогрессированием гепатоцеллюлярного рака после ортотопической трансплантации печени, которые проходили лечение на базе ФГБУ НМИЦ онкологии им. Н.Н. Блохина в период с 2009 по 2020 г. Проанализировали и оценили общую и безрецидивную выживаемости в зависимости от проведения bridge-терапии, типа лечения, наличия сосудистой инвазии и тромбоза воротной вены.Результаты. По результатам bridge-терапии прогрессирование стадии гепатоцеллюлярного рака отмечалось у 9 пациентов, стабилизация - у 17, частичный/полный ответ - у 9 человек. Медиана безрецидивной выживаемости пациентов, которым проводилась bridge-терапия и down-stage терапии, составила 23,6 месяца, среди пациентов, которым не проводилась - 35,6 месяца. Медиана общей выживаемости при проведении хирургического лечения составила 79,8 месяца, тогда как при лучевой терапии - 17,2 месяца.Выводы. У изученной группы пациентов лечение переносилось удовлетворительно. Условием проведения считается оптимизация протокола иммуносупрессии и модификация дозовых режимов системной терапии, что приводит к улучшению отдалённых результатов лечения (общая и безрецидивная выживаемости).
Ортотопическая трансплантация печени, гепатоцеллюлярный рак, цирроз печени, прогрессирование, bridge-терапия, down-stage терапия
Короткий адрес: https://sciup.org/143182958
IDR: 143182958 | УДК: 616.36-006.6:615.849.1: | DOI: 10.20340/vmi-rvz.2024.2.TX.3
Текст научной статьи Факторы прогноза у пациентов с гепатоцеллюлярным раком, прогрессирующим после трансплантации печени
ОРИГИНАЛЬНАЯ СТАТЬЯ
Гепатоцеллюлярный рак (ГЦР) составляет 90 % всех случаев первичного рака печени. Основными факторами риска являются вирусные гепатиты, метаболические (диабет, неалкогольная жировая болезнь печени) и токсические нарушения, болезни обмена веществ [1]. По данным GLOBOCAN заболеваемость раком печени у мужчин составляет 14,1 на 100 тыс. населения, у женщин – 5,2 на 100 тыс. Смертность составляет 12,9 и 4,8 на 100 тыс. населения соответственно. В статистике смертности от рака ГЦР занимает третье место [2]. Это связано с бессимптомным течением на ранних стадиях и жёсткими критериями отбора пациентов для трансплантации печени [3]. Пятилетняя выживаемость при ГЦР составляет 18 % [4–10].
В 2023 году по данным НМИЦ трансплантологии и искусственных органов им. академика В.И. Шумакова в России было выполнено 812 трансплантаций печени, окололо 15 % из них – по поводу ГЦР. Ортотопическая трансплантация печени (ОТП) необходима пациентам уже на ранней стадии ГЦР [11]. По данным разных источников рецидив ГЦР составляет от 16 до 50 % случаев, что связано с расширением критериев отбо- ра пациентов для трансплантации печени. Факторами прогноза являются количество первичных опухолей, наличие макро- и микрососудистой инвазии, уровень альфа-фетопротеина (АФП), размер самого крупного опухолевого очага. Все перечисленные факторы относятся к прогностическим критериям рецидива ГЦР после ОТП [12–18].
Миланские критерии являются международным стандартом отбора пациентов для трансплантации. Они включают в себя следующие условия: наличие одного новообразования размером не более 5 см или наличие до трёх опухолевых очагов, при этом самый большой узел не должен превышать 3 см, без сосудистой инвазии и распространения опухоли за пределы печени. Данные критерии позволили увеличить пятилетнюю выживаемость пациентов до 80 % [21–23].
Большинство пациентов на момент постановки диагноза выходят за пределы данных критериев [9]. В таких случаях показано применение down-stage терапии или терапии понижения стадии, которая позволяет в ряде случаев перевести пациента в рамки миланских критериев. В листе ожидания на ОТП для предотвращения прогрессирования ГЦР проводят bridge- и down-stage терапию. В научных исследованиях описаны разные методы данной терапии: радиоэмболизация Y-90, трансартериальная химиоэмболизация (ТАХЭ), микроволновая, радиочастотная или криоабляция, а также комбинации этих методов [24–28].
Посттрансплантационное прогрессирование ГЦР является основной причиной низкой выживаемости пациентов после ОТП, большинство из них происходит в первые два года наблюдения. Но встречается как раннее прогрессирование, так и позднее [29]. Медиана выживаемости пациентов с прогрессированием после ОТП составляет от 5 до 15 месяцев [30–31].
Вопрос о лечение пациентов с прогрессирующей ГЦР после ОТП остаётся открытым в связи с отсутствием клинических рекомендаций. Это связано с тем, что пациентов после ОТП не включают в клинические исследования. Весь имеющийся опыт основан на отдельных клинических случаях.
Цель исследования: оценить результаты противоопухолевого лечения пациентов с прогрессированием гепатоцеллюлярного рака после трансплантации печени.
Материалы и методы
Проанализированы результаты лечения 50 пациентов с прогрессированием гепатоцеллюлярного рака после ОТП, которые проходили лечение на базе ФГБУ НМИЦ онкологии им. Н.Н. Блохина в период с 2009 по 2020 г.
Описательная статистика представлена в виде наблюдаемого числа (относительная частота) для качественных переменных и медианы (1-й и 3-й квартили) – для количественных. Для сравнения количественных переменных между группами пациентов применялся тест Манна – Уитни, для сравнения качественных переменных – точный тест Фишера. Анализ выживаемости проводился с использованием метода Каплана – Мейера и лог-рангового теста и моделей пропорциональных рисков Кокса.
Результаты
Анализ результатов лечения 50 пациентов с прогрессированием гепатоцеллюлярного рака после ОТП показал следующие результаты. Медиана длительности наблюдения от момента постановки диагноза составила 50,8 (30,2–81,7) месяца, медиана длительности наблюдения от момента ОТП – 34,1 (16–57,7) месяца. Согласно Барселонской классификации у 40 % обследованных установлена стадия A, у 38 % – стадия B и у 22 % – стадия C (первичная). При оценке пациентов для трансплантации печени лишь 42 % подходили под миланские критерии (МК), 58 % соответствовали калифорнийским или выше калифорнийских критериев, что характеризует заведомо неблагоприятную группу с высоким риском про- грессирования. Характеристики пациентов представлены в таблице 1.
У 65,9 % пациентов отмечался тромбоз воротной вены. Медиана безрецидивной выживаемости пациентов с тромбозом составила 21,9 [95 % ДИ: 16,1; 66,5] месяца, среди пациентов без него – 35,6 [95 % ДИ: 23,6; 54,4] месяца.
42 % пациентов подходили под миланские критерии для трансплантации печени, 6 % – под калифорнийские критерии и 52 % – под критерии выше калифорнийских. Медиана безрецидивной выживаемости у пациентов с миланскими критериями составила 44 [95 % ДИ: 32,9; 66,5] месяца, с калифорнийскими критериями – 19,4 [нижняя граница 95 % ДИ: 8,4] месяца, с критериями выше калифорнийских – 20,9 [95 % ДИ: 15,0; 62,3] месяца. Распределение пациентов по стадиям ГЦР представлено в таблице 2.
Медиана безрецидивной выживаемости у пациентов с I стадией составила 34,1 [95 % ДИ: 19,9; 54,4] месяца, со II стадией – 29,2 [нижняя граница 95 % ДИ: 12,9] месяца, с III стадией – 23,6 [95 % ДИ: 16,1; 66,8] месяца, с IV стадией – 10,8 [нижняя граница 95 % ДИ: 10,5] месяца.
По результатам bridge-терапии прогрессирование стадии ГЦР по данным патоморфологического исследования экспланта отмечалось у 9 пациентов, стабилизация – у 17, частичный/полный ответ – у 9 человек. Медиана безрецидивной выживаемости пациентов, которым проводилась bridge-терапия и down-stage терапии, составила 23,6 месяца, среди пациентов, которым терапия не проводилась, – 35,6 месяца (рис. 1).
Стадия опухолевого процесса была выше, и пациенты с down-stage терапией находились дольше в листе ожидания (табл. 3) в связи с проводимым лечением, возможно, это послужило различием выживаемости данных групп.
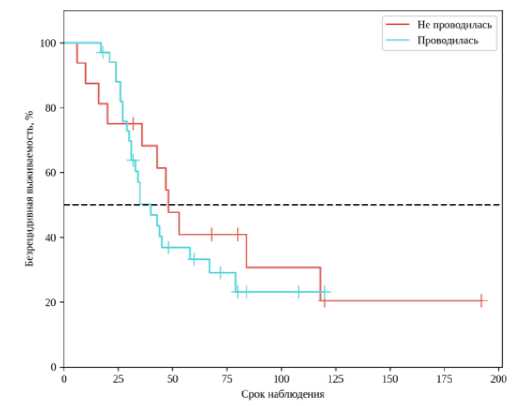
Рисунок 1. Кривая безрецидивной выживаемости в зависимости от проведения bridge-терапии
Figure 1. Recurrence-free survival curve depending on the bridge treatment
Таблица 1. Основные характеристики и их влияние на безрецидивную выживаемость пациентов (БРВ)
Table 1. Main characteristics and their impact on patients' relapse-free survival (RFS)
|
Параметр |
N = 50 |
БРВ, Ме [95 % ДИ] |
||
|
Пол |
||||
|
мужской |
42/50 (84 %) |
43,1 [95 % ДИ: 30,7; 95,5] |
||
|
женский |
8/50 (16 %) |
78,4 [95 % ДИ: 42,1; 90,3] |
||
|
Возраст на момент постановки диагноза |
54 |
(50,5 ‒ 62) |
– |
|
|
Возраст на момент трансплантации |
56 |
(50,5 ‒ 62) |
– |
|
|
Вес, кг |
78,5 (70,5 ‒ 85) |
– |
||
|
Child-Pugh |
||||
|
нет цирроза |
4/49 (8,2%) |
– |
||
|
A |
24/49 (49%) |
56,2 [95 % ДИ: 32,9; 78,3] |
||
|
B |
18/49 (36,7%) |
35,4 [95 % ДИ: 24,7; 95,5] |
||
|
C |
3/49 (6,1%) |
59,0 [95 % ДИ: 54; 98] |
||
|
Bridge-терапия |
||||
|
не проводилась |
15/50 (32 %) |
35,6 [95 % ДИ: 16,1; 82,9] |
||
|
проводилась |
35/50 (68 %) |
23,6 [95 % ДИ: 18,5; 44] |
||
|
Эффект bridge- и down-stage терапии |
||||
|
полный ответ |
2/35 (5,7 %) |
– |
||
|
частичный ответ |
7/35 (21,1 %) |
29,6 [нижняя граница 95 % ДИ: 18,5] |
||
|
стабилизация |
17/35 (48,6 %) |
19,9 [нижняя граница 95 % ДИ: 16,1] |
||
|
прогрессирование |
9/35 (23,7 %) |
28,5 [нижняя граница 95 % ДИ: 19,4] |
||
|
АФП на момент обнаружения ГЦР |
32,9 |
(9,2 ‒ 429,5) |
||
|
до 400 |
34/46 (73,9 %) |
– |
||
|
более 400 |
12/46 (26,1 %) |
– |
||
|
АФП на момент ОТП |
27,0 |
(5,8 ‒ 225,5) |
– |
|
|
до 400 |
38/48 (79,2 %) |
– |
||
|
более 400 |
10/48 (20,8 %) |
– |
||
|
Степень дифференцировки |
||||
|
Gx-G1 |
21/47 (44,7 %) |
– |
||
|
G2-G3 |
26/47 (55,3 %) |
– |
||
|
Микрососудистая инвазия |
27/43 (62,8 %) |
23,6 [95 % ДИ: 19,4; 62,3] |
||
|
Тромбоз в бассейне воротной вены |
27/41 (65,9 %) |
21,9 [95 % ДИ: 16,1; 66,5] |
||
|
Стадия ГЦР на момент ОТП |
||||
|
I |
15/50 (30 %) |
34,1 [95 % ДИ: 19,9; 54,4] |
||
|
II |
14/50 (28 %) |
29,2 [нижняя граница 95 % ДИ: 12,9] |
||
|
III |
18/50 (36 %) |
23,6 [95 % ДИ: 16,1; 66,8] |
||
|
IV |
3/50 (6 %) |
10,8 [нижняя граница 95 % ДИ: 10,5] |
||
|
BCLC |
||||
|
A |
20/50 (40 %) |
78,1 [95 % ДИ: 30,9; 95,1] |
||
|
B |
19/50 (38 %) |
39,3 [95 % ДИ: 26,1; 58,7] |
||
|
C |
11/50 (22 %) |
59 [95 % ДИ: 25,7; 97,5] |
||
|
Критерии ОТП |
||||
|
миланские |
21/50 (42 %) |
44 [95 % ДИ: 32,9; 66,5] |
||
|
калифорнийские |
3/50 (6 %) |
19,4 [нижняя граница 95 % ДИ: 8,4] |
||
|
выше калифорнийских |
26/50 (52 %) |
20,9 [95 % ДИ: 15,0; 62,3] |
||
|
Вирусный гепатит В |
6/50 (14,6 %) |
39,1 [95 % ДИ: 20,3; 58,7] |
||
|
Вирусный гепатит C |
35/50 (85,4 %) |
54,6 [95 % ДИ: 29,1; 129,4] |
||
|
Таблица 2. Распределение пациентов по стадиям ГЦР, которым проводилась bridge-терапия Table 2. Distribution of patients by stage of HCC who received bridge therapy |
Таблица 3. Длительность ожидания ОТП от момента постановки диагноза Table 3. Waiting time for OLT from the moment of diagnosis |
|||
|
Стадия ГЦР на момент ОТП |
Характеристика |
р |
Не проводилась Проводилась bridge и p |
|
|
I |
11/35 (31,4 %) |
bridge и down-терапия |
stage down-stage терапия |
|
|
2,4 (0,9 ‒ 4,5) 11,8 (6,8 ‒ 20,7) < 0,0001* |
||||
|
II |
10/35 (28,6 %) |
0,904 |
||
|
Примечание: * – |
статистически значимые различия (р < 0,05). |
|||
|
III |
11/35 (31,4 %) |
|||
|
IV |
3/35 (8,6 %) |
|||
|
Стадия ГЦР (BCLC – Barcelona Clinic Liver Cancer) |
||||
|
A |
14/35 (40 %) |
|||
|
B |
14/35 (40 %) |
0,823 |
||
|
C |
7/35 (20 %) |
|||
Таблица 4. Характеристика пациентов на момент прогрессирования ГЦР после ОТП
Table 4. Characterization of patients at the time of HCC progression after OLT
|
Показатель |
Абс. / % |
|
Пол |
|
|
мужской |
42 / 50 (84 %) |
|
женский |
8 / 50 (16 %) |
|
bridge-терапия |
|
|
не проводилась |
15 / 50 (32 %) |
|
проводилась |
35 / 50 (68 %) |
|
Лечение рецидива ГЦР |
|
|
хирургическое лечение |
15 / 50 (32,6 %) |
|
лучевая терапия |
19 / 50 (43,2 %) |
|
системная терапия |
41 / 50 (80,4 %) |
|
Побочные эффекты системной терапии |
|
|
наличие |
27 (65,9 %) |
|
отсутствие |
14 (34,1 %) |
|
Дисфункция трансплантата на фоне системной терапии на всех линиях |
|
|
наличие |
10 (24,4 %) |
|
отсутствие |
31 (75,6 %) |
У 32,6 % пациентов с прогрессированием ГЦР проводили хирургическое лечение, 43,2 % – получали лучевую терапию. Медиана общей выживаемости при проведении хирургического лечения составила 79,8 месяца, тогда как при лучевой терапии – 17,2 месяца. Это подтверждает, что хирургическое лечение остаётся приоритетным при прогрессировании ГЦР после ОТП.
Основными органами метастазирования были лёгкие, печень, кости. Большой редкостью при ГЦР является метастазирование в головной мозг, которое было отмечено у 6 % пациентов с прогрессированием после ОТП. Всем пациентам при обнаружении прогрессирования проводилась коррекция иммуносупрессивной (ИС) терапии совместно с трансплантологами. Выполняли снижение доз препаратов до эффективного минимума и добавление к схеме ИС антипролиферативного препарата. Анализ лечения прогрессирования ГЦР после ОТП представлен в таблице 5.
41 (80,4 %) пациент с рецидивом ГЦР получал системную терапию или комбинацию локальной и системной терапии. Препаратами выбора были ингибиторы тирозинкиназы (70,3%) – регорафениб, сорафениб, ленватиниб, кабозантиниб. 24,4 % пациентов проходили курс цитостатической терапии, где основным методом лечения был гемцитабин в сочетании с цисплатином. Вторую линию терапии получили 52,9 % пациентов. Основными препаратами были ингибиторы тирозинкиназы (ИТК). Хирургическое лечение проводилось в 25 % случаев, лучевая терапия – в 29 %. У 50 % пациентов отмечалась стабилизация состояния на фоне проводимой терапии, у 12 % – полный или частичный эффект в ответ на терапию и у 12 % – прогрессирование ГЦР.
Таблица 5. Анализ лечения прогрессирования ГЦР после ОТП Table 5. Analysis of treatment of HCC progression after OLT
|
Показатели |
Категории |
Абс. |
% |
95% ДИ |
|
Радиочастотная аблация на зону рецидива |
Не проводилась |
36 |
97,3 |
85,8–99,9 |
|
Проводилась |
1 |
2,7 |
0,1–14,2 |
|
|
Системная терапия рецидива |
Не проводилась |
8 |
15,7 |
7,0–28,6 |
|
Проводилась |
41 |
80,4 |
66,9–90,2 |
|
|
Симптоматическая терапия |
2 |
3,9 |
0,5–13,5 |
|
|
Ингибиторы тирозинкиназы |
Не проводилась |
14 |
28,0 |
16,2–42,5 |
|
Проводилась |
36 |
72,0 |
57,5–83,8 |
|
|
Иммунотерапия |
Не проводилась |
47 |
94,0 |
83,5–98,7 |
|
Проводилась |
3 |
6,0 |
1,3–16,5 |
|
|
Xимиотерапия |
Проводилась |
40 |
80,0 |
66,3–90,0 |
|
Не проводилась |
10 |
20,0 |
10,0–33,7 |
|
|
Вид системной терапии рецидива |
ПХТ |
4 |
11,1 |
3,1–26,1 |
|
Сорафениб |
4 |
11,1 |
3,1–26,1 |
|
|
Левантиниб |
10 |
27,8 |
14,2–45,2 |
|
|
Регорафениб |
17 |
47,2 |
30,4–64,5 |
|
|
Кселода |
1 |
2,8 |
0,1–14,5 |
|
|
Эффективность проводимой системной терапии |
Стабилизация |
20 |
44,4 |
29,6–60,0 |
|
Частичный эффект |
3 |
6,7 |
1,4–18,3 |
|
|
Прогрессирование |
21 |
46,7 |
31,7–62,1 |
|
|
Полный эффект |
1 |
2,2 |
0,1–11,8 |
|
|
Количество линий системной терапии |
Не проводилась |
2 |
4,9 |
0,6–16,5 |
|
1 линия |
13 |
31,7 |
18,1–48,1 |
|
|
2 линии |
12 |
29,3 |
16,1–45,5 |
|
|
3 линии |
12 |
29,3 |
16,1–45,5 |
|
|
4 линии |
2 |
4,9 |
0,6–16,5 |
|
|
Лучевая терапия рецидива |
Отсутствие |
25 |
56,8 |
41,0–71,7 |
|
Наличие |
19 |
43,2 |
28,3–59,0 |
|
|
Хирургическое лечение рецидива |
Отсутствие |
31 |
67,4 |
52,0–80,5 |
|
Наличие |
15 |
32,6 |
19,5–48,0 |
Основными побочными эффектами на фоне проводимой терапии были диарея, кожная токсичность, артериальная гипертензия. Все нежелательные явления были I-II степени, что не приводило к отсрочке или снижению дозы проводимой терапии. У 10 пациентов на фоне лекарственной терапии отмечалась обратимая дисфункция трансплантата. 70 % пациентов начинали системную терапию с редуцированных доз, при удовлетворительной переносимости производили эскалацию дозы. Анализ побочных эффектов представлен в таблице 6.
Таблица 6. Анализ побочных эффектов терапии прогрессирования ГЦР после ОТП
Table 6. Analysis of side effects of therapy for HCC progression after OLT
|
Показатели |
Категории |
Абс. |
% |
95% ДИ |
|
Токсичность |
Отсутствие |
5 |
20,8 |
7,1 – 42,2 |
|
Наличие |
19 |
79,2 |
57,8 – 92,9 |
|
|
Кожная токсичность |
Отсутствие |
19 |
47,5 |
31,5 – 63,9 |
|
1 степень |
21 |
52,5 |
36,1 – 68,5 |
|
|
Диарея |
Отсутствие |
20 |
48,8 |
32,9 – 64,9 |
|
1 степень |
19 |
46,3 |
30,7 – 62,6 |
|
|
2 степень |
2 |
4,9 |
0,6 – 16,5 |
|
|
Артериальная гипертензия |
Отсутствие |
12 |
29,3 |
16,1 – 45,5 |
|
Наличие |
29 |
70,7 |
54,5 – 83,9 |
|
|
Слабость |
Отсутствие |
22 |
55,0 |
38,5 – 70,7 |
|
Наличие |
18 |
45,0 |
29,3 – 61,5 |
Обсуждение
Мы провели исследование, проанализировав результаты лечения 50 пациентов с прогрессированием ГЦР после ОТП. Медиана длительности наблюдения от момента постановки диагноза составила 50,8 месяца. У 85,4 % пациентов в анамнезе наблюдался вирусный гепатит С, у остальных (14,6 %) – вирусный гепатит В. В мире отмечается, что 78 % ГЦР вызвано либо гепатитом B (53 %), либо гепатитом C (25 %) [35]. Было отмечено, что высокая концентрация ДНК вируса гепатита В является риском прогрессирования ГЦР [34]. БРВ у пациентов с хроническим вирусным гепатитом В составила 39,1 месяца, а с ХГВ С – 54,6 месяца.
Bridge-терапия проводилась 68 % пациентам, что было обусловлено длительным сроком ожидания трансплантата. При этом лишь 15 пациентов подходили под миланские критерии трансплантации печени, 2 пациента подходили под калифорнийские критерии и 18 пациентов превышали критерии.
В литературе опубликовано несколько исследований, в которых описано, что посттрансплантационная ИС является катализатором прогрессирования ГЦР и причиной раннего метастазирования [31–33].
В 2018 году D. Gassmann описал случай прогрессирования ГЦР на фоне иммуносупрессивной терапии и приёма сорафениба, а затем анти-PD-1 препарата – ниволумаба, применение которого привело к потере трансплантата через неделю. Также в его работе были описаны результаты лечения иммунотерапией у 29 пациентов после трансплантации, в
10 случаях отмечалось прогрессирование заболевания на фоне применения терапии, в 3-х – летальный исход, потеря трансплантата у 4 из 11 пациентов при ОТП и у 7 из 13 после трансплантации почки, что ограничивает применение иммунотерапии у данной когорты пациентов [31].
В нашем исследование пациентам производилась коррекция ИС терапии с целью снижения риска распространения опухолевого процесса – снижение доз препаратов до оптимального уровня с сохранением ИС эффекта или добавление в схему лечения препаратов антипролиферативного действия. На фоне коррекции ИС терапии контроль над заболеванием отмечался у 48 % пациентов, частичный эффект – у 11 % и у 41 % – прогрессирование ГЦР.
Заключение
Применение системной терапии у пациентов с прогрессированием гепатоцеллюлярного рака после ортотопической трансплантации печени возможно, и это позволяет контролировать болезнь длительное время. При возникновении рецидива ГЦР после ОТП следует использовать возможности локальных методов лечения. Наряду с этим следует проводить оценку распространённости опухолевого процесса для последующего решения о индивидуальной тактике лечения для каждого пациента. Для предупреждения прогрессирования ГЦР после ОТП необходимо индивидуализировать протоколы иммуносупрессии с акцентом на антипролифератив-ные препараты.
Список литературы Факторы прогноза у пациентов с гепатоцеллюлярным раком, прогрессирующим после трансплантации печени
- Sangro B., Sarobe P., Hervas-Stubbs S., & Melero I. Advances in immunotherapy for hepatocellular carcinoma. Nature reviews Gastroenterology & hepatology. 2021;18(8):525-543. https://doi.org/10.1038/s41575-021-00438-0
- International Agency for Research on Cancer. Cancer today. 2020. URL: https://gco.iarc.fr/today/home
- Chakraborty E, Sarkar D. Emerging therapies for hepatocellular carcinoma (HCC). Cancers. 2022;14(11):2798. https://doi.org/10.3390/cancers14112798
- Asafo-Agyei К, Samant H. Hepatocellular Carcinoma. StatPearls Publishing. 2023. URL: https://pubmed.ncbi.nlm.nih.gov/32644603
- Kneuertz PJ, Cosgrove DP, Cameron AM, Kamel IR, Geschwind JFH, Herman JM, et al. Multidisciplinary management of recurrent hepatocellular carcinoma following liver transplantation. J Gastrointest Surg. 2012;16:874-881. URL: https://www.researchgate.net/publication/319528507_Multimodal_oncological_approach_in_patients_affected_by_recurrent_hepatocellula r_carcinoma_after_liver_transplantation
- Rahimi RS, Trotter JF. Liver transplantation for hepatocellular carcinoma: outcomes and treatment options for recurrence. Ann Gastroenterol Q Publ Hell Soc Gastroenterol. 2015;28(3):323. URL: https://www.semanticscholar.org/paper/Liver-transplantation-for-hepatocellular-carcinoma%3A-Rahimi-Trotter/8d49a8b0b0b8211263c2faae9e7c4ec050de606d
- Kooby DA, Egnatashvili V, Graiser M, Delman KA, Kauh J, Wood WC, et al. Changing management and outcome of hepatocellular carcinoma: evaluation of 501 patients treated at a single comprehensive center. J Surg Oncol. 2008;98(2):81-88. URL: https://pubmed.ncbi.nlm.nih.gov/1 8623039
- Mazzaferro V, Llovet JM, Miceli R, Bhoori S, Schiavo M, Mariani L et al. Predicting survival after liver transplantation in patients with hepatocellular carcinoma beyond the Milan criteria: a retrospective, exploratory analysis. Lancet Oncol. 2009;10(1):35-43. URL: https://pubmed.ncbi.nlm.nih.gov/! 9058754
- Stras WA, Wasiak D, t^giewska B, Tronina O, Hrenczuk M, Gotlib J et al. Recurrence of hepatocellular carcinoma after liver transplantation: risk factors and predictive models. Ann Transplant. 2022;27:e934924-1. https://doi.org/10.12659/A0T.934924
- Wang X, Yu H, Zhao F, Xu Y, Wang C, Liu K, et al. Microwave ablation versus radiofrequency ablation as bridge therapy in potentially transplantable patients with single HCC < 3 cm: A propensity score-matched study. Eur J Radiol. 2023;164:110860. https://doi.org/1 0.1016/j.ejrad.2023.110860
- Qadan M, Fong ZV, Delman AM, Gabr A, Salem R, Shah SA. Review of use of Y90 as a bridge to liver resection and transplantation in hepatocellular carcinoma. J Gastrointest Surg. 2021;25:2690-2699. https://doi.org/10.1007/s11605-021-05095-x
- Yao FY, Hirose R, LaBerge JM, Davern III TJ, Bass NM, Kerlan Jr RK, et al. A prospective study on downstaging of hepatocellular carcinoma prior to liver transplantation. Liver Transpl. 2005;11 (12):1505-1514. https://doi.org/10.1002/lt.20526
- Zhang W, Xu AH, Wang W, Wu YH, Sun QL, Shu C. Radiological appearance of hepatocellular carcinoma predicts the response to trans-arterial chemoembolization in patients undergoing liver transplantation. BMC Cancer. 2019;19:1-10. https://doi.org/10.1186/s12885-019-6265-1
- Khalaf H, Alsuhaibani H, Al-Sugair A, Al-Mana H, Al-Mutawa A, Al-Kadhi Y et al. Use of yttrium-90 microsphere radioembolization of hepatocellular carcinoma as downstaging and bridge before liver transplantation: a case report. В: Transplantation proceedings. Elsevier. 2010:994-998. https://doi.org/10.1016/j.transproceed.2010.03.019
- Zori AG, Limaye AR, Firpi R, Morelli G, Soldevila-Pico C, Suman A, et al. Locoregional therapy protocols with and without radioembolization for hepatocellular carcinoma as bridge to liver transplantation. Am J Clin Oncol. 2020;43(5):325-333. https://doi.org/10.1097/C0C.0000000000000678
- Tomonari T, Sato Y, Tanaka H, Tanaka T, Taniguchi T, Sogabe M et al. Conversion therapy for unresectable hepatocellular carcinoma after lenvatinib: three case reports. Medicine (Baltimore). 2020;99(42). https://doi.org/10.1097/MD.0000000000022782
- Kang E, Martinez M, Moisander Joyce H, Saenger YM, Griesemer AD, Kato T et al. Stable liver graft post anti PD1 therapy as a bridge to transplantation in an adolescent with hepatocellular carcinoma. Pediatr Transplant. 2022;26(3):e14209. https://doi.org/10.1111/petr.14209
- Олисов О.Д., Новрузбеков М.С., Гуляев В.А., Луцык К.Н. Роль ингибиторов кальциневрина в прогрессии гепатоцеллюлярной карциномы после трансплантации печени. Трансплантология. 2022;14(3):292-300. Olisov O.D., Novruzbekov M.S., Gulyaev V.A., Lutsyk K.N. The role of calcineurin inhibitors in the progression of hepatocellular carcinoma after liver transplantation. Transplantation. 2022;14(3):292-300. (In Russ). https://doi.org/10.23873/2074-0506-2022-14-3-292-300
- Mehta N, Heimbach J, Harnois DM, Sapisochin G, Dodge JL, Lee D, et al. Validation of a Risk Estimation of Tumor Recurrence After Transplant (RETREAT) Score for Hepatocellular Carcinoma Recurrence After Liver Transplant. JAMA Oncol. 2017 Apr;3(4):493-500. URL: https://pubmed.ncbi.nlm.nih.gov/27838698
- Tran BV, Moris D, Markovic D, Zaribafzadeh H, Henao R, Lai Q и др. Development and validation of a REcurrent Liver cAncer Prediction ScorE (RELAPSE) following liver transplantation in patients with hepatocellular carcinoma: Analysis of the us multicenter hcc transplant consortium. Liver Transpl. 2023;29(7):683-697. https://doi.org/10.1097/LVT.0000000000000145
- Rodriguez-Peralvarez M, Tsochatzis E, Naveas MC, Pieri G, Garcfa-Caparrôs C, O'Beirne J, и др. Reduced exposure to calcineurin inhibitors early after liver transplantation prevents recurrence of hepatocellular carcinoma. J Hepatol. 2013;59(6):1193-1199. https://doi.org/1 0.1016/j.jhep.2013.07.01 2
- Lerut J, Iesari S, Foguenne M, Lai Q. Hepatocellular cancer and recurrence after liver transplantation: what about the impact of immunosuppression? Transl Gastroenterol Hepatol. 2017;2. https://doi.org/1 0.21037/tgh.2017.09.06
- Agopian VG, Harlander-Locke M, Zarrinpar A, Kaldas FM, Farmer DG, Yersiz H et al. A novel prognostic nomogram accurately predicts hepatocellular carcinoma recurrence after liver transplantation: analysis of 865 consecutive liver transplant recipients. J Am Coll Surg. 2015;220(4):41 6-427. https://doi.org/10.1016/j.jamcollsurg.2014.12.025
- Lozanovski VJ, Dohler B, Weiss KH, Mehrabi A, SQsal C. The differential influence of cold ischemia time on outcome after liver transplantation for different indications-who is at risk? A collaborative transplant study report. Front Immunol. 2020;11:892. URL: https://amsdottorato.unibo.it/10078/1/tesi%20dottorato%20dott.%20Maroni%20Lorenzo.pdf
- Nagai S, Yoshida A, Facciuto M, Moonka D, Abouljoud MS, Schwartz ME, et al. Ischemia time impacts recurrence of hepatocellular carcinoma after liver transplantation. Hepatology. 2015;61(3):895-904. https://doi.org/10.1002/hep.27358
- Sharma P, Welch K, Hussain H, Pelletier SJ, Fontana RJ, Marrero J, et al. Incidence and risk factors of hepatocellular carcinoma recurrence after liver transplantation in the MELD era. Dig Dis Sci. 2012;57:806-812. https://doi.org/10.1007/s10620-011-1910-9
- Vagefi PA, Dodge JL, Yao FY, Roberts JP. Potential role of the donor in hepatocellular carcinoma recurrence after liver transplantation. Liver Transpl. 2015;21(2):187-194. https://doi.org/10.1002/lt.24042
- Чернобровкина Т.Я., Янковская Я.Д. Гепатоцеллюлярный рак. Современные достижения в диагностике и лечении. Архивъ Внутренней Медицины. 2016;1(27):63-69. Chernobrovkina T.Ya., Yankovskaya Ya.D. Hepatocellular cancer. Modern advances in diagnosis and treatment. Archive of Internal Medicine. 2016;1(27):63-69. https://doi.org/10.20514/2226-6704-2016-6-1 -63-69
- Panackel C, Mathew JF, Jacob M. Immunosuppressive drugs in liver transplant: an insight. J Clin Exp Hepatol. 2022;12(6):1557-1571. https://doi.org/1 0.1016/j.jceh.2022.06.007
- Mehta N, Frenette C, Tabrizian P, Hoteit M, Guy J, Parikh N, et al. Downstaging outcomes for hepatocellular carcinoma: results from the multicenter evaluation of reduction in tumor size before liver transplantation (MERITS-LT) consortium. Gastroenterology. 2021;161(5):1502-1512. https://doi.org/10.1 053/j.gastro.2021.07.033
- Gassmann D, Weiler S, Mertens JC, Reiner CS, Vrugt B, Nageli M. Liver allograft failure after nivolumab treatment-a case report with systematic literature research. Transplant Direct. 2018;4(8). https://doi.org/10.1097/TXD.0000000000000814
- Сидоров Д.В., Ложкин М.В., Петров Л.О., Исаева А.Г., Гусакова М.С. Комбинированные обширные резекции печени у больных местнораспространенным гепатоцеллюлярным раком - клинические случаи. Res Pract Med J. 2020;7(2):154-163. Sidorov D.V., Lozhkin M.V., Petrov L.O., Isaeva A.G., Gusakova M.S. Combined extensive liver resections in patients with locally advanced hepatocellular carcinoma -clinical cases. Res Pract Med J. 2020;7(2):154-163. https://doi.org/10.17709/2409-2231-2020-7-2-14
- Gabutti A, Bhoori S, Cascella T, Bongini M. Hepatocellular carcinoma recurrence after liver transplantation. Oncology (Williston Park, NY). 2020;34(3):692516-692516. URL: https://europepmc.org/article/med/32212134
- Urata Y, Kubo S, Takemura S, Uenishi T, Kodai S, Shinkawa H, et al. Effects of antiviral therapy on long-term outcome after liver resection for hepatitis B virus-relat ed hepatocellular carcinoma. J Hepato-Biliary-Pancreatic Sci. 2012;19(6):685-96. https://doi.org/10.1007/s00534-011 -0489-z
- Lai Q, Vitale A, Iesari S, Finkenstedt A, Mennini G, Spoletini G, et al. Intention-to-treat survival benefit of liver transplantation in patients with hepatocellular cancer. Hepatology. 2017;66(6): 1910-1919.


