Факторы риска нестабильности имплантатов после спондилэктомии у пациентов с опухолями позвоночника
Автор: Заборовский Н.С., Масевнин С.В., Мураховский В.С., Мухиддинов Р.А., Смекалнков О.А., Пташников Д.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.31, 2025 года.
Бесплатный доступ
Введение. Спондилэктомия при опухолях позвоночника обеспечивает оптимальный локальный контроль, однако сопровождается высоким риском нестабильности имплантатов.Цель работы - определить факторы риска нестабильности имплантатов после спондилэктомии у пациентов с опухолевым поражением позвоночника.Материалы и методы. Ретроспективное когортное исследование включает пациентов с опухолями позвоночника, которым выполнена резекция новообразования в 2007-2023 гг. Критерии включения: спондилэктомия с установкой протеза тела позвонка, локализация в грудном или поясничном отделах, период наблюдения ≥ 12 мес. Для выявления предикторов нестабильности использованы методы LASSO-регрессии и Random Forest с последующим мультивариантным анализом.Результаты. Нестабильность имплантатов развилась у 16 пациентов (18,4 %). Факторами риска являлись: использование костного цемента вместо аллотрансплантата (OR = 0,125, p = 0,014), несоответствие контактных поверхностей > 10° (OR = 0,214, p = 0,026), проседание протеза > 2 мм через 3 мес. (OR = 4,497, p = 0,023).Обсуждение. Выявленные факторы риска имеют важное клиническое значение для профилактики нестабильности имплантатов. Использование костного трансплантата вместо цемента, точное соответствие контактных поверхностей и контроль раннего проседания протеза позволяют значительно снизить риск несостоятельности металлоконструкции. Полученные результаты подтверждают необходимость тщательного предоперационного планирования и регулярного послеоперационного мониторинга.Заключение. Выявлены три независимых фактора риска нестабильности имплантатов после спондилэктомии у пациентов с опухолевым поражением позвоночника: использование костного цемента вместо аллотрансплантата, несоответствие контактных поверхностей протеза более 10°, проседание протеза более 2 мм через 3 мес., которые следует учитывать при планировании хирургического вмешательства и послеоперационном мониторинге для профилактики нестабильности металлоконструкции.
Опухоли позвоночника, спондилэктомия, нестабильность имплантатов, факторы риска, протез тела позвонка
Короткий адрес: https://sciup.org/142245097
IDR: 142245097 | УДК: 616.711.5/.6-006-089.873.4-06:616.711-008.1-071 | DOI: 10.18019/1028-4427-2025-31-2-183-193
Текст научной статьи Факторы риска нестабильности имплантатов после спондилэктомии у пациентов с опухолями позвоночника
В соответствии с онкологическими представлениями спондилэктомия при опухолях позвоночника обеспечивает наилучший локальный контроль заболевания [1–4]. Однако с биомеханической точки зрения эта операция вызывает значительное нарушение стабильности позвоночника, что требует тщательного планирования реконструктивного этапа вмешательства [5–7].
Современные принципы реконструкции после тотальной спондилэктомии основаны на концепции круговой стабилизации позвоночника [8]. Протез тела позвонка играет ключевую роль в восстановлении передней опорной колонны, обеспечивая адекватную анатомическую высоту межтелового промежутка и распределение осевой нагрузки [9]. Задняя инструментальная фиксация, в свою очередь, создает жесткую систему, препятствующую избыточной подвижности в оперированном сегменте [10]. Несмотря на постоянное совершенствование хирургической техники и имплантатов, частота механических осложнений после подобных вмешательств остается значительной [11]. К наиболее серьезным осложнениям относятся нестабильность металлоконструкции, миграция протеза тела позвонка и формирование псевдоартроза [12, 13]. Эти осложнения могут приводить к необходимости повторных операций, ухудшению качества жизни пациентов и снижению эффективности онкологического лечения [14, 15].
Понимание факторов, которые влияют на развитие нестабильности имплантов, имеет решающее значение для оптимизации хирургической тактики и улучшения отдаленных результатов лечения.
Цель работы — определить факторы риска нестабильности имплантатов после спондилэктомии у пациентов с опухолевым поражением позвоночника.
МАТЕРИАЛЫ И МЕТОДЫ
Ретроспективное когортное исследование включает пациентов с опухолями позвоночника, которым была выполнена резекция новообразования в период с 2007 по 2023 гг. Исследование одобрено локальным этическим комитетом.
Критерии включения : (1) выполненная спондилэктомия, (2) установка протеза тела позвонка сетчатого типа (mesh cage), (3) локализация в грудном или поясничном отделах; (4) полная информация о состоянии металлоконструкции; (5) период наблюдения ≥ 12 мес.
Критерии исключения : (1) пациенты с более чем 20 % пропущенных значений в наборе данных; (2) неагрессивные доброкачественные опухоли; (3) патологические переломы позвоночника, не связанными с опухолями.
В исследование включены 87 пациентов, оперированных в период с 2007 по 2023 гг. Неполные данные (не более 20 % пропущенных значений) имели 8 (9,2 %) пациентов без случаев нестабильности, что скорректировано методом множественной импутации. В исследуемой группе преобладали пациенты мужского пола (60 %). Медиана возраста составила 56 (48,5; 62) лет. Большинство пациентов (63 %) до операции передвигались самостоятельно, 17 % использовали дополнительные средства опоры, 20 % не могли ходить. По шкале ECOG преобладали пациенты с оценкой 1–2 балла (67 %). Медиана времени от диагностики патологии до операции составила 4 (2; 6) мес. (табл. 1).
Таблица 1
Общая характеристика пациентов
|
Характеристика |
Показатели |
|||
|
медиана |
абс. |
% |
||
|
Количество пациентов |
87 |
100 |
||
|
Женщины |
35 |
40,2 |
||
|
Мужчины |
52 |
59,8 |
||
|
Возраст, лет |
56 (48,5; 62,0) |
|||
|
Индекс массы тела |
23,9 (21,9; 26,5) |
|||
|
Индекс коморбидности, баллы |
7 (2,0; 8,5) |
|||
|
Ходьба до операции |
не ходит |
17 |
19,5 |
|
|
ходит с дополнительной опорой |
15 |
17,2 |
||
|
ходит самостоятельно |
55 |
63,3 |
||
|
Статус по ECOG |
0 |
3 |
3,4 |
|
|
1 |
27 |
31,0 |
||
|
2 |
31 |
35,6 |
||
|
3 |
16 |
18,4 |
||
|
4 |
10 |
11,6 |
||
|
Индекс сакропении |
0,7 (0,7; 0,8) |
|||
|
Время до операции, мес. |
4 (2; 6) |
|||
Резекцию опухоли выполняли в объеме спондилэктомии единым блоком (en bloc). Широкую en bloc резекцию проводили в случаях, когда это было технически возможно без компромисса значимых структур. При эпидуральном распространении опухоли или вовлечении магистральных сосудов проводили менингиолиз, выделение сосудов, выполняли запланированную краевую или внутриочаговую en bloc спондилэктомию с максимально возможным удалением опухолевой ткани (намеренная трансгрессия). После спондилэктомии проводили замещение пострезекционного дефекта сетчатым протезом тела позвонка и инструментальную реконструкцию позвоночника транспедикулярной системой фиксации. Заполняли протез костным цементом или аллогенным костным трансплантатом. На грудном отделе оперативное вмешательство стандартно выполняли из заднего доступа, в отдельных случаях использовали комбинированный доступ для мобилизации массивных опухолей. На поясничном отделе позвоночника операцию проводили в два этапа, — из заднего и переднего доступов. После операции пациентов направляли к онкологу для решения вопроса об адъювантной терапии.
Данные содержали как количественные, так и качественные переменные, включая возраст, пол, уровень поражения позвоночника, характеристики опухоли, данные о предоперационной неврологической функции, хирургические параметры, объем кровопотери, осложнения во время и после операции, а также исходы, такие как амбулаторный статус и наличие механической нестабильности конструкции. В общей сложности проанализированы 42 переменные.
Индекс сакропении оценивали как отношение поперечной площади пояснично-подвздошной мышцы к площади тела L4 позвонка [16], степень инвазии опухолевого процесса — по Tomita [17], плотность кости — в единицах Хаунсфилда (HU) на уровне L1 [18], инвазивность операции — по критериям N. Kumar et al. [19], рентгенологические параметры — по КТ в средне-сагиттальной проекции в прооперированном сегменте (пораженный уровень и смежные позвонки). Локальный угол рассматривали как угол Кобба между верхней замыкательной пластинкой краниального смежного с протезом позвонка и нижней замыкательной пластинкой каудального смежного с протезом позвонка [20]. Высоту сегмента (среднюю высоту сегмента с протезом) рассчитывали как среднее арифметическое двух значений. Переднюю дистанцию определяли как расстояние от верхнего переднего края смежного краниального позвонка до нижнего края каудального позвонка, заднюю дистанцию — от верхнего заднего края смежного краниального позвонка до нижнего края каудального позвонка (рис. 1). Проседание протеза рассматривали как уменьшение высоты сегмента по сравнению с послеоперационными показателями, несоответствие контактных поверхностей — как угол более 10° между контактной поверхностью протеза и замыкательной пластинкой (рис. 2) [21]. Осложнения оценивали по системе SAVES 2 [22]. Общую выживаемость определяли от момента оперативного вмешательства на позвоночнике до летального исхода или последнего контрольного наблюдения, выживаемость без локального рецидива — как время от операции до диагностики рецидива на основании инструментальных методов исследования. Также отслеживали наличие отдаленных послеоперационных осложнений и функциональный результат способности больного к самостоятельному передвижению (степень восстановления неврологического статуса).
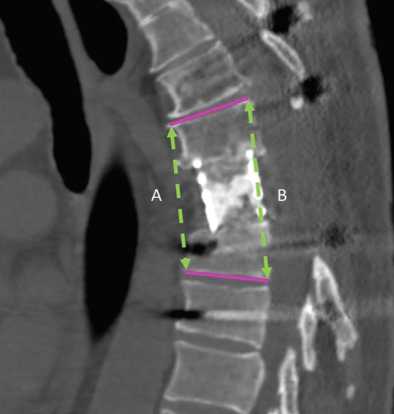
Рис. 1. КТ грудного отдела позвоночника, срединно-сагиттальный срез: состояние после резекции хондросаркомы Th7 позвонка: А — передняя дистанция сегмента, B — задняя дистанция
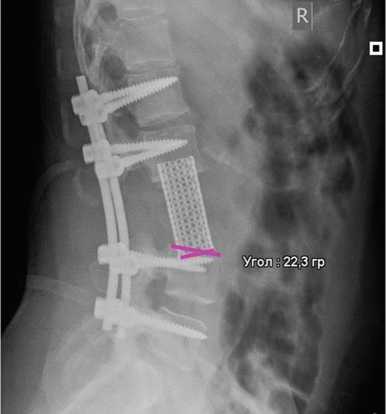
Рис. 2. Боковая рентгенограмма поясничного отдела позвоночника: состояние после резекции гемангиоэндотелиомы L3 позвонка; угол 22° несоответствия контактных поверхностей протеза и замыкательной пластинки L3 позвонка
сегмента с протезом тела позвонка
Для анализа данных использовали язык R версии 4.3.3, среда разработки R. Studio [23]. Пропущенные значения в данных обработаны методом множественной импутации с использованием алгоритма PMM ( англ .: Predictive Mean Matching) из пакета mice для R. Для каждой пропущенной переменной выполнено пять импутаций, что позволило учесть неопределенность, связанную с пропусками данных [24]. Средние значения представлены в виде медианы, интервальная оценка — интерквартильный размах (25 %; 75 %).
Для уменьшения размерности данных и отбора значимых предикторов использовали регуляризованную логистическую регрессию методом LASSO ( англ .: Least Absolute Shrinkage and Selection Operator). Данный метод позволяет сократить количество переменных и устранить проблемы мультиколлинеарности [25]. LASSO-регрессия выполнена с помощью функции cv.glmnet из пакета glmnet в среде R. Оптимальное значение регуляризационного параметра λ выбрано на основе кросс-валидации. Переменные с ненулевыми коэффициентами, отобранные с помощью LASSO, использованы для построения финальной модели.
Дополнительно для валидации результатов LASSO и выявления потенциальных нелинейных взаимодействий между переменными применен метод Random Forest с использованием пакета ranger . Данный метод позволяет оценить важность переменных с учетом их взаимного влияния и нелинейных связей [26]. Результаты Random Forest использованы для подтверждения выбора предикторов, полученных методом LASSO.
Для моделирования факторов риска нестабильности металлоконструкции использована Firth логистическая регрессия, которая устраняет проблему смещения оценок в малых выборках и при редких исходах [27]. Регрессия проведена с использованием пакета logistf в R. Количественная оценка факторов риска представлена в виде отношения шансов.
РЕЗУЛЬТАТЫ
Большинство пациентов (67 %) имели солитарное метастатическое поражение позвоночника. Преимущественно поражался грудной отдел позвоночника (68 %), реже — поясничный отдел (28 %). По классификации SINS локализация распределена относительно равномерно между переходным (39 %), полуригидным (37 %) и мобильным (24 %) отделами. У большинства пациентов (86,2 %) зарегистрировано поражение одного сегмента. Механическая боль присутствовала у 83 % пациентов. Преобладал литический тип костного поражения (61 %). У 67 % пациентов сохранялась нормальная ось позвоночника. По классификации Tomita преобладало поражение 4 типа (56 %) — эпидуральная компрессия (табл. 2).
Таблица 2
Характеристики опухолевого поражения
|
Характеристика |
Показатели ( n = 87) |
|||
|
медиана |
абс. |
% |
||
|
Тип опухоли по ВОЗ |
метастатическая |
58 |
66,7 |
|
|
первично-злокачественная |
22 |
25,3 |
||
|
первичная доброкачественная (агрессивная) |
7 |
8,0 |
||
|
Отдел позвоночника |
грудной (Th3–10) |
59 |
67,8 |
|
|
грудо-поясничный (Th11–L1) |
4 |
4,6 |
||
|
поясничный (L2–L5) |
24 |
27,6 |
||
|
Локализация по SINS |
переходный |
34 |
39,1 |
|
|
мобильный |
21 |
24,1 |
||
|
полуригидный |
32 |
36,8 |
||
|
Количество сегментов |
более 1 сегмента |
12 |
13,8 |
|
|
1 сегмент |
75 |
86,2 |
||
|
Механическая боль |
безболезненное течение |
12 |
13,8 |
|
|
да |
72 |
82,8 |
||
|
нет |
3 |
3,4 |
||
|
Тип костного поражения |
литическое |
53 |
60,9 |
|
|
смешанное |
34 |
39,1 |
||
|
Наличие деформации |
De novo кифоз или сколиоз |
19 |
21,8 |
|
|
нормальная ось |
58 |
66,7 |
||
|
подвывих или трансляция |
10 |
11,4 |
||
|
Степень поражения сегмента по Tomita |
3 |
7 |
8,1 |
|
|
4 |
49 |
56,3 |
||
|
5 |
12 |
13,8 |
||
|
6 |
19 |
21,8 |
||
|
Единицы HU в L1 |
103 (83,5; 122,5) |
|||
|
Лучевая терапия до операции |
7 |
8,1 |
||
В большинстве случаев (66 %) использовали комбинированный хирургический доступ. Медиана времени операции составила 270 (227,5–360,0) мин., медиана кровопотери — 1700 (1000–2500) мл. В большинстве случаев (55 %) выполняли фиксацию позвоночника 2 уровня выше, 2 уровня ниже пораженного сегмента. Преимущественно (82 %) использовали титановые стержни диаметром 5,5 мм. В одном случае потребовалась позвоночно-тазовая фиксация. В качестве материала заполнения протеза в зоне контакта с костью чаще применяли костный трансплантат (62 %), реже костный цемент (38 %). Медиана высоты протеза составила 40 (29–54) мм, медиана площади опорной поверхности — 420 (280–450) мм². Несоответствие более 10° между контактной поверхностью протеза и смежной замыкательной пластинкой наблюдали в 46 % случаев. После операции отмечено изменение локального угла (медиана 3 (0–6,5)°) и высоты оперированного сегмента (медиана 0,0 (–1,0–1,5) мм) (табл. 3).
Таблица 3
Хирургическое лечение и параметры имплантатов
|
Характеристика |
Показатели ( n = 87) |
|||
|
медиана |
абс. |
% |
||
|
Хирургический доступ |
задний |
30 |
34,5 |
|
|
комбинированный |
57 |
65,5 |
||
|
Кровопотеря, мл |
1700 (1000; 2500) |
|||
|
Время операции, мин |
270 (227,5; 360,0) |
|||
|
Индекс инвазивности опе |
рации |
17 (16; 20) |
||
|
Протяженность фиксации, сегменты |
3 |
8 |
9,2 |
|
|
4 |
2 |
2,3 |
||
|
5 |
48 |
55,3 |
||
|
6 |
9 |
10,3 |
||
|
7 |
15 |
17,2 |
||
|
8 |
3 |
3,4 |
||
|
9 |
2 |
2,3 |
||
|
Тип стержней |
5,5 мм |
71 |
81,6 |
|
|
6 мм |
13 |
14,9 |
||
|
дополнительные стержни |
3 |
3,4 |
||
|
Материал заполнения протеза |
цемент |
33 |
37,9 |
|
|
костный трансплантат |
54 |
62,1 |
||
|
Высота протеза, мм |
40 (29; 54) |
|||
|
Несоответствие контактных поверхностей > 10° |
40 |
46,0 |
||
|
Изменение локального угла, ° |
3 (0; 6,5) |
|||
|
Изменение высоты сегмента, мм |
0,0 (–1,0; 1,5) |
|||
При анализе результатов лечения медиана проседания протеза через 3 мес. составила около 1 (0; 2) мм, при последнем наблюдении — около 2 (1; 3) мм. По шкале хирургических осложнений SAVES v.2 у большинства пациентов (76 %) осложнений не наблюдали. В послеоперационном периоде 20 % пациентов получали терапию бисфосфонатами, 14 % — лучевую терапию. Через 3 мес. после операции отмечено улучшение двигательной функции, 77 % пациентов передвигались самостоятельно. Локальный рецидив опухоли развился у 23 (26 %) пациентов. Медиана общей выживаемости составила 28 (16; 55.5) мес.
Таблица 4
Результаты лечения и показатели выживаемости
|
Характеристика |
Показатели ( n = 87) |
|||
|
медиана |
абс. |
% |
||
|
Проседание протеза через 3 мес. |
> 2 мм |
29 |
33,3 |
|
|
≤ 2 мм |
58 |
66,7 |
||
|
проседание протеза при последнем наблюдении, мм |
2 (1; 3) |
|||
|
Тяжесть осложнений SAVES v.2, степень |
1 (нет осложнений) |
66 |
75,9 |
|
|
2 |
6 |
6,9 |
||
|
3 |
10 |
11,5 |
||
|
4 |
1 |
1,1 |
||
|
5 |
4 |
4,6 |
||
|
Бисфосфонаты после операции |
17 |
19,5 |
||
|
Лучевая терапия после операции |
12 |
13,8 |
||
|
Ходьба через 3 мес. |
не ходит |
7 |
8,0 |
|
|
ходит с дополнительной опорой |
13 |
14,9 |
||
|
ходит самостоятельно |
67 |
77,1 |
||
|
Локальный рецидив |
23 |
26,4 |
||
|
Общая выживаемость, мес. |
28 (16,0; 55,5) |
|||
Нестабильность имплантатов, потребовавшая ревизионного хирургического вмешательства, развилась у 16 пациентов (18,4 %). Среди случаев нестабильности: перелом стержней ( n = 6; 36,5 %), расшатывание винтов с развитием переходного кифоза ( n = 8; 50 %), миграция протеза тела позвонка ( n = 2; 12,5 %). При этом отмечено, что во всех случаях перелом стержней и расшатывание винтов сопровождались проседанием протеза более 4 мм в тела смежных позвонков. Псевдоартроз отмечен в 75 % случаев у пациентов с нестабильностью имплантов.
По результатам LASSO-регрессии ( λ = 0,036) из 42 исходных предикторов наиболее значимые ассоциации с риском нестабильности имплантатов показали следующие факторы:
-
— материал заполнения протеза ( β = –0,984);
-
— несоответствие контактных поверхностей более 10° ( β = 0,448);
-
— проседание протеза более 2 мм через 3 мес. ( β = 0,188);
-
— длина фиксации ( β = –0,114);
-
— количество оперированных сегментов ( β = –0,104);
-
— разница высоты сегмента до и после операции ( β = 0,116);
-
— функциональный статус через 3 мес. ( β = 0,113);
-
— проседание протеза при последнем наблюдении ( β = 0,081);
-
— возраст ( β = 0,010);
-
— общая выживаемость ( β = 0,006);
-
— время до операции ( β = –0,004);
-
— длительность операции ( β = –0,004).
Для подтверждения выбора предикторов дополнительно проведен анализ с использованием метода Random Forest, который позволяет оценить важность переменных с учетом их нелинейных взаимодействий.
Среди 42 исследованных характеристик наибольшую важность продемонстрировали:
-
— проседание протеза при последнем наблюдении (importance score = 0,031);
-
— материал заполнения протеза (0,008);
-
— разница высоты сегмента до и после операции (0,007);
-
— общая выживаемость (0,007).
Проседание протеза более 2 мм через 3 мес. (0,007) и несоответствие контактных поверхностей (0,005) также вошли в число наиболее значимых факторов, что частично согласуется с результатами LASSO-регрессии.
Для последующего мультивариантного анализа с использованием Firth регрессии отобраны три предиктора с наибольшими коэффициентами LASSO-регрессии. Ограничение количества предикторов до трех позволило избежать переобучения модели, учитывая размер исследуемой выборки [28]. Все отобранные факторы имеют важное клиническое значение, так как характеризуют основные биомеханические параметры использованной конструкции.
При мультивариантном анализе с использованием Firth регрессии выявлены следующие независимые факторы риска нестабильности имплантатов (рис. 3):
-
— использование костного трансплантата вместо цемента снижало вероятность нестабильности в 8 раз (OR = 0,125, 95 % CI: 0,026–0,475, p = 0,014);
-
— отсутствие несоответствия контактных поверхностей ассоциировалось с меньшим риском (вероятность ниже в 4,7 раз) нестабильности (OR = 0,214, 95 % CI: 0,047–0,815, p = 0,026);
-
— проседание протеза более 2 мм через 3 мес. увеличивало вероятность нестабильности в 4,5 раза (OR = 4,497, 95 % CI: 1.224–18,41, p = 0,023).
0.1 1.0 10.0
Модель продемонстрировала статистически значимую прогностическую ценность (LR χ ² = 24,74, df = 3, p < 0,001).
Проседание > 2 мм
Несоответствие контактных поверхностей < 10 гр
Материал заполнения протеза
Отношение шансов
Рис. 3. Результаты Firth регрессии
ОБСУЖДЕНИЕ
В данном исследовании проведен анализ факторов риска нестабильности имплантатов после спондилэктомии у пациентов с опухолевым поражением позвоночника. Частота нестабильности составила 18,4 %, что согласуется с данными литературы. Так, T. Shimizu et al. сообщают о 32,4 % случаев несостоятельности после тотальной en bloc спондилэктомии [29], а K. Yoshioka et al. отмечают значительные различия в частоте нестабильности в зависимости от уровня вмешательства: от 5,9 % при операциях на грудном отделе до 42,9 % при вмешательствах на поясничном уровне [30]. Выявленные варианты несостоятельности конструкции включали перелом стержней (36,5 %), расшатывание винтов с развитием переходного кифоза (50 %) и миграцию протеза тела позвонка (12,5 %). Эти данные согласуются с систематическим обзором Z. Li et al., где несостоятельность конструкции (12,1 %) была одним из наиболее частых осложнений [31].
Многофакторный анализ выявил три независимых предиктора нестабильности имплантатов. Наиболее значимым фактором оказался выбор материала для заполнения протеза, — использование костного трансплантата снижало риск нестабильности в восемь раз по сравнению с цементом. Это соответствует концепции, предложенной T. Akamaru et al., о лучшей костной интеграции при использовании костного трансплантата, особенно в случаях доброкачественных или первичных злокачественных опухолей [32]. Ранее, как отмечали R.P. Melcher и J. Harms, использование костного цемента считалось допустимой опцией для передней реконструкции, особенно в случаях метастатического поражения или при выраженном остеопорозе [33]. Такая тактика оправдана при относительно небольшой ожидаемой продолжительности жизни пациентов. Однако современные достижения в лечении онкологических больных привели к значительному увеличению выживаемости, в том числе у пациентов с метастатическими поражениями позвоночника [34]. В нашем исследовании медиана общей выживаемости составила 28 мес., что создает предпосылки для развития поздних осложнений. При использовании цемента пациенты чаще доживают до развития псевдоартроза и несостоятельности конструкции, что подтверждается высокой частотой псевдоартроза (75 %) в группе пациентов с нестабильностью имплантатов.
Несоответствие контактных поверхностей протеза и смежных замыкательных пластинок более 10° повышало риск нестабильности в 4,7 раза. M.H. Mohammad-Shahi et al. подтверждают критическую важность этого фактора, демонстрируя риск несостоятельности металлоконструкции даже при углах несоответствия от 0° до 10° [35]. Данный фактор особенно важен при многоуровневых резекциях [36], при которых, по данным K. Yoshioka et al., риск нестабильности значительно возрастает с увеличением протяженности реконструкции [30]. Это может объясняться тем, что увеличение количества точек контакта при многоуровневой реконструкции создает более сложную биомеханическую систему, в которой даже небольшие отклонения в позиционировании протеза на каждом уровне могут суммироваться и приводить к значительному перераспределению нагрузок на всю конструкцию. При этом неравномерное распределение сил на контактных поверхностях может создавать зоны локального перенапряжения, что ускоряет износ стержней.
Проседание протеза более 2 мм через 3 мес. после операции увеличивало вероятность нестабильности в 4,5 раза. T. Shimizu et al. также идентифицировали раннее проседание (≥2 мм через 1 мес.) как независимый фактор риска несостоятельности инструментария [29]. Согласно A.R. Vaccaro et al., на развитие раннего проседания влияют несколько ключевых факторов: качество костной ткани, площадь контакта имплантата с телом позвонка, степень интраоперационной дистракции, техника подготовки замыкательных пластинок и соответствие механических свойств имплантата и кости (модуль упругости) [37]. Интересно отметить, что все эти факторы взаимосвязаны и могут усиливать влияние друг друга. Например, при сниженной минеральной плотности кости особое значение приобретает уве- личение площади контакта имплантата с телом позвонка для лучшего распределения нагрузки [38]. В свою очередь, чрезмерная интраоперационная дистракция может привести к повреждению замыкательных пластинок, что в сочетании с несоответствием модуля упругости имплантата и кости создает предпосылки для раннего проседания даже при изначально корректном позиционировании протеза.
Полученные результаты и анализ литературы позволяют сформулировать практические рекомендации для снижения риска нестабильности имплантатов:
-
— рассматривать использование костного трансплантата как метод выбора при отсутствии противопоказаний, учитывая его способность к биологической интеграции и ремоделированию;
-
— при подготовке к операции тщательно планировать точки фиксации, зоны контакта протеза, использовать современные методы визуализации для оценки качества костной ткани и проводить предоперационное моделирование установки имплантатов;
-
— во время операции обеспечивать максимально точное соответствие контактных поверхностей, избегать чрезмерной дистракции и минимизировать повреждение замыкательных пластинок при подготовке ложа для протеза;
-
— в послеоперационном периоде проводить тщательный рентгенологический мониторинг, контролировать процесс остеоинтеграции;
-
— при наличии факторов риска (остеопороз, многоуровневое поражение, локализация в переходных отделах) использовать стержни увеличенного диаметра, удлинять зону фиксации и применять дополнительные стержни;
-
— с целью профилактики нестабильности использовать индивидуальные протезы тел позвонков, изготовленные методом 3D-печати, которые позволяют оптимизировать распределение нагрузки за счет точного соответствия анатомии пациента, создавать дополнительные точки фиксации в конструкции имплантата, а также применять материалы с модулем упругости, близким к костной ткани (PEEK-композиты).
Индивидуализация хирургического лечения с учетом этих рекомендаций может способствовать снижению частоты нестабильности имплантатов и улучшению отдаленных результатов лечения пациентов с опухолевым поражением позвоночника.
Исследование имеет ряд ограничений. Ретроспективный характер исследования ограничивает возможность контроля качества собираемых данных и увеличивает риск систематических ошибок. Одноцентровой формат может снижать внешнюю валидность результатов. Относительно небольшой размер выборки (87 пациентов) ограничивает статистическую мощность исследования, особенно учитывая гетерогенность популяции по типам опухолей (метастатические, первично-злокачественные и агрессивные доброкачественные опухоли). Длительный период набора материала (2007–2023 гг.) мог сопровождаться изменениями в хирургической технике и периоперационном ведении пациентов. Наличие пропущенных данных (9,2 % случаев), несмотря на использование современных методов статистической обработки, могло повлиять на результаты анализа. Ограничение количества предикторов в финальной модели до трех переменных, хотя и обоснованное размером выборки, могло привести к потере потенциально значимых факторов риска. Кроме того, потенциальное влияние конкурирующих рисков (например, летальный исход) ограничивает оценку частоты нестабильности в отдаленном периоде.
ЗАКЛЮЧЕНИЕ
По результатам исследования выявлены три независимых фактора риска нестабильности имплантатов после спондилэктомии у пациентов с опухолевым поражением позвоночника: использование костного цемента вместо аллотрансплантата для заполнения протеза тела позвонка, несоответствие контактных поверхностей протеза со смежными замыкательными пластинками более 10° и проседание протеза более 2 мм через 3 мес. после операции. Выявленные факторы риска следует учитывать при планировании хирургического вмешательства и в послеоперационном мониторинге пациентов для профилактики нестабильности металлоконструкции.


