Факторы риска неудач и эмбрионических потерь при экстракорпоральном оплодотворении
Автор: Рудакова Е.Б., Лобода О.А., Полторака Е.В., Бурова О.М., Пилипенко М.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Оригинальные статьи
Статья в выпуске: 4-1 т.23, 2008 года.
Бесплатный доступ
На основании проведенных исследований выяв- лены факторы риска неудач ЭКО, установлена роль хронического эндометрита в генезе неудач ЭКО и значение патологии системы гемостаза для развития эмбрионических потерь.
Экстракорпоральное оплодотворение, хронический эндометрит, патология гемостаза
Короткий адрес: https://sciup.org/14918918
IDR: 14918918 | УДК: 618.177-089.888-06-053.13
Текст научной статьи Факторы риска неудач и эмбрионических потерь при экстракорпоральном оплодотворении
Проблема лечения бесплодия в настоящее время приобретает не только медико-социальное, но и экономическое значение. На сегодняшний день широкое распространение получил метод лечения бесплодия путем экстракорпорального оплодотворения прео-вуляторных ооцитов (ЭКО) и переноса дробящихся эмбрионов в полость матки (ПЭ). Несмотря на постоянное совершенствование данного метода, его эффективность, по данным многоцентровых исследований, сравнительно низкая (20-35%). Согласно данным отчета Всемирного конгресса (WCFS 1995), бла14
гоприятный исход беременности после ЭКО и ПЭ имеет место в 73,1% случаев, у 21% женщин беременность прерывается в период до 18-20 недель [1]. В этом аспекте представляет интерес изучение факторов риска неудач ЭКО и причин эмбрионических потерь.
МАТЕРИАЛ И МЕТОДЫ
Первым этапом исследования был ретроспективный анализ 40 амбулаторных карт пациенток, которые проходили лечение сочетанных форм бесплодия с использованием метода ЭКО. Для изучения структуры причин неудач ЭКО у пациенток учитывались данные клинического, лабораторного, инструментального методов обследования. На втором этапе исследования, с целью оценки роли хронического эндометрита (ХЭ) в генезе неудач ЭКО, было обследовано 34 пациентки, которые готовились к проведению ЭКО после предшествующей неудачной попытки, с помощью клинического, ультразвукового, микробиологического и морфологического [2] методов. ИГХ-исследование биоптатов эндометрия с ХЭ проводилось с использованием моноклональных антител («Novoсastra», UK) к эстрогеновым (ЭР) и прогестероновым (ПР) рецепторам. Интенсивность реакции на ЭР и ПР в ядрах клеток эпителия желез и стромальных клеток оценивалась по методу гистологического счета «quickscore» (Detre S. и соавт., 1995).
Для выявления места в структуре причин эмбриони-ческих потерь нарушений в системе гемостаза (СГ) была проанализирована 21 амбулаторная карта пациенток, имевших прервавшуюся беременность после ЭКО в первом триместре, оценивалось наличие волчаночного антикоагулянта (ВА), состояние сосудисто-тромбоцитарного (спонтанная агрегация и с использованием индукторов) и коагуляционного звеньев гемостаза (АЧТВ, ПТИ, фибриноген, РФМК, XII А-зависимый фибринолиз).
Статистические методы. Количественные данные представлены как среднее ± стандартное отклонение (M±σ). Анализ данных проводился с использованием метода кривых регрессий нелинейного типа; для оценки статистической значимости различий между сравниваемыми группами применялся ранговый непараметрический критерий Манна-Уитни (U тест); для выявления силы корреляционной связи использовались непараметрические коэффициенты корреляции: ранговый Спирмена (rs) и парный Тау Кэндалла (rk). Критический уровень значимости при проверке статистических гипотез в данном ис- следовании принимался равным 0,05. Обработка данных проводилась программой «Statistica 7».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По данным уровня ХГ, на 14-й день после ПЭ у 18 пациенток (45%) наступила имплантация, у 22 пациенток (55%) беременность отсутствовала. При анализе причин неудач ЭКО выявлены следующие факторы, которые статистически значимо увеличивают риск несостоявшейся имплантации: возраст женщин старше 35 лет (rk=0,03, р=0,005), сниженный фолликулярный резерв (rk=0,25, р=0,01), полип эндометрия (rk=0,23, р=0,02) и хронический эндометрит (rk=0,24, р=0,02) в анамнезе, доза рФСГ более 250 ед. (rk=0,56, р=0,00), выполнение пункции на 16-17-й день цикла (rk=0,32, р=0,00), перенос эмбриона на 1-2-е сутки после пункции (rk=0,28, р=0,01), число про-пунктированных фолликулов до 5 (rk=0,24, р=0,03), толщина М-эхо эндометрия меньше 8 мм (rk=0,34, р=0,00), отсутствие синдрома гиперстимуляции яичников (rk=0,40, р=0,00). Значимой корреляционной связи между другими факторами и вероятностью
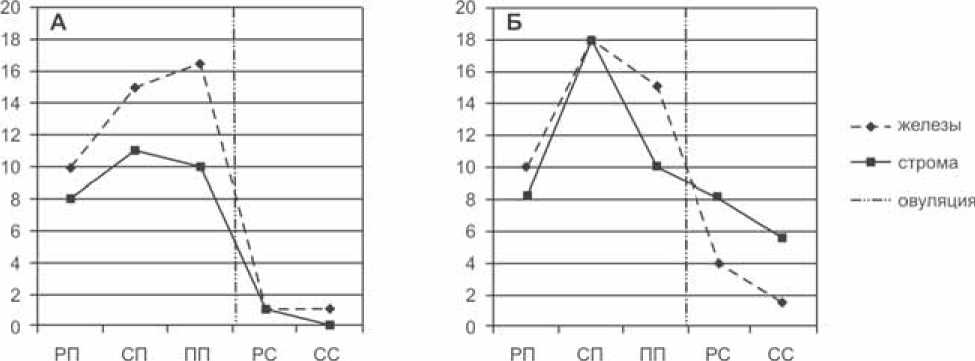
Рис. 1. Показатели экспрессии рецепторов к эстрогену (А) и прогестерону (Б) при ХЭ
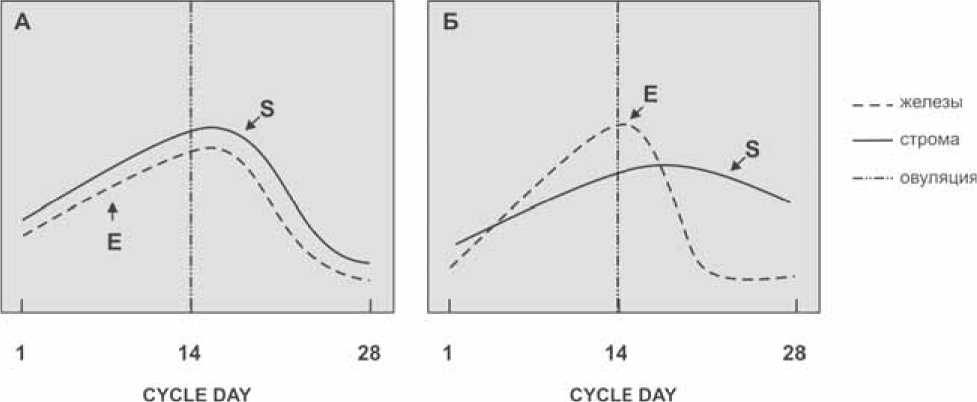
Рис. 2. Динамика экспрессии ER (А) и PR (Б) в нормальном эндометрии (по Moutsasou P., Sekeris C. E. [3])
наступления беременности после ЭКО не выявлено (р>0,05). Из 18 женщин с установленным фактом имплантации по данным ХГ, на УЗИ беременность на 28-й день после ПЭ была подтверждена у 11 женщин (61%), у 7 (39%) отмечались преэмбрионичес-кие потери. При статистическом анализе факторов риска преэмбрионических потерь значимых показателей не выявлено (р>0,05), что свидетельствует о необходимости дальнейшего детального изучения.
Из 34 пациенток, готовящихся к проведению ЭКО после предшествующей неудачной попытки, у 19 (56%) на основании клинико-аппаратного обследования был заподозрен хронический эндометрит. Морфологически ХЭ был выявлен у 25 женщин (74%): у 19 с клиникой ХЭ и у 6 без подозрения на данную патологию. По данным ИГХ-исследования выявлено, что экспрессия ЭР и ПР при ХЭ отличается от таковой в норме (при сравнении с литературными данными [3, 4]) (рис 1, 2). Отмечается смещение пика уровня экспрессии ЭР и ПР в сторону средней и поздней стадий фазы пролиферации (подтверждается при построении диаграмм рассеяния с расчетом кривых регрессий нелинейного типа), в то время как в нормальном эндометрии пик приходится на овуляцию. Было выявлено статистически значимо более раннее истощение рецепторного аппарата: резкое снижение экспрессии рецепторов с началом фазы секреции (при попарном сравнении уровня экспрессии рецепторов в среднюю и позднюю стадии фазы пролиферации с ранней стадией фазы секреции с помощью критерия Манна-Уитни, p<0,05). Наличием данных изменений рецепторного аппарата можно объяснить неспособность половых гормонов обеспечить полноценное циклическое преобразование эндометрия и тем самым подготовить его к приему бластоцисты.
Была оценена эффективность проведения патогенетической терапии в комплексном лечении пациенток с ХЭ путем применения в первой группе (n=5) только этиотропной терапии ХЭ, во второй – этиотропной и патогенетической терапии (n=6). В первой группе эффективность циклов ЭКО составила 20%, во второй – 67%. При сравнительной оценке толщины М-эхо в цикле ЭКО перед переносом эмбриона в первой группе женщин данный показатель составлял 7±1,22 мм, во второй – 10±1,79 мм. Толщина М-ЭХО эндометрия во второй группе женщин была статистически значимо выше, чем в первой (U=0,00, n=11, р<0,05). Выявлена значительная корреляционная связь между толщиной эндометрия и наступлением беременности (rs=0,866; n=11, р<0,001).
При анализе СГ пациенток, имеющих ранние эм-брионические потери, выявлено, что у 6 пациенток (28,5%) наблюдалась гиперагрегация тромбоцитов с гиперкоагуляцией, у 8 (38%) гиперагрегация тромбоцитов сопровождалась отсутствием изменений в коагулограмме, у 6 пациенток (28,5%) гипоагрегация тромбоцитов сочеталась с гиперкоагуляцией, у 1 па-16
циентки (4,8%) была выявлена гипоагрегация при нормальной коагуляции, то есть в данной группе у всех женщин отмечалась патология СГ с преобладанием активации сосудисто-тромбоцитарного и внутрисосудистого звеньев. В исследуемой группе ВА был выявлен у 5 женщин (23,8%), исходя из чего можно предположить, что у остальных женщин патология СГ вызвана другими причинами, в том числе наследственными тромбофилиями (что необходимо подтвердить в последующих исследованиях).
ВЫВОДЫ
Одной из основных причин несостоявшейся имплантации в программе ЭКО является ХЭ. В связи с недостаточной эффективностью клинико-аппаратных методов диагностики ХЭ (чувствительность 76%, специфичность 100%), морфологическое исследование биоптатов эндометрия с применением ИГХ является необходимым звеном в обследовании женщин перед ЭКО после первой неудачной попытки. Патогенетическая терапия является обязательным элементом в комплексном лечении ХЭ, так как при её проведении увеличивается вероятность имплантации за счет устранения морфофункциональных нарушений эндометрия, о чем косвенно свидетельствует его лучший ответ на гормональную стимуляцию в цикле ЭКО.
Ведущей причиной ранних эмбрионических потерь является патология СГ, которая обусловливает неполноценность имплантации и нарушение плацентации [5]. Данный факт свидетельствует о необходимости комплексного исследования СГ у всех женщин, вступающих в программу ЭКО, т.к. своевременная коррекция данной патологии позволит повысить частоту успешных исходов беременности после ЭКО.
Список литературы Факторы риска неудач и эмбрионических потерь при экстракорпоральном оплодотворении
- Экстракорпоральное оплодотворение и его новые направления в лечении женского и мужского бесплодия: Руководство для врачей//под ред. В.И. Кулакова, Б.В. Леонова. -М.: Медицинское информационное агенство, 2000. -782 с.
- Mazur M. Diagnosis of endometrial biopsies and curettings: a practical approach//M. Mazur, R. J. Kurman. -NY.: Springer, 2005. -394 p.
- Moutsasou P., Sekeris C. E. Estrogen and Progesterone Receptors in the Endometrium//Annals of the New York Academy of Science. -1995. -Vol. 816. -P. 99-115.
- Henry N. Jabbour, Rodney W. Kelly, Hamish M. Fraser, Hilary O. D. Critchley Endocrine Regulation of Menstruation//Endocrine Reviews. -2004. -Vol. 27, № 1. -P. 17-46.
- Сидельникова В. М. Привычная потеря беременности: руководство для врачей//М.: ТриадаХ, 2005. -304 с.


