Факторы риска переломов костной ткани у больных с коморбидной патологией
Автор: Чынгышпаев Д.Ш., Малеванная В.А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 3 т.10, 2024 года.
Бесплатный доступ
У пациентов с сердечной недостаточностью (СН) наблюдаются повышенные уровни провоспалительных цитокинов, таких как фактор некроза опухоли-α (ФНО-α) и интерлейкин-6 (IL-6), что приводит к активации макрофагов, нарушению микрососудистой функции, изменениями в сокращении мышц и развитием фиброза. Кроме того, эти провоспалительные цитокины способствуют резорбции кости, тем самым увеличивая частоту переломов костей. Цель исследования - оценить влияние рецепторов фактора некроза опухоли-альфа 1 и 2 типов (ФНО-α-SR1 и ФНО-α-SR2) на вероятность переломов у лиц с остеопорозом, которые одновременно страдают хронической сердечной недостаточностью (ХСН) и сахарным диабетом 2 типа (СД 2). Исследование было проведено на 178 женщинах в возрасте от 50 до 65 лет. Среди этих женщин 48 находились в группе 1 и имели как сердечную недостаточность, так и диабет 2 типа. В группу 2 вошли 93 пациента с остеопорозом и сердечной недостаточностью, в группу 3-37 женщин с остеопорозом, сердечной недостаточностью и сахарным диабетом 2 типа. В качестве контрольной группы были выбраны 35 женщин в постменопаузе без каких-либо клинических и инструментальных признаков патологии сердечно-сосудистой системы или остеопороза. Уровни рецепторов ФНО-α-SR1 и ФНО-α-SR2 в группах пациентов 1-3 были заметно выше (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рецепторы фактора некроза опухоли α, коморбидность, сердечная недостаточность, сахарный диабет, остеопороз
Короткий адрес: https://sciup.org/14129882
IDR: 14129882 | УДК: 616.7 | DOI: 10.33619/2414-2948/100/40
Текст научной статьи Факторы риска переломов костной ткани у больных с коморбидной патологией
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.7
Сердечная недостаточность — это заболевание, которое приводит к определенной степени кислородного голодания в тканях, что может привести к усилению резорбции костной ткани [1, 2]. Это может способствовать развитию остеопороза у пациентов с сердечной недостаточностью [3]. Такое усиление резорбции костной ткани может быть вызвано рядом факторов, в том числе гиперактивацией ренин-ангиотензин-альдостероновой системы (РААС), что приводит к повышению уровня паратгормона (ПТГ) [4, 5]. Кроме того, наличие минералокортикоидных рецепторов в костных клетках позволяет предположить, что альдостерон может действовать непосредственно на костную ткань. Другие факторы, которые могут способствовать развитию остеопороза у пациентов с сердечной недостаточностью, включают хроническое заболевание почек и дефицит витамина D [6]. Снижение двигательной активности, которое часто является результатом потери функциональности, также может привести к значительной потере костной и мышечной массы [7, 8].
У женщин снижение уровня остеопротегерина (ОПГ) связано с развитием постменопаузального остеопороза, поскольку дефицит эстрогена, вызванный физиологическими изменениями, снижает экспрессию белка [9]. ОПГ влияет на эндотелий, ограничивая кальцификацию артериальной стенки. У мышей с дефицитом ОПГ наблюдается ранний остеопороз и кальцификация артерий, что напрямую связано со степенью потери костной массы [10, 11]. Кроме того, высокие концентрации ОПГ были связаны с большей тяжестью ишемической болезни сердца и более высоким риском смертности от сердечно-сосудистых заболеваний. У пациентов с сердечной недостаточностью (СН) более высокие уровни ОПГ связаны с более тяжелыми симптомами заболевания, снижением минеральной плотности костной ткани (МПК) и повышенным риском смертности от всех причин [12].
Фактор некроза опухоли- α (TNF- α) и интерлейкин-6 (IL-6) повышены у пациентов с СН, что способствует активации макрофагов, микрососудистой дисфункции, сократительным изменениям и фиброгенезу[13]. Эти цитокины усиливают резорбцию костей, увеличивая риск переломов. TNF- α является катаболическим агентом костей, который стимулирует остеокластогенез, подавляет рекрутирование предшественников остеобластов, ингибирует экспрессию генов белков костного матрикса и может обеспечивать некоторую устойчивость к кальцитриолу[14,15]. Уровни растворимых рецепторов TNF- α 1 и 2, которые являются наиболее надежными биомаркерами длительного воздействия TNF- α, были связаны с более высоким риском перелома бедра, даже после учета других факторов риска [14].
Использование лекарств при лечении сердечной недостаточности (СН) может иметь негативные последствия для здоровья костей. В частности, было обнаружено, что петлевые диуретики увеличивают выведение кальция через почки, что может способствовать потере костной массы. Кроме того, гипотензивный эффект других препаратов, применяемых при лечении СН, может увеличить риск падений и переломов, особенно у пожилых пациентов [1]. Хотя точные механизмы связи между СН и остеопорозом остаются неясными, некоторые изменения, наблюдаемые при СН, связаны с потерей костной массы [1].
Цель исследования — изучить влияние растворимых рецепторов TNF- α типов 1 и 2 (TNF- α -SR1 и TNF- α -SR2) на риск переломов у пациентов с остеопорозом, вызванным хронической сердечной недостаточностью (ХСН) и сахарным диабетом 2 типа.
Материалы и методы
Этот эксперимент был одобрен Комитетом по этике Наблюдательного совета институциональных медицинских наук (IHSM) (Протокол №5, дата: 5 сентября 2021 г.). В исследовании приняли участие 178 женщин в возрасте от 50 до 65 лет, разделенных на четыре разные группы. В 1 группу вошли 48 женщин, у которых наблюдались как сердечная недостаточность (СН), так и сахарный диабет 2 типа. Во 2 группу вошли 93 пациента с остеопорозом и сердечной недостаточностью. Третью группу составили 37 женщин с остеопорозом, СН и сахарным диабетом 2 типа. В качестве контрольной группы были отобраны 35 женщин в постменопаузе в возрасте от 50 до 65 лет без клинических и инструментальных признаков сердечно-сосудистой или остеопорозной патологии. Для оценки минеральной плотности костной ткани использовали двухэнергетическую рентгеновскую абсорбциометрию для рентгенологического исследования поясничного отдела позвоночника и проксимального отдела бедренной кости. Т-тест использовался для характеристики снижения минеральной плотности костной ткани, а остеопороз диагностировали при Т -критерии менее -2,5. Концентрацию рецепторов TNF-a-SR1 и TNF-a-SR2 в сыворотке крови определяли методом иммуноферментного анализа.
Пациенты, ранее проходившие терапию бисфосфонатами, а также те, кто в настоящее время принимает кортикостероиды и лечение на основе эстрогена, не были включены в выборку исследования.
После 36-месячного периода наблюдения пациенты были разделены на две группы в зависимости от течения остеопороза. В первую группу вошли пациенты с неблагоприятным течением, во вторую — с благоприятным течением. Для оценки течения остеопороза учитывали регистрацию малотравматических переломов крупных костей, таких как бедра, тела позвонков и лучевой кости, а также прогрессирующее снижение минеральной плотности костей, определяемое методом двухэнергетической рентгеновской абсорбциометрии.
Статистический анализ результатов проводился с использованием пакета статистических программ STATISTICA. Рассчитывали среднее значение и стандартную ошибку среднего значения для исследуемых количественных переменных (M ±m). Для выявления потенциальных предикторов неблагоприятного течения CH и остеопороза и оценки влияния различных показателей использовали статистический показатель «отношение шансов» (ОR) И соответствующие ему 95% доверительные интервалы (-95% C.I. + 95% C.I.) .
Результаты и обсуждение
При оценке основных клинических характеристик женщин установлено, что средние значения возраста, продолжительности менопаузы, гликированного гемоглобина, ФВЛЖ, общего холестерина и индекса массы тела в исследуемых группах были сходными. Однако в группе с ХСН, остеопорозом и СД 2 у большего числа больных в анамнезе были инфаркт миокарда и острое нарушение мозгового кровообращения, по сравнению с пациентами в первой и второй группах.
За 36-месячный период наблюдения за прогрессированием остеопороза во 2 группе у 32 пациенток (34,4%) наблюдались остеопоротические переломы крупных костей и/или снижение МПК, а в 3-й группе — у 22 женщин (59,5%). Только у 5 женщин первой группы больных ХСН и СД 2 без предшествующего остеопороза на момент включения отмечено снижение МПК, отвечающее критерию остеопороза, за период наблюдения.
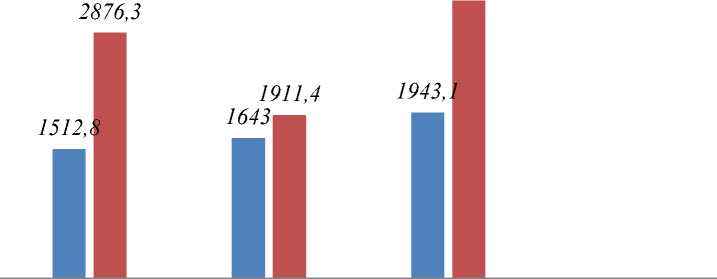
Уровни растворимых рецепторов TNF-α-SR1 и TNF-α-SR2 у пациентов первой-третей групп были достоверно выше (р<0,01), чем в контрольной группе. При этом уровни обоих рецепторов в 3-й группе были достоверно выше, чем у пациентов 1 и 2 групп (Рисунок 1).
3256,8
■ TNF-α-SR1 (пг/мл)
■ TNF-α-SR2 (пг/мл)
ХСН+СД2 ХСН+ОП ХСН+СД2+ОП
Рисунок 1. Результаты сравнительного анализа уровней TNF-α-SR1 и TNF-α-SR2 в исследуемых группах
По результатам исследования уровни TNF- α -SR1 и TNF- α -SR2 были разделены на четыре группы (Q1-Q4) в порядке возрастания концентрации. Риск, связанный с TNF- α -SR2, показал постепенное увеличение вероятности развития остеопороза, при этом соотношение шансов (ОR) увеличилось с 1,4 до 12,83. Однако статистически значимый риск наблюдался только для 3-4 квартиля. Уровень Q4 TNF- α -SR1 продемонстрировал существенное увеличение риска остеопоротических переломов, затрагивающих крупные кости скелета, а также значительное снижение МПК за 36 месяцев (OR=5,25, р=0,038).
По данным анализа потенциальных предикторов неблагоприятного течения остеопороза, вероятность развития остеопоротических переломов у пациентов с ХСН значительно увеличивается при применении петлевых диуретиков. Сообщалось, что соотношение шансов для этой ассоциации составило 6,29 с 95% доверительным интервалом 1,45-17,26 и значением р 0,015.
В контролируемом рандомизированном клиническом исследовании более высокие уровни растворимых рецепторов TNF-α-SR1 и TNF-α-SR2 в крови были обнаружены среди женщин в постменопаузе с сопутствующими заболеваниями, включая сердечную недостаточность (ХСН), диабет 2 типа и остеопороз, что связано с повышенным риском остеопоротических переломов (Рисунок 2).
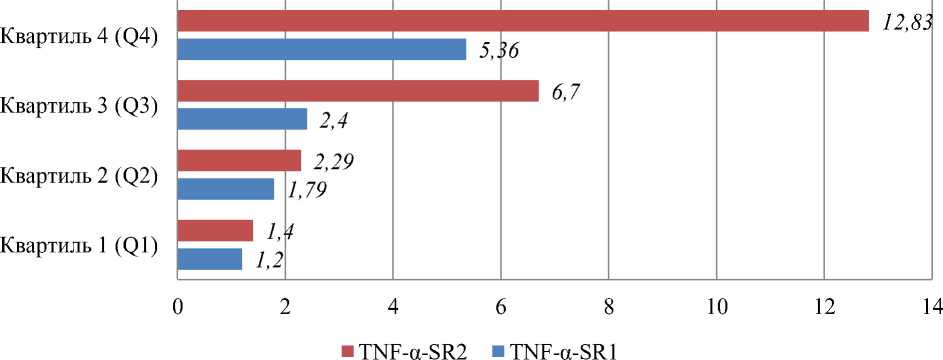
Рисунок 2. Потенциал уровней TNF-a-SR1 и TNF-a-SR2 в прогнозировании неблагоприятного исхода остеопороза
Особый интерес представляют исследования, посвященные роли рецепторов TNF-α в прогнозировании риска переломов. В исследовании, проведенном J. A. Cauley, прогностическая ценность TNF-α-SR1 и SR2 оказалась низкой [16]. Аналогичным образом, исследование S.W. Ing выявили, что женщины с самым высоким уровнем растворимых рецепторов TNF-α имели более чем двукратный повышенный риск перелома бедра, независимо от других факторов риска. Наши результаты по оценке влияния концентрации TNF-α-SR1 и SR2 на риск переломов согласуются с данными SW Ing. [17].
В совокупности эти результаты позволяют предположить, что использование препаратов, блокирующих действие TNF-α, может быть многообещающим подходом для профилактики и лечения остеопороза.
TNF-α является жизненно важным компонентом иммунной системы, ответственным за регулирование как врожденного, так и адаптивного иммунитета, а также способствующим инициированию и поддержанию воспаления. Макрофаги и иммунные клетки являются основными клеточными источниками TNF-α, которые активируются в ответ на инфекции или повреждение тканей. Следовательно, важно поддерживать регулируемую экспрессию этого цитокина для поддержания тканевого гомеостаза и борьбы с инфекциями.
Однако нерегулируемая экспрессия и передача сигналов TNF-α могут привести к патологическим состояниям, включая хроническое воспаление и повреждение тканей. Чтобы противодействовать провоспалительным и повреждающим ткани эффектам передачи сигналов TNF-α, были разработаны методы лечения, которые нейтрализуют его. Эта терапия против TNF-α эффективна при лечении аутоиммунных заболеваний, таких как ревматоидный артрит, псориаз и анкилозирующий спондилит. Несмотря на клинический успех терапии анти-ФНО, она не оказывает эффекта при лечении некоторых заболеваний, сопровождающихся аутоиммунным повреждением тканевых структур, таких как рассеянный склероз, и может вызывать серьезные побочные эффекты, в том числе оппортунистические инфекции, инвазивные грибковые инфекции, реактивацию туберкулеза, развитие других аутоиммунных заболеваний и лимфом [18]. Поэтому применение препаратов против ФНО ограничено и противопоказано по ряду параметров.
На эффекты анти-TNF-терапии могут влиять различные функции TNF-α, который связывается с двумя разными рецепторами: TNF-α-SR1 и TNF-α-SR2 [19]. B моделях заболеваний на животных удаление TNF-α-SR1 приводит к уменьшению или отсутствию заболевания, тогда как удаление TNF-α-SR2 усугубляет заболевание. Эти данные свидетельствуют о том, что передача сигналов TNF-а через TNF-α-SR1 в основном запускает проапоптотические и воспалительные реакции, тогда как TNF-α-SR2 способствует иммунной регуляции и регенерации тканей.
Повышенные уровни TNF обнаруживаются при ряде хронических заболеваний, включая воспалительные заболевания, при которых одобрена терапия против TNF. Помимо этого, терапия также применяется при других хронических заболеваниях, таких как сердечная недостаточность (СН) и остеопороз [13, 20]. Доклинические данные позволяют предположить, что нейтрализация TNF- α при СН может оказывать благоприятное влияние на течение заболевания. Однако клинические исследования антагонистов TNF-α показали негативное влияние на течение СН и увеличение смертности [21]. Исследования на мышах с активацией рецептора TNF- α показывают, что TNF- α -SR1 и TNF- α -SR2 оказывают противоположные эффекты на ремоделирование тканей, гипертрофию, воспаление и гибель клеток. Хотя активация TNF- α -SR1 усугубляет эти явления, активация TNF- α -SR2 оказывает благотворное влияние на эти процессы [22]. Другие исследования показывают, что после инфаркта миокарда активация TNF- α -SR1 усугубляет ремоделирование левого желудочка, в то время как состояние миокарда улучшается за счет передачи сигналов TNF- α -SR2 [23].
В целом эти данные указывают на то, что полная блокада TNF- α не рекомендуется при заболеваниях сердца из-за защитной роли, которую TNF- α играет. Таким образом, маловероятно, что терапия анти-ФНО будет эффективной для профилактики или лечения остеопороза у пациентов с хронической сердечной недостаточностью (ХСН).
В исследовании было обнаружено, что применение петлевых диуретиков связано с повышенным риском остеопоротических переломов у пациентов с ХСН. Петлевые диуретики действуют за счет увеличения количества кальция и магния, выделяемых с мочой, что приводит к их истощению и ускорению потери костной массы и повреждению микроархитектоники кости. Несколько исследований продемонстрировали сильную корреляцию между использованием петлевых диуретиков и снижением минеральной плотности костной ткани (МПК). Однако исследования взаимосвязи между петлевыми диуретиками и риском перелома бедра не всегда показали четкую связь [24-28], возможно, из-за различий в других факторах риска остеопороза и риска падения, вызванного гиповолемией и низким сердечным выбросом. среди участников исследования.
Заключение
Женщины в постменопаузе с хронической сердечной недостаточностью (XCH) и высоким уровнем растворимых рецепторов TNF-α-SR1 и TNF-α-SR2 подвергаются повышенному риску неблагоприятного исхода остеопороза. Стоит отметить, что применение петлевых диуретиков связано с более высокой вероятностью остеопоротических переломов у пациентов с ХСН.
Список литературы Факторы риска переломов костной ткани у больных с коморбидной патологией
- Ge G., Li J., Wang Q. Heart failure and fracture risk: a meta-analysis // Osteoporosis International. 2019. V. 30. P. 1903-1909. https://doi.org/10.1007/s00198-019-05042-2
- Abe H., Semba H., Takeda N. The roles of hypoxia signaling in the pathogenesis of cardiovascular diseases // Journal of atherosclerosis and thrombosis. 2017. V. 24. №9. P. 884-894. https://doi.org/10.5551/jat.RV17009
- Arnett T. R., Gibbons D. C., Utting J. C., Orriss I. R., Hoebertz A., Rosendaal M., Meghji S. Hypoxia is a major stimulator of osteoclast formation and bone resorption // Journal of cellular physiology. 2003. V. 196. №1. P. 2-8. https://doi.org/10.1002/jcp.10321
- Mo C., Ke J., Zhao D., Zhang B. Role of the renin–angiotensin–aldosterone system in bone metabolism // Journal of bone and mineral metabolism. 2020. V. 38. P. 772-779. https://doi.org/10.1007/s00774-020-01132-y
- Beavan S., Horner A., Bord S., Ireland D., Compston J. Colocalization of glucocorticoid and mineralocorticoid receptors in human bone // Journal of Bone and Mineral Research. 2001. V. 16. №8. P. 1496-1504.. https://doi.org/10.1359/jbmr.2001.16.8.1496
- Patel R. B., Fonarow G. C., Greene S. J., Zhang S., Alhanti B., DeVore A. D., Vaduganathan M. Kidney function and outcomes in patients hospitalized with heart failure // Journal of the American College of Cardiology. 2021. V. 78. №4. P. 330-343. https://doi.org/10.1016/j.jacc.2021.05.002
- Herrmann M., Engelke K., Ebert R., Müller-Deubert S., Rudert M., Ziouti F., Jakob F. Interactions between muscle and bone - where physics meets biology // Biomolecules. 2020. V. 10. №3. P. 432. https://doi.org/10.3390/biom10030432
- Clynes M. A., Gregson C. L., Bruyère O., Cooper C., Dennison E. M. Osteosarcopenia: where osteoporosis and sarcopenia collide // Rheumatology. 2021. V. 60. №2. P. 529-537. https://doi.org/10.1093/rheumatology/keaa755
- Jia J., Zhou H., Zeng X., Feng S. Estrogen stimulates osteoprotegerin expression via the suppression of miR-145 expression in MG-63 cells // Molecular medicine reports. 2017. V. 15. №4. P. 1539-1546. https://doi.org/10.3892/mmr.2017.6168
- Pandey A., Khan Y. A., Kushwaha S. S., Mohammed F., Verma A. Role of serum osteoprotegerin as a diagnostic indicator of primary osteoporosis in perimenopausal and postmenopausal women: an Indian perspective // Malaysian orthopaedic journal. 2018. V. 12. №1. P. 31. https://doi.org/10.5704%2FMOJ.1803.006
- Shilov S. N., Teplyakov A. T., Yakovleva I. L. Clinical and pathogenetic relationship of chronic heart failure, type 2 diabetes mellitus and osteoporosis. Complex problems of cardiovascular diseases. // Russ. 2018. V. 10. P. 2306-1278.
- Aramburu-Bodas Ó., García-Casado B., Salamanca-Bautista P., Guisado-Espartero M. E., Arias-Jiménez J. L., Barco-Sánchez A., Manzano L. Relationship between osteoprotegerin and mortality in decompensated heart failure with preserved ejection fraction // Journal of cardiovascular medicine. 2015. V. 16. №6. P. 438-443. https://doi.org/10.2459/JCM.0000000000000229
- Hanna A., Frangogiannis N. G. Inflammatory cytokines and chemokines as therapeutic targets in heart failure // Cardiovascular Drugs and Therapy. 2020. V. 34. №6. P. 849-863. https://doi.org/10.1007/s10557-020-07071-0
- Ing S. W., Orchard T. S., Lu B., LaMonte M. J., Barbour K. E., Cauley J. A., Jackson R. D. TNF receptors predict hip fracture risk in the WHI study and fatty acid intake does not modify this association // The Journal of Clinical Endocrinology & Metabolism. 2015. V. 100. №9. P. 3380-3387. https://doi.org/10.1210/JC.2015-1662
- Kindle L., Rothe L., Kriss M., Osdoby P., Collin-Osdoby, P. Human microvascular endothelial cell activation by IL-1 and TNF-α stimulates the adhesion and transendothelial migration of circulating human CD14+ monocytes that develop with rankl into functional osteoclasts // Journal of Bone and Mineral Research. 2006. V. 21. №2. P. 193-206. https://doi.org/10.1359/JBMR.051027
- Cauley J. A., Danielson M. E., Boudreau R. M., Forrest K. Y., Zmuda J. M., Pahor M., Newman A. B. Inflammatory markers and incident fracture risk in older men and women: the Health Aging and Body Composition Study // Journal of bone and mineral research. 2007. V. 22. №7. P. 1088-1095. https://doi.org/10.1359/jbmr.070409
- Ing S. W., Orchard T. S., Lu B., LaMonte M. J., Barbour K. E., Cauley J. A., Jackson R. D. TNF receptors predict hip fracture risk in the WHI study and fatty acid intake does not modify this association // The Journal of Clinical Endocrinology & Metabolism. 2015. V. 100. №9. P. 3380-3387. https://doi.org/10.1210/JC.2015-1662
- Monaco C., Nanchahal J., Taylor P., Feldmann M. Anti-TNF therapy: past, present and future // International immunology. 2015. V. 27. №1. P. 55-62. https://doi.org/10.1093/intimm/dxu102
- Fischer R., Marsal J., Guttà C., Eisler S. A., Peters N., Bethea J. R., Kontermann R. E. Novel strategies to mimic transmembrane tumor necrosis factor-dependent activation of tumor necrosis factor receptor 2 // Scientific Reports. 2017. V. 7. №1. P. 6607. https://doi.org/10.1038/s41598-017-06993-4
- Шилов С. Н., Березикова Е. Н., Самсонова Е. Н., Попова А. А., Яковлева И. В., Молоков А. В., Шмидт Г. Влияние растворимых рецепторов фактора некроза опухоли-α на течение коморбидной патологии: хронической сердечной недостаточности, ассоциированной с сахарным диабетом 2-го типа и остеопорозом // Сибирский медицинский вестник. 2020. №3. С. 30-35. EDN: FZYKEW
- Mann D. L. Inflammatory mediators and the failing heart: past, present, and the foreseeable future // Circulation research. 2002. V. 91. №11. P. 988-998. https://doi.org/10.1161/01.RES.0000043825.01705.1B
- Hamid T., Gu Y., Ortines R. V., Bhattacharya C., Wang G., Xuan Y. T., Prabhu S. D. Divergent tumor necrosis factor receptor–related remodeling responses in heart failure: role of nuclear factor-κB and inflammatory activation // Circulation. 2009. V. 119. №10. P. 1386-1397. https://doi.org/10.1161/CIRCULATIONAHA.108.802918
- Monden Y., Kubota T., Inoue T., Tsutsumi T., Kawano S., Ide T., Sunagawa K. Tumor necrosis factor-α is toxic via receptor 1 and protective via receptor 2 in a murine model of myocardial infarction // American Journal of Physiology-Heart and Circulatory Physiology. 2007. V. 293. №1. P. H743-H753. https://doi.org/10.1152/ajpheart.00166.2007
- Heidrich F. E., Stergachis A., Gross K. M. Diuretic drug use and the risk for hip fracture // Annals of internal medicine. 1991. V. 115. №1. P. 1-6. https://doi.org/10.7326/0003-4819-115-1-1
- Corrao G., Mazzola P., Monzio Compagnoni M., Rea F., Merlino L., Annoni G., Mancia G. Antihypertensive medications, loop diuretics, and risk of hip fracture in the elderly: a populationbased cohort study of 81,617 Italian patients newly treated between 2005 and 2009 // Drugs & aging. 2015. V. 32. P. 927-936. https://doi.org/10.1007/s40266-015-0306-5
- Lai S. W., Cheng K. C., Lin C. L., Liao K. F. Furosemide use and acute risk of hip fracture in older people: A nationwide case–control study in Taiwan // Geriatrics & Gerontology International. 2017. V. 17. №12. P. 2552-2558. https://doi.org/10.1111/ggi.13087
- Rejnmark L., Vestergaard P., Heickendorff L., Andreasen F., Mosekilde L. Loop diuretics increase bone turnover and decrease BMD in osteopenic postmenopausal women: results from a randomized controlled study with bumetanide // Journal of bone and mineral research. 2006. V. 21. №1. P. 163-170. https://doi.org/10.1359/JBMR.051003
- 28 Lim L. S., Fink H. A., Kuskowski M. A., Taylor B. C., Schousboe J. T., Ensrud K. E. Loop diuretic use and increased rates of hip bone loss in older men: the Osteoporotic Fractures in Men Study // Archives of internal medicine. 2008. V. 168. №7. P. 735-740. https://doi.org/10.1001/archinte.168.7.735


