Факторы риска развития рецидива перипротезной инфекции у пациентов с гемофилией
Автор: Ким А.Ю., Суримова В.А., Зоренко В.Ю., Клясова Г.А., Куликов С.М.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 5 т.15, 2025 года.
Бесплатный доступ
Актуальность. Эндопротезирование суставов – хирургический метод терапии деформирующего артроза, применение которого увеличивается с каждым годом. С улучшением доступности заместительной терапии для пациентов с гемофилией эндопротезирование стало эффективным методом терапии гемофилической артропатии. С ростом количества операций неизбежно растёт количество осложнений, одним из которых является перипротезная инфекция. Важной проблемой являются рецидивы инфекции, которые по международным данным могут достигать 23,1%. В случае больных гемофилией доля рецидивирующих инфекций сотавляет 50%. Факторы риска развития рецидива перипротезной инфекции у пациентов с гемофилией требуют дополнительного изучения, которое позволит профилактировать инфекционные осложнения после эндопротезирования суставов. Цель: проанализировать перипротезные инфекции у пациентов с гемофилией и рецидивы данного осложнения, а также оценить влияние различных факторов риска на вероятность развития рецидива. Материалы и методы. В ретроспективном исследовании проанализированы случаи перипротезной инфекции у пациентов с гемофилией, которым в период с 2015 по 2024 гг. было выполнено хирургическое лечение. Выявлены факторы риска при дебюте заболевания и оценено их влияние на вероятность развития рецидива инфекции. Результаты. Проанализировано 102 оперативных вмешательства у 47 пациентов. Рецидивы перипротезита возникли в 56,9% случаев. Общая вероятность рецидива растет к 40 месяцу после вмешательства до 64%. При гемофилии В вероятность рецидива к 12 месяцам достигает 71%. Наиболее подверженная риску возрастная группа – пациенты с дебютом в возрасте 60 лет и старше. Одноэтапный протокол терапии имеет наиболее высокий шанс рецидива. Поражённый сустав, антибиотикорезистентность возбудителя, маркеры вирусного гепатита не имели значительного влияния. Интраоперационная кровопотеря менее 400 мл увеличивает риск рецидива инфекции. Ревизионный статус протеза повышает вероятность развития рецидива в 2,86 раза. Полимикробная инфекция имеет более высокие шансы развития рецидива. Выводы. Были получены значимые корреляции между некоторыми факторами риска, в частности: гемофилия В и одноэтапный протокол лечения с сохранением протеза увеличивают риск развития рецидива. Статус протеза, количество возбудителей и возраст пациентов увеличивают вероятность рецидива, что согласуется с данными мировой литературы. Интраоперационная кровопотеря, вероятнее всего, нерелевантный фактор, так как не учитывает общую кровопотерю.
Перипротезная инфекция [D016459], гемофилия [D006467], эндопротезирование суставов [D019643], рецидив [D012008], факторы риска [D012307], артропатия [D001168], послеоперационные осложнения [D011183], реэндопротезирование [D012086], полимикробная инфекция [D060085], антибиотикотерапия [D000900]
Короткий адрес: https://sciup.org/143185327
IDR: 143185327 | УДК: 616.7-18.5/.6-089.844-06-022.7:616.151.5 | DOI: 10.20340/vmi-rvz.2025.5.CLIN.5
Текст научной статьи Факторы риска развития рецидива перипротезной инфекции у пациентов с гемофилией
ОРИГИНАЛЬНАЯ СТАТЬЯ
Эндопротезирование является наиболее результативным методом лечения терминальной стадии деформирующего артроза, а его применение демонстрирует устойчивую тенденцию к росту. По прогнозам, к 2030 году в США количество таких операций увеличится: для коленного сустава — с 572 000 до 633 000, а для тазобедренного — с 1,16 до 3,48 миллиона [1]. Аналогичный рост ожидается и в европейских странах, включая Англию и Германию, где также предсказывается увеличение числа подобных хирургических вмешательств [2, 3].
С увеличением количества операций возрастает и частота осложнений, требующих проведения ревизионных вмешательств. По данным некоторых исследователей, их доля может достигнуть 10% от общего числа первичных эндопротезирований, что эквивалентно примерно 400 000 случаям ежегодно. Одним из главных факторов, обуславливающих необходимость повторных операций, является пе-рипротезная инфекция (ППИ). Согласно прогнозам, к 2030 году именно ППИ станет основной причиной выполнения ревизионных вмешательств [4].
В увеличении количества проводимых артропластик также сыграли роль пациенты с соматиче- скими заболеваниями, например пациенты с врождёнными коагулопатиями. Разработка концентратов свертывания крови и создание специализированных стационаров значительно улучшили доступность эндопротезирования как основного метода лечения пациентов с гемофилией на терминальной стадии гемофилической артропатии. В то же время эти нововведения привели к увеличению частоты осложнений.
Гемофилия представляет собой врождённое нарушение плазменного гемостаза, сцепленное с Х-хромосомой, и возникает в результате дефицита или отсутствия фактора свертывания крови VIII (FVIII) — гемофилия А, или фактора свертывания крови IX (FIX) — гемофилия В.
Основным клиническим проявлением заболевания являются спонтанные или травматические гематомы и гемартрозы. Без адекватного лечения многократные кровоизлияния в суставы и ткани неизбежно приводят к выраженным деформациям и прогрессированию гемофилической артропатии.
Профилактика гемофилической артропатии основывается на непрерывной и адекватной заместительной терапии препаратами дефицитных факторов свертывания, в то время как эндопротезирова- ние остаётся единственным методом лечения терминальных стадий заболевания [5].
По данным отделения травматологии и реконструктивно-восстановительной ортопедии для пациентов с гемофилией в Национальном медицинском исследовательском центре гематологии в период с 1992 по 2014 год из 675 эндопротезирований 59 (8,8%) пациентам потребовалось ревизионное эндопротезирование, у 18 (3%) пациентов развились инфекционные осложнения, у 9/18 (50%) после ревизионного эндопротезирования (второго этапа лечения ППИ) развился рецидив инфекции [6]. Перипротезит и его рецидивы приводят к глубокой инвалидизации пациентов, и данной проблеме посвящено не так много работ в виду малого объёма когорты. Исследования проводятся как анализ опыта эндопротезирования пациентов гемофилией в неспециализированных отделениях и долгосрочные результаты лечения, поэтому ППИ в этих исследованиях фигурирует как осложнение, а причины и факторы риска рецидива не изучались вовсе [7, 8].
Вопросу рецидивирующего течения ППИ и факторов риска развития рецидива в общей популяции посвящено множество работ.
В ретроспективном исследовании Chen Y.C. и со-авт. изучался вопрос факторов риска неудачи лечения после двухэтапного лечения ППИ коленных суставов. Необходимость повторной операции по причине инфекции (рецидив) или смертность, связанная с ППИ, расценивались как неудачи терапии. Наиболее влиятельными факторами риска установлены мужской пол и положительная интраоперационная культура во время реимплантации. Исследователи отмечают, что рецидив чаще всего вызывался новыми патогенами, а одноэтапный протокол (DAIR – Debridement, Antibiotics, and Implant Retention) демонстрировал высокую выживаемость протеза при соблюдении сроков протокола [9].
Однако, Knoll L. и соавт. при сравнении ППИ разного генеза (гематогенная/негематогенная) выявили единственный независимый фактор риска развития рецидива/летальности в течение 6 лет для обеих групп – сохранение протеза, что говорит о повышении риска при использовании протокола DAIR. Также авторы отмечают достоверное увеличение количества рецидивов при гематогенной инфекции [10].
Опубликовано большое число исследований клинического опыта работы отделений, например исследование Lee D. W. и соавт. с анализом работы департамента ортопедии больницы Сеульского национального университета [11]. Проводился ретроспективный анализ 65 случаев двухэтапной терапии ППИ коленного сустава с последующей оценкой исходов и факторов риска неудачи терапии. Рецидив ППИ после двухэтапного реэндопротезирования коленного сустава возникает в 23,1% случаев. К ключевым факторам риска отнесены: ревизионный статус протеза, полимикробная инфекция и высокая скорость оседания эритроцитов в предоперационном периоде.
Изучению факторов риска, влияющих на развитие рецидивов ППИ посвящён метаанализ Bhanushali A. и соавт., где оценивались пациенты без рецидивов и пациенты с персистирующей инфекцией после двухэтапной терапии ППИ тазобедренного сустава. Авторы выявили, что ожирение, цирроз печени, ревизионный статус протеза, курение или внутривенное употребление наркотиков повышают риск развития рецидива [12].
Вопросу эффективности протокола DAIR уделены отдельные работы. Так, Sun Y. и соавт. опубликовали систематический обзор прогноза одно- и двухэтапной тактики лечения ППИ. Исследователи пришли к выводу, что при использовании одноэтапного протокола количество рецидивов на 31% ниже [13].
Однако, среди исследований о факторах риска развития и частоте рецидивов ППИ нет работ, где бы изучалась когорта пациентов с гемофилией, хотя и частота рецидивов у данной группы выше в сравнении с общей популяцией [6].
ППИ у пациентов с гемофилией после тотального эндопротезирования крупных суставов развиваются с большей частотой и часто рецидивируют. Причины увеличения частоты рецидивов требуют дальнейшего исследования для разработки эффективных мер профилактики и улучшения результатов лечения.
Цель: оценить влияние различных факторов риска на вероятность развития рецидива ППИ у пациентов с гемофилией.
Задачи
Определить частоту развития рецидива ППИ у пациентов с гемофилией.
Выявить доступные для анализа факторы риска.
Провести анализ влияния каждого фактора на вероятность развития рецидива.
Материалы и методы
Проведён ретроспективный анализ 102 прооперированных ППИ у 47 пациентов, получавших лечение в ФГБУ «НМИЦ гематологии» Минздрава России с 2015 по 2024 гг. Критериями включения в исследование были: установленный диагноз гемофилии А или гемофилии В; диагностированная в условиях стационара ППИ. Для анализа использовали прото- колы операций, результаты микробиологических исследований и данные историй болезней.
Классификация случаев ППИ производилась по предшествующему анамнезу:
-
• Впервые выявленные инфекции.
-
• Рецидивы ППИ на том же суставе после 2-го этапа лечения – ревизионного эндопротезирования.
-
• Рецидивы ППИ после 1-го этапа лечения – установки артикулирующего/цементного спейсера. Данное событие оценивалось как осложнённое течение заболевания.
-
• Нарушение репаративных процессов в послеоперационном периоде (зияние краёв раны или формирование новых свищевых ходов), потребовавшее некрэктомии в рамках текущей госпитализации. Указанные осложнения интерпретированы как критерии резистентного инфекционного процесса, требовавшие коррекции терапевтической стратегии.
В случаях первичной ППИ, симптомы которой возникли в течение 30 дней после эндопротезирования, использовали одноэтапный протокол лечения с радикальной санацией и сохранением протеза, установкой проточной системы с растворами антисептиков (диоксидин или полигексадин) и длительной антибиотикотерапией. В остальных случаях выполняли двухэтапную ревизию с использованием артикулирующего или цементного спейсера (костным цементом с добавлением гентамицина).
Забор материала производился на каждом этапе лечения:
-
• Подготовка к операции – синовиальная жидкость.
При наличии свищевого хода осуществляли забор экссудата. В отсутствии свища проводили аспирацию суставной жидкости посредством пункции. По актуальным клиническим рекомендациям предпочтительно пункционное взятие материала, вместо отделяемого из свища, однако наша работа подразумевает ретроспективный сбор данных с 2015 года, поэтому возможны несовпадения с актуальными рекомендациями [15].
-
• Операция – биоптат и/или раневое отделяемое.
Интраоперационно отбирали 3–5 образцов максимально инфицированных тканей (визуальная оценка) в зоне кость–цемент, а также раневого отделяемого.
-
• Послеоперационное лечение – раневое отделяемое.
При наличии экссудации из послеоперационной раны материал отбирали с учётом продолжающейся антимикробной терапии.
В дальнейшем производился посев биоматериалов на питательные среды с последующей вери- фикацией при росте культур, с дальнейшим определением категории антибиотикорезистентности возбудителей в соответствии с актуальными на момент исследования критериями Института клинических и лабораторных стандартов США и Европейского комитета по определению чувствительности к антибиотикам. При анализе данные результаты скорректированы в соответствии с российскими рекомендациями определения чувствительности микроорганизмов к антимикробным препаратам [16].
Среди доступных факторов для проведения факторного анализа производилось исследование следующих:
-
• Тип коагулопатии:
-
- наследственный дефицит фактора VIII;
-
- наследственный дефицит фактора IX;
-
- ингибиторная форма гемофилии А.
-
• Возраст. Классификация возрастных групп согласно ВОЗ:
-
- до 40 лет;
-
- 40-60 лет;
-
- 60 лет и старше.
-
• Оперируемый сустав. Инфицирование смежных суставов встречалось в единичных случаях, которые являлись формами некупируемой инфекции, поэтому являются не репрезентативными. Инфицирование других протезированных суставов за данный период не встречалось:
-
- коленный сустав;
-
- тазобедренный сустав.
-
• Хирургическая тактика. Так как в данной работе не ставится вопрос сравнения эффективности протоколов лечения, хирургические тактики рассматривались исключительно для оценки влияния на вероятность рецидива.
-
- Цементный спейсер/артикулирующий спейсер (рассматривались как разные типы тактик).
-
- Проточно-промывная система (одноэтапный протокол DAIR).
-
- Цементный спейсер совместно с проточнопромывной системой. Данная тактика применялась при злокачественном резистентном течении инфекции.
-
• Лабораторное обнаружение возбудителя. Обнаруженных возбудителей также делили по чувствительности к антибиотикам.
-
- возбудитель не обнаружен;
-
- чувствительные изоляты;
-
- резистентные изоляты (лабораторно подтвержденная резистентность к одному и более антибиотику).
-
• Наличие маркеров перенесённого гепатита:
-
- серологически обнаруженные антитела к вирусному гепатиту В/С;
-
- без антител.
-
• Статус протеза. Подразумевается кратность операции, предшествующей дебюту ППИ:
-
- первичный;
-
- ревизионный.
-
• Количество обнаруженных возбудителей. Учёт возбудителей за весь период лечения:
-
- возбудитель не обнаружен;
-
- один возбудитель;
-
- два и более возбудителя.
-
• Кровопотеря более 400 мл. Косвенный признак проведённых гемотрансфузий в послеоперационном периоде.
-
- более 400 мл;
-
- менее 400 мл.
Все собираемые данные являются факторами риска развития ППИ и согласно выводам II Международной согласительной конференции по пери-протезной инфекции суставов [17].
Для анализа полученных данных применялись классические методы частотного анализа. Для анализа таблиц сопряжённости использовали критерий Фишера. Результаты считали достоверными при значении p<0,05.
Анализ долгосрочных результатов терапии проводили с помощью процедур событийного анализа: оценок выживаемости Каплана – Мейера и модели пропорциональных рисков Кокса.
Для статистической обработки данных использовали Python 3.12.4 и процедуры статистического пакета программ SAS 9.4 (SAS Institute Inc., Cary, NC, США).
Результаты
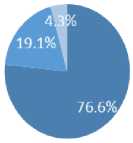
Распределение по типу гемофилии следующее:
-
• Наследственный дефицит фактора VIII – 36 пациентов.
-
• Наследственный дефицит фактора IX – 9 пациентов.
-
• Гемофилия А, ингибиторная форма – 2 пациента.
Возрастной диапазон на момент дебюта заболевания составлял от 29 до 66 лет, медианный возраст – 41 год.
-
■ гемофилия А/ hemophilia А
-
■ гемофилия B/hemophilia В
ш ингибиторная форма гемофилии А/ inhibitor form of hemophilia A Рисунок 1. Распределение пациентов по типу гемофилии Figure 1. Distribution of patients by type of hemophilia
По предшествующему анамнезу операции разделились следующим образом:
-
• Первичная ППИ – 44 операции (43,1%).
-
• Рецидивы перипротезита – 23 операции
(22,5%).
-
• Рецидивы после имплантации спейсера – 14
операций (13,7%).
-
• Некрэктомии – 21 оперативное вмешательство (20,6%).
Выполнено 333 микробиологических исследования:
-
• Биоптат – 60/333 образцов (18,0%), 37/60 – отрицательные (61,7%).
-
• Раневое отделяемое – 273/333 исследований (82,0%), 160/273 с отрицательным результатом (58,6%).
По количеству рецидивов распределение следующее:
-
• без рецидивов – 21 пациент (51,2%);
-
• 1 рецидив – 11 пациентов (26,8%);
-
• 2 рецидива – 4 пациента (9,7%);
-
• 3 рецидива – 1 пациент (2,4%);
-
• 4 рецидива – 1 пациент (2,4%);
-
• 5 рецидивов – 1 пациент (2,4%);
-
• 8 рецидивов – 2 пациента (4,8%).
Среди положительных проб были обнаружены возбудители, представленные в таблице 1.
Таблица 1. Выявленные возбудители ППИ
Table 1. Identified pathogens of PPI
Возбудитель Кол-во изолятов Частота (%)
Грамположительные
|
Staphylococcus aureus |
47 |
28,1 |
|
Staphylococcus epidermidis |
32 |
19,2 |
|
Enterococcus faecalis |
18 |
10,8 |
|
Staphylococcus lugdunensis |
7 |
4,2 |
|
Streptococcus agalactiae |
6 |
3,6 |
|
Streptococcus oralis |
6 |
3,6 |
|
Staphylococcus haemolyticus |
4 |
2,4 |
|
Streptococcus dysgalactiae |
4 |
2,4 |
|
Staphylococcus hominis |
3 |
1,8 |
|
Corynebacterium amycolatum |
3 |
1,8 |
|
Streptococcus mitis |
2 |
1,2 |
|
Corynebacterium striatum |
2 |
1,2 |
|
Staphylococcus caprae |
1 |
0,6 |
|
Staphylococcus capitis |
1 |
0,6 |
|
Staphylococcus intermedius |
1 |
0,6 |
|
Staphylococcus schleiferi |
1 |
0,6 |
|
Enterococcus raffinosus |
1 |
0,6 |
|
Грамотрицательные |
||
|
Pseudomonas aeruginosa |
7 |
4,2 |
|
Enterobacter cloacae |
5 |
3 |
|
Proteus mirabilis |
4 |
2,4 |
|
Klebsiella pneumoniae |
3 |
1,8 |
|
Stenotrophomonas maltophilia |
2 |
1,2 |
|
Pantoea calida |
1 |
0,6 |
|
Acinetobacter baumannii |
1 |
0,6 |
|
Грибы |
||
|
Candida parapsilosis |
4 |
2,4 |
Используя статистические методы, описанные выше, были получены следующие результаты.
Влияние типа коагулопатии на вероятность развития рецидива представлена на рисунке 2.
Для группы гемофилии В все случаи рецидивов происходят в первый год после операции, и к 12 месяцам вероятность рецидива достигает 71%. Для гемофилии А рецидивы развиваются на всём периоде наблюдений и только к 40 месяцу достигают сопоставимой с группой В вероятности (63%). Ингибиторная форма гемофилии А в выборке представлена двумя случаями особо тяжёлого течения
ППИ, которые привели к ранним рецидивам и ампутации конечности.
Влияние возраста на вероятность рецидива представлена на рисунке 3.
Все наблюдаемые рецидивы в группе 60+ происходят в первый год после первичной инфекции, вероятность развития рецидива в данной группе также значимо выше по сравнению с остальными возрастными группами и достигает 79% (p=0,02).
Итоговая вероятность развития рецидива и темп развития в группах до 40 лет и 40–60 лет сопоставимы, итоговая вероятность к концу наблюдения 63% и 60% соответственно.
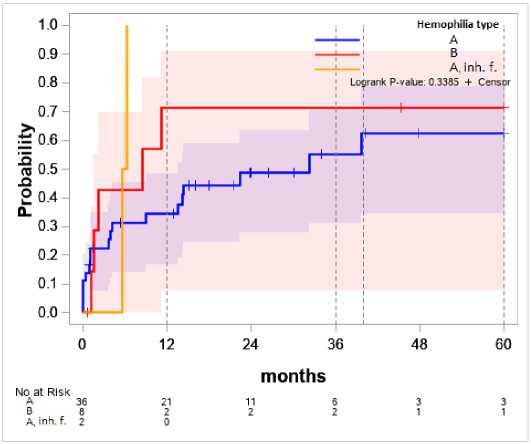
Рисунок 2. Зависимость типа коагулопатии и вероятности рецидива. A, inh. f. – гемофилия А, ингибиторная форма
Figure 2. Correlation between the type of coagulopathy and the probability of relapse. A, inh. f. – inhibitor form of the haemophilia A
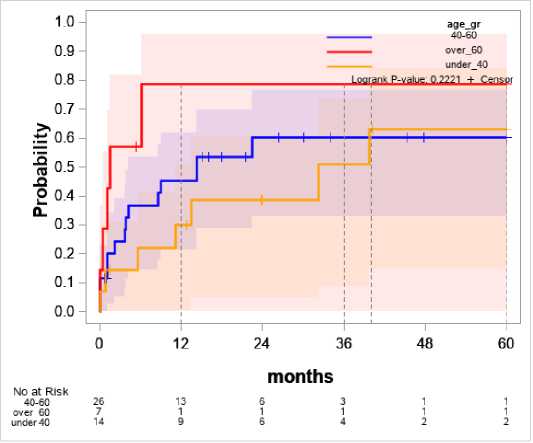
Рисунок 3. Зависимость возраста и вероятности рецидива Figure 3. Correlation between age and probability of relapse over_60 – старше 60 лет under_40 – моложе 40 лет
Влияние выбранной хирургической тактики на риск рецидива (рис. 4)
Использование проточно-промывной системы с сохранением протеза повышает риск развития рецидива в первый год (только в одном случае рецидив произошел позднее 12 месяцев) и является самым неэффективным способом лечения в нашей выборке – к 24 месяцу вероятность 85%. Сопоставимая вероятность к 36-му месяцу выявлена при использовании цементного спейсера – 77%. Значимо эффективнее использование артикулирующего спейсера – к 36-му месяцу 35% вероятность (p=0,003). Двум пациентам выполнили операции с использованием одновременно промывной системы и цементного спейсера – у обоих произошёл рецидив в первые месяцы.
Пораженный сустав (рис. 5)
Значимой разницы в вероятности развития рецидива в зависимости от оперируемого сустава не обнаружено, однако к 36-му месяцу вероятность рецидива в случае поражения тазобедренного сустава ниже, чем в случае коленного – 43% и 63% соответственно.
Обнаружение возбудителя и чувствительность к антибиотикам (рис. 6)
Так как установленные возбудители отличаются высоким разнообразием, факторный анализ индивидуальной резистентности к антибиотикам каждого изолята рассматривать затруднительно. Для наглядности результатов собранные биоматериалы объединены в три группы, влияние которых рассматривалось отдельно.
Не обнаружена ассоциация с наличием анти-биотикорезистентности и вероятностью развития рецидива.
Наличие маркеров перенесенного вирусного гепатита В/С (рис. 7)
Рассматривалось наличие других хронических инфекций, но, кроме единичного кариеса, основным исследуемым параметром стал вирусный гепатит.
Не обнаружено существенных различий в вероятности повторной операции в зависимости от наличия маркеров перенесённого вирусного гепатита.
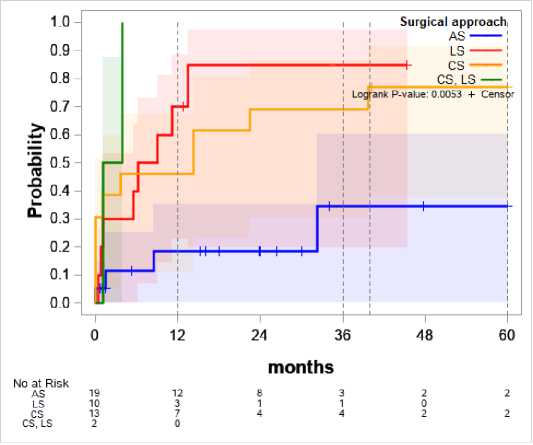
Рисунок 4. Зависимость хирургической тактики и вероятности рецидива
Figure 4. Correlation of surgical tactics and the probability of relapse
AS – articulating spacer – артикулирующий спейсер
LS – lavage system – проточно-промывная система
CS – cement spacer – цементный спейсер
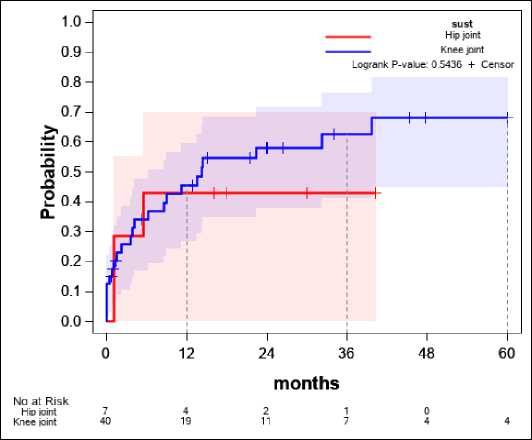
Рисунок 5. Зависимость оперируемого сустава и вероятности рецидива
Figure 5. Correlation between the operated joint and the probability of relapse
- Susceptible isolates - No pathogen detected
Resistant isolates _ogrank P-value: 0.9179 + Censor
No at Risk
Susceptible isolates No pathogen detected Resistant isolates
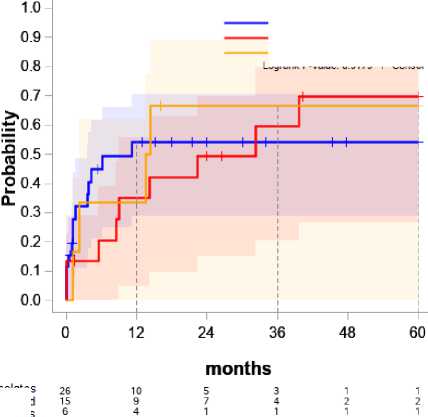
Рисунок 6. Зависимость резистентности возбудителя и вероятности рецидива
Figure 6. Correlation between pathogen resistance and the likelihood of relapse
Susceptible isolates – чувствительные изоляты
No pathogen detected – патогены не обнаружены
Resistant isolates – резистентные изоляты
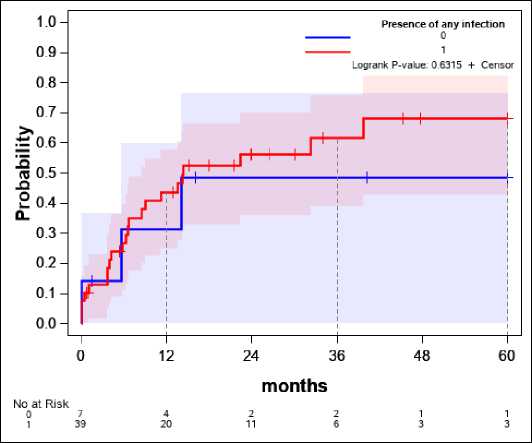
Рисунок 7. Зависимость наличия других инфекций и вероятности рецидива
Presence of any infection – наличие любой инфекции
Figure 7. Correlation between the presence of other infections and the probability of relapse
Интраоперационная кровопотеря (рис. 8)
При интраоперационной кровопотере менее 400 мл риск к первым 12 месяцам достигает 55% и 70% к 36 месяцам. В то же время риск рецидива при кровопотере более 400 мл только к 60 месяцу достигает 53%.
Статус протеза (рис. 9)
В случае, если операция, предшествовавшая дебюту, имела ревизионный статус, то риск повторного вмешательства оценивался в 2,86 раза выше.
Количество установленных возбудителей (рис. 10)
Полиинфекция имеет более высокий риск в первые 12 месяцев, однако моноинфекция и ППИ без обнаруженного возбудителя к 36 месяцу увеличивают вероятность рецидива в равной степени.
Общая вероятность рецидива
Если проанализировать вероятность повторной операции, то можно сделать вывод, что вероятность повторной операции на сроке 12 месяцев от первичной составляет 44%, на сроке 36 месяцев – 59%, на сроке 40 месяцев – 64% и после 40 месяцев вероятность повторных операций уже не увеличивается.
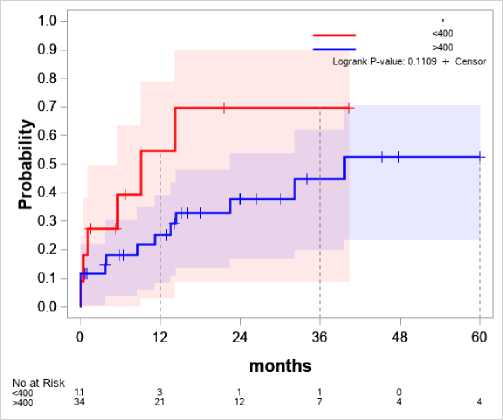
Рисунок 8. Зависимость интраоперационной кровопотери и вероятности рецидива
Figure 8. Correlation between intraoperative blood loss and the likelihood of recurrence
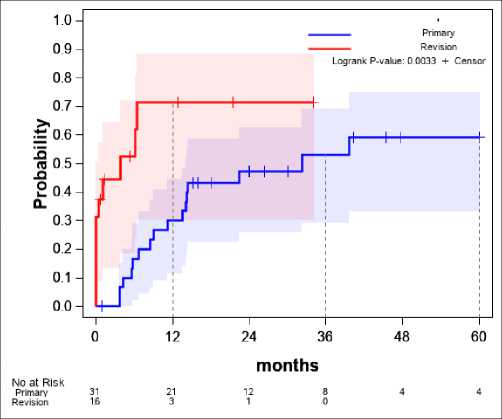
Рисунок 9. Зависимость статуса протеза и вероятности рецидива
Figure 9. Correlation between prosthesis status and the likelihood of relapse
Primary – первичный статус
Revision – ревизионный статус
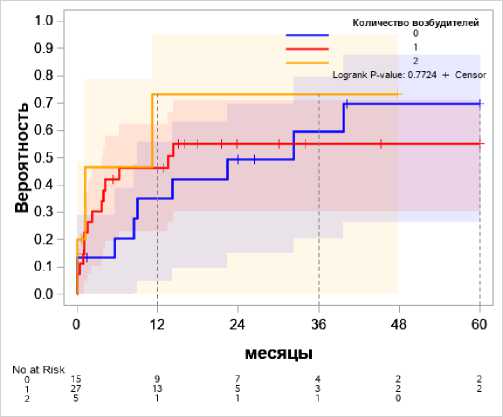
Рисунок 10. Зависимость количества возбудителей и вероятности рецидива
Figure 10. Correlation between the number of pathogens and the probability of relapse
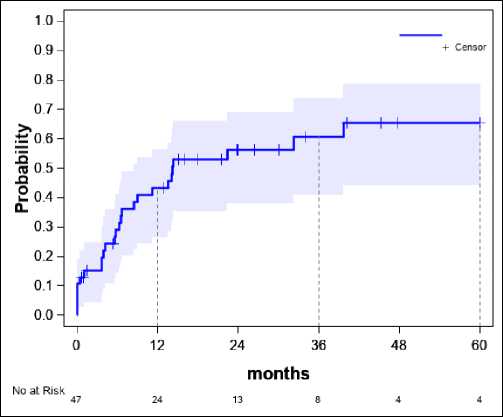
Рисунок 11. Общая вероятность рецидива
Figure 11. Overall probability of relapse
Обсуждение
Количество пациентов с гемофилией В составляет около 20%, что соответствует общей эпидемиологии заболевания.
Медианный возраст пациентов с гемофилией и развившейся ППИ заметно ниже, чем в общей популяции согласно российским исследованиям [18].
Рассматривая развившиеся ППИ с учётом анамнеза, обращает на себя внимание, несмотря на преобладание первичной ППИ, количество рецидивов, а особенно рецидивов с установленным спейсером, что свидетельствует о тяжёлом течении заболевания, которое может рецидивировать даже после санации и удаления металлоконструкций. Некрэктомии, ввиду неудовлетворительного заживления, в том числе говорят о резистентной инфекции, однако в последующем целесообразен учёт таких операций не как отдельных единиц, а как факторов риска. Однако в выборке есть пациенты, течение ППИ которых имело злокачественный характер, и некрэктомии проводились в течение полугода с момента удаления эндопротеза до ампутации конечности.
Наиболее частым возбудителем ППИ у больных гемофилией являлись S. epidermidis и S. aureus , что соответствует результатам отечественных исследований [18], однако наблюдается высокое разнообразие возбудителей.
Рассматривая факторный анализ, в частности влияние типа коагулопатии на вероятность рецидива, обращает на себя внимание разница между типами гемофилий, где при наследственном дефиците IX фактора свертывания крови вероятность рецидива достигает своего пика к 12 месяцам и превосходит таковой риск при наследственном дефиците VIII фактора свертывания крови даже к 40 месяцам после дебюта. В выборку с ингибиторной формой попали только два пациента, что ограничивает репрезентативность полученных результатов.
Возрастная стратификация подтверждает выводы II согласительной конференции по ППИ [17] о том, что возраст старше 60 лет повышает вероятность развития ППИ и её персистирующего течения. Однако интерес представляет и то, что более молодой возраст (до 40 лет) сопоставим по рискам с более старшей группой. То есть влияние данного фактора не линейное.
Хотя, по данным мировых исследований [9], одноэтапный протокол DAIR с сохранением протеза улучшает результаты лечения, анализ использования этого протокола у пациентов с гемофилией показывает противоположный результат. Также вызывает интерес большая разница в эффективности использования артикулирующего и цементного спейсеров, где разница состоит только в конечном используемом импланте, однако разница в результатах 42%.
При исследовании вероятности рецидива в зависимости от поражённого сустава выделяется разница в количестве ППИ, возникших в области коленного и тазобедренного суставов, что вероятнее всего связано с повреждением конкретных суставов при гемофилической артропатии [5]. Поэтому для получения более конкретных результатов необходимо расширить группу.
Анализируя резистентность возбудителей к антибиотикам, важно отметить, что вероятность развития рецидива для ППИ без обнаруженного возбудителя через 36 месяцев от дебюта равна группе с резистентными штаммами и выше, чем с установленным возбудителем без резистентности – 60%, 67% и 54% соответственно, что говорит о сложности диагностики данного заболевания и важности идентификации возбудителя.
Маркеры вирусных гепатитов хотя и являются факторами риска, не имеют такого влияния, как цирроз печени [17], вероятно из-за этого не установлено корреляции с риском развития рецидива ППИ.
Анализ интраоперационной кровопотери вызывает наибольшее количество вопросов. Было сделано предположение, что некрэктомии, включёные в анализ, при более маленькой кровопотере сами по себе являются фактором риска развития рецидива ППИ. Однако при исключении их из анализа (рис. 8) разница стала ещё больше. Так как интраоперационная кровопотеря – это косвенный признак, который должен был свидетельствовать о проведёных гемотрансфузиях, но не учитывал послеоперационную кровопотерю (кратно превышающую интраоперационную в некоторых случаях), утверждать о релевантности данного предиктора мы не можем.
Кратность оперативного вмешательства (статус протеза) по данным проведённого анализа значительно увеличивает риск рецидива ППИ, что подтверждается выводами согласительной конференции [17]. Также количество ревизионных вмешательств у пациентов с гемофилией в целом значительно больше в виду низкой коагуляции и более раннего возраста первичных вмешательств, что повышает важность данного фактора.
Учитывая мировой опыт [11], представлялось важным оценить влияние полимикробной инфекций. В первый год после ППИ наличие более одного возбудителя действительно увеличивает вероятность рецидива, однако к 36 месяцу данный фактор не имеет значительного влияния.
Говоря про общую вероятность рецидива, важно отметить разницу между когортой пациентов с гемофилией и общей популяцией, как например в некоторых зарубежных публикациях [11]: у больных гемофилией рецидив ППИ возникает более чем в 2 раза чаще. И вероятность развития рецидива увеличивается со временем – до 64% к 40 месяцу после операции, что обуславливает необходимость дальнейшего исследования причин такого высокого числа инфекционных осложнений для их профилактики.
Выводы
При исследовании рецидивов ППИ у больных гемофилией частота развития составила 56,9%, а также были получены значимые корреляции между некоторыми факторами риска, в частности: гемофилия В и одноэтапный протокол лечения с сохранением протеза увеличивают риск развития рецидива. Статус протеза, количество возбудителей и возраст пациентов увеличивают вероятность рецидива, что согласуется с данными мировой литературы. Маркеры перенесённых вирусных гепатитов, анатомическое расположение инфицированного сустава и наличие антибиотикорезистентности у возбудителя не имели выраженного влияния на частоту рецидивов. Интраоперационная кровопотеря, вероятнее всего, нерелевантный фактор, так как не учитывает общую кровопотерю.
Заключение
Рецидивы перипротезита у пациентов с гемофилией и развившейся перипротезной инфекцией возникли в 56,9% случаев. Хотя данное исследование имеет ограниченную выборку пациентов, были получены значимые корреляции между некоторыми факторами риска, в частности:
-
• Пациенты с гемофилией В имеют большую вероятность рецидива в первые 12 месяцев после дебюта.
-
• Протокол DAIR имеет меньшую эффективность, чем двухэтапная ревизия, а использование артикулирующего спейсера значительно снижает вероятность риска развития рецидива ППИ в сравнении с цементным спейсером.
-
• Наличие резистентности к антибиотикам у возбудителей и анатомическое расположение поражённого сустава не имеют выраженной корреляции с риском рецидива.
-
• Интраоперационная кровопотеря более 400 мл снижает риск рецидива. Данный фактор риска не учитывает общую кровопотерю, поэтому релевантность полученых результатов необходимо проверить дополнительно.
-
• Маркеры перенесённых вирусных гепатитов не имеют выраженного влияния на развитие рецидива ППИ.
Результаты анализа остальных факторов риска, таких как статус протеза, количество возбудителей и возраст пациентов согласуются с данными мировой литературы.


