Фармакологический профиль антагониста aLa-ааренорецепторов силодозина
Автор: Michel Martin C.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Андрология
Статья в выпуске: 1, 2012 года.
Бесплатный доступ
Антагонисты al-адренорецепторов, фармакология, селективность, симптомы нижних мочевых путей, доброкачественная гиперплазия предстательной железы
Короткий адрес: https://sciup.org/142188287
IDR: 142188287
Текст статьи Фармакологический профиль антагониста aLa-ааренорецепторов силодозина
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №1 2012
α1A-адренорецепторов по сравнению с α1B-адренорецепторами с промежуточным сродством к α1D-адренорецепторам [8] (рисунок 1). Наряду с этим многочисленные исследования на клонированных рецепторах человека в отношении различных подтипов α-адренорецепторов показали высокую селективность силодозина в отношении α1A-подтипа, что подтверждено двумя независимыми лабораториями [9-12].
Таким образом, силодозин не только имеет значительно более высокую селективность в отношении α1A-адренорецепторов по сравнению с α1B-адренорецепторами (> 100 раз), но обладает селективностью и в отношении α1A-адренорецепторов по сравнению с α1D-адренорецепторами (примерно в 50 раз) (рисунок 1). Селективность в отношении α1A-адренорецепторов по сравнению с α1B- и α1D-адренорецепторами подтверждена исследованиями радиолигандного связывания на различных образцах тканей млекопитающих, включая ткань предстательной железы (ПЖ) человека [9-17]. Соответственно, радиомеченый силодозин стал стандартным инструментом для селективной маркировки α1A-адренорецепторов в тканях [15, 18-20]. При внутривенном введении крысам силодозина, меченого тритием, отмечалось долговременное специфическое связывание препарата с α1А-рецепторами тканях ПЖ, в то время как связывание с α1B/D содержащими тканями, такими как аорта, селезенка и печень, было отмечено в значительно меньшей степени по сравнению с меченым тритием празозином. Таким образом, биохимически была подтверждена α1А-селективность силодозина in vivo [18, 21]. Кроме того, очень малое количество силодозина было обнаружено в головном мозге, что свидетельствует о его слабой спо-
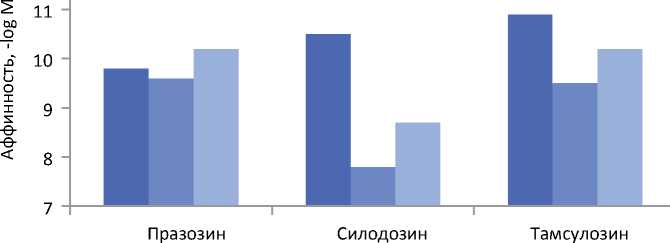
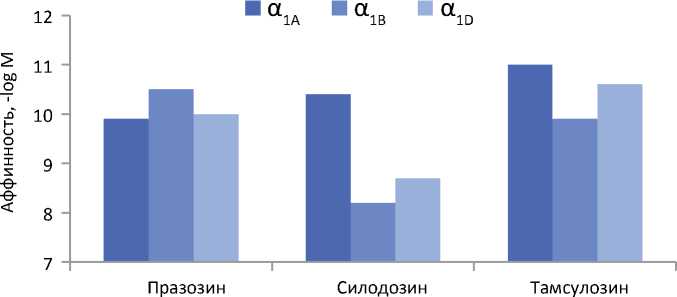
Рисунок 1. Сродство празозина, силодозина и тамсулозина к клонированным подтипам α 1-адренорецепторов по отчетам двух независимых лабораторий. Самый высокий столбик отображает самую высокую аффинность по логарифмической шкале. Отражена разница в сродстве α -блокаторов к различным подтипам адренорецепторов. С изменениями из Shibata et al. [9] и Tatemichi et al. [12]
собности преодолевать гематоэнцефалический барьер, и, следовательно, низком риске развития нежелательных явлений центрального генеза.
Альфа1-адренорецепторы в некоторых тканях имеют удивительно низкое сродство к празозину и другим α-адреноблокаторам квина-золинового семейства, и это связывают с наличием α1L-рецепторов. В последних работах показано, что α1L-рецепторы не являются отдельным видом рецепторов, а представляют собой фенотип α1A-адренорецепторов. Фенотип α1L опосредует сокращение предстательной железы у кроликов, и в меньшей степени у человека [5]. Важно, что силодозин имеет одинаково высокую аффинность к α1A-адренорецепторам классического типа, и к фенотипу α1L [10, 17, 19, 20].
ФАРМАКОДИНАМИЧЕСКИЕ ЭФФЕКТЫ
Исходя из умеренной подтиповой селективности тамсулозина, возникли вопросы относительно возможностей высокоселективной блокады α1A-адренорецепторов для лечения симптомов нарушения опорожнения мочевого пузыря. Си-лодозин улучшал скорость потока мочи у крыс с индуцированной гормонами или обструктивной ДГПЖ [31, 32] и симптомы в клинических исследованиях [33]. Силодозин действует не только на уровне гладкой мускулатуры ПЖ, но и на уровне афферентных нервов мочевого пузыря, что позволяет целенаправленно воздействовать на гиперактивность мочевого пузыря и симптомы накопления [34].
Для определения функциональной уроселективности были проведены дополнительные ис- a следования силодозина in vivo. В исследовании на уретроанестезированных крысах, эффекты силодо-зина и других α-адреноблокаторов сравнивали в отношении ингибирования, вызванного фенилэфрином, подъема интрауретрального давления и снижения артериального давления [35]. На этих моделях силодозин демонстрировал функциональную уроселективность, которая превосходила другие α-адреноблокаторы, включая там-сулозин. Большая функциональная уроселективность силодозина была продемонстрирована в ходе исследованиях на анестезированных [24, 36] или децеребрированных собаках [37]. В другом исследовании на животных выяснено, что силодозин не оказывал влияния на артериальное давление, частоту сердечных сокращений, данные электрокардиограммы, пока не были назначены дозы, многократно превышающие терапевтические [38]. Во всех этих исследованиях функциональная уроселективность силодозина была меньше, чем ожидали на основании селективности в отношении α1A-адренорецепторов, но все равно она была выше, чем у других препаратов сравнения, включая тамсулозин. Силодозин реже вызывал ортостатическую гипотензию у анестезированных мышей по сравнению с празозином или тамсулозином [39].
НЕЖЕЛАТЕЛЬНЫЕ ЯВЛЕНИЯ
Возможным нежелательным явлением приема α-адреноблокаторов является нарушение эякуляции, которое часто называют ретроградной эякуляцией. Было показано, что чаще наблюдается анэякуляция, а не ретроградная эякуляция [40, 41]. Это нежелательное явление при использовании тамсулозина отмечали чаще [40]. Данное нежелательное явление связали с наличием селективности в отношении α1A-адренорецепторов. Нарушение эякуляции часто наблюдали при использовании силодозина [33, 42], но клиническая важность этого явления остается не выясненной, т.к. пациенты, у которых отмечают нарушения эякуляции во время лечения тамсулозином или силодозином, в подавляющем большинстве не желают прекращать лечение, что подтверждает приоритет облегчения симптоматики для пациентов [43, 44].
Редким, но возможным нежелательным явлением, связанным с α-адреноблокаторами, является интраоперационный синдром «дряблой» радужки, который определяется только во время хирургического лечения катаракты [45]. Это нежелательное явление чаще наблюдают при лечении тамсулози-ном, но не до конца выяснено, есть ли связь этого феномена с селективностью к α1A-адренорецепторам [13]. В настоящий момент в Европе не было отмечено интраоперационного синдрома дряблой радужки после приема силодозина, хотя в Японии было зарегистрировано несколько случаев. В экспериментальном исследовании на кроликах показано, что отношение между дозами, которые влияют на функцию зрачка, и дозами, воздействующими на уретральную функцию (параметр для определения лечебного эффекта на СНМП/ЖГПЖ) у силодозина такое же, как и у других α-адреноблокаторов [46].
ФАРМАКОКИНЕТИКА
Исследования, проведенные с альфузозином (неселективен в отношении подтипов α-адренорецеп-торов) и тамсулозином (умеренная α1A-селективность), продемонстрировали, что наряду с подтиповой селективностью такие факто- ры, как выборочное накопление в урогенитальных тканях и плавный фармакокинетический профиль, играют большую роль в переносимости α-адреноблокаторов [47]. В исследованиях внутривенного введения меченого тритием сило-дозина крысам препарат на долгое время задерживался в семявыносящих протоках и ПЖ по сравнению с аортой, селезенкой, сердцем, легкими, почками или плазмой крови [18, 48]. Следует отметить, что ингибирование подъема внутриу-ретрального давления, вызванного фенилэфрином, коррелировало со связыванием в ПЖ силодозина [49]. Следовательно, силодозин селективно распределяется в урогенитальных тканях, как и альфу-зозин и тамсулозин. Благодаря плавному фармакокинетическому профилю у существующих форм выпуска силодозина максимальная терапевтическая концентрация в плазме крови достигается через 2-6 ч., что превышает таковую у тамсу-лозина. При этом период полувыведения составляет 13 ч. [50, 51].
ВЫВОДЫ
Силодозин является новым α-адреноблокатором для лечения пациентов с СНМП/ДГПЖ. Он обладает уникальной селективностью в отношении α1A-адрено-рецепторов, доказанной в биохимических и функциональных исследованиях in vitro , и превосходной функциональной уроселективностью, что было показано на крысах и собаках in vivo . Кроме того, силодозин дольше задерживается в ПЖ по сравнению с другими тканями и плазмой крови; эта задержка тоже способствует уроселективности. В результате этих особенностей воздействие силодозина на сердечно-сосудистую систему минимально. □
УРОРЕК"

Никтурия
ДЛЯ ИДЕАЛЬНОГО СЧЕТА в матче против ДГПЖ
Чувство неполного опорожнения мочевого пузыря
Учащенное
УРОРЕК’ является наиболее уросе-лективным альфа-блокатором. УРОРЕК"’ способствует облегчению симптомов ДГПЖ, повышая уровень качества жизни пациентов.
Силодозин 4мг; 8мг
САМЫЙ УРОСЕЛЕКТИВНЫЙ АЛЬФ А-БЛОК ATOP
НА СЕГОДНЯШНИЙ ДЕНЬ Ъ2'3
БОЛЕЕ ВЫСОКАЯ ЭФФЕКТИВНОСТЬ В ОТНОШЕНИИ
СИМПТОМОВ, ВЫЗЫВАЮЩИХ НАИБОЛЬШЕЕ
БЕСПОКОЙСТВО У ПАЦИЕНТОВ
(одновременно учащенное мочеиспускание, никтурия и чувство неполного опорожнения мочевого пузыря), по сравнению с тамсулозином 4
ДОКАЗАННАЯ БЕЗОПАСНОСТЬ В ОТНОШЕНИИ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ 4'5
-
1. Tatemichi 5 et al. Yakugaku Zasshi 2006; 126: 209-216
-
2. Schwinn DA, Roehrborn CG. Int J Urol 2008; 15:193-199
-
3. Lepor H. Rev Urol 2009; 11: 59-S13
-
4. Montorsi F. Eur Urol Suppl 2010;9:491-495
5* Silodosin Integrated Summary of Safety, September 2008, data on file
ООО «Русфик». Москва, Краснопресненская набережная, 12, ЦМТ, офис 747 Тел./факс: + 7 495 258 20 Об,
Для медицинских работников и специалистов здравоохранения.

Регистрационный номер: ЛС Р-005971/01 -250610

RECORDATI
Список литературы Фармакологический профиль антагониста aLa-ааренорецепторов силодозина
- Roehrborn C.G., Mc Connel J., Barry M.J. et al. Guideline on the Management of Benign Prostatic Hypertrophy. А11А website: http://www.auanet.org/content/guidelines-and-quality-care/clinical-guidelines/main-reports/bph-management/preface_toc.pdf.
- Milani S., Djavan B. Lower urinary tract symptoms suggestive of benign prostatic hyperplasia: latest updated on ü1-adrenoceptor antagonists//BJU Int. 2005. Vol. 95, Suppl 4. P. 29-36.
- van Dijk M.M., de la Rosette JJMCH, Michel M.C. Tamsulosin -modifi ed-release and oral-controlled absorption system formulation in the treatment of benign prostatic hyperplasia//Therapy. 2006. Vol. 3. P. 237-246.
- Nickel J.C., Sander S., Moon T.D. А-meta-analysis of the vascular-related safety profile and efficacy of а-adrenergic blockers for symptoms related to benign prostatic hyperplasia//Int J Clin Pract. 2008. Vol. 62. P. 1547-1559.
- Michel M.C., Vrydag W. а1-а2-and ß-Adrenoceptors in the urinary bladder, urethra and prostate//Br J Pharmacol. 2006. Vol. 147. P. 88-119.
- Guimaraes S., Moura D. Vascular adrenoceptors: an update//Pharmacol Rev. 2001. Vol. 53. P. 319-356.
- Rudner X.L., Berkowitz D.E., Booth J.V., Funk B.L., Cozart K.L., D,Amico E.B., El-Moalem H., Page S.O., Richardson C.D., Winters B., Marucci L., Schwinn D.A.l. Subtype specifi c regulation of human vascular ü1-adrenergic receptors by vessel bed and age//Circulation. 1999. Vol. 100. P. 2336-2243.
- Michel M.C., Kenny B.A., Schwinn D.A. Classifi cation of ü1-adrenoceptor subtypes//Naunyn-Schmiedeberg's Arch Pharmacol. 1995. Vol. 352. P. 1-10.
- Shibata K., Foglar R., Horie K., Obika K., Sakamoto A., Ogawa S., Tsujimoto G. KMD-3213, a novel, potent, ü1A-adrenoceptor-selective antagonist: characterization using recombinant human ü1-adrenoceptors and native tissues//Mol Pharmacol. 1995. Vol. 48, № 2. P. 250-258.
- Murata S., Taniguchi T., Muramatsu I. Pharmacological analysis of the novel, selective ü1-adrenoceptor antagonist, KMD-3213, and its suitability as a tritiated radioligand//Br J Pharmacol.1999. Vol. 127. P. 19-26.
- Piao H., Taniguchi T., Nakamura S. et al. Cloning of rabbit a1b-adrenoceptor and pharmacological comparison of а1А-, ü1B-and аШ-adrenoceptors in the rabbit//Eur J Pharmacol. 2000. Vol. 396. P. 9-17.
- Tatemichi S., Kobayashi K., Maezawa A., Kobayashi M., Yamazaki Y., Shibata N. ü1-Adrenoceptor subtype selectivity and organ specifi city of silodosin (KMD-3213)//Yakugaku Zasshi. 2006. Vol. 126. P. 209-216.
- Nakamura S., Taniguchi T., Suzuki F., Akagi Y., Muramatsu I. Evaluation of ü1-adrenoceptors in the rabbit iris: pharmacological characterization and expression of mRNA//Br J Pharmacol. 1999. Vol. 127. P. 1367-1374.
- Ohmi K., Shinoura H., Nakayama Y., Goda N., Tsujimoto G. Characterization of ü1-adrenoceptors expressed in a novel vascular smooth muscle cell line cloned from p53 knockout mice, P53LMAC01 (AC01) cells//Br J Pharmacol. 1999. Vol. 127. P. 756762.
- Murata S., Taniguchi T., Takahashi M., Okada K., Akiyama K., Muramatsu I. Tissue selectivity of KMD-3213, an ü1-adrenoceptor antagonist, in human prostate and vasculature//J Urol. 2000. Vol. 164. P. 578-583.
- Tanaka T., Zhang L., Suzuki F., Muramatsu I. Alpha-1 adrenoceptors: evaluation of receptor subtype-binding kinetics in intact arterial tissues and comparison with membrane binding//Br J Pharmacol. 2004. Vol. 141. P. 468-476.
- Morishima S., Tanaka T., Yamamoto H., Suzuki F., Akino H., Yokoyama O., Muramatsu I. Identification of Ü-1L and ü-1A-adrenoceptors in human prostate by tissue segment binding//J Urol. 2007. Vol. 177. P. 377-381.
- Yamada S., Okura T., Kimura R. In vivo demonstration of ü1A-adrenoceptor subtype selectivity of KMD-3213 in rat tissues//J Pharmacol Exp Ther. 2001. Vol. 296. P. 160167.
- Morishima S., Suzuki F., Yoshiki H.G. et al. Identification of the a1Ladrenoceptor in rat cerebral cortex and possible relationship between ü1L-and ü1A-adrenoceptors//Br J Pharmacol. 2008. Vol. 153. P. 1485-1494.
- Morishima S., Suzuki F., Nishimune A., Yoshiki H., Akino H., Yokoyama O., Muramatsu I. Visualization and tissue distribution of a1L-adrenoceptor in human prostate by the fluorescently labeled ligand Alexa-488-silodosin//J Urol. 2010. Vol. 183. P. 812-819.
- Yamada S., Ohkura T., Kimura R., Kawabe K. In vivo receptor binding of novel ü1-adrenoceptor antagonists for treatment of benign prostatic hyperplasia//Life Sci. 1998. Vol. 62. P. 1585-1589.
- Suzuki F., Taniguchi T., Takauji R., Murata S., Muramatsu I. Splice isoforms of а1А-adrenoceptor in rabbit//Br J Pharmacol. 2000. Vol. 129. P. 1569-1576.
- YAmagishi R., Akiyama K., Nakamura S., Hora M., Masuda N., Matsuzawa A., Murata S., Ujiie A., Kurashina Y., Iizuka K., Kitazawa M. Amagishi R., Akiyama K., Nakamura S., Effect of KMD-3213, an ü1Aadrenoceptor-selective antagonist, on the contractions of rabbit prostate and rabbit and rat aorta//Eur J Pharmacol. 1996. Vol. 315. P. 73-79.
- Tatemichi S., Tomiyama Y., Maruyama I., Kobayashi S., Kobayashi K., Maezawa A., Kobayashi M., Yamazaki Y., Shibata N. Uroselectivity in male dogs of silodosin (KMD-3213), a novel drug for the obstructive component of benign prostatic hyperplasia//Neurourol Urodyn. 2006. Vol. 25. P. 792-799.
- Moriyama N., Nasu K., Takeuchi T., Akiyama K., Murata S., Nishimatsu H., Yano J., Tsujimoto G., Kawabe K. Quantification and distribution of ü1-adrenoceptor subtype mRNAs in human vas deferens: comparison with those of epididymal and pelvic portions//Br J Pharmacol. 1997. Vol. 122. P. 1009-1014.
- Moriyama N., Akiyama K., Murata S., Taniguchi J., Ishida N., Yamazaki S., Kawabe K. KMD-3213, a novel ü1A-adrenoceptor antagonist, potently inhibits the functional ü1-adrenoceptor in human prostate//Eur J Pharmacol. 1997. Vol. 331. P. 39-42.
- Autelitano D.J., Woodcock E.A. Selective activation of ü1A-adrenergic receptors in neonatal cardiac myocytes is sufficient to cause hypertrophy and differential regulation of ü1-adrenergic receptor subtype mRNAs//J Mol Cell Cardiol. 1998. Vol. 30. P. 15151523.
- Zhu J., Taniguchi T., Takauji R., Suzuki F., Tanaka T., Muramatsu I. Inverse agonism and neutral antagonism at a constitutively active alpha-1a adrenoceptor//Br J Pharmacol. 2000. Vol. 131. P. 5460-552.
- Hein P., Goepel M., Cotecchia S., Michel M.C. A quantitative analysis of antagonism and inverse agonism at wild-type and constitutively active hamster ü1B-adrenoceptors//Naunyn-Schmiedeberg's Arch Pharmacol. 2001. Vol. 363. P. 34-39.
- Zhang L., Taniguchi T., Tanaka T., Shinozuka K., Kunitomo M., Nishiyama M., Kamata K., Muramatsu I. Alpha-1 adrenoceptor upregulation induced by prazosin but not KMD-3213 or reserpine in rats//Br J Pharmacol. 2002. Vol. 135. P. 1757-1764.
- Tatemichi S., Akiyama K., Kobayashi M., Yamazaki Y., Yokoyama O., Uruno T. A selective ü1A-adrenoceptor antagonist inhibits detrusor overactivity in a rat model of benign prostatic hyperplasia//J Urol. 2006. Vol. 176.P. 1236-1241.
- Yazaki Y., Aikawa K., Ogawa S. et al. A selective ü1A-adrenoceptor antagonist improves detrusor overactivity secondary to bladder outlet obstruction through the inhibition of the afferent activation in the rat.//Neurourol Urodyn. 2008. Vol. 27. P. 610-611.
- Marks L.S., Gittelman M.C., Hill L.A., Volinn W., Hoel G. Rapid efficacy of the highly selective ü1A-adrenoceptor antagonist silodosin in men with signs and symptoms of benign prostatic hyperplasia: pooled results of 2 phase 3 studies//J Urol. 2009. Vol. 181. P. 2634-2640.
- Yokoyama O., Ito H., Aoki Y., Oyama N., Miwa Y., Akino H. Selective ü1A-blocker improves bladder storage function in rats via suppression of C-fiber afferent activity//World J Urol. In press. DOI 10.1007/s00345-009r-r0481-2.
- Akiyama K., Hora M., Tatemichi S., Masuda N., Nakamura S., Yamagishi R., Kitazawa M. KMD-3213, a uroselective and longacting ü1A-adrenoceptor antagonist, tested in a novel rat model//J Pharmacol. Exp Ther. 1999. Vol. 291. P. 81-91.
- Tomiyama Y., Tatemichi S., Tadachi M., Kobayashi S., Hayashi M., Kobayashi M., Yamazaki Y., Shibata N. Effect of silodosin on intraurethral pressure increase induced by hypogastric nerve stimulation in dogs with benign prostatic hyperplasia//Yakugaku Zasshi. 2006. Vol. 126. P. 225-230.
- Akiyama K., Noto H., Nishizawa O., Sugaya K., Yamagishi R., Kitazawa M., Tsuchida S. Effect of KMD-3213, an a1Aadrenoceptor antagonist, on the prostatic urethral pressure and blood pressure in male decerebrate dogs//Int J Urol. 2001. Vol. 8. P. 177-183.
- Tatemichi S., Kiguchi S., Kobayashi M., Yamazaki Y., Shibata N., Uruno T. Cardiovascular effects of the selective ü1A-adrenoceptor antagonist silodosin (KMD-3123), a drug for the treatment of voiding dysfunction//Arzneimittelforschung. 2006. Vol. 56. P. 682-687.
- Akiyama K., Hora M., Yamagishi R., Kitazawa M. Effects of KMD-3213, a uroselective ü1A-adrenoceptor antagonist, on the tilt-induced blood pressure response in normotensive rats//Jpn J Pharmacol. 2002. Vol. 90. P. 131-137.
- van Dijk M.M., de la Rosette JJMCH, Michel M.C. Effects of ü1-adrenoceptor antagonistsonmale sexual function//Drugs. 2006. Vol. 66. P. 287-301.
- Nagai A, Hara R, Yokoyama T, Jo Y, Fujii T, Miyaji Y. Ejaculatory dysfunction caused by the new ü1-blocker silodosin: a preliminary study to analyze human ejaculation using color Doppler ultrasonography.//Int J Urol. 2008. Vol. 15. P. 915-918.
- Kawabe K, YoshidaM, HommaY Silodosin, a new ü1A-adrenoceptor selective antagonist for treating benign prostatic hyperplasia: a results of a phase III randomized, placebocontrolled, double-blind study in Japanese men.//BJU Int. 2006. Vol. 98. P. 1019-1024.
- Speakman M.J., Snijder R.J., Anthonijs G., Doyle C.A. Patients on tamsulosin experiencing abnormal ejaculation choose to remain longer in clinical trials and have slightly better improvement in symptom score than other patients. Abstract.//J Urol. 2003. Vol. 169. P. 334.
- Roehrborn C.G., Lepor H., Kaplan S.A. Retrograde enaculation induced by silodosin is the result of relaxation of smooth musculature in the male urogenital tracts and is associated with greater urodynamic and symptomatic improvements in men LUTS secondary to BPH. Abstract//J Urol. 2009. Vol. 181, Suppl. P. 694.
- Chang D.F., Campbell J.R. Intraoperative floppy iris syndrome associated with tamsulosin//J Cataract Refract Surg. 2005. Vol. 31. P. 664-673.
- Watanabe M, Ohtake A, Yuyama H, et al. Effects of ü1-adrenoceptor antagonists on pupil diameter and intraurethral pressure in rabbits.//Jpn Pharmacol Ther. 2006. Vol. 34. P. 653-661.
- Michel M.C. The forefront of novel therapeutic agents based on the pathophysiology of lower urinary tract dysfunction: a-blockers in the treatment of male voiding dysfunc-tion-how do they work and why do they differ in tolerability?//J Pharmacol Sci. 2010. Vol. 112. P. 151-157.
- Okura T., Yamada S., Abe Y., Kimura R. Selective and sustained occupancy of prostatic ü1-adrenoceptors by oral administration of KMD-3213 and its plasma concentration in rats//J Pharm Pharmacol. 2002. Vol. 54. P. 975-982.
- Akiyama K., Tatemichi S., Katayama S., Nakajima M., Oki T., Okura T., Yamada S., Kimura R. Relationship between prostatic ü1-adrenoceptor binding and reduction in intraurethral pressure following continuous infusion of KMD-3213 in rats//Pharmacology. 2002. Vol. 64. P. 140-147.
- Franco-Salinas G., de la Rosette JJMCH, Michel M.C. Pharmacokinetics and pharmacodynamics of tamsulosin in its modifi edrelease and oral-controlled absorption system formulations//Clin Pharmacokin. 2010. Vol. 49. P. 177-188.
- Shimizu T., Miyashita I., Matsubara Y., Ikeda M., Yamaguchi M. Pharmacokinetic profile of silodosin in clinical practice//Yakugaku Zasshi. 2006. Vol. 26. P. 257-263.


