Фасет-синдром. Малоинвазивное хирургическое лечение. Клинический случай и обзор литературы
Автор: Потапов Виталий Энгельсович, Сороковиков Владимир Алексеевич, Ларионов Сергей Николаевич, Животенко Александр Петрович
Журнал: Клиническая практика @clinpractice
Рубрика: Клинический случай
Статья в выпуске: 4 т.12, 2021 года.
Бесплатный доступ
Обоснование. Дегенеративная патология дугоотростчатых суставов поясничного отдела позвоночника остается значимой медико-социальной проблемой в связи со стойким болевым синдромом, высокой частотой встречаемости и нередкой инвалидизацией пациентов в исходе заболевания. Фасет-синдром - наиболее распространенная нозологическая форма дегенеративно-дистрофического процесса (спондилоартроз), потенциальный источник боли с формированием нестабильности позвоночно-двигательного сегмента и, соответственно, хронического болевого синдрома. Описание клинического случая. В нейрохирургическом отделении Иркутского научного центра хирургии и травматологии выполнено оперативное лечение в объеме дерецепции дугоотростчатых суставов LII-LIII, LIII-LIV, LIV-LV пациенту с жалобами на интенсивные (ВАШ=8) боли и дискомфорт в пояснично-крестцовом отделе позвоночника справа, возникающие в вертикальном положении и усиливающиеся при наклонах и сгибании-разгибании туловища с периодическим распространением в правую ягодичную область и по задней поверхности бедра. В послеоперационном периоде пациент отметил снижение интенсивности болевого синдрома в пояснично-крестцовом отделе позвоночника до 3 баллов по визуальной аналоговой шкале и был выписан из отделения на 5-е сут после операции в удовлетворительном состоянии. Заключение. Понимание морфологических, клинических и рентгенологических особенностей течения дегенеративного поражения фасеточных суставов позволяет повышать диагностические возможности выявления фасет-синдрома поясничного отдела позвоночника и эффективно применять транскутанные хирургические технологии для лечения хронических болевых синдромов.
Дугоотростчатый сустав, фасет-синдром, анатомия, болевой синдром в спине, спондилоартроз
Короткий адрес: https://sciup.org/143178094
IDR: 143178094 | DOI: 10.17816/clinpract81435
Текст научной статьи Фасет-синдром. Малоинвазивное хирургическое лечение. Клинический случай и обзор литературы
Submitted 04.08.2021 Revised 24.08.2021 Published 26.11.2021
в его изменении. БОС-технология имеет некоторые собственные преимущества. Это самостоятельный метод, который может использоваться как в монорежиме, так и в комплексе восстановительного лечения и направлен на активизацию собственных резервов организма пациента.
Для построения БОС используются различные технические способы и органы чувств. Основными каналами обратной связи являются зрение, слух или их комбинация, гораздо реже используется кинестетический канал [1, 4]. БОС-технологию для восстановления функции ходьбы применяют сравнительно недавно по причине технической сложности регистрации ее основных параметров (скорости, длины цикла шага, частоты шага [1]) как результирующих функций перемещения в пространстве. Однако скорость ходьбы зависит от других изменений, которые и определяют, собственно, двигательную патологию, в частности наличие контрактур в суставах, изменение функции мышц, болевой синдром при определенных движениях или осевой нагрузке на конечность и др. Кроме этого, наиболее часто используемый параметр «скорость ходьбы» не является специфичным для той или иной патологии, т.к. скорость может падать в результате самых различных патологических со-
▼ж^жтжтж LVAVAVAV ГАТАТ стояний. Данный параметр при всей его важности не является специфичным даже для стороны поражения, в отличие от длины цикла шага — наиболее редко используемого параметра, который может отличаться для левой и правой стороны. Специфичностью к стороне не обладает и третий параметр — частота шага. В то же время для больных с церебральным инсультом существенно меняются не только перечисленные параметры, но и те, которые их определяют [5–7] — длительность цикла шага, периодов опоры, двойной и одиночной опоры; гармоничность (равные промежутки времени начала цикла шага одной и другой стороны).
В ряде случаев используемое для БОС-трени-ровки оборудование позволяет выделить отдельные параметры — динамическую нагрузку на конечность [8, 9] или клиренс стопы с опорой [10].
В последние годы благодаря развитию новых технологий для БОС-тренировки ходьбы у больных церебральным инсультом стали использовать параметры электромиографии (ЭМГ) (чаще трехглавая мышца голени), а также пространственно-вре- менные, кинематические, кинетические, при этом пространственно-временные параметры ориентированы в основном на тренировку длины шага на паретичной стороне [3].
При выполнении ходьбы и других упражнений больными с последствиями церебрального инсульта или болезнью Паркинсона в качестве БОС активно используется технология носимых сенсоров [11]. Применяются, в частности, сенсоры на инерционной технологии, которые регистрируют различные биомеханические показатели, что позволяет потенциально перейти к более селективному выбору параметров ходьбы для тренировки.
Для таких технологий, как БОС-тренировка, характерно наличие определенного количества однотипных тренировочных сессий заданной дли- тельности, при этом в литературе отмечается значительный разброс параметров — от 10 до 20 [3, 10]. Так, в настоящем обзоре приведены значения и периодичность тренировок от 3 раз в неделю до 2 раз в день с отметкой, что информации по причине такого разброса недостаточно. В исследовании M. Druzbicki и соавт. [12] на очень близком материале указаны 15 тренировочных сессий. В то же время имеются сообщения об эффективности только одной тренировки [9], которая, од- нако, проводилась по параметрам реакции опоры (динамической нагрузки). По длительности одной тренировки также имеется существенный разброс.
В аналитическом обзоре [3] приводятся значения от 11 до 30 мин, в исследовании [12] — 30 мин, в работе [10] — 10 мин.
Результаты использования различных видов БОС-тренировки ходьбы у больных с церебральным параличом демонстрируют в ряде случаев и противоречивые показатели [12]. Так, по результатам тренировки ходьбы на тредмиле 30 больных с подострой формой церебрального инсульта с использованием БОС по кинетическим параметрам (15 человек) и без использования БОС (15 человек) показано отсутствие отличий функции ходьбы между группами, однако в обеих группах отмечены положительные изменения в биомеханике параметров ходьбы. Более раннее исследование этой же группы авторов дает положительный результат в улучшении симметрии и пространственно-временных параметров [13].
Таким образом, большинство исследований признает перспективность БОС-тренировки для восстановления функции ходьбы, что особенно актуально у больных с церебральным инсультом в раннем восстановительном периоде, когда идет формирование образца ходьбы на фоне имеющегося повреждения. При этом данные по применению высокоселективных параметров ходьбы для БОС-тренировки представлены незначительно в силу технологической сложности их использования для БОС. Кроме этого, основные параметры тренировки (частота, длительность, критерии нагрузки и оценки эффективности) остаются противоречивыми.
Цель исследования — изучить возможность применения технологии БОС-тренировки с целенаправленным воздействием на один из базовых параметров, характеризующих симметрию ходьбы (длительность периода опоры), у больных с церебральным инсультом в раннем восстановительном периоде.
МЕТОДЫ
Дизайн исследования
Экспериментальное проспективное нерандомизированное интервенционное продольное пилотное исследование.
Критерии соответствия
Критерии включения : пациенты с гемипарезом в раннем восстановительном периоде (1–6 мес)
впервые возникшего ишемического инсульта; возраст до 75 лет; функциональная готовность к вертикализации; адекватная реакция на пробу с ортостазом; возможность держать вертикальную стойку в течение минуты; ходьба без посторонних вспомогательных предметов; ясное сознание с уровнем бодрствования, достаточным для усвоения и выполнения инструкций при проведении исследования и тренировок; отсутствие когнитивных нарушений, препятствующих пониманию поставленных исследователем задач; отсутствие сенсомоторной афазии; наличие тонуса в мышцах нижней конечности выше 2 баллов по модифицированной шкале спастичности Ашфорт; отсутствие декомпенсированной соматической патологии, ишемических изменений на ЭКГ, сердечной недостаточности (II класс и выше по Killip); отсутствие заболеваний центральной и периферической нервной системы помимо инсульта, сопровождающихся неврологическим дефицитом (последствия травм, опухоли, полинейропатии и т.п.); отсутствие ортопедической патологии (суставные деформации и контрактуры, выраженный болевой синдром, ампутации конечностей и др.).
Критерии исключения : неадекватная реакция сердечно-сосудистой системы во время проведения тренировки; страх ходьбы по тредмилу; отказ пациента от проведения лечебных мероприятий; отрицательная динамика неврологического и/или соматического статуса.
Условия проведения
Исследование выполнено в период с 2020 по 2021 г. в лаборатории клинической биомеханики Федерального центра мозга и нейротехнологий Федерального медико-биологического агентства Российской Федерации.
Описание медицинского вмешательства
В исследование вошли 12 пациентов, которым был проведен курс БОС-тренировки по гармонизации периода опоры в раннем восстановительном периоде полушарного церебрального инсульта в бассейне средней мозговой артерии.
Используемые клинические шкалы
Для определения возможностей пациента использовали клинические шкалы, оценивающие ходьбу: тест «Встань и иди» (Timed Up and Go Test, TUG) [14] и индекс ходьбы Хаузера (Hauser Ambulation Index) [15], а также шкалы, диагностирующие баланс пациента: шкала Berg Balance [16] и тест устойчивости стояния (Standing balance test) [17].
Методика оценки функции ходьбы
Биомеханическое исследование функции ходьбы проводили с помощью комплекса «Стэдис» (Нейрософт, Иваново). Для этого инерционные сенсоры «Нейросенс» фиксировали на крестце, наружной поверхности средней трети бедра, наружной лодыжке и подъеме стопы с обеих сторон (рис. 1). Всего использовалось 7 сенсоров.
Каждый сенсор содержит еще два канала ЭМГ-регистрации. Сенсоры на бедре использовали для регистрации ЭМГ-сигнала с прямой мышцы бедра и суммарной активности двуглавой и полу-сухожильной мышцы, а сенсоры на голени — для регистрации ЭМГ передней большеберцовой мышцы и суммарной активности наружной и внутренней головок трехглавой. Для регистрации ЭМГ использовали одноразовые гелевые электроды установленные в соответствии с рекомендациями SENIAN [18].
Положение пациента стоя прямо с выпрямленными тазобедренными и коленными суставами принимали за нейтральное (положение калибровки). Далее выполняли регистрацию биомеханических параметров во время ходьбы. Пациент проходил
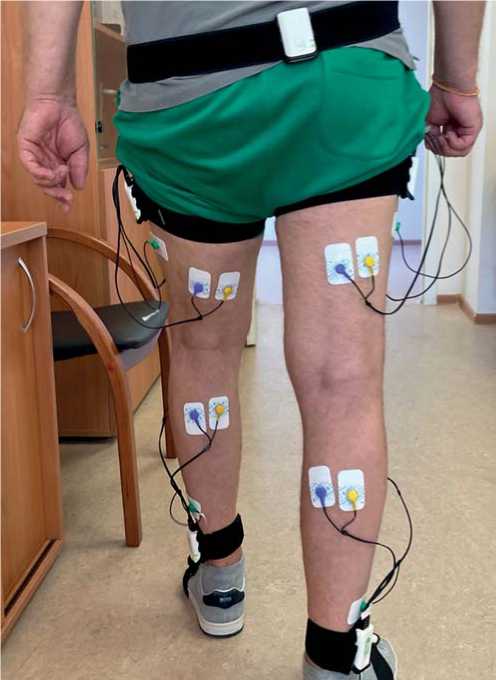
Рис. 1. Процесс регистрации биомеханических параметров ходьбы.
Fig. 1. The acquisition of the gait parameters.


в произвольном темпе дистанцию 10 м, разворачиваясь каждый раз в конце и снова продолжая движение. Шаги с неустановившимися параметрами (разгон и торможение) программное обеспечение автоматически отбрасывает. Остальные циклы шага калькулируются. В среднем мы завершали регистрацию при достижении 30 циклов шага (60 обычных шагов) или более. Программное обеспечение на основе верифицированного алгоритма определения циклов шага (ЦШ), снабженного нейросетью, определяло ЦШ для каждой ноги и в соответствии с ними рассчитывало параметры. Для последующего анализа были выбраны следующие биомеханические параметры :
-
1) временные: длительность ЦШ в сек., коэффициент ритмичности (КР) (отношение времени опоры — меньшее к большему). Отдельные временные периоды ЦШ измеряли в процентах от ЦШ: период опоры (ПО), период одиночной опоры (ОО), суммарный период двойной опоры (ДО) и параметр начала ЦШ другой ноги (начало второй двойной опоры, НВД);
-
2) пространственные: высота подъема стопы (в см), скорость ходьбы (V, км/ч).
Кинематические параметры регистрировали для тазобедренного, коленного и голеностопного суставов в сагиттальной плоскости (сгибание-разгибание) с построением гониограммы за ЦШ с по- следующим автоматическим определением следующих показателей:
-
• для тазобедренного сустава: максимальная амплитуда за ЦШ в градусах (ТА) и фаза максимального разгибания (ТХ);
-
• для коленного сустава: амплитуда первого сгибания (Ка1) и ее фаза (Кх1), амплитуда разгибания (Ка2) и ее фаза (Кх2), амплитуда махового сгибания (Ка3) и ее фаза (Кх3);
-
• для голеностопного сустава анализировали только развиваемую в течение ЦШ амплитуду (ГА).
ЭМГ мышц анализировали максимальную, развиваемую амплитуду за ЦШ (в мкВ) для передней большеберцовой мышцы (Tib. аnt.), икроножных мышц (Gastrocnemius), прямой мышцы бедра (Rect. fem.) и полусухожильной, полуперепончатой и двуглавой мышц бедра (Semi-bic. fem.).
Методика БОС-тренировки
Мы применяли БОС-тренировку исходя из тех возможностей, которые были посильны пациентам и технически осуществимы в течение их трехне- дельного пребывания в стационаре. Таким образом, можно было осуществить 10 тренировок, в среднем число процедур составило 10±0,58 (9–11).
Длительность тренировки при строгом соответствии всем критериям включения и исключения во многом определялась текущим состоянием пациента на момент ее проведения. По этой причине мы не следовали строгому выполнению тренировки в течение заданного времени, например 30 мин [12], а проводили ее до появления признаков утомления (жалобы на усталость, отсутствие динамики изменения тренируемых параметров, потеря ритмичности движения и др.). В среднем длительность тренировки составила 18 (от 15 до 20) мин.
Для БОС-тренировки использовали ту же систему «Стэдис», которая обладает функционалом для целевой тренировки ходьбы по выбранному параметру [19]. Функционал состоит из двух действий — оценки функции ходьбы и последующей тренировки. Оценка проводилась посредством двух сенсоров «Нейросенс», фиксируемых в области наружной лодыжки голеней эластичными манжетами. Первым этапом пациент с установленными сенсорами становился на беговую дорожку, после чего дорожку включали и выбирали режим скорости, комфортный для пациента. После этого проводилось скрининговое тестирование ходьбы на тредмиле в течение 2 мин. По окончании выводился отчет с пространственно-временными параметрами ходьбы, где отмечался период опоры в качестве тренируемого. Далее проводилась БОС-трениров-ка (рис. 2), где выбранный параметр отображался в виде столбиков с отметками планируемого диапазона изменений. Выход за установленный диапазон показывался как ошибочный, при этом замедлялось передвижение по виртуальной среде и выполнение требуемого в виртуальной среде задания. Имелись и другие детали, отображающие эффективность выполнения задания в зависимости от используемой виртуальной среды. Тренировка проводилась в автоматическом режиме до утомления пациента. При необходимости границы допустимых колебаний выбранного параметра можно было отрегулировать вручную.
Марка тредмила Runner RHC500 компании Air machine (США). Скорость тренировки увеличивали на каждом занятии, и в среднем она составляла от 1,39±0,44 до 1,71±0,42 км/ч.
Для удобства применения в условиях лаборатории, когда положение монитора для БОС-среды было оптимальным сзади дорожки, использовался режим задней скорости. С учетом того, что скорость ходьбы данных пациентов была незначительной, режима движения назад оказалось достаточно.
Этическая экспертиза
Исследование выполнено в соответствии с этическими принципами Хельсинкской декларации с получением письменного согласия пациентов на участие в исследовании и одобрено локальным этическим комитетом ФЦМН ФМБА России от 19 июля 2021 г.
Статистический анализ
Обработка полученных результатов была проведена стандартными методами описательной вариационной статистики с расчетом средних значений и среднеквадратичного отклонения. Использовали программный пакет Statistica 12. Оценку достоверности различий выполняли с помощью критерия Вилкоксона–Манна–Уитни с критерием p <0,05. Проводили сравнительную оценку аналогичных параметров контралатеральной и паретичной сторон с показателями группы нормы.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование вошли 12 пациентов с гемипарезом в раннем восстановительном периоде впервые возникшего ишемического инсульта, из них 10 мужчин и 2 женщины, средний возраст 23–65 (51,58±11,38) лет, средний рост 164–195 (176,67±8,18) см, средний вес 70–102 (84,58±9,6) кг, дней после острого нарушения мозгового кровообращения — 28–179 (119,83±54,49), в том числе с поражением правого полушария головного мозга — 4, левого — 8.
В соответствии с целью работы проведено исследование 20 практически здоровых лиц, из них 10 женщин, 10 мужчин, средний возраст 23–35 (28,8±3,66) лет, средний рост 168–188 (176,8±5,53) см, средний вес 55–100 (76,25±14,09) кг,

Рис. 2. Процесс тренировки.
Fig. 2. The training process.
не имеющих в анамнезе травм и заболеваний опорно-двигательного аппарата.
Основные результаты исследования
Результаты исследования динамики состояния по клиническим шкалам представлены в табл. 1.
В результате проведенного лечения происходит достоверное улучшение по показателям теста «Встань и иди» и индекса ходьбы Хаузера ( p <0,05).
Таблица 1 / Table 1
Результаты исследования по клиническим шкалам / The results of investigation by clinical scale
|
Период |
Тест «Встань и иди», сек |
Индекс ходьбы Хаузера |
Шкала Berg Balance |
Тест устойчивости стояния |
|
До |
23,17±6,21 |
3,5±0,52 |
47,25±3,7 |
3,75±0,62 |
|
После |
20,08±5,32* |
2,75±0,87* |
50,33±3,68 |
3,92±0,29 |
Примечание. * Достоверно с вероятностью p <0,05 по сравнению с таким же показателем до лечения.
Note. * Significant with a probability of p <0.05 compared with the same indicator before the treatment.

кт ГА
Данные анализа пространственно-временных параметров ходьбы представлены в табл. 2.
Цикл шага демонстрирует достоверное увеличение, а ритмичность ходьбы — снижение с обеих нижних конечностей по сравнению с группой нормы (p <0,05). Скорость ходьбы пациентов до и после лечебных процедур показывает достоверное снижение по сравнению с группой нормы (p <0,05). Высота подъема стопы с паретичной конечности до лечения достоверно меньше показателя группы нормы, а после лечения — достоверно меньше показателя контралатеральной стороны (p <0,05) при практически неизменном значении. Показатель ПО контралатеральной конечности достоверно больше, чем показатель нормы, как до, так и после лечения (p <0,05). Для паретичной конечности он же достоверно ниже по сравнению с таким же показателем контралатеральной стороны до лечения (p <0,05). Параметр ОО паретичной ко- нечности достоверно меньше такового для нормы (p <0,05), а также контралатеральной стороны как до, так и после лечения (p <0,05). Период ДО демонстрирует достоверное увеличение по сравнению с группой нормы для обеих сторон до и после лечения (p <0,05). Показатель НВД контралатеральной стороны до и после лечения достоверно выше по сравнению с группой нормы (p <0,05); тот же параметр для паретичной стороны до и после лечения достоверно ниже по сравнению с группой нормы и с показателями контралатеральной стороны (p <0,05).
Кинематические параметры для тазобедренного, коленного и голеностопного суставов представлены в табл. 3.
Амплитуда тазобедренного сустава паретич-ной конечности достоверно ниже до и после лечения по сравнению с группой нормы и показателями контралатеральной конечности (p <0,05). До проводимого лечения момент (фаза) полного разгибания (ТХ) контралатеральной конечности наступает позже, чем в группе нормы и на паре-тичной стороне (p <0,05). Амплитуды коленного сустава Ка1 и Ка2 до и после лечения достоверно ниже показателей нормы с обеих нижних конечностей (p <0,05). Для паретичной стороны момент первого сгибания (Ка1) наступает раньше как до, так и после лечения, чем в группе нормы (p <0,05). Маховые амплитуды сгибания коленного сустава (Ка3) обеих конечностей до лечения и паретичной конечности после лечения достоверно меньше показателя нормы (p <0,05). Фаза этого сгибания (Кх3) контралатеральной конечности до и после лечения наступает позже, чем в группе нормы (p <0,05), а для паретичной ко-
Таблица 2 / Table 2
Пространственно-временные параметры ходьбы / Spatio-temporal gait parameters
|
Параметр |
До |
После |
Норма |
||
|
КС |
ПС |
КС |
ПС |
||
|
ЦШ, с. |
1,48±0,21* |
1,49±0,23* |
1,45±0,26* |
1,44±0,24* |
1,09±0,07 |
|
ПО, % |
71,14±2,76* |
62,78±3,37# |
69,94±3,49* |
63,04±2,95 |
62,85±1,51 |
|
ОО, % |
37,19±3,11 |
28,78±3,18*# |
37,36±2,62 |
30,39±3,09*§ |
37,21±1,40 |
|
ДО, % |
33,97±3,31* |
34,01±3,16* |
32,59±3,57* |
32,65±3,58* |
25,63±2,75 |
|
НВД, % |
55,58±2,75* |
44,40±3,25*# |
54,34±2,48* |
46,04±2,71*§ |
49,91±0,41 |
|
ВПС, см |
12,42±1,62 |
10,42±3,12* |
12,92±1,44 |
10,83±3,10§ |
12,55±2,06 |
|
V, км/ч |
2,24±0,60* |
2,44±0,79* |
4,42±0,56 |
||
|
КР |
0,79±0,13* |
0,82±0,12* |
0,98±0,01 |
||
Примечание. Достоверно с вероятностью p <0,05: * — по сравнению с таким же значением в группе нормы, # — по сравнению с таким же показателем контралатеральной стороны до лечения; § — по сравнению с таким же показателем контралатеральной стороны после лечения. КС/ПС — контралатеральная/паретичная сторона; ЦШ — цикл шага; ПО — период опоры; ОО — период одиночной опоры; ДО — суммарный период двойной опоры; НВД — начало второй двойной опоры; ВПС — высота подъема стопы; V — скорость ходьбы; КР — коэффициент ритмичности.
Note. Significant with a probability of p <0.05: * — compared with the same value in the normal group, # — compared with the same indicator of the contralateral side before the treatment, § — compared with the same indicator of the contralateral side after the treatment. КС/ПС — contralateral/paretic side; ЦШ — step cycle; ПО — period of support; ОО — period of single support; ДО — total period of double support; НВД — beginning of the second double support; ВПС — the height of the foot; V — walking speed; КР — coefficient of rhythm.
Таблица 3 / Table 3
Амплитудно-фазовые параметры движения тазобедренного, коленного и голеностопного суставов (амплитуды в градусах, фазы в %ЦШ) /
Amplitudes and phases of a joint’s motion during the walking cycle for hip, knee and ankle joints (amplitudes in degrees, phases in % of walking cycle)
|
Параметр |
До |
После |
Норма |
||
|
КС |
ПС |
КС |
ПС |
||
|
ТА, град. |
30,50±3,71 |
24,17±5,73*# |
32,25±2,67 |
24,08±6,97*§ |
33,16±4,78 |
|
ТХ, %ЦШ |
58,88±4,14* |
51,30±3,82# |
54,94±5,36 |
53,15±4,21 |
53,21±3,04 |
|
Ка1, град. |
7,15±3,85* |
6,37±4,94* |
7,04±5,50* |
6,88±5,18* |
14,60±3,47 |
|
Кх1, %ЦШ |
12,09±4,85 |
10,13±3,97* |
10,37±3,94 |
10,08±4,81* |
13,10±3,52 |
|
Ка2, град. |
-1,13±7,48* |
-5,10±38,38* |
-0,19±8,19* |
-3,73±7,55* |
4,77±4,80 |
|
Кх2, %ЦШ |
33,92±8,49 |
38,38±6,208 |
34,51±8,01 |
40,40±7,64 |
36,50±4,01 |
|
Ка3, град. |
49,96±8,75* |
27,7±14,25*# |
50,91±8,76 |
29,46±15,85*§ |
56,50±7,33 |
|
Кх3, %ЦШ |
76,07±2,85* |
66,71±4,59# |
75,25±3,30* |
67,03±4,77§ |
69,13±2,92 |
|
ГА, град. |
26,42±3,78* |
22,58±3,18*# |
26,92±6,63* |
23,50±5,85* |
33,42±6,25 |
Примечание. Достоверно с вероятностью p <0,05: * — по сравнению с таким же значением в группе нормы, # — по сравнению с таким же показателем контралатеральной стороны до лечения; § — по сравнению с таким же показателем контралатеральной стороны после лечения. КС/ПС — контралатеральная/паретичная сторона; ТА — максимальная амплитуда за цикл шага; ТХ — фаза максимального разгибания; Ка1 — амплитуда первого сгибания; Кх1 — фаза первого сгибания; Ка2 — амплитуда разгибания; Кх2 — фаза амплитуды разгибания; Ка3 — амплитуда махового сгибания; Кх3 — фаза амплитуды махового сгибания; ГА — амплитуда, развиваемая в течение цикла шага.
Note. Significant with a probability of p <0.05: * — compared with the same value in the normal group, # — compared with the same indicator of the contralateral side before the treatment, § — compared with the same indicator of the contralateral side after the treatment. КС/ПС — contralateral/paretic side; ТА — maximum amplitude per step cycle; ТХ — phase of maximum extension; Ка1 — amplitude of the first flexion; Кх1 — phase of the first flexion; Ка2 — amplitude of extension; Кх2 — phase of the amplitude of extension; Ка3 — amplitude of the flywheel flexion; Кх3 — phase of the amplitude of the flywheel flexion; ГА — amplitude developed during the step cycle.
нечности — раньше, чем для контралатеральной ( p <0,05). Амплитуда голеностопного сустава до и после лечения достоверно ниже показателей нормы с обеих нижних конечностей ( p <0,05). Амплитуда голеностопного сустава паретич-ной конечности до лечения ниже аналогичного показателя контралатеральной конечности ( p <0,05).
Результаты исследования ЭМГ-активности исследуемых мышц показаны в табл. 4.
Максимум электрической активности m. gastrocnemius паретичной конечности до и после лечения достоверно ниже аналогичных показателей в норме ( p <0,05) и достоверно меньше аналогичного показателя контралатеральной конечности до лечения ( p <0,05).
Таблица 4 / Table 4
Максимальные амплитуды электромиограмм исследуемых мышц (в мкВ) / The maximal amplitudes of EMG of investigated muscles (in mkV)
|
Мышца |
До |
После |
Норма |
||
|
КС |
ПС |
КС |
ПС |
||
|
Tib. аnt. |
131,42±3,82 |
101,67±8,58 |
125,00±41,90 |
120,75±66,07 |
135,45±29,03 |
|
Gastrocnemius |
118,08±72,29 |
55,00±5,87*# |
110,25±67,16 |
68,92±57,93* |
118,15±44,48 |
|
Rect. fem. |
59,83±21,72 |
48,08±42,30 |
64,25±20,66 |
56,83±36,29 |
67,60±43,82 |
|
Semi-bic. fem. |
78,83±37,08 |
55,83±41,65 |
82,42±39,73 |
56,00±39,59 |
75,00±27,22 |
Примечание. Достоверно с вероятностью p <0,05: * — по сравнению с таким же значением в группе нормы, # — по сравнению с таким же показателем контралатеральной стороны до лечения. КС/ПС — контралатераль-ная/паретичная сторона.
Note. Significant with a probability of p <0.05: * — compared with the same value in the normal group, # — compared with the same indicator of the contralateral side before the treatment. КС/ПС — contralateral/paretic side.


ОБСУЖДЕНИЕ
Из временных параметров реабилитации наиболее важным с точки зрения гармонизации ходьбы является тренируемый ПО. Его изменения потенциально характеризуют, собственно, эффект тренировки. До начала тренировки мы видим типичный вариант правила перераспределения функций и правила предоставления оптимума [20]. Данный показатель на стороне поражения соответствует норме как до, так и после лечения, в то время как на контралатеральной стороне он существенно и достоверно выше. После окончания лечения различия ПО между пораженной и контралатеральной стороной становились недостоверны. Таким образом, проведенное лечение с точки зрения гармонизации функции ходьбы по этому параметру оказалось эффективным.
Абсолютные значения остальных отмеченных изменений на стороне поражения (сохраняющаяся асимметрия периодов ОО и НВД) выросли, но дан- ное изменение не достигало уровня достоверности (p >0,05). Аналогичные закономерности имеются и для параметров высоты подъема стопы, V и КР.
В результате мы можем отметить, что за время лечения объективные пространственно-временные характеристики ходьбы имеют относительно незначительные положительные, но достоверные изменения. Данный результат подтверждается также и полученными достоверными позитивными отличиями по тесту «Встань и иди» и шкале Хаузера.
Кинематика движений в суставах демонстрирует относительно малые, но достоверные изменения. Для тазобедренного сустава динамика параметров отсутствует, т.е. его функция существенно не меняется, и асимметрия по амплитуде сохраняется. Для коленного сустава наибольшая динамика отмечается для основной, маховой, амплитуды и ее фазы. По данной амплитуде имеется максимально выраженная асимметрия между паретичной и контралатеральной конечностью, которая сохраняется практически неизменной и после окончания курса лечения. При этом фаза махового сгибания существенно больше на контралатеральной стороне и приближается к норме на паретичной.
Функция голеностопного сустава также асимметрична с преимущественным снижением на стороне пареза с положительной, хотя и не достигающей уровня достоверности динамикой после лечения. При этом достоверных отличий между паретичной и контралатеральной стороной по его окончании уже нет. Таким образом, ходьба остается медленной, но симметричность ее возрастает.
Анализируемые мышцы не обнаруживают достоверных изменений, кроме икроножной на стороне пареза, активность которой существенно меньше не только по сравнению с нормой, но и контралатеральной конечностью. Однако после курса лечения ЭМГ-активность несколько возра- стает, и данная асимметрия теряет достоверность при сохранении статистически значимых отличий от нормы. Что интересно, активность анализируемых мышц, за исключением икроножной, остается в пределах нормы. Очевидно, что в данной группе это был еще и эффект критериев отбора. В том случае, когда для построения БОС использовалась ЭМГ-активность трехглавой мышцы голени [21], то ее не анализировали в качестве переменного параметра исследования, поэтому возможность сравнительного анализа также от- сутствует.
Обнаруженные изменения и их динамика могут быть охарактеризованы как компенсаторные, при этом конечность на стороне пареза в тех случаях, когда собственных ресурсов паретич-ной ноги достаточно, функционирует в режиме, близком к нормальному, что хорошо видно по целому ряду биомеханических параметров. Контралатеральной конечности достается отличная от нормативной количественная и качественная активность, но здоровая сторона вполне способна это перенести. В результате лечения биомеханические параметры ходьбы модифицируются с общим трендом в сторону нормализации. В целом, однако, мы можем отметить только положительную тенденцию, поскольку в раннем восстановительном периоде процесс реабилитации ходьбы только начинается. Полученные результаты показывают, что для рассматриваемого контингента больных общее количество тренировок должно быть больше. Лимит стационарной реабилитации в 3 нед в данном случае является существенным ограничением. Продолжение тренировок после выписки из стационара теоретически возможно в амбулаторном режиме или режиме дневного стационара, но их организация не всегда технически выполнима.
Ограничения исследования
Мы не могли исключить в данном исследовании влияния других факторов: другие виды восстано- эактика
Том 12 № 4
вительного лечения, которые нельзя было отменить; собственные занятия отдельных пациентов вне лечебного плана; ряд индивидуальных особенностей, способствующих или противодействующих эффективному восстановлению.
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что целенаправленная БОС-тренировка функции ходьбы по ПО позволяет снижать функциональную асимметрию по данному параметру, а также имеет положительный эффект для других показателей походки.
В настоящее время имеется технологическая возможность использовать различные изолированные параметры ходьбы для построения БОС. Возможности и эффективность их применения для целенаправленной коррекции требуют дальнейшего изучения.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Вклад авторов. Д.В. Скворцов — дизайн исследования, поиск и обработка литературы, проведение исследования, обработка данных, написание текста статьи; С.Н . Кауркин — поиск и обработка литературы, проведение исследования, обработка первичных данных, статистическая обработка, написание текста статьи; Г.Е. Иванова — общее руководство, дизайн исследования; Б.Б. Поляев, М.А. Булатова — отбор и обследование больных для исследования, клиническое исследование. Авторы подтверждают соответствие своего авторства международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи прочли и одобрили финальную версию перед публикацией).
Author contribution. D.V. Skvortsov — research design, literature search and processing, research, data processing, writing the text of the article; S.N. Kaurkin — literature search and processing, research, processing of primary data, statistical processing, writing the text of the article; G.E. Ivanova — general management, study design; B.B. Polyaev, M.A. Bulatova — selection and examination of patients for research, clinical research. The authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published and agree to be accountable for all aspects of the work.
Источник финансирования. Работа выполнена в рамках государственного задания ФМБА России (НИР «Разработка новых технологий медицинской реабилитации у пациентов с поражениями и заболеваниями головного мозга») АААА-А19-119042590030-2.
Funding source. The work was carried out within the framework of the state assignment of the FMBA of Russia (R&D “Development of new technologies for medical rehabilitation in patients with brain lesions and diseases”) АААА-А19-119042590030-2.
Список литературы Фасет-синдром. Малоинвазивное хирургическое лечение. Клинический случай и обзор литературы
- Шпагин М.В., Яриков А.В., Назмеев И.А., и др. Опыт де-нервации дугоотростчатых суставов поясничного отдела позвоночника // Хирургия позвоночника. 2019. Т. 16, № 1. С. 57-62. [Shpagin MV, Yarikov AV, Nazmeev IA, et al. The experience of denervation of facet joints in the lumbar spine. Spine Surgery. 2019;16(1):57-62. (In Russ).] doi: 10.14531/ss2019.1.57-62
- Parenteau CS, Lau EC, Campbell IC, Courtney A. Prevalence of spine degeneration diagnosis by type, age, gender, and obesity using Medicare data. Sci Rep. 2021;11(1):5389. doi: 10.1038/s41598-021 -84724-6
- Спирин Н.Н., Киселев Д.В. Проблема хронической боли в спине: фасеточный синдром // Русский медицинский журнал. 2015. Т. 23, № 17. С. 1025-1030. [Spirin NN, Kiselev DV. Chronic back pain problems: facet syndrome. Russian Medical Journal. 2015;23(17):1025-1030. (In Russ).]
- Manchikanti L, Kaye AD, Soin A, et al. Comprehensive evidence-based guidelines for facet joint interventions in the management of chronic spinal pain: American society of interventional pain physicians (ASIPP) guidelines facet joint interventions 2020 guidelines. Pain Physician. 2020;23(3S):S1-S127.
- Каратеев А.Е., Давыдов О.С., Яхно Н.Н., и др. Остео-артрит суставов позвоночника как причина хронической боли в нижней части спины // Научно-практическая ревматология. 2019. Т. 55, № 2. С. 1-16. [Karateev AE, Davydov OS, Yakhno NN, et al. Spinal osteoarthritis as a cause of chronic low back pain. Scientific and Practical Rheumatology. 2019;55(Suppl. 2):1-16. (In Russ).] doi: 10.14412/1995-4484-2019-1-16
- Потапов В.Э., Кошкарева З.В., Животенко А.П., и др. Пункционные хирургические технологии в лечении фасет-синдрома при спондилоартрозах в поясничном отделе (обзор литературы) // Acta Biomedica Scientifica. 2020. Т. 5, № 2. С. 36-42. [Potapov VE, Koshkareva ZV, Zhivotenko AP, et al. Puncture surgical technologies in the treatment of facet syndrome for spondylarthro-sis in the lumbar spine (literature review). Acta Biomedica Scientifica. 2020;5(2):36-42. (In Russ).] doi: 10.29413/ABS.2020-5.2.6
- Lv B, Yuan J, Ding H, et al. Relationship between endplate defects, modic change, disc degeneration, and facet joint degeneration in patients with low back pain. Biomed Res Int. 2019;2019:9369853. doi: 10.1155/2019/9369853
- Varlotta GP, Lefkowitz TR, Schweitzer M, et al. The lumbar facet joint: a review of current knowledge: part 1: anatomy, biomechanics, and grading. Skeletal Radiol. 2011;40(1):13-23. doi: 10.1007/s00256-010-0983-4
- Murena L, Canton G, Giraldi G, Bassini S. Spine pain: clinical features. In: Cova M, Stacul F. (eds). Pain imaging. Springer, Cham; 2019. doi: 10.1007/978-3-319-99822-0-7
- Хорошев Д.В., Ильялов О.Р., Устюжанцев Н.Е., Ня-шин Ю.И. Биомеханическое моделирование межпозвоночного диска поясничного отдела человека — современное состояние проблемы // Российский журнал биомеханики. 2019. Т. 23, № 3. C. 411-422. [Khoroshev DV, Ilyalov OR, Ustyuzhantsev NE, Nyashin YI. Biomechanical modeling of the intervertebral disc of the human lumbar spine — the current state of the problem. Russian Journal of Biomechanics. 2019;23(3):411-422. (In Russ).] doi: 10.15593/RZhBiomeh/2019.3.07
- Луцик А.А., Шмидт И.Р., Колотов Е.Б. Спондилоартроз. Новосибирск: Издатель, 2003. 290 с. [Lutsik AA, Schmidt IR, Kolotov EB. Spondyloarthrosis. Novosibirsk: Publisher; 2003. 290 р. (In Russ.)]
- Митьковский С.В., Кипарисова Е.С., Кочетков А.В., Митьковский В.Г К вопросу о наиболее частых причинах хронического болевого синдрома пояснично-крестцовой локализации. Современные подходы немедикаментозного лечения // Курортная медицина. 2020. № 4. С. 75-88. [Mitkovsky SV, Kipari-sova ES, Kochetkov AV, Mitkovsky VG. To the question of the most common causes of chronic pain syndrome of lumbosacral localization. Modern approaches to non-drug treatment. Spa Medicine. 2020;(4):75-88. (In Russ).]
- Manchikanti L, Schultz DM, Falco FJ, Singh V. Lumbar facet joint interventions. In: Manchikanti L, Kaye A, Falco F, Hirsch J. (eds). Essentials of interventional techniques in managing chronic pain. Springer, Cham; 2018. doi: 10.1007/978-3-319-60361-2-19
- Дедух Н.В., Малышкина С.В., Керн М., Панков Е.Я. Возрастные изменения межклеточного вещества гиалиновой и коллаген-волокнистой хрящевой ткани // Архив анатомии, гистологии и эмбриологии. 1988. Т. 114, № 4. С. 35-40. [Dedukh NV, Malyshkina SV, Kern M, Pankov EY. Age-related changes in the intercellular substance of hyaline and collagen-fibrous cartilage. Archive of Anatomy, Histology and Embryology. 1988;114(4):35-40. (In Russ).]
- Луцик А.А., Колотов Е.Б. Диагностика и лечение спон-дилоартроза // Хирургия позвоночника. 2004. № 1. С. 55-59. [Lutsik AA, Kolotov EB. Diagnosis and treatment of spondyloarthro-sis. Spine Surgery. 2004;(1):55-59. (In Russ).]
- Gries NC, Berlemann U, Moore RJ, Vernon-Roberts B. Early histologic changes in lower lumbar discs and facet joints and their correlation. Eur Spine J. 2000;9(1):23-29. doi: 10.1007/s005860050004
- Hofmann UK, Keller RL, Walter C, Mittag F. Predictability of the effects of facet joint infiltration in the degenerate lumbar spine when assessing MRI scans. J Orthop Surg Res. 2017;12(1):180. doi: 10.1186/s13018-017-0685-x
- Lattig F, Fekete TF, Grob D, et al. Lumbar facet joint effusion in MRI: a sign of instability in degenerative spondylolisthesis? Eur Spine J. 2012;21(2):276-281. doi: 10.1007/s00586-011-1993-1
- Beazell JR, Mullins M, Grindstaff TL. Lumbar instability: an evolving and challenging concept. J Man Manip Ther. 2010; 18(1):9-14. doi: 10.1179/106698110X12595770849443
- Конев В.П., Кривошеин А.Е., Колесов С.В., и др. Морфологические изменения в фасеточных суставах при различных степенях дегенерации межпозвоночных дисков // Современные проблемы науки и образования. 2020. № 2. C. 130-136. [Konev VP, Krivoshein AE, Kolesov SV, et al. Morphological changes in facet joints with various degrees of degeneration of intervertebral discs. Modern Problems of Science and Education. 2020;2:130-136. (In Russ).] doi: 10.17513/spno.29658
- Kim HJ, Kang KT, Son J, et al. The influence of facet joint orientation and tropism on the stress at the adjacent segment after lumbar fusion surgery: a biomechanical analysis. Spine J. 201515(8):1841-1847. doi: 10.1016/j.spinee.2015.03.038
- Ткачев А.М., Епифанов А.В., Акарачкова Е.С., и др. Патофизиологические механизмы дегенерации межпозвонковых дисков // РМЖ. Медицинское обозрение. 2019. Т. 3, № 4-2. C. 72-77. [Tkachev AM, Epifanov AV, Akarachkova ES, et al. Pathophysiological mechanisms of intervertebral disc degeneration. RMJ. Medical Review. 2019;3(4-2):72-77. (In Russ).]
- Gawri R, Rosenzweig DH, Krock E, et al. High mechanical strain of primary intervertebral disc cells promotes secretion of inflammatory factors associated with disc degeneration and pain. Arthritis Res Ther. 2014;16(1):R21. doi: 10.1186/ar4449
- Ma K, Chen S, Li Z, et al. Mechanisms of endogenous repair failure during intervertebral disc degeneration. Osteoarthritis Cartilage. 2019;27(1):41-48. doi: 10.1016/j.joca.2018.08.021
- Fujiwara A, Lim TH, An HS, et al. The effect of disc degeneration and facet joint osteoarthritis on the segmental flexibility of the lumbar spine. Spine (Phila Pa 1976). 2000;25(23):3036-3044. doi: 10.1097/00007632-200012010-00011
- Weishaupt D, Zanetti M, Boos N, Hodler J. MR imaging and CT in osteoarthritis of the lumbar facet joints. Skeletal Radiol. 1999;28(4):215-219. doi: 10.1007/s002560050503
- Manchikanti L, Hirsch JA, Falco FJ, Boswell MV. Management of lumbar zygapophysial (facet) joint pain. World J Orthop. 2016;7(5):315-337. doi: 10.5312/wjo.v7.i5.315
- Boswell MV, Manchikanti L, Kaye AD, et al. A best-evidence systematic appraisal of the diagnostic accuracy and utility of facet (zygapophysial) joint injections in chronic spinal pain. Pain Physician. 2015;18(4):E497- E533.
- Saito T, Steinke H, Miyaki T, et al. Analysis of the posterior ramus of the lumbar spinal nerve: the structure of the posterior ramus of the spinal nerve. Anesthesiology. 2013;118(1):88-94. doi: 10.1097/ALN.0b013e318272f40a


