Фазообразование в системе нитрат кальция – вода – спирт при отрицательных температурах
Автор: Нифталиев Сабухи Илич Оглы, Кузнецова Ирина Владимировна, Клоков Глеб Викторович, Богдаев Алексей Анатольевич
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Фундаментальная и прикладная химия, химическая технология
Статья в выпуске: 3 (53), 2012 года.
Бесплатный доступ
Изучена взаимная растворимость тройных систем Ca(NO 3) 2 – H 2O – i-C 3H 7OH. Эти системы могут быть использованы в качестве охлаждающей жидкости для промышленных холодильных установок. методом сечений при -5 и –10 °С исследована растворимость в трёхкомпонентных системах соль – вода – спирт. Определены компонентные составы равновесных жидкой и твёрдой фаз, построены фазовые диаграммы растворимости, установлены координаты областей гомогенных растворов.
Нитрат кальция, изопропанол, диаграммы растворимости, рефрактометрия, фазобразование
Короткий адрес: https://sciup.org/14039869
IDR: 14039869 | УДК: 546-1
Текст научной статьи Фазообразование в системе нитрат кальция – вода – спирт при отрицательных температурах
Большое количество сточных вод, образующихся на промышленных предприятиях по производству минеральных удобрений, требуют дальнейшей утилизации, в том числе и в виде продуктов вторичного использования.
Физико-химические свойства одного из побочных компонентов производства полифос-фатных удобрений – раствора, содержащего нитрат кальция, позволяют модифицировать его с целью получения жидкости с низкой температурой замерзания, пригодной для дальнейшего применения в качестве хладоносителя в промышленных холодильных установках. Известно, что бинарные растворители (вода-спирт) существенно влияют на растворимость неорганических солей из-за образования гидратов и сольватов, эффектов всаливания и высаливания и могут стабилизировать полученную систему в области низких температур [1].
Тройные системы нитрат кальция – вода – изопропанол в области низких температур не изучены, поэтому исследование условий кристаллизации раствора нитрата кальция, модифицированного изопропанолом в области отрицательных температур, является актуальным, представляет научную и практическую значимость.
Богдаев А.А., 2012
Цель работы – изучить растворимость компонентов системы нитрат кальция – вода – изопропанол при отрицательных температурах и атмосферном давлении методом сечений [2] .
В состав тройных систем нитрат кальция – вода – изопропанол входят двойные системы: Ca(NO 3 ) 2 – H 2 O; Ca(NO 3 ) 2 –i-C 3 H 7 OH и H 2 O –i-C 3 H 7 OH. Данные о растворимости солей свидетельствуют, что нитрат кальция в воде растворяется значительно лучше, чем в спиртах [3]. Растворимость соли уменьшается при увеличении углеводородного радикала: метиловый спирт > этиловый спирт > пропиловые спирты > бутиловые спирты в соответствии со снижением величин диэлектрической проницаемости растворителей [4].
Одноатомные спирты растворяются в воде в значительных количествах благодаря образованию прочных водородных связей с ее молекулами. Строение и структура водноспиртовых растворов существенно зависят от концентрации спирта, его природы, добавок неэлектролита, температуры и других факторов [5, 6].
Эксп еримент проводили в изолированном хладотермостате на основе элементов Пельтье с цифровым термометром
Testo 735-2 – компактным, многофункциональным прибором для измерения температуры в пределах от -200… +400 °С с погрешностью ±0,03 °С.
После снаряжения исследуемой смесью сосуд термостатировали при непрерывном перемешивании. Время установления равновесия в каждой системе определяли, отбирая пробы насыщенного раствора и анализируя их химический состав. Равновесие устанавливалось приблизительно через 30 мин перемешивания. После отстаивания смеси отбирались 3 пробы насыщенного раствора и 2–3 пробы осадка. Измеряли показатель преломления жидкой (L) и твердой (S) (после плавления) фаз на рефрактометре ИРФ – 454Б2М с термостатом. Измерение показателя преломления позволяет непосредственно установить концентрацию двухкомпонентного раствора [7]. Результаты исследования системы H 2 O – i-C 3 H 7 OH при температуре -5 0 С представлены на рис. 1 и в таблице.
Таблица
Состав жидкой и твердой фаз системы H 2 O – i-C 3 H 7 OH при -5 °С
|
Массовая доля спирта в исх. растворе, % |
Показатель преломления жидкой фазы |
Массовая доля спирта в жидкой фазе, % |
Показатель преломления твёрдой фазы после плавления |
Массовая доля спирта в твёрдой фазе, % |
|
0 |
- |
- |
1,3333 |
0 |
|
5 |
1,3333 |
- |
1,3368 |
5,0 |
|
10 |
1,3421 |
11,2 |
1,3389 |
7,5 |
|
15 |
1,3463 |
16,1 |
1,3423 |
11,2 |
|
20 |
1,3501 |
20,0 |
- |
- |
|
25 |
1,3541 |
25,0 |
- |
- |
|
40 |
1,3570 |
40,0 |
- |
- |
|
60 |
1,3620 |
60,0 |
- |
- |
|
80 |
1,3720 |
80,0 |
- |
- |
|
100 |
1,3776 |
100,0 |
- |
- |
Форма рассмотренной кривой зависит от природы компонентов и их взаимодействия при образовании раствора, а также от способа выражения его состава. Линейный характер прямой в области низких концентраций изопропанола говорит о точности рефрактометрического анализа и возможности его использования в дальнейших измерениях [6]. Значение показателя преломления твердой фазы (таблица) выше значения показателя преломления воды (1,333), что свидетельствует о наличии в кристаллической фазе изопропанола. При повышении концентрации спирта выше 15 % раствор не замерзает.
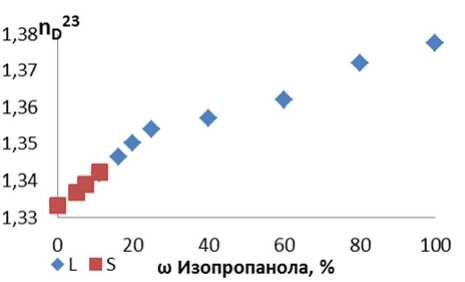
Рис. 1. Зависимость показателя преломления от массовой доли i-C 3 H 7 OH в твердой (S) и жидкой (L) фазах при -5 °С
Трехкомпонентные смеси различного состава готовили в массовом соотношении взвешиванием на аналитических весах. Правильность приготовления растворов контролировали рефрактометрически по справочным данным. Изотермич еское изучение растворимости компонентов систем Ca(NO 3 ) 2 – H 2 O – спирт осуществляли в бюксах. В качестве измеряемого параметра выбран коэффициент преломления. По воспроизводимости результатов измерения установлено, что равновесие в исследуемых системах достигается в течение трех дней. Относительная погрешность определения растворимости нитрата кальция составила ±0,5 %.
Результаты экспериментов представлены в виде концентрационных треугольников Гиб-бса‒Розебома, вершины которых отвечают чистым компонентам, точки на сторонах — составам бинарных систем, а точки внутри треугольников характеризуют состав тройных смесей. Диаграммы растворимости систем Ca(NO 3 ) 2 – H 2 O – спирт построены на основе изучения смесей компонентов трех сечений на каждом из двух концентрационных треугольников. Тройные смеси характеризовались переменным содержанием соли и постоянным соотношением масс воды и спирта 90:10 (I сe-чение), 80:20 (II сечение), 50:50 (V сечение).
По экспериментальным данным строили функциональные кривые зависимости коэффициента преломления водно-спиртовой фазы от содержания нитрата кальция при -5 °С (рис. 2).
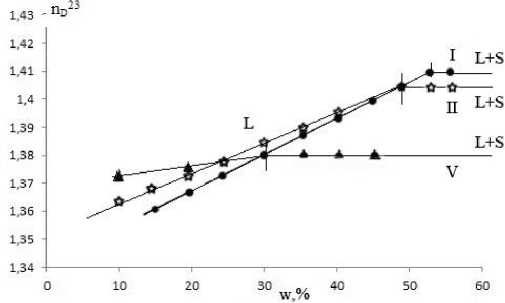
Рис. 2. Зависимость коэффициента преломления жидкой фазы от содержания нитрата кальция в смесях компонентов I, II и V сечений тройной системы Ca(NO 3 ) 2 – H 2 O – i-C 3 H 7 OH
По точкам пересечения ветвей функциональных кривых построены линии растворимости на треугольниках состава систем нитрат кальция – вода – спирт (рис.3, 4).
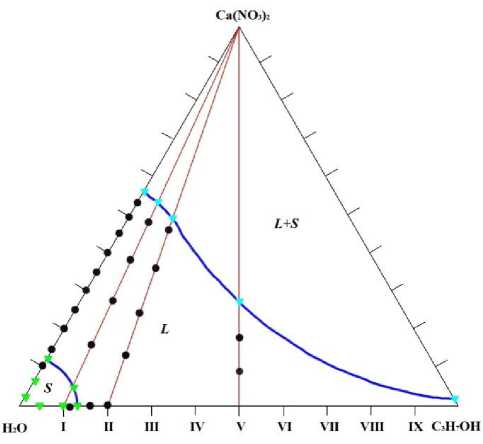
# - Жидкая фаза
▲ - Твердая фаза
Рис. 3. Диаграмма растворимости системы Ca(NO 3 ) 2 – H 2 O – i-C 3 H 7 OH при -5 °С
Из рис. 3 видно, что функциональные кривые всех сечений аналогичны и состоят из двух ветвей, относящихся к гомогенному (L-жидкость, S-твердое) и насыщенному (L +S) состояниям смесей компонентов. Линии растворимости непрерывны, что соответствует кристаллизации в системах одной твердой фазы нитрата кальция при увеличении концентраций спирта и соли и кристаллизации всей системы в области низких концентраций компонентов. Область гомогенного раствора L ограничена линиями кристаллизации двух твёрдых фаз. Одна из них отсекает поле кристаллизации льда, примыкающее к вершине H2O концентрационного треугольника, другие ограничивают области кристаллизации нитрата кальция. Проанализируем ход растворимости и фазовые соотношения, рассматривая диаграмму слева направо. Интервал гомогенной растворимости нитрата кальция в чистой воде при t = -5 °C ограничен двумя точками. Первая соответствует 12 мас.% Сa(NO3)2. Растворы с меньшим содержанием нитрата кальция являются гетерогенными и содержат кристаллы льда. Вторая точка соответствует 58,3 мас. % Сa(NO3)2. Увеличение содержания нитрата кальция приводит к появлению в системе равновесия «насыщенный раствор — тетра- гидрат нитрата кальция - Сa(NO3)2・4H2O» [8]. С увеличением массовой доли спирта растворимость соли уменьшается и ограничивается растворимостью Сa(NO3)2 в чистом изопропаноле 0,5 мас.%.
На фазовой диаграмме, полученной таким же методом, при – 10 °С (рис. 4) видно, что область жидкого состояния уменьшается за счет расширения фазы S. Область S+L возросла незначительно из‐за увеличения растворимости соли в спирте при понижении температуры.
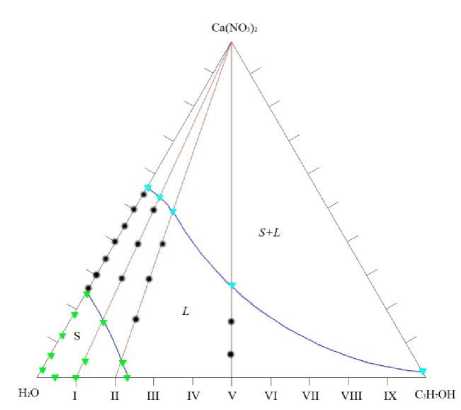
# - Жидкая фаза
▲ - Твердая фаза
Рис. 4. Диаграмма растворимости системы
Ca(NO 3 ) 2 – H 2 O – i-C 3 H 7 OH при -10 °С
Таким образом, выявлено монотонное уменьшение растворимости нитрата кальция при увеличении массового содержания изопропилового спирта в смешанном растворителе, а при снижении температуры – уменьшение площади, соответствующей жидкой фазе L. Изученные фазовые диаграммы могут быть использованы при выборе оптимального соотношения компонентов смеси для создания технической охлаждающей жидкости.


