Фазовое равновесие в системе пропанол - пропил формиат с глубоким эвтектическим растворителем (хлорид холина: мочевина) при 313.15 К
Автор: Голикова А.Д., Смирнов А.А.
Журнал: Международный журнал гуманитарных и естественных наук @intjournal
Рубрика: Химические науки
Статья в выпуске: 11-5 (74), 2022 года.
Бесплатный доступ
В работе представлены экспериментальные данные о разделении смеси пропанол - пропилформиат с помощью глубокого эвтектического растворителя (ГЭР) на основе хлорида холина (ChCl). Фазовое равновесие жидкость - жидкость для системы пропанол - пропилформиат - ГЭР изучено при 313.15 К и атмосферном давлении. Составы равновесных фаз были определены с помощью метода ядерного магнитного резонанса. С помощью расчета коэффициентов распределения и значения селективности была произведена оценка эффективности разделения системы пропанол - пропилформиат с помощью ГЭР на основе хлорид холина и донора водородной связи (мочевина). Корреляция экспериментальных результатов проводилась с помощью модели локального состава NRTL.
Пропанол, глубокий эвтектический растворитель, экстракция растворителем, хлорид холина
Короткий адрес: https://sciup.org/170197279
IDR: 170197279 | DOI: 10.24412/2500-1000-2022-11-5-125-129
Текст научной статьи Фазовое равновесие в системе пропанол - пропил формиат с глубоким эвтектическим растворителем (хлорид холина: мочевина) при 313.15 К
Глубокие эвтектические растворители являются новым классом перспективных жидких сред. Интерес в разработке и исследовании ГЭР возникает из-за их потенциала как, экологически безопасных растворителей, их необычных свойств сольватации и недорогой стоимости [1]. Благодаря своим свойствам ГЭР нашли применение во многих отраслях промышленности [2], в том числе данные растворители нашли свое применение в пищевой [3, 4] и косметической индустриях [5]. В данной работе представлены результаты исследования разделения системы 1-пропанол + 1-пропилформиат с помощью глубокого эвтектического растворителя на основе хлорида холина. Спирты и сложные эфиры широко используются как растворители, ароматизаторы, активные компоненты и консерванты в различных областях промышленности, особенно в тех, что касаются продуктов питания и косметических средств.
Экспериментальная часть
В данной работе проведено исследование фазового равновесия жидкость – жидкость в псевдо-тройной системе, представленной в виде фазовых диаграмм, состоящих из спирта, сложного эфира и ГЭР: 1-пропанол – 1-пропилформиат – ГЭР при температурах 313.15 К, давлении 101.3 кПа. В качестве ГЭР рассмотрена смесь хлорид холина – мочевина (Ur) в мольном соотношении 1:2 (рассматривается в качестве псевдо-компонента). Исходя из экспериментально определённых данных о составах сосуществующих фаз рассчитаны и определены коэффициенты распределения спирта и сложного эфира, селективность извлечения спирта, помимо этого определены параметры NRTL. Для проведения эксперимента были использованы 1-пропанол, 1-пропилформиат (компании «Вектон») и хлорид холина (компании AppliChem.) Хлорид холина сушили в вакуумном сушильном шкафу. Спирт и эфир очищали методом ректификации. Чистоту реактивов проверяли на газовом хромато- графе (1-пропанол, 1-пропилформиат) и термогравиметрическим анализом (хлорид холина, мочевина). Предварительно хлорид холина был выдержан под вакуумом (1 Па) при нагревании (343 К) в течение 5 ч для удаления воды. Затем хлорид холина помещался в сосуды объёмом 5 мл с добавлением мочевины. Масса веществ была установлена гравиметрическим методом с помощью весов Shinko VIBRA HT-120CE (Япония) (точность до 0.001 г). Смесь помещалась в ультразвуковую ваннеу при 313.15 К до образования прозрачной жидкости (2-4 ч). Метод Карла Фишера был применен для определения содержание воды. Образцы ГЭР содержат менее 0.1 массовых % воды, что не превышает допустимого значения. Далее в виалы до- бавлялись предварительно рассчитанные колличества спирта (1-пропанол) и эфира (1-пропилформиат) и производилось перемешивание при постоянной темпетатуте (313.15К). Следующим шагом было термостатирование выдерживание образцов для установления полного разделения фаз. Каждая фаза анализировалась методом ядерного магнитного резонанса (ЯМР-спектрометр 500 МГц Bruker AVANCE III).
Обсуждение результатов
Экспериментальные данные фазового равновесия жидкость-жидкость, полученные для системы 1-пропанол + 1- пропил-формиат + ГЭР (хлорид холина:мочевина) при температуре 313.15 К приведены в таблмце 1 и на рисунке 1.
Таблица 1. Экспериментальные данные равновесия жидкость — жидкость для системы 1-пропанол (1) + 1- пропилформиат(2) — ГЭР (ChCl/Ur) (3) при 313.15 K и P=101.3 кПа, ω i — массовые доли, β i – коэффициент распределения, S – селективность.
|
Органическая фаза |
ГЭР фаза |
Расчетные параметры |
||||||
|
w 1 |
w 2 |
w 3 |
w 1 |
w 2 |
w 3 |
β спирт |
β эфир |
S |
|
0,000 |
0,999 |
0,001 |
0,000 |
0,024 |
0,527 |
- |
- |
- |
|
0,075 |
0,924 |
0,001 |
0,020 |
0,020 |
0,517 |
0,267 |
0,022 |
12,32 |
|
0,142 |
0,853 |
0,001 |
0,031 |
0,017 |
0,519 |
0,218 |
0,020 |
10,95 |
|
0,218 |
0,770 |
0,005 |
0,043 |
0,018 |
0,504 |
0,197 |
0,023 |
8,44 |
|
0,273 |
0,703 |
0,011 |
0,049 |
0,018 |
0,504 |
0,179 |
0,026 |
7,01 |
|
0,320 |
0,643 |
0,019 |
0,056 |
0,023 |
0,497 |
0,175 |
0,036 |
4,89 |
|
0,353 |
0,594 |
0,028 |
0,058 |
0,021 |
0,494 |
0,164 |
0,035 |
4,65 |
|
0,387 |
0,548 |
0,035 |
0,061 |
0,021 |
0,498 |
0,158 |
0,038 |
4,11 |
|
0,421 |
0,502 |
0,044 |
0,063 |
0,020 |
0,486 |
0,150 |
0,040 |
3,76 |
|
0,450 |
0,455 |
0,055 |
0,062 |
0,018 |
0,492 |
0,138 |
0,040 |
3,48 |
|
0,473 |
0,422 |
0,060 |
0,066 |
0,018 |
0,481 |
0,140 |
0,043 |
3,27 |
|
0,502 |
0,373 |
0,073 |
0,080 |
0,022 |
0,469 |
0,159 |
0,059 |
2,70 |
|
0,527 |
0,331 |
0,081 |
0,086 |
0,022 |
0,464 |
0,163 |
0,066 |
2,46 |
1-пропано.л
0,0
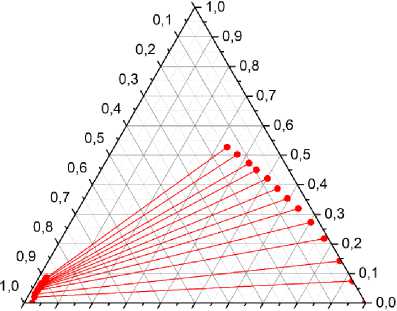
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1,0
ГЭР (ChCl/Ur) 1-пропилформиат
Рис. 1. Ноды равновесия жидкость–жидкость в псевдотройной системе с участием ГЭР (ChCl/Ur): 1-пропанол+1- пропилформиат–ГЭР (313.15 K).
Для оценки эффективности экстракции были рассчитаны коэффициенты распределения (βi) и селективность (S) представленные в таблице 1:
II п _ Испирт
Р спирт = ,
Испирт
А ф-р ’ /^ (1)
Иэфир
^ _ / И/^ирт А / ^фир А
VМ^пирт/ Х^эфир/ где w - массовая доля компонента i в органической фазе (I) или в фазе ГЭР (II). Для более наглядного восприятия были построены зависимости значения селективности от содержания 1-пропанола и коэффициентов распределения от содержания спирта и эфира. Зависимости представлены на рисунках 2 и 3.
(2),
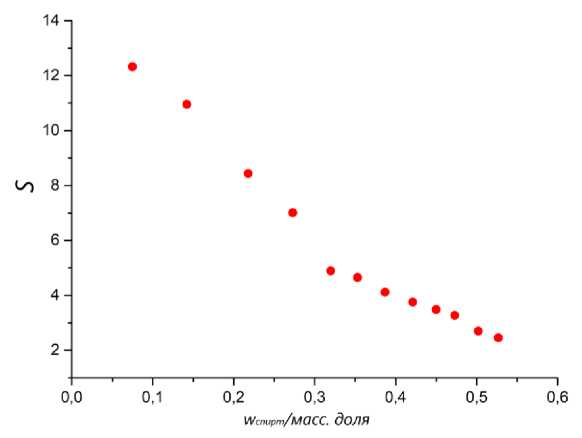
Рис. 2. Зависимость селективности от концентрации 1-пропанола в органической фазе в системе: 1-пропанол + 1-пропилформиат-ГЭР (ChCl:Ur) при 313.15 К.
0,30-1
0,25
0,20 -▲ ео.о.15-
0,10
0,05-
0,00----------.----------1----------,----------т----------.----------1----------,----------т----------.----------1----------.,
0,0 0,1 0,2 0,3 0,4 0,50,6
Wrapm/масс. доля
Рис. 3. Зависимость коэффициентов распределения от массовой доли 1-пропанола в системе: 1-пропанол + 1-пропилформиат-ГЭР (ChCl:Ur) при 313.15 К, красные треугольники (▲) - коэффициенты распределения спирта (в спирт ), красные квадраты ( | ) - коэффициенты распределения эфира (в эфира )
Зависимости коэффициентов распределения 1-пропанола и 1-пропилформиата от концентрации спирта приведены на Рис. 2. Коэффициенты распределения спирта имеют тенденцию к снижению, в то время как коэффициенты распределения эфира увеличиваются, но не значительно. Зависимости значений селективности от массовой доли спирта, представлены на Рис. 3. Исходя из полученных зависимостей, можно сделать вывод, что селективность разделения снижается с увеличением содержания спирта в системе.
Моделирование
Все экспериментальные результаты были проверены на внутреннюю согласованность с помощью моделей Отмера– Тобиаса [6], Хэнда и [7] Бахмана [8]. Тагже было проведено моделирование с помощью модели NRTL [9]. Подробное описание моделей и их применение для исследованных систем также представлены в работах [10, 11]. В таблицах 2 и 3 представлены расчетные параметры для системы 1- пропанол – 1- пропилформиат – ГЭР(ChCl/Ur) полученные с помощью представленных моделей соответственно.
Таблица 2. Результаты корреляции с помощью моделей Отмера–Тобиаса, Хэнда и Бахмана для описания результатов равновесия жидкость – жидкость псевдо-тройной системы 1- пропанол-1- пропилформиат – ГЭР ((ChCl/Ur) полученных при 313.15 К
|
Отмер–Тобиас |
|||
|
a |
b |
c |
R2 |
|
0,0221 |
0,3416 |
-2,3898 |
0,9739 |
|
Хэнд |
|||
|
a |
b |
c |
R2 |
|
-0,0332 |
-0,3106 |
-2,0092 |
0,9665 |
|
Бахман |
|||
|
a |
b |
c |
R2 |
|
0,1768 |
0,7617 |
0,0292 |
0,9997 |
Коэффициент корреляции (R2) выше 0.9 указывает на высокую согласованность полученных экспериментальных данных (табл. 2).
Таблица 3. Энергетические параметры g ji , полученные корреляцией экспериментальных данных о фазовом равновесии жидкость–жидкость моделью NRTL для псевдо-тройной системы 1- пропанол+1- пропилформиат + ГЭР (ChCl/Ur) при 313.15К.
Заключение. Представлены данные об экстракционных свойствах глубокого эвтектического растворителя хлорид холина-мочевина (1:2). Данные о фазовом равновесии в системе 1- пропанол + 1 – пропил-формиат с указанным ГЭР получены методом ядерного магнитного резонанса при температуре 313.15 К во всем диапазоне концентраций. Была подтверждена высокий уровень внутренней согласованности.
Список литературы Фазовое равновесие в системе пропанол - пропил формиат с глубоким эвтектическим растворителем (хлорид холина: мочевина) при 313.15 К
- Hayyan M. et al. A novel technique for separating glycerine from palm oil-based biodiesel using ionic liquids // Fuel Processing Technology. - 2010. - Vol. 91, № 1. - P. 116-120.
- Jablonsky M. et al. Extraction of value-added components from food industry based and agro-forest biowastes by deep eutectic solvents // Journal of Biotechnology. - 2018. - Vol. 282. - P. 46-66.
- Dai Y., Verpoorte R., Choi Y.H. Natural deep eutectic solvents providing enhanced stability of natural colorants from safflower (Carthamus tinctorius) // Food Chemistry. - 2014. -Vol. 159. - P. 116-121.
- Khare L. et al. Menthol based hydrophobic deep eutectic solvent for extraction and purification of ergosterol using response surface methodology // Food Chemistry. - 2021. - Vol. 340. - P. 127979.
- Oktaviyanti N.D., Kartini, Mun'im A. Application and optimization of ultrasound-assisted deep eutectic solvent for the extraction of new skin-lightening cosmetic materials from Ixora ja-vanica flower // Heliyon. - 2019. - Vol. 5, № 11. - P. e02950.
- Othmer D.F., Tobias P.E. Liquid -Liquid Extraction Data -Toluene and Acetaldehyde Systems // Ind. Eng. Chem. - 1942. - Vol. 34, №6. - P. 690-692.
- Hand D.B. Dineric Distribution // J. Phys. Chem. - 1930. - Vol. 34, № 9. - P. 1961-2000.
- Bachman I. Convergence of Tie Lines in Ternary Liquid Systems. // J. Phys. Chem. - 1940. - Vol. 44, №4. - P. 446-449.
- Renon H., Prausnitz J.M. Local compositions in thermodynamic excess functions for liquid mixtures // AIChE Journal. - 1968. - Vol. 14, № 1. - P. 135-144.
- Самаров А.А., Тойкка М.А., Тойкка А.М. Фазовые равновесия в системах спирт-эфир с глубокими эвтектическими растворителями на основе хлорида холина при 293.15 и 313.15 K // Теор. основы хим. технол. - 2021. - Vol. 55, №2. - P. 224-234.
- Samarov A.A. et al. Liquid-Liquid Equilibrium Data for the System N-Octane + Toluene + DES at 293.15 and 313.15 K and Atmospheric Pressure // Theor Found Chem Eng. - 2018. -Vol. 52, № 2. - P. 258-263.


