Фермент-индуцирующее действие оригинального антиконвульсанта галодиф - модулирующий временной фактор, перспективы клинического применения при терапии пароксизмальных расстройств
Автор: Шушпанова Т.В., Новожеева Т.П., Васильева О.А., Удут В.В.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Психофармакотерапия
Статья в выпуске: 4 (121), 2023 года.
Бесплатный доступ
Введение. Совершенствование фармакотерапии возможно путём создания новых лекарственных средств и оптимизации терапевтического мониторинга. Данный подход может быть реализован при условии изучения особенностей биотрансформации препарата ферментами монооксигеназной системы печени (МОС), его фармакокинетики и фармакодинамики в организме.
Антиконвульсант, галодиф, пароксизм, печень, цитохром р450, микросомальная система окисления, фармакокинетика
Короткий адрес: https://sciup.org/142239824
IDR: 142239824 | УДК: 615.241:612.354.2:616.853 | DOI: 10.26617/1810-3111-2023-4(121)-61-69
Текст научной статьи Фермент-индуцирующее действие оригинального антиконвульсанта галодиф - модулирующий временной фактор, перспективы клинического применения при терапии пароксизмальных расстройств
В настоящее время существует острая необходимость в разработке эффективных и безопасных методов лечения социально значимых заболеваний и создании новых фармакотерапевтических средств. Несмотря на значительные успехи, достигнутые в эпилептологии, у значительной части (более 30%) пациентов не удается добиться полного контроля над приступами, в связи с чем остается актуальным создание новых антиэпилептических препаратов (АЭП), рациональных комбинаций существующих АЭП с учетом их механизмов действия [1, 2, 3]. Повышенный интерес представляют препараты с отличным от других АЭП механизмом действия [3, 4, 5, 6].
Разработка оригинальных инновационных соединений, обладающих модуляторным действием на нейрональные рецепторы, в частности рецепторы γ -аминомаслянной кислоты (ГАМК), способствует созданию новых лекарственных препаратов и является значимой стратегией в лечении пароксизмальных расстройств, эпилепсии, болезней зависимости с выраженным компульсивным влечением к ПАВ [7, 8, 9]. Совершенствование фармакотерапии возможно путём создания новых лекарственных средств. Оптимизация фармакотерапии практически осуществима путём использования разных форм и различных путей введения лекарственных средств, за счет включения оптимальных дозовых режимов, обеспечивающих максимальный терапевтический эффект при отсутствии (или минимальной выраженности) нежелательных реакций, разработки способов прогнозирования эффективности лечения и устранения возможных осложнений, на основе подбора рациональных комбинаций препаратов и предупреждения их нежелательного фармакокинетического взаимодействия, а также с помощью терапевтического мониторинга [9, 10]. Большинство этих подходов может быть реализовано лишь при условии изучения особенностей биотрансформации препарата ферментами монооксигеназной системы печени, фармакокинетики и фармакодинамики препарата в организме.
Применяемые в терапии пароксизмальных состояний антиконвульсанты, оказывающие противосудорожное, антипароксизмальное действие, снижающие компульсивное влечение к приему ПАВ, также могут обладать выраженным фермент-индуцирующим действием в отношении цитохром Р450-зависимой монооксигеназной системы (МОС) печени, стимулируя детоксикационную функцию печени. ГАМК-стимулирующее действие антиконвульсанта галодиф с противосудорожной активностью, усиливающее процессы торможения в головном мозге, эффективно для купирования пароксизмальных расстройств, эпилепсии, тревожно-депрессивной симптоматики, раздражительности и агрессивности в структуре алкогольного абстинентного синдрома (отмены алкоголя), снижения компульсивного влечения к алкоголю. Ранее нами были изучены фермент-индуцирующие свойства цитохром Р-450 зависимой МОС печени и фармакокинетических параметров оригинального отечественного антиконвульсанта галодиф в зависимости от различных сроков длительности действия препарата [9].
В отечественной и зарубежной литературе представлены данные, которые свидетельствуют о том, что не обнаружено клинически значимых фармакокинетических взаимодействий между АЭС и лекарственными средствами, метаболизированными CYP3A4, CYP2C19, CYP1A2 или CYP2C9. При этом сопутствующее использование психотропных препаратов, метаболизируемых CYP2D6, может потребовать корректировки дозы [4, 10, 11]. Представлено, что антиконвульсант галодиф обладает выраженным противосудорожным действием, снижающим алкогольную мотивацию [8, 12], и выраженным фермент-индуцирующим действием в отношении цитохром Р450-зависимой МОС печени [9]. Длительное его применение может сопровождаться как изменением фармакокинетики самого галодифа, так и назначаемых совместно с ним лекарственных средств. Это побудило нас исследовать фармакокинетику галодифа в важном органе-мишени – печени – с учетом различной длительности введения его в организм.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить параметры фармакокинетики галодифа, оценить фермент-индуцирующее действие на микросомальную цитохром Р450-зависимую систему окисления печени экспериментальных белых крыс в зависимости от длительности введения.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальное исследование выполнено на 50 белых беспородных крысах-самцах массой 200-220 граммов, полученных из питомника НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга Томского НИМЦ РАН (г. Томск). Животных содержали в условиях лабораторного вивария, на стандартной диете, при нормальном световом режиме. Содержание экспериментальных животных соответствовало правилам, принятым Европейской конвенцией по защите животных, используемым при выполнении экспериментальных и иных научных целей (Страсбург, 1986), и правилам лабораторной практики (приказ № 267 от 19.06.2003 Минздрава РФ).
Галодиф является оригинальным противосудорожным препаратом, разработанным для лечения и профилактики эпилепсии и алкогольной зависимости. Галодиф представляет собой нециклическое производное мочевины (1-[(3-хлорфенил)(фенил)метил]мочевина). В отличие от своих предшественников, является действующим веществом, не требующим трансформации в печени, что значительно снижает его токсичность и уменьшает побочные эффекты
Галодиф вводили в форме суспензии на 1% крахмальной слизи внутрижелудочно в эффективной дозе 100 мг/кг. Продолжительность введения составила 1, 5 и 15 дней, что обусловлено фазными изменениями активности монооксигеназной системы печени при назначении галодифа: активация после 3-4 введений, ослабление индуктивного ответа к концу 1 месяца [13]. Животных из экспериментальных групп декапитировали, перфузировали печень ледяным 1,15% раствором хлорида калия. Микросомальную фракцию из гомогената печени крыс получали по методу, предложенному И.И. Карузиной, А.И. Арчаковым [14], с использованием высокоскоростного центрифугирования 50000 g при температуре 2-4°С, в течение 2- часов. Полученные осадки ресуспендировали в фосфатном буфере рН 7,4, концентрация белка в препаратах микросом составляла 20-30 мг/мл. Анализ микросом проводили в течение первых 6 часов после выделения. Содержание белка в микросомальной фракции оценивали по микрометоду Лоури. Содержание цитохромов семейства CYР450 в микросомальной фракции оценивали по методу Omura, Sato [15], принцип которого основан на сравнении дифференциальных спектров окисленного и восстановленного CYР450. Спектры снимали на дифференциальном спектрофотометре Хитачи-557 (сканирующий двухлучевой режим).
Определение галодифа в микросомальной фракции печени крыс проводили методом экстракции галодифа из гомогената печени крыс хлороформом при нейтральном рН при центрифугировании со скоростью 3000 об/мин в течение 5 минут для полного разделения фаз. Хлороформный слой отбирали, измерение проводили на спектрофотометре при длине волны 433 нм. Концентрацию галодифа рассчитывали в соответствии с калибровочным графиком, построенным по растворам субстанции галодифа в возрастающей концентрации в изопропаноле (0,5-200 мкг/мл). Калибровочный график сохранял линейность в пределах 0,5-100 мкг/мл. Перед расчётом по графику из величины оптической плотности опытной пробы вычитали величину оптической плотности нулевой пробы для компенсации вклада в оптическую плотность эндогенных веществ. Количественный анализ галодифа осуществляли с учетом взаимодействия первичной алифатической аминогруппы молекулы галодифа с n-диметиламинобензальдегидом. Параметры фармакокинетики рассчитывали модельнонезависимым методом статистических моментов. Статистическую значимость различий оценивали по λ-критерию Колмогорова-Смирнова.
Данные представлены в виде М±SD. Различия считали статистически значимыми при p <0,05. Все расчёты осуществляли с помощью пакета программ STATISTICA для Windows v. 12.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе выполнения исследовании оценивали фармакокинетику галодифа в органе-мишени печени при длительном режиме его введения, проводили сопоставление параметров фармакокинетики с индуцирующим действием препарата в отношении микросомальной системы окисления печени, оценивали роль индуцирующих свойств в реализации противосудорожных свойств галодифа. Проведено сопоставление параметров фармакокинетики с показателями ферментиндуцирующего действия препарата при его введении в зависимости от различных сроков введения препарата: 1, 5 и 15 дней.
Оценивали биохимические показатели состояния монооксигеназ печени и параметры фармакокинетики галодифа в зависимости от различной длительности его введения экспериментальным животных. Показано, что 1-кратное введение галодифа в дозе 100 мг/кг через 24 часа после введения препарата статистически значимо не изменяет уровень цитохрома Р450 в микросомальной фракции печени крыс (табл. 1).
Т а б л и ц а 1. Значения параметров фармакокинетики галодифа в ткани печени в зависимости от различной длительности введения препарата
|
Параметр |
1-кратное введение |
5-кратное введение |
15-кратное введение |
|
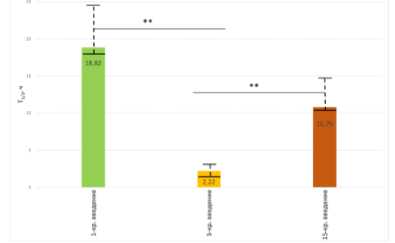
Т 1/2 , ч |
18,82 ± 6,25 |
2,22 ± 0,52** |
10,79 ± 2,90** |
|
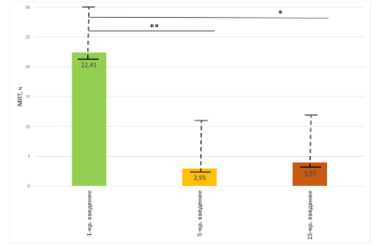
MRT, ч |
22,41 ± 7,07 |
2,95 ± 0,73* |
3,97 ± 1,03* |
|
MDT, ч |
11,77 ± 3,97 |
9,10 ± 2,42* |
0,97 ± 0,080* |
|
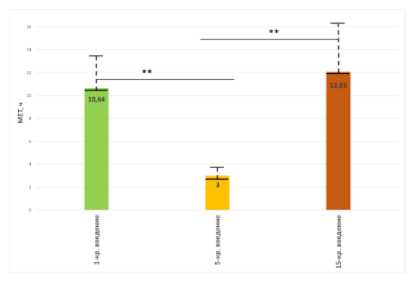
MET, ч |
10,64 ± 2,84 |
3,00 ± 0,65** |
12,05 ± 4,10** |
|
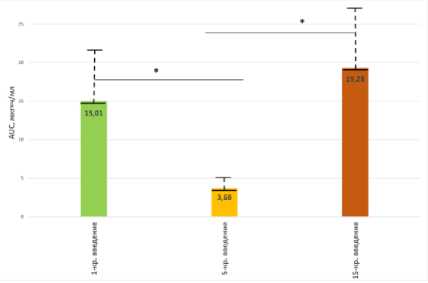
АUС, мкг ⋅ ч/мл |
15,01 ± 4,86 |
3,68 ± 0,79* |
19,28 ± 7,13* |
Статистическая значимость различий по λ -критерию Колмогорова-Смирнова в ‒ р<0,01, ** ‒ р<0,05.
П р и м е ч а н и е.
сравнении с 1-кратным введением:
Фармакокинетика галодифа при 1-кратном введении характеризуется высокой величиной периода полувыведения (Т1/2) и низким значением общего клиренса. Высокие показатели среднего времени удерживания (MRT) и среднего времени элиминации (MET) свидетельствуют о задержке препарата в организме. Значительная величина площади под кривой «концентрация-время» указывает на большой объем содержания галодифа в организме (табл. 1, рис. 1, 2, 3 и 4).
Р и с у н о к 1. Фармакокинетический параметр Т½ ‒ Р и с у н о к 2. Фармакокинетический параметр MRT ‒ время полувыведения галодифа в ткани печени крыс среднее время удерживания галодифа в ткани печени в зависимости от продолжительности введения: крыс в зависимости от продолжительности введения: 11-кратное, 5-кратное, 15-кратное кратное, 5-кратное, 15-кратно
Р и с у н о к 3. Фармакокинетический параметр MET Р и с у н о к 4. Фармакокинетический параметр AUC ‒ ‒ среднее время элиминации галодифа в ткани площадь под фармакокинетической кривой галодифа печени крыс в зависимости от продолжительности в ткани печени крыс в зависимости от введения: 1-кратное, 5-кратное, 15-кратное продолжительности введения: 1-кратное, 5-кратное, 15- кратное
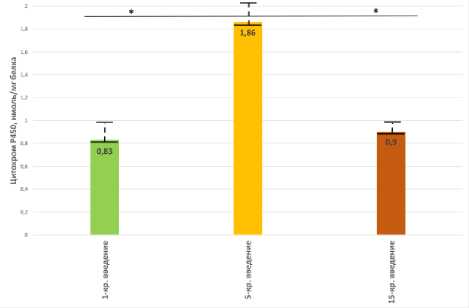
Рисунок 5. Уровень цитохрома Р450 в зависимости от продолжительности введения: 1-кратное, 5-кратное, 15-кратное
Выявленные большой период полувыведения препарата (Т^), относительно высокие величины MRT и МЕТ свидетельствуют о существенной задержке галодифа в ткани печени при 1-кратном введении. Значительная величина площади под кинетической кривой ( AUC ) также указывает на длительную циркуляцию препарата в организме крыс после 1-кратного введения. При этом тканевая доступность галодифа для печени не высока, поэтому значительное количество препарата, задерживаемое в ткани, по-видимому, обусловлено замедленной его элиминацией.
Наши данные совпадают с аналогичными публикациями о том, что в молекулярном механизме действия индукторов фазе индукции предшествует фаза ингибирования (торможения) образования/распада фермент-субстратных комплексов [11]. Установлено, что 1-кратное введение галодифа в дозе 100 мг/кг через 24 часа не изменяло статистически значимо уровень цитохрома Р450 в микросомальной фракции печени крыс (рис. 5). Этот эффект обусловлен как липофильными свойствами галодифа, так и способностью связываться с гемсодержащими ферментами, в том числе с цитохромами семейства CYP Р450 микросомальной МОС печени [13].
В результате 5-кратного введения галодифа наблюдаются существенные изменения параметров фармакокинетики: уменьшается период его полувыведения, возрастает общий клиренс, снижаются значения среднего времени удерживания, элиминации и распределения, что подтверждает ускорение выведения галодифа из организма. Вследствие уменьшения биологической доступности галодифа резко снижается величина AUC, по-видимому, за счет его ускоренной элиминации. По результатам 5-кратного введения галодифа в дозе 100 мг/кг в микросомальной фракции печени крыс значительно возрастает уровень цитохрома Р450, что характеризует стимуляцию функциональной активности монооксигеназ [11, 13]. В случае 5-кратного введения в дозе 100 мг/кг галодиф проявляет выраженные свойства индуктора монооксигеназ и, следовательно, может ускорять биотрансформацию и элиминацию экзогенных и эндогенных субстратов, в том числе и собственный метаболизм. Очевидно, что этот эффект обусловлен индуцирующими свойствами галодифа в отношении микросомальной системы окисления печени. Полученные данные по фармакокинетике свидетельствуют об ускорении собственной биотрансформации галодифа, описанной в отношении многих антиконвульсантов-индукторов МОС -фенобарбитала, карбамазепина, гексамидина [10, 13, 16]. Вероятность ускорения собственного метаболизма следует учитывать в клинической практике при назначении галодифа. Таким образом, несмотря на процессы индукции МОС гепатоцитов и возможные процессы аутоиндукции и ускорения элиминации, печень остается важной биомишенью для фармакологического воздействия молекул галодифа и через 5 суток его ежедневного введения в дозе 100 мг/кг.
После курсового 15-кратного введения галодифа в дозе 100 мг/кг возросший при кратковременном введении уровень цитохрома Р450 снижается, а сам препарат проявляет умеренные свойства индуктора монооксигеназ печени и, возможно, модифицирует элиминацию из организма экзогенных и эндогенных субстратов, в том числе и собственную биотрансформацию и элиминацию. Этот факт подтверждают полученные данные по фармакокинетике 15-дневного введения галодифа.
Представленные структурированные фармакокинетические параметры галодифа (табл. 1, рис. 1-4) свидетельствуют об ускоренной элиминации по сравнению с 1-кратным назначением. Общий клиренс снижен в сравнении с 5-дневным введением, однако увеличен по сравнению с 1-кратным введением препарата. Площадь под фармакокинетической кривой значительно возрастает по сравнению с величиной AUC после 5-дневного введения, но существенно ниже таковой при 1-кратном введении. При курсовом 15-кратном введении галодифа крысам его выведение из организма замедляется. Содержание цитохрома Р-450 в ткани печени повышено по сравнению с 1-кратным введением галодифа, однако отличается от соответствующих показателей активности МОС после 5-кратного введения [8, 11]. Полученные результаты согласуются с имеющимися данными о стимулирующем максимальном ответе МОС в период от 3 до 8 дней. Этот факт подтверждает фармакокинетический профиль галодифа в ткани печени при 15-кратном введении.
Исходя из величин параметров фармакокинетики галодифа в ткани печени при 5дневном введении можно заключить, что по-прежнему имеет место ускоренная элиминация препарата. Однако величина Т% заметно возрастает по сравнению с таковой в условиях 5-кратного введения галодифа. В то время как MRT существенно не изменяется, увеличивается МЕТ, достигая уровня среднего времени элиминации при 1-кратном назначении препарата. АUС также резко возрастает до величины площади под фармакокинетической кривой, наблюдавшейся при 1-кратном введении, что может свидетельствовать о повышении тканевой доступности препарата. Таким образом, судя по расчетным параметрам фармакокинетики, можно сделать вывод о повышении тканевой доступность галодифа в ткани печени животных в условиях его длительного введения.
ЗАКЛЮЧЕНИЕ
Полученные результаты коррелируют с показателями функционального состояния МОС печени ‒ наблюдается выраженная индукция цитохрома Р450. Параметры элиминации препарата из печени также свидетельствуют о выраженной тканевой доступности молекул галодифа. При 15-кратном введении галодифа элиминация препарата из организма замедляется по сравнению с 5-кратным введением, оставаясь ускоренной относительно 1-кратного назначения.
Фармакокинетические параметры элиминации препарата из печени одновременно с этим свидетельствуют о выраженном ускорении прохождения молекул галодифа через гепатобилиарный тракт.
Наиболее клинически важные взаимодействия используемых в клинической практике антиконвульсантов возникают в результате индукции или ингибирования метаболизма назначаемых лекарств [16]. В отличие от индукции ферментов цитохрома Р450 микросомальной оксидазной системы печени, ингибирование ферментов приводит к снижению метаболического клиренса лекарственного препарата, концентрация которого в сыворотке может увеличиваться, что приводит к дополнительным токсическим эффектам [8, 11]. При алкогольной зависимости это является наиболее важным в связи с постоянным токсическим воздействием на организм человека [17].
Для того чтобы избежать нежелательных взаимодействий, необходимо знать, как лекарственное средство влияет на цитохром Р450-зависимый окислительный метаболизм ксенобиотиков целевого контингента больных (например, при длительном назначении препарата больным эпилепсией, пациентам с пароксизмальными расстройствами, включая больных с зависимостью от ПАВ, для предотвращения развития рецидива и алкогольного делирия).
Список литературы Фермент-индуцирующее действие оригинального антиконвульсанта галодиф - модулирующий временной фактор, перспективы клинического применения при терапии пароксизмальных расстройств
- Akiyama T, Otsubo H. Antiepileptic drugs in North America. Brain Nerve. 2010 May;62(5):519-26. Japanese. PMID: 20450099.
- Мухин К.Ю., Пылаева О.А. Эффективность и переносимость леветирацетама (препарат Кеппра®) в лечении эпилепсии: обзор литературы Русский журнал детской неврологии. 2015. Т. 10, № 2. С. 38-53. https://doi.org/10.17650/2073-8803-2015-10-2-38-53
- Nevitt SJ, Sudell M, Cividini S, Marson AG, Tudur Smith C. Antiepileptic drug monotherapy for epilepsy: a network meta-analysis of individual participant data. Cochrane Database Syst Rev. 2022 Apr 1;4(4):CD011412. doi: 10.1002/14651858. CD011412.pub4. PMID: 35363878; PMCID: PMC8974892.
- Johannessen Landmark C, Patsalos PN. Drug interactions involving the new second- and third-generation antiepileptic drugs. Expert Rev Neurother. 2010 Jan;10(1):119-40. doi: 10.1586/ern.09.136. PMID: 20021326.
- Patsalos PN, Spencer EP, Berry DJ. Therapeutic Drug Monitoring of Antiepileptic Drugs in Epilepsy: A 2018 Update. Ther Drug Monit. 2018 Oct;40(5):526-548. doi: 10.1097/FTD. 0000000000000546. PMID: 29957667.
- Киссин М.Я., Бондаренко И.И. Опыт применения лакосамида в комплексной терапии пациентов с фармакорезистентной парциальной эпилепсией. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013. Т. 113, № 9. C. 23-28.
- Шушпанова Т.В., Семке В.Я., Бохан Н.А., Новожеева Т.П., Бадыргы И.О., Дорошенко А.С., Худолей В.Н. Эффективность оригинального антиконвульсанта галодифа у больных с компульсивным влечением к алкоголю, ассоциированным с изменением уровней стероидных гормонов. Сибирский вестник психиатрии и наркологии. 2012. № 3 (72). С. 65-71.
- ShushpanovaTV, BokhanNA, LebedevaEV, MandelAI, NovozheevaTP, SolonskyAV, SchastnyiED, SemkeAV, KazennykhTV, UdutVV, ArbitGA, FilimonovVD. Treatment of alcoholic patients using anticonvulsant urea derivative influences the metabolism of neuro-active steroid hormones – the system of stress markers. Journal Addiction Research & Therapy. 2016;7(2):271. doi:10.4172/2155-6105.1000271
- ШушпановаТ.В., БоханН.А., СтанкевичК.С., НовожееваТ.П., МандельА.И., СчастныйЕ.Д., КисельН.И., ШушпановаО.В., УдутВ.В., СафроновС.М., БоевР.С., КнязеваЕ.М. ИнновационныймодуляторГАМКрецепторов‒ активатормикросомальнойцитохром-Р450 оксидазнойсистемыпечениубольныхалкоголизмом. Химико-фармацевтический журнал. 2020. Т. 54, № 11. С. 9-16. https://doi.org/10.30906/0023-1134-2020-54-11-9-16(in Russian).
- Rodrigues C, Chiron C, Rey E, Dulac O, Comets E, Pons G, Jullien V. Population pharmacokinetics of oxcarbazepine and its monohydroxy derivative in epileptic children. Br J Clin Pharmacol. 2017 Dec;83(12):2695-2708. doi: 10.1111/bcp.13392. Epub 2017 Sep 20. PMID: 28771787; PMCID: PMC5698580.
- Новожеева Т.П., Смагина М.И., Черевко Н.А., Фатеева С.Н. Бензобарбитал и фторбензобарбитал – индукторы фенобарбиталового типа монооксигеназной системы печени. Бюллетень сибирской медицины. 2011. Т. 10, № 5. С. 78-81.
- Шушпанова Т.В., Семке В.Я., Новожеева Т.П., Бохан Н.А. Терапия оригинальным антиконвульсантом галодиф влияет на свойства бензодиазепиновых рецепторов тромбоцитов и уровни нейроактивных стероидных гормонов у больных алкоголизмом. Сибирский вестник психиатрии и наркологии. 2013. № 2 (77). С. 73-78.
- Ляхович В.В., Цырлов И.Б. Индукция ферментов метаболизма ксенобиотиков. Новосибирск: Изд-во Наука, 1981. 240 с.
- Карузина И.И., Арчаков А.И. Выделение микросомальной фракции печени и характеристика ее окислительных систем. В книге: Современные методы в биохимии / под ред. В.Н. Ореховича. М.: Изд-воМедицина, 1977. С. 49-62.
- Omura T, Sato R. The carbon monoxide-binding pigment of liver microsomes. I. Evidence for its hemoprotein nature. J Biol Chem. 1964 Jul; 239:2370-8. PMID: 14209971.
- Zaccara G, Perucca E. Interactions between antiepileptic drugs, and between antiepileptic drugs and other drugs. Epileptic Disord. 2014 Dec;16(4):409-31. doi: 10.1684/epd.2014.0714. PMID: 25515681.
- Кисель Н.И., Бедарев Р.И., Мандель А.И., Шушпанова Т.В., Мазурова Л.В., Новожеева Т.П., Солонский А.В., Гарганеева Н.П., Бурдовицина Т.Г., Гончикова И.А., Попова Т.А. Алгоритм персонализированной терапии больных алкоголизмом с коморбидными нарушениями детоксицирующей функции печени и когнитивными расстройствами. Сибирский вестник психиатрии и наркологии. 2022. № 4 (117). С. 33-43. https://doi.org/10.26617/1810-3111-2022-4(117)-33-43


