Ферментативная конверсия пищевого белка и оценка антиоксидантной активности пептидов
Автор: С.Д. Жамсаранова, С.Н. Лебедева, Б.А. Болхонов, Д.В. Соколов
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Технология мясных, молочных и рыбных продуктов и холодильных производств (технические науки)
Статья в выпуске: 4 (83), 2021 года.
Бесплатный доступ
Одним из пищевых белков, традиционно используемых для диетической коррекции и профилактики нарушений липидного обмена и связанных с ним сердечно-сосудистых заболеваний, ожирения, артериальной гипертензии, метаболического синдрома, являются белки сои. Использование современных технологий обработки соевого белка позволяет получить гидролизаты, которые проявляют гиполипидемические, гипохолестеринемические и другие свойства. Наиболее перспективным направлением использования гидролизатов пищевых белков является разработка низкоаллергенных продуктов профилактического назначения. Цель настоящего исследования получение ферментативного гидролизата соевого белка и оценка антиоксидантных свойств полученных пептидов. В работе представлена двухстадийная схема ферментативного гидролиза соевого белка с применением пепсина и трипсина, обеспечивающая высокую степень гидролиза (82-83 %). Фракционирование соевого гидролизата позволило разделить его на 3 основные фракции (высоко-, среднеи низкомолекулярную). Определена суммарная антиоксидантная активность полученных пептидных фракций. Наибольшей антиоксидантной активностью обладала среднемолекулярная фракция, суммарное содержание антиоксидантов в которой составило 71,2±4,83 мг/100 см3. Значительный интерес в дальнейших работах будут представлять поиски пептидов, обладающих гипоаллергенными, иммуномодулирующими и другими свойствами. Предполагается, что гидролизат белков сои может быть использован в качестве функционального ингредиента комплексного действия в составе различных специализированных пищевых продуктов.
Соевый белок, ферментативная конверсия, антиоксидантная активность.
Короткий адрес: https://sciup.org/142230509
IDR: 142230509 | УДК: 664.38:57.014, 612.398 | DOI: 10.53980/24131997_2021_4_5
Текст научной статьи Ферментативная конверсия пищевого белка и оценка антиоксидантной активности пептидов
Одним из пищевых белков, традиционно используемых для диетической коррекции и профилактики нарушений липидного обмена и связанных с ним сердечно-сосудистых заболеваний, ожирения, артериальной гипертензии, метаболического синдрома, являются белки сои. Использование современных технологий обработки соевого белка позволяет получить гидролизаты, которые проявляют гиполипидемические, гипохолестеринемические и другие свойства [1, 2].
Обзорная статья М.Л. Доморощенковой и соавт. (2014) посвящена структурной модификации белков сои как перспективного объекта био- и нанотехнологии [3]. Интерес к технологии структурной модификации белковых соединений сои связан с желанием ведущих мировых производителей улучшить функциональные свойства выпускаемых ими пищевых ингредиентов и осуществить выделение и выпуск в промышленных количествах определенных типов соевых полипептидов и пептидов с подтвержденными медико-биологическими свойствами.
Последние десятилетия характеризуются ростом аллергических заболеваний среди населения. В структуре распространенности данных заболеваний в Российской Федерации пищевая непереносимость составляет 80 %. Пищевая непереносимость и пищевая аллергия являются серьезной проблемой не только у нас в стране, но и в странах Европы и Америки [4].
На сегодня зарегистрировано более 150 аллергенов (IUIS), из которых 80 % - это пищевые аллергены. Известны более 170 пищевых продуктов, для которых зарегистрированы проявления пищевой аллергии. Численность людей, страдающих пищевой аллергией, с каждым годом растет. Вместе с тем возрастает и число людей с нарушениями функций пищеварения, для которых характерна непереносимость пищевого белка. По данным Института иммунологии Федерального медико-биологического агентства России, каждый третий житель России подвержен аллергии [5]. Таким образом, пищевая аллергия является серьезной медико-социальной проблемой.
Единственным полноценным методом предотвращения и лечения пищевой аллергии является полный отказ от продуктов, содержащих аллергены, что практически недостижимо. Однако возможно проведение профилактики и назначение специализированных диет, снижающих аллергические симптомы и нормализующих общий аллергический фон [6]. В связи с этим особую актуальность приобретают научные исследования по разработке и созданию гипоаллергенных продуктов массового потребления.
Наиболее перспективным направлением для получения гипоаллергенных продуктов профилактического назначения является биокаталитическая конверсия белков. Одним из широко используемых подходов является ферментативный гидролиз пищевых белков. Ферментативные гидролизаты обладают рядом преимуществ по сравнению со смесями кристаллических аминокислот с точки зрения физиологии пищеварения и всасывания. Нутритивные потребности организма удовлетворяются теми формами пищевых веществ, к которым, по-види-мому, он был адаптирован в ходе эволюции, и, по утверждению ряда авторов, питание продуктами, в которых белковый компонент представлен пептидами, более физиологично по сравнению с потреблением продуктов на основе аминокислотных смесей [7].
Сверхтонкая дисперсность размером в несколько мкм оказывает влияние не только на физико-химические и технологические свойства, но и на скорость и полноту всасывания этих компонентов, их концентрацию в биологических жидкостях. Кроме того, мелкодисперсные биологически активные вещества более стабильны при длительном хранении. Размер частиц, по мнению ряда авторов, достаточный для всасывания в желудочно-кишечном тракте, должен составлять 0,08-0,1 мм [8].
Многолетние исследования ряда авторов показали, что возможное проникновение коротких пептидов в клетку через мембраны клеток и ядра является вполне обоснованным и аргументированным. Транспорт осуществляется благодаря сочетанию стерических и физико-химических свойств. Основным механизмом проникновения коротких пептидов является пино-цитоз. Что касается возможного проникновения коротких пептидов в ядро, то благодаря наличию пор они проницаемы для свободно диффундирующих низкомолекулярных веществ с молекулярной массой до 3,5 кДа [9].
Экспериментальные и клинические исследования выявили эффективность перорального применения коротких пептидов, их устойчивость к действию ферментов желудочно-кишечного тракта и плазмы, способность активировать всасывание различных биологически активных веществ, проникать в цитоплазму, ядро и ядрышки клеток-мишеней [10].
Попадая в кровь, короткоцепочечные пептиды могут проявлять различную биологическую активность, поддерживая гомеостаз организма [11]. Учеными Санкт-Петербургского института биорегуляции и геронтологии СЗО РАМН на протяжении многих лет разрабатывается концепция пептидной биорегуляции, в основе которой лежит представление об участии эндогенных пептидных биорегуляторов в поддержании структурного и функционального гомеостаза клеточных популяций. Нарушение пептидной биорегуляции снижает устойчивость организма к дестабилизирующим факторам внешней и внутренней среды, что является одной из причин ускоренного старения и развития патологии, ассоциированной с возрастом. Разработаны технологии выделения пептидов, на основе которых созданы лекарственные препараты, успешно применяющиеся для профилактики и лечения различных патологических состояний [12].
В работе М.Л. Доморощенковой и соавт. (2014) приведены данные о научных исследованиях в этой области, проводимых в России и за рубежом. Автор отмечает, что проведение масштабных НИР в России сдерживается отсутствием целевого государственного финансирования и потенциально заинтересованных в их результатах предприятий по глубокой переработке сои. Технологии структурной модификации белковых соединений в России до сих пор не вышли за пределы лабораторий. В зарубежных странах, наоборот, данное направление активно развивается. В 2002 - 2004 гг. началось промышленное производство гидролизатов соевых белков на заводах по глубокой переработке сои компаний ADM (США), Solae (США) и Solbar (Израиль). Затем аналогичные производства появились в Китае, Малайзии, Японии, Тайване и Южной Корее. Интерес к технологии структурной модификации белковых соединений сои чрезвычайно высок. В силу этого количество открытых зарубежных публикаций невелико. Результаты исследований публикуются лишь после завершения коммерциализации новых продуктов [3].
Цель данной работы – получить ферментативный гидролизат соевого белка и оценить антиоксидантные свойства полученных пептидов.
Материал и методы исследования
Протеолитическую активность ферментных препаратов определяли по ГОСТ 344302018 [13].
Содержание общего азота определяли колориметрическим методом с реактивом Несслера по ОФС.1.7.2.0027.15 [14].
Содержание аминного азота в негидролизованном сырье и полученных гидролизатах определяли методом формольного титрования (метод Серенса) [15].
Степень гидролиза (СГ) белка рассчитывали по формуле:
СГ = (ΝΑΑ-NΑΑo) × 100%, NΟΑ-NΑΑo где NОА – содержание общего азота, %; NААо – содержание азота в негидролизованном сырье, %; Naa- содержание аминного азота в гидролизате после гидролиза в течение некоторого периода, %.
Для исследования фракционного состава гидролизата использовали метод гель-фильтрации [16]. Фракционирование осуществляли на колонке размером 1х25 см, заполненной молсе-лектом G-55 с высотой геля в колонке, равной 20 см. Количество нанесенный пробы составляло 1 см3. В качестве элюента была использована дистиллированная вода. После нанесения гидролизата на колонку он был элюирован в потоке воды со скоростью 35 см3/ч. Отбор проб осуществляли по 1 см3. Поглощение элюата определяли при длине волны 210 нм. Каждую отобранную фракцию дополнительно исследовали на содержание пептидов по методу Варбурга и Христиана [17], затем рассчитывали процентное содержание каждой фракции по отношению к общему числу компонентов.
Суммарная антиоксидантная активность пептидных фракций оценивалась амперометрическим методом на хроматографе «Цвет-Яуза-01-АА» [18].
Обработку экспериментальных данных проводили с использованием расчета средних значений (M), стандартной ошибки среднего (m) и параметрического критерия оценки (t-критерия Стьюдента). Результаты считали достоверными при достижении уровня значимости различий ( р ≤0,05).
Результаты исследования и их обсуждение
Ферментативный гидролиз белков проводят с использованием как отдельных ферментов животного, микробиологического и грибкового происхождения (пепсин, трипсин, ренин, папаин, панктеатин, алкалаза и др.), так и ферментных препаратов (в частности «Новозаймс», «Флавозим» и др.) [7]. Выбор ферментного препарата зависит в основном от назначения получаемых гидролизатов и желаемой степени гидролиза [19]. Еще одним немаловажным фактором при выборе ферментных препаратов является их доступность на российском рынке.
Для работы были выбраны ферменты пепсин и трипсин. Их использование в процессе гидролиза повторяет (моделирует) естественный процесс пищеварения. По субстратной специфичности они являются протеазами - эндопептидазами, которые катализируют расщепление внутренних пептидных связей (пепсин – в желудочном соке, трипсин – в панкреатическом соке).
Перед проведением гидролиза соевого протеина была определена протеолитическая активность используемых ферментных препаратов. Протеолитическая активность пепсина составила 198,3±13,5 ед./г, трипсина – 1150, 0±79,8 ед./г.
Гидролиз проводили при оптимальном для каждого фермента значении рН (для пепсина - 1,5 - 2,0, для трипсина - 7,8 - 8,7), температуре, равной +39 ° С, но с разным фермент-субстрат-ным соотношением (1:30, 1:20 и 1:10) в течение 5-6 ч.
Полученные данные по степени гидролиза соевого протеина пепсином и трипсином представлены соответственно в таблицах 1 и 2.
Таблица 1
Динамика степени гидролиза соевого протеина пепсином ( M±m )
|
Продолжительность гидролиза, ч |
Степень гидролиза, %, при разных соотношениях «фермент - субстрат» |
||
|
1 вариант (1:30) |
2 вариант (1:20) |
3 вариант (1:10) |
|
|
1 |
7,6±0,28 |
16,5±0,38*1,3 |
20,4±0,30*1,2 |
|
3 |
20,4±0,30 |
22,4±0,33*3 |
28,0±0,56*1,2 |
|
5 |
33,1±0,56 |
42,0±0,47*1 |
45,8±0,61*1 |
|
6 |
36,2±0,44 |
44,2±0,65*1 |
46,1±0,70*1 |
Примечание. *1,2,3 – достоверно значимые отличия относительно 1, 2 или 3 варианта (р≤0,05).
Таблица 2
Динамика степени гидролиза соевого протеина трипсином ( M±m )
|
Продолжительность гидролиза, ч |
Степень гидролиза, %, при разных соотношениях «фермент - субстрат» |
||
|
1 вариант (1:30) |
2 вариант (1:20) |
3 вариант (1:10) |
|
|
1 |
16,5±0,27 |
49,6±0,53 *1, 3 |
54,7±0,57 *1, 2 |
|
3 |
62,3±0,63 |
66,2±0,66 * 3 |
58,5±0,60 * 2 |
|
5 |
71,2±0,70 |
71,2±0,98 * 3 |
58,8±0,84 *1, 2 |
Примечание. * 1,2,3 - достоверно значимые отличия относительно 1, 2 или 3 варианта (р<0,05).
Как следует из данных таблицы 1, в первом варианте при действии пепсина за первые 3 ч степень гидролиза увеличилась в 2,7 раза, затем через 2 ч отмечено увеличение в 1,6 раза, а в период с 5 до 6 ч отмечено незначительное увеличение степени гидролиза (в 1,1 раза), в связи с чем процесс более 5 ч посчитали нецелесообразным.
Во втором варианте за первые 3 ч степень гидролиза увеличилась в 1,4 раза, затем наблюдалось резкое увеличение значений почти в 2 раза, далее происходило незначительное увеличение степени гидролиза в 1,1 раза, что указывало на низкую эффективность процесса при продолжительности более 5 ч.
В третьем варианте за первые 3 ч отмечено увеличение гидролиза в 1,4 раза, на 5 ч процесса - увеличение степени гидролиза в 1,6 раза, в период с 5 до 6 ч происходило незначительное увеличение степени гидролиза.
Таким образом, выбранная продолжительность процесса составила 5 ч, а фермент-суб-стратное соотношение - 1:20, поскольку соотношение реагирующих компонентов 1:10 не приводило к достоверно значимому увеличению степени гидролиза.
Как следует из данных таблицы 2, в первом варианте наблюдалось резкое увеличение степени гидролиза в 3,8 раза при продолжительности процесса 1 и 3 ч, далее происходило незначительное его повышение (в 1,1 раза) при увеличении процесса до 5 ч.
Во втором варианте через 1 ч степень гидролиза по сравнению с первым вариантом была выше в 3 раза. За 3 ч наблюдалось повышение степени гидролиза в 1,3 раза, в период с 3 до 5 ч отмечено ее незначительное повышение - в 1,1 раза. Дальнейшее проведение гидролиза сочли нецелесообразным.
В третьем варианте через 1 ч степень гидролиза по сравнению со вторым вариантом была выше в 1,1 раза. За 5 ч наблюдалось незначительное повышение степени - в 1,1 раза, поэтому проведение гидролиза более 3 ч, по-видимому, нецелесообразно. Было выбрано фермент-суб-стратное соотношение 1:20, поскольку его увеличение до 1:10 не приводило к достоверно значимому увеличению степени гидролиза, и время 3 ч.
С целью достижения более высокой степени гидролиза и определения эффективной продолжительности процесса было проведено последовательное внесение выбранных ферментов, моделирующих естественный процесс пищеварения: сначала пепсин, затем трипсин при фер-мент-субстратном соотношении, равном 1:20. Вариант одновременного внесения ферментов не рассматривался, поскольку условия их действия (значения рН) разные.
В исследовании были апробированы 2 схемы (2 варианта) двухстадийного процесса с целью достижения высоких значений степени гидролиза.
-
1. Сначала проводили гидролиз пепсином в течение 3 ч (рН 1,5, температура 39 ° С), а затем вносили трипсин и еще 4 ч проводили гидролиз, изменяя рН до 8,5 путем добавления 10%-ного раствора карбоната натрия.
-
2. Сначала проводили гидролиз пепсином в течение 5 ч (рН 1,5, температура 39 ° С), а затем вносили трипсин и еще 2 ч проводили гидролиз, изменяя рН до 8,5 путем добавления 10%-ного раствора карбоната натрия.
После завершения процесса гидролиза для инактивации ферментов проводили тепловую обработку гидролизата при температуре 85 - 90 ° С в течение 10 мин.
Полученные данные по изменению степени гидролиза соевого протеина в ходе двухстадийного процесса представлены на рисунке 1.
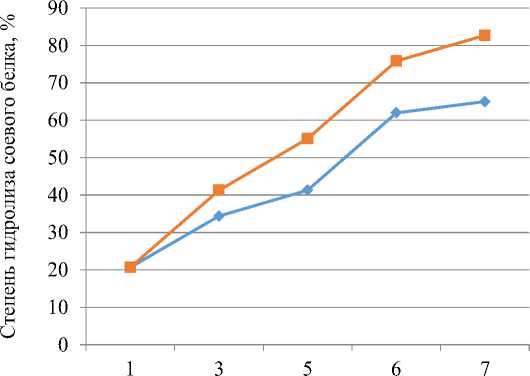
Продолжительность гидролиза, ч
1-я схема двухстадийного гидролиза
2-я схема двухстадийного гидролиза
Рисунок 1 – Динамика степени гидролиза соевого протеина при последовательном внесении ферментов (пепсин и трипсин)
Как следует из данных, представленных на рисунке 1, наибольшая степень гидролиза была достигнута при использовании 2-й схемы. Последовательное внесение ферментов приводило к увеличению степени гидролиза соевого белка, которая через 7 ч составила 82 - 83 % (82,7±0,8). Для 1-й схемы максимальная степень гидролиза составила 65,0±0,3(р≤0,05).
Полученный ферментативный соевый гидролизат представлял собой жидкость бледножелтого цвета. Осадка (нерастворимых продуктов гидролиза) не наблюдалось.
Таким образом, экспериментально установлено, что условиями ферментативного гидролиза, обеспечивающими максимальное значение степени его интенсивности, является гидролиз соевого протеина сначала пепсином при рН 1,5 и температуре 39 ° С в течение 5 ч, а затем - трипсином при рН 8,5 и температуре 39 ° С в течение 2 ч при постоянном перемешивании. Степень гидролиза при этом составила 82 - 83 %.
С.Н. Зориным (2017) были изучены активность различных ферментных препаратов (панкреатин, флавоэнзим, нейтральная и щелочная протеазы) и их эффективность при одностадийном гидролизе изолятов соевого белка в лабораторных условиях [20]. При соотношении «субстрат - фермент» 20:1 одноэтапный пятичасовой протеолиз соевого белка ферментным препаратом панкреатин с последующей нанофильтрационной обработкой позволил получить гидролизат с высоким содержанием средних пептидов. Суммарный выход общего азота относительно исходного белка составил 83,1 %.
В работе Т.А. Мурановой и соавт. (2019) при ферментолизе соевого белка был использован комплексный ферментный препарат - протосубтилин при соотношениях «субстрат - фермент» 20:1 и 100:1 в интервале 1–20 ч при комнатной температуре. Авторами установлено, что при соотношении 20:1 и времени гидролиза 20 ч общий выход растворимого пептидного материала составлял 12,8 %, в том числе 2,4 % свободных аминокислот. Разброс масс пептидов находился в основном в пределах 1,5–12 кДа [21].
Принимая во внимание тот факт, что выбранные ферментные препараты (пепсин и трипсин) являются эндопептидазами, действующими на эндогенные пептидные связи, расщепляя белковые молекулы на более мелкие фрагменты, для характеристики фракционного состава использовали метод гель-хроматографии. Полученные данные фракционирования представлены на рисунке 2.
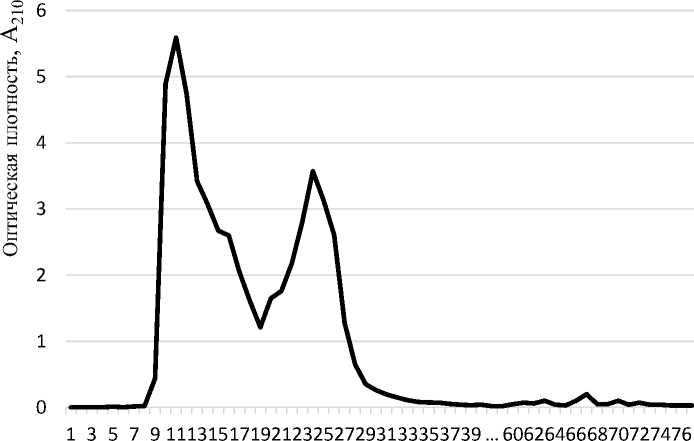
Номер пробы
Рисунок 2 – Фракционирование гидролизата соевого белка
Как следует из данных рисунка 2, в результате гель-хроматографии исследуемый гидролизат разделился на три основные фракции (условно – высоко-, средне- и низкомолекулярную): I пик (10–17 пробирок) – объем элюата составил 8 см3; II пик (21–27 пробирок) – 7 см3; III пик (61–73 пробирки) – объем элюата составил 13 см3. При этом на долю I, II и III фракций приходилось соответственно 11,4, 10,0 и 18,6 % от всего объема элюата (в сумме – 40,0 %).
Концентрация пептидов в гидролизате составила 11,3 мг/см3. Количество нанесенного гидролизата на колонку составляло 1 см3. Концентрация пептидов во фракциях составила соответственно: в I фракции – 0,9 мг/ см3, во II – 0,3 мг/ см3 и в III – 0,15 мг/ см3. Таким образом, на долю пептидов I фракции приходилось 7,2 мг (63,7 % пептидов), II фракции – 2,1 мг (18,6 % пептидов) и III фракции – 1,95 мг (17,3 % пептидов).
Для оценки антиоксидантной активности полученных пептидных фракций была определена суммарная антиоксидантная активность (далее - САА) амперометрическим методом на хроматографе «Цвет-Яуза-01-АА». Результаты определения САА фракций соевого гидролизата представлены в таблице 3.
Таблица 3
Суммарная антиоксидантная активность пептидных фракций соевого гидролизата ( M±m )
|
№ пробы |
Номер фракции |
Концентрация белка во фракции, мг/ см3 |
Суммарная антиоксидантная активность, мг/100 см3 |
|
1 |
I |
0,3 |
30,5±1,83 |
|
2 |
I |
0,1 |
5,8±0,04*1 |
|
3 |
I |
0,05 |
не определяется (низкое значение) |
|
4 |
II |
0,1 |
71,2±4,83*1,2 |
|
5 |
II |
0,05 |
37,1±0,66*4,6 |
|
6 |
III |
0,05 |
5,7±0,87 |
Примечание. *1,2,4,6 – достоверные отличия относительно соответственно 1, 2, 4 и 6 групп.
Как следует из данных таблицы 3, при равных концентрациях белка наибольшей антиоксидантной активностью обладала II фракция (4 и 5 пробы).
В обзоре T.J. Ashaolu (2020) на основе анализа порядка 200 статей изучены механизмы возникновения и использования растительных антиоксидантных пептидов для питания человека. Кроме того, подчеркиваются потребность в пищевых антиоксидантах и понимание важности проблем, связанных с использованием антиоксидантных пептидов. Предполагается, что дальнейшие исследования качества и безопасности подтвердят возможность коммерциализации антиоксидантных пептидов при создании и расширении ассортимента функциональных пищевых продуктов [22].
Заключение
Таким образом, методом ферментативной конверсии белка сои был получен гидролизат с высокой степенью гидролиза.
Схемой ферментативного гидролиза соевого белка, обеспечивающей наивысшую степень гидролиза, послужила схема двухстадийного процесса: сначала использование фермента пепсина (рН 1,5 и температура 39 ° С) в течение 5 ч, а затем - трипсина (рН 8,5 и температура 39 ° С) в течение 2 ч. Степень гидролиза при этом составила 82 - 83 %. Протеолитическая активность используемых ферментов (пепсина и трипсина) составила соответственно 198,3 и 1150,0 ед./г.
Фракционирование соевого гидролизата позволило разделить его на 3 основные фракции (предположительно – высоко-, средне- и низкомолекулярную).
Определена суммарная антиоксидантная активность полученных пептидных фракций. Наибольшей антиоксидантной активностью обладала II фракция, которая составила 71,2±4,83 мг/100 см3.
Известно, что полноценное питание составляет основу жизнедеятельности организма человека и является важнейшим фактором, способствующим снижению рисков развития алиментарно-зависимых заболеваний. Полноценное питание обеспечивает активное долголетие и формирование адаптационного потенциала организма. Однако пищевая промышленность не может в полной мере удовлетворить потребность в гипоаллергенных и специализированных пищевых продуктах, не вызывающих пищевую непереносимость для данной категории людей, которая составляет от 13 до 35 % россиян. Предполагается, что гидролизат белков сои может быть перспективен в качестве функционального ингредиента в составе различных специализированных пищевых продуктов. В дальнейшей работе значительный интерес будут привлекать гипоаллергенный и иммуномодулирующий потенциалы полученных гидролизатов.
Список литературы Ферментативная конверсия пищевого белка и оценка антиоксидантной активности пептидов
- Зорин С.Н., Мазо В.К., Воробьева И.С. и др. Технология получения пептидного модуля на основе гидролизата белка сои // Пищевая промышленность. – 2017. – № 10. – С. 20–23.
- Сидорова Ю.С., Мазо В.К., Кочеткова А.А. Экспериментальная оценка гиполипидемических свойств белков сои, риса и их ферментативных гидролизатов. Краткий обзор литературы // опросы питания. – 2018. – Т. 87, № 2. – С. 77–84. DOI: 10.24411/0042 –8833 –2018 –10021.
- Доморощенкова М.Л., Хайес Д., Шушкевич А.Ю. Структурная модификация белков сои как перспективная био- и нанотехнология // Вестник ВНИИЖ. – 2014. – № 2. – С. 30–35.
- Лисицын А.Б., Чернуха И.М., Лунина О.И. Пищевая гиперчувствительность и продукты из сырья животного происхождения // Теория и практика переработки мяса. – 2017. – № 2. – С. 23–36. DOI: 0.21323/2414 –438X –2017 –2 –2 –23 –36.
- Харитонов В.Д., Будрик В.Г., Агаркова Е.Ю. и др. К вопросу о перспективных направлениях борьбы с аллергией // Техника и технология пищевых производств. – 2012. – № 4. – С. 1–4.
- Громов Д.А., Борисова А.В., Бахарев В.В. Пищевые аллергены и способы получения гипоаллергенных пищевых продуктов // Техника и технология пищевых производств. – 2021. – Т. 51, № 2. – С. 232–247.
- Зорин С.Н. Ферментативные гидролизаты пищевых белков для специализированных пищевых продуктов диетического (лечебного и профилактического) питания // Вопросы питания. – 2019. – Т. 88, № 3. – С. 23–31. DOI:10.24411/0042 –8833 –2019 –10026.
- Мезенова Н.Ю., Верхотуров В.В., Волков В.В. и др. Определение технологических показателей порошков биологически активных пептидов из рыбьей чешуи в составе биопродукта для спортивного питания // Известия вузов. Прикладная химия и биотехнология. – 2016. – Т. 6, № 2. – С. 104–114. DOI:10.21285/2227 –2925 –2016 –6 –2 –104 –114.
- Хавинсон В.Х., Соловьев А.Ю., Тарновская С.И. и др. Механизм биологической активности коротких пептидов: проникновение в клетку и эпигенетическая регуляция экспрессии генов // Успехи современной биологии. – 2013. – Т. 133, № 3. – С. 310–316.
- Тутельян В.А., Хавинсон В.Х., Рыжак Г.А. и др. Короткие пептиды как компоненты питания: молекулярные основы регуляции гомеостаза // Успехи современной биологии. – 2014. – Т. 134, № 3. – С. 227–235.
- Гришин Д.В., Подобед О.В., Гладилина Ю.А. и др. Биоактивные белки и пептиды: современное состояние и новые тенденции практического применения в пищевой промышленности и кормопроизводстве // Вопросы питания. – 2017. – Т. 86, № 3. – С. 19–31.
- Хавинсон В.Х., Рыжак Г.А. Пептидная регуляция основных функций организма // Вестник Росздравнадзора. – 2010. – № 6. – С. 58–62.
- ГОСТ 34430-2018 Ферментные препараты для пищевой промышленности. Метод определения протеолитической активности. М.: Стандартинформ, 2018. – 15 с.
- ОФС.1.7.2.0027.15 Определение общего азота с реактивом Несслера в иммунобиологических лекарственных препаратах / Государственная фармакопея Российской Федерации. – 2015. – XIV изд. – Т. II.
- ОФС.1.2.3.0022.15 Определение аминного азота методами формольного и йодометрического титрования / Государственная фармакопея Российской Федерации. – 2015. – XIV изд. – Т. I.
- Конюхов В.Ю. Хроматография. – М.: Лань, 2012. – 224 с.
- Тумаков С.А., Темирбулатов Р.А., Савченко Р.П. Методы количественного определения белков: теоретические основы, дифференцированный подход и практическое использование: учеб. пособие. – Самара; Пенза, 2006. – 85 с.
- Яшин А.Я., Яшин Я.И., Черноусова Н.И. и др. Новый прибор для определения антиоксидантов в лекарственных препаратах, биологически активных добавках, пищевых продуктах и напитках ЦветЯуза-01АА. – М.: НПО «Химавтоматика», 2005. – 100 с.
- Бычкова Е.С., Рождественская Л.Н., Погорова В.Д. Технологические особенности и перспективы использования растительных белков в индустрии питания. Ч. 2. Способ снижения антипитательных свойств растительного сырья // Хранение и переработка сельхозсырья. – 2018. – № 3. – С. 46–52.
- Зорин С.Н., Воробьева И.С., Воробьева В.М. и др. Получение ферментативного гидролизата изолята соевого белка // Пищевая промышленность. – 2017. – № 8. – С. 13–15.
- Муранова Т.А., Зинченко Д.В., Мирошников А.И. Гидролизаты соевых белков для стартовых кормов аквакультуры: поведение белков при ферментолизе, композиционный анализ гидролизатов // Биоорганическая химия. – 2019. – Т. 45, № 4. – С. 380–390. DOI: 10.1134/S0132342319030035.
- Ashaolu T.J. Antioxidative peptides derived from plants for human nutrition: their production, mechanisms and applications // Eur. Food Res. Technol. – 2020. – Vol. 246. – P. 853–865. DOI:10.1007/s00217 –020 –03479 –y.


