Ферментативный гидролиз морских бурых водорослей Ascophyllum nodosum и Undaria pinnatifida: подбор условий для эффективного извлечения полифенолов
Автор: Табакаева О.В., Капуста С.В., Табакаев А.В., Тихонов С.Л.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 1 (96), 2025 года.
Бесплатный доступ
В статье рассматривается процесс ферментативного гидролиза морских бурых водорослей Ascophyllum nodosum и Undaria pinnatifida с целью оптимизации условий для эффективного извлечения полифенолов. Морские бурые водоросли представляют собой богатый источник биоактивных соединений, включая полифенолы, которые обладают антиоксидантными, противовоспалительными и антимикробными свойствами. Исследование акцентирует внимание на сложности клеточной стенки водорослей, которая ограничивает биодоступность их питательных компонентов. Ферментативный гидролиз рассматривается как предпочтительный метод разрушения клеточных стенок, позволяющий сохранить структуру биомолекул и снизить экологическую нагрузку по сравнению с химическими методами. В ходе работы использованы специфические ферменты, способные разрывать белково-полисахаридные комплексы на более усвояемые формы, что повышает биодоступность и сохраняет функциональные свойства полифенолов. Результаты исследования показали, что подбор оптимальных условий ферментативного гидролиза позволяет значительно увеличить извлечение полифенолов из водорослей. Полученные данные открывают перспективы для использования ферментолизатов бурых водорослей в пищевой и других отраслях промышленности, предлагая экологически устойчивый подход к использованию морских ресурсов.
Водоросли, ферментативный гидролиз, фермент, полифенолы, извлечение, морские ресурсы
Короткий адрес: https://sciup.org/142244154
IDR: 142244154 | УДК: 66.094.3 | DOI: 10.53980/24131997_2025_1_43
Текст научной статьи Ферментативный гидролиз морских бурых водорослей Ascophyllum nodosum и Undaria pinnatifida: подбор условий для эффективного извлечения полифенолов
Морские бурые водоросли представляют собой ценный ресурс для пищевой промышленности благодаря содержанию большого разнообразия биоактивных веществ. Пищевые системы, обогащенные биологически активными веществами природного происхождения, становятся популярными у потребителей как средства для поддержания здоровья, а также для лечения и профилактики различных заболеваний, заменяя некоторые традиционные синтетические препараты. Биологически активные соединения природного происхождения проявляют широкий спектр активности: могут оказывать противовоспалительное [1], антимикробное [2], иммуномодулирующее [3], противоопухолевое [4] и антиоксидантное [5] действие.
Антиоксиданты – соединения, способные отдавать электроны, чтобы стабилизировать свободные радикалы, содержащие неспаренные электроны, и нейтрализовать их воздействие на организм [6]. Антиоксиданты могут иметь эндогенное происхождение, т. е. синтезироваться системами организма (глутатионпероксидаза и супероксиддисмутаза), и экзогенное происхождение – поступать в организм из внешних источников [7]. Экзогенные антиоксиданты предотвращают чрезмерную выработку свободных радикалов, тем самым предотвращая повреждение клеток. Если повреждение клетки уже произошло, то экзогенные антиоксиданты способны контролировать уровень свободных радикалов, тем самым предотвращая дальнейшее повреждение и возникновение заболеваний, вызванных окислительным стрессом [8]. Антиоксиданты природного происхождения, такие как полифенолы, содержащиеся в морских водорослях, оказывают эффективное воздействие на свободные радикалы.
Фенольные соединения морских бурых водорослей демонстрируют широкий спектр биологической активности, включая антиоксидантные [9], противомикробные и противовоспалительные свойства [10], что привлекает внимание научного сообщества и производителей пищевой продукции. Однако вопрос усвояемости водорослей имеет первостепенное значение, особенно в отношении сложности клеточной стенки. Прочные структуры клеточных стенок морских водорослей могут препятствовать действию пищеварительных ферментов, затрудняя доступ к внутриклеточным соединениям [11]. Это создает ограничения для биодоступности питательных компонентов водорослей. Для более эффективного извлечения биологически активных веществ были разработаны различные стратегии разрушения клеточной стенки, которые можно разделить на химические, физические и биологические методы. Разрушение клеток предпочтительно проводить в щадящих условиях, чтобы снизить потребление энергии и сохранить структуры биомолекул [12]. Ферментативный гидролиз в пищевой промышленности приобретает все большую популярность благодаря своим многочисленным преимуществам, к которым можно отнести: отсутствие токсичных отходов, селективность и проведение гидролиза в щадящих условиях, что помогает сохранить биологически активные вещества [13]. Этот процесс позволяет извлекать из водорослей ценные компоненты, которые могут быть использованы для создания функциональных продуктов питания, обогащенных биоактивными соединениями. Ферментативный гидролиз водорослей позволяет эффективно использовать морские ресурсы и снижать экологическую нагрузку по сравнению с химическими методами обработки. В процессе ферментативного гидролиза используются специфические ферменты, которые разрушают клеточные стенки водорослей и расщепляют белково-полисахаридные комплексы на более мелкие, легко усваиваемые формы [14]. Это позволяет не только улучшить усвояемость и биодоступность питательных веществ, но и сохранить их функциональные свойства. Процесс ферментативного гидролиза бурых водорослей хорошо изучен как с точки зрения теоретических основ, так и в аспекте практического применения для отдельных видов водорослей и ферментов. Исследования активно проводятся учеными многих стран, значительный вклад в эту область внесли российские исследователи, такие как Т.Н. Звягинцева, А.А. Хитров, Е.Д. Облучинская, А.В. Подкорытова, И.А. Кадникова, Н.М. Аминина и др. Тем не менее остаются нерешенными задачи, связанные с повышением эффективности выхода целевых компонентов, снижением стоимости ферментов и адаптацией технологий для промышленного применения.
Целью настоящего исследования является получение ферментативных гидролизатов из морских бурых водорослей и определение содержания полифенолов в полученных фермен-толизатах. Это позволит оценить потенциал использования ферментолизатов, полученных из бурых водорослей, в пищевой и других областях промышленности.
Материалы и методы
Для изучения содержания полифенолов в ферментолизатах бурых водорослей использовался метод ферментативного гидролиза с варьированием ключевых параметров процесса.
В качестве объектов исследования были выбраны два вида морских бурых водорослей: Ascophyllum nodosum и Undaria pinnatifida .
Ascophyllum nodosum представляет собой крупную бурую водоросль в виде ветвящегося куста с длинными талломами, которые могут достигать 1–1,5 м в длину [15]. Водоросль растет на каменистом и песчаном грунте в защищенных от прибоя местах, часто образует плотные заросли, предоставляющие среду обитания для морских организмов. Сушеный резаный Ascophyllum nodosum приобретен в интернет-магазине «Архангельский водорослевый комбинат» [16].
Undaria pinnatifida – вид бурых водорослей темно-зеленого или оливкового цвета, слоевище состоит из пластины длиной 40–80 см, стволика длиной 8–12 см и ризоидов. Растет на скалистом и каменистом грунтах на глубине 0,5–6,0 м [17]. Сушеные водоросли Undaria pinnatifida торговой марки EAT VEGAN приобретены в интернет-магазине [18].
Сухие водоросли предварительно измельчали до порошкообразного состояния на электрическом измельчителе и заливали водой в разном соотношении (порошок водорослей: вода): 1 : 3 ( A. nodosum ) и 1 : 4 ( U. pinnatifida ) для набухания водорослевого порошка. Соотношение водорослевого порошка и воды выбрано исходя из рекомендаций производителей. Каждый подготовленный образец морских водорослей (5,0 г) взвешивали на электронных весах марки Vibra (Shinko Denshi), вносили в термостойкую колбу. Ферментные препараты класса гидролаз (бета-глюканаза и целлюлаза, производитель ООО «Торговый дом “Биопрепарат”») предварительно развели водой, получив растворы с активностью 1000 ед/мл, измерили pH полученного раствора, который составил 4,50 для бета-глюканазы и 4,00 для целлюлазы. Характеристики ферментных препаратов представлены в таблице 1 [19].
Таблица 1 Характеристики ферментных препаратов
|
Фермент |
Активность, ед/мл |
Оптимальные условия |
Рабочий диапазон |
||
|
pH |
°C |
pH |
°C |
||
|
Бета-глюканаза ( Beta-glucanase ) |
10 000 |
4,0–5,0 |
65–70 |
3,5–7,5 |
40–80 |
|
Целлюлаза ( Cellulase ) |
4 000 |
3,5–4,5 |
50–65 |
2,0–6,5 |
30–75 |
Растворы ферментных препаратов добавляли в термостойкие колбы в разном соотношении (порошок бурой водоросли: раствор ферментного препарата) 1 : 5, 1 : 7, 1 : 10. Колбы закрывали притертыми крышками и ставили в термостат Binder на 12, 18, 24, 36 и 48 ч при температуре 65 °C. Затем помещали колбы в водяную баню ULAB UT-4300 на 30 мин при температуре 84±1 °C для инактивации ферментов. Колбы охлаждали до комнатной температуры и фильтровали через обеззоленный фильтр. Полученный фильтрат использовали для дальнейших исследований.
Схема получения ферментативных гидролизатов из морских бурых водорослей представлена на рисунке 1.
Измельчение сухих водорослей I
Набухание порошка из водорослей в воде:
ГМ для Ascophyllum nodosum – 1 : 3; ГМ для Undaria pinnatifida – 1 : 4 I
Обработка ферментами класса гидролаз (бета-глюканаза, целлюлаза) при температуре 65 ° C, продолжительность
-
12, 18, 24, 36, 48 ч; pH 4,40 для бета-глюканазы и 5,10 для целлюлазы
Ингибирование ферментов при температуре 84±1 ° C, 30 мин
Фильтрование ферментолизата
Рисунок 1 – Схема получения ферментативных гидролизатов из морских бурых водорослей
Влияние режимов ферментативного гидролиза на выход полифенолов определяли по общему содержанию полифенолов в гидролизате. Общее содержание полифенолов определяли с помощью реакции с реактивом Folin-Ciocalteu по методу, описанному в работе [20], с небольшими изменениями, используя галловую кислоту в качестве стандарта. Полученные образцы ферментолизатов бурых водорослей разводили в 100 раз. Аликвоту разбавленного образца 1 мл смешивали с 5 мл 10%-ного раствора реактива Folin-Ciocalteu. Приливали 4 мл 7,5%-ного раствора Na 2 CO 3 и оставляли в темноте на 60 мин при комнатной температуре. После этого измеряли оптическую плотность с помощью спектрофотометра UNICO 2800 при длине волны 765 нм. Общее содержание полифенолов рассчитывали, используя стандартную калибровочную кривую, измерения проводили трижды. Количество полифенолов исследуемых бурых водорослей, перешедших в гидролизат, выражали их массовой долей в анализируемой пробе Х , % на сухое вещество, которую рассчитывали по формуле:
X =
c - 100 - 1 - 100 - 100
m - асв
где c – массовая концентрация полифенолов в разбавленном гидролизате, мг/см3; 100 – кратность разведения исходного гидролизата бурых водорослей; 1 – общий объем исходного гидролизата бурых водорослей, см3; m – масса пробы, мг; ω св – массовая доля сухого вещества в пробе, %.
Массовую долю воды в пробе W , %, определяли стандартным методом [21]. Вычисления проводили по формуле:
W = ( m-m 2 ) - 100 , m 1 - m
где m 1 - масса стаканчика с навеской до высушивания с учетом стеклянной палочки, г; т2 -масса стаканчика с навеской после высушивания с учетом стеклянной палочки, г; т - масса стаканчика с учетом стеклянной палочки, г; 100 – коэффициент пересчета в проценты.
Массовую долю сухого вещества в пробе ω св , % определяли по формуле:
ю св = 100 - W , (3)
где W - массовая доля воды в пробе, %.
Исследования проведены на базе ФГАОУ ВО «Дальневосточный федеральный университет».
Результаты и их обсуждение
Для расчета общего количества полифенолов, перешедших в гидролизат, необходимо было определить массовую долю сухого вещества в пробе. Данные о содержании сухого вещества в полученных ферментолизатах из водоросли Undaria pinnatifida и Ascophyllum nodosum при разных условиях ферментативного гидролиза представлены в таблице 2.
Таблица 2
Содержание сухого вещества в полученных ферментолизатах из водоросли
Undaria pinnatifida и Ascophyllum nodosum при разных условиях ферментативного гидролиза, %
|
Соотношение порошок водоросли ( U. pinnatifida) : ферментный препарат |
Концентрация активного вещества в растворе, % |
Продолжительность гидролиза, ч |
||||
|
12 |
18 |
24 |
36 |
48 |
||
|
Бета-глюканаза ( Beta-glucanase ) |
||||||
|
1 : 5 |
11,08 |
88,6±0,7 |
88,8±0,7 |
89,1±0,7 |
88,9±0,7 |
88,5±0,7 |
|
1 : 7 |
11,61 |
88,8±0,7 |
88,9±0,7 |
89,4±0,7 |
89,0±0,7 |
88,6±0,7 |
|
1 : 10 |
12,05 |
89,0±0,7 |
89,3±0,7 |
89,7±0,7 |
89,3±0,7 |
88,8±0,7 |
|
Целлюлаза ( Cellulase ) |
||||||
|
1 : 5 |
24,00 |
89,0±0,7 |
89,7±0,7 |
89,4±0,7 |
89,5±0,7 |
89,1±0,7 |
|
1 : 7 |
25,15 |
89,1±0,7 |
89,9±0,7 |
89,7±0,7 |
89,5±0,7 |
89,5±0,7 |
|
1 : 10 |
26,09 |
89,0±0,7 |
90,0±0,7 |
89,8±0,7 |
89,9±0,7 |
89,5±0,7 |
|
Соотношение порошок водоросли ( A. nodosum) : ферментный препарат |
Концентрация активного вещества в растворе, % |
Продолжительность гидролиза, ч |
||||
|
12 |
18 |
24 |
36 |
48 |
||
|
Бета-глюканаза ( Beta-glucanase ) |
||||||
|
1 : 5 |
11,08 |
88,1±0,7 |
88,4±0,7 |
88,6±0,7 |
88,5±0,7 |
88,3±0,7 |
|
1 : 7 |
11,61 |
88,4±0,7 |
88,4±0,7 |
88,8±0,7 |
88,8±0,7 |
88,4±0,7 |
|
1 : 10 |
12,05 |
89,0±0,7 |
89,1±0,7 |
89,5±0,7 |
89,2±0,7 |
88,8±0,7 |
|
Целлюлаза ( Cellulase ) |
||||||
|
1 : 5 |
24,00 |
88,3±0,7 |
88,6±0,7 |
88,9±0,7 |
88,4±0,7 |
88,1±0,7 |
|
1 : 7 |
25,15 |
88,4±0,7 |
88,9±0,7 |
88,8±0,7 |
88,4±0,7 |
88,3±0,7 |
|
1 : 10 |
26,09 |
89,1±0,7 |
89,3±0,7 |
89,0±0,7 |
88,6±0,7 |
88,4±0,7 |
По мере продолжения процесса концентрация сухого вещества может стабилизироваться или даже уменьшаться из-за растворения продуктов гидролиза в воде или их дальнейшего превращения.
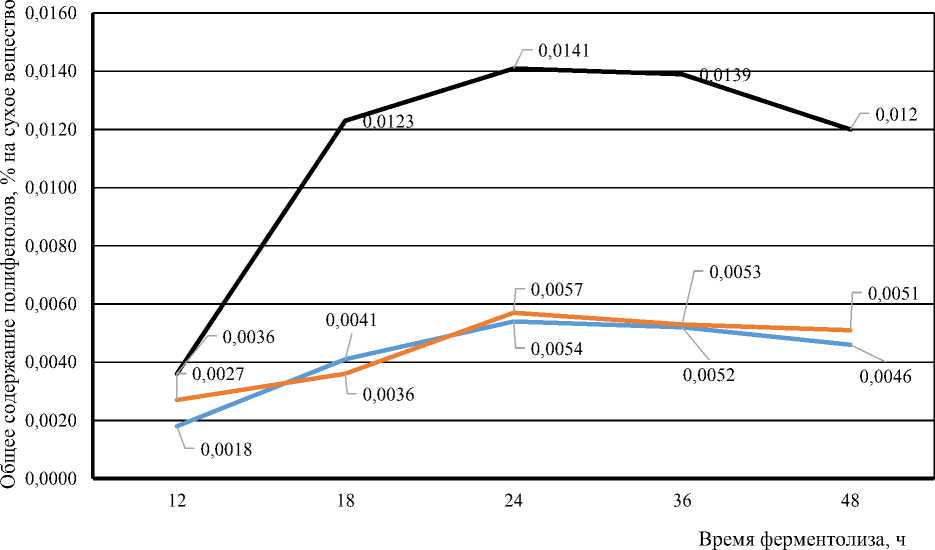
В ходе исследования было изучено содержание общего количества полифенолов в фер-ментолизатах, полученных из бурых водорослей при различных условиях ферментативного гидролиза. Полученные данные позволили оценить влияние условий гидролиза на выход це- левых биологически активных соединений. Данные о содержании общего количества полифенолов в полученных ферментолизатах с помощью ферментного препарата «бета-глюканаза» (Beta-glucanase) из водоросли Undaria pinnatifida при разных условиях ферментативного гидролиза представлены на рисунке 2. Для каждой концентрации активного вещества представлены данные для пяти временных точек: 12, 18, 36, 24 и 48 ч.
С активного вещества, %
^^^м11,08 ^^^м11,61 ^^^^^^^ 12,05
Рисунок 2 – Содержание общего количества полифенолов в полученных ферментолизатах с помощью ферментного препарата «бета-глюканаза» из водоросли Undaria pinnatifida при разных условиях ферментативного гидролиза
Данные, представленные на рисунке 2, показывают, что в ферментолизатах, полученных из морской бурой водоросли Undaria pinnatifida с использованием ферментного препарата «бета-глюканаза», содержание полифенолов увеличивалось при переходе от 12 до 24 ч, затем постепенно снижалось с увеличением времени гидролиза. Наибольшее содержание полифенолов (0,0141 %) достигалось при соотношении 1 : 10 (концентрация активного вещества в растворе 12,05 %) и времени гидролиза 24 ч. После достижения определенного времени гидролиза (24 ч) дальнейшее увеличение времени не приводило к увеличению содержания полифенолов для всех соотношений.
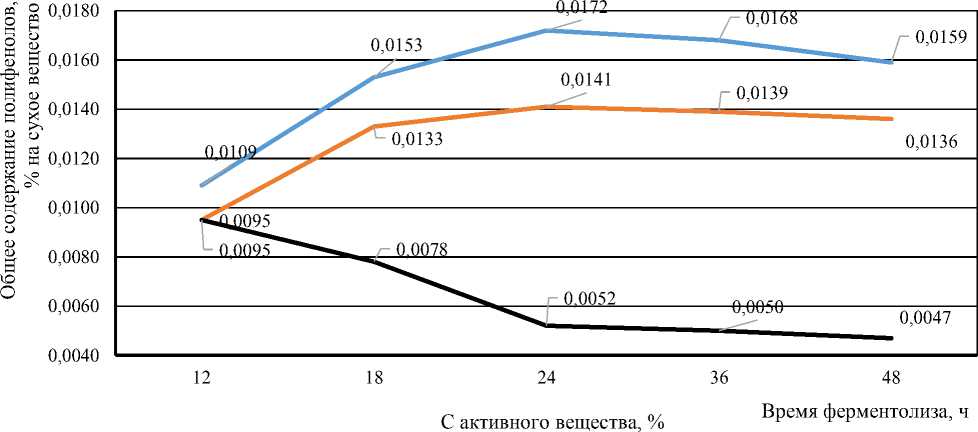
Данные о содержании общего количества полифенолов в полученных ферментолизатах с помощью ферментного препарата «целлюлаза» ( Cellulase ) из водоросли Undaria pinnatifida при разных условиях ферментативного гидролиза представлены на рисунке 3.
В ферментолизатах, полученных с использованием ферментного препарата «целлюлаза», содержание полифенолов при соотношении 1:5 (концентрация активного вещества в растворе равна 24,00 %) и 1 : 7 (концентрация активного вещества в растворе равна 25,15 %) увеличивалось от 12 до 24 ч и затем незначительно снижалось. При соотношении 1 : 10 (концентрация активного вещества в растворе равна 26,09 %) наблюдалось снижение содержания полифенолов от 12 до 48 ч гидролиза. Увеличение соотношения фермента к порошку водоросли не всегда приводило к увеличению содержания полифенолов. Наибольшее содержание полифенолов (0,0172 %) достигалось при соотношении 1 : 5 и времени гидролиза 24 ч.
^^^в 24,00 ^^^в25,15 ^^^в26,09
Рисунок 3 – Содержание общего количества полифенолов в полученных ферментолизатах с помощью ферментного препарата «целлюлаза» из водоросли Undaria pinnatifida при разных условиях ферментативного гидролиза
При соотношении 1 : 10 наблюдалось снижение содержания полифенолов после 12 ч гидролиза, что может указывать на деградацию полифенолов или другие химические процессы.
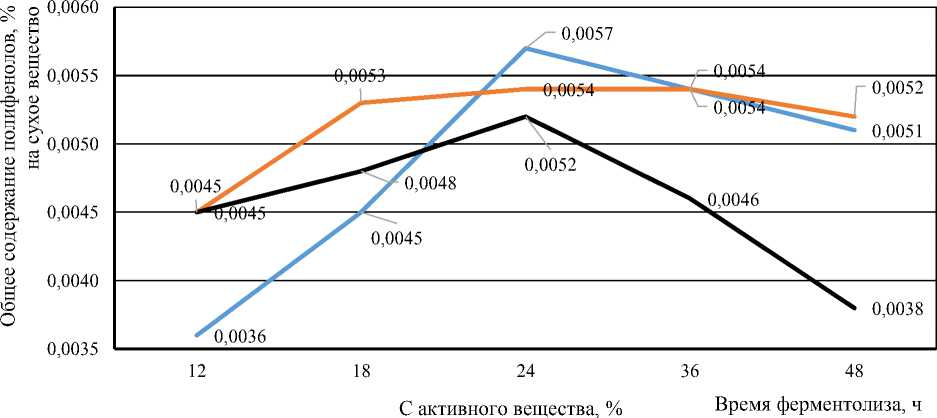
Данные о содержании общего количества полифенолов в полученных ферментолизатах с помощью ферментного препарата «бета-глюканаза» ( Beta-glucanase ) из водоросли Ascophyl-lum nodosum при разных условиях ферментативного гидролиза представлены на рисунке 4.
■■■■■■■в11,08
11,61 ^^^^м 12,05
Рисунок 4 – Содержание общего количества полифенолов в полученных ферментолизатах с помощью ферментного препарата «бета-глюканаза» из водоросли Ascophyllum nodosum при разных условиях ферментативного гидролиза
Анализ данных, представленных на рисунке 4, показывает, как использование различных ферментных препаратов и условий влияло на содержание полифенолов в ферментолиза-тах из морской бурой водоросли Ascophyllum nodosum . В ферментолизатах, полученных из морской бурой водоросли Ascophyllum nodosum с использованием ферментного препарата бета-глюканаза при соотношении 1 : 5 (концентрация активного вещества в растворе 11,08 %), концентрация полифенолов повышалась с увеличением времени гидролиза (0,0036 % после 12 ч до 0,0052 % после 24 ч), но затем уменьшалась. При соотношении 1 : 10 (концентрация активного вещества в растворе 12,05 %) наблюдалась аналогичная тенденция. Это указывает на то, что оптимальное время для гидролиза в данном эксперименте составляет около 24 ч, так как дальнейшее увеличение времени не приводило к значительному увеличению концентрации полифенолов.
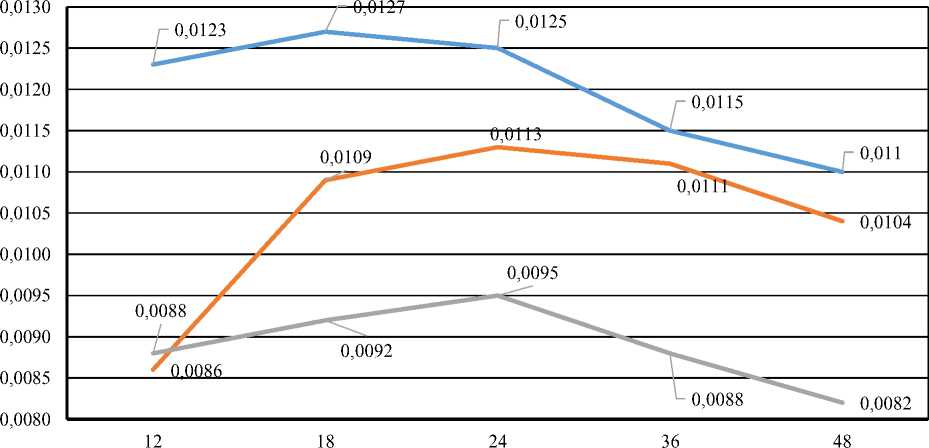
Данные о содержании общего количества полифенолов в полученных ферментолизатах с помощью ферментного препарата «целлюлаза» ( Cellulase ) из водоросли Ascophyllum nodosum при разных условиях ферментативного гидролиза представлены на рисунке 5.
Время ферментолиза, ч
С активного вещества, %
^^^^^л 24,00 ^^^^^^25,15 ^^^^^^ 26,09
Рисунок 5 – Содержание общего количества полифенолов в полученных ферментолизатах с помощью ферментного препарата «целлюлаза» из водоросли Ascophyllum nodosum при разных условиях ферментативного гидролиза
В ферментолизатах, полученных с использованием ферментного препарата целлюлаза, при соотношении 1 : 5 (концентрация активного вещества в растворе 24,00 %), содержание полифенолов составляло 0,0127 % после 12 ч ферментолиза, затем наблюдалось уменьшение содержания полифенолов с увеличением продолжительности ферментолиза. Для соотношения 1 : 7 (концентрация активного вещества в растворе 25,15 %) наблюдалось увеличение содержания полифенолов после 24 ч, с последующим уменьшением. При соотношении 1 : 10 (концентрация активного вещества в растворе 26,09 %) содержание полифенолов увеличивалось с 0,0088 % после12 ч до 0,0095 % после 24, затем снижалось. В данном случае соотношение 1 : 5 при гидролизе в течение 18 ч может быть наиболее эффективным для извлечения полифенолов.
Также была проведена статистическая обработка результатов получением уравнений регрессии, описывающих изменение общего количества полифенолов в ферментолизатах, полученных из бурых водорослей, при разных условиях проведения ферментолиза. Полученные данные представлены в таблице 3. Коэффициенты аппроксимации для уравнений регрессии, представленных в таблице 3, являются высокими и составляют не менее 0,8944.
Таблица 3
Уравнения регрессии, описывающие динамику изменения общего количества полифенолов в ферментолизатах из бурых водорослей при разных условиях проведения ферментолиза от длительности процесса
|
Концентрация активного вещества (для Cellulase ) |
Общее количество полифенолов |
|||
|
Undaria pinnatifida |
Ascophyllum nodosum |
|||
|
уравнение регрессии |
коэффициент аппроксимации |
уравнение регрессии |
коэффициент аппроксимации |
|
|
24,00 % |
y = -0,0009x2 + 0,0067x + 0,0053 |
R² = 0,9829 |
y = -0,0002x2 + 0,0007x + 0,0118 |
R² = 0,9264 |
|
25,15 % |
y = -0,0007x2 + 0,0048x + 0,0056 |
R² = 0,9414 |
y = -0,0005x2 + 0,0032x + 0,006 |
R² = 0,9546 |
|
26,09 % |
y = 0,0004x2 -0,0035x + 0,0128 |
R² = 0,9695 |
y = -0,0002x2 + 0,0011x + 0,0079 |
R² = 0,9363 |
|
11,08 % |
y = -0,0005x2 + 0,0038x - 0,0014 |
R² = 0,9913 |
y = -0,0003x2 + 0,0021x + 0,0017 |
R² = 0,9406 |
|
11,61 % |
y = -0,0003x2 + 0,0027x + 0,0002 |
R² = 0,8944 |
y = -0,0002x2 + 0,0011x + 0,0037 |
R² = 0,9441 |
|
12,05 % |
y = -0,0017x2 + 0,0118x - 0,0059 |
R² = 0,9601 |
y = -0,0002x2 + 0,0012x + 0,0035 |
R² = 0,9422 |
Примечание. y (% на сухое вещество) – общее содержание полифенолов; x (ч) – время ферментолиза.
Полученные результаты открывают новые перспективы для разработки более эффективных методов извлечения полифенолов из водорослей, что может иметь большое значение для пищевой и других видов промышленности. Эти данные подчеркивают важность учета специфики ферментных препаратов и их взаимодействия с различными видами водорослей для достижения максимальной эффективности процесса.
Заключение
В результате проведенного исследования были выявлены оптимальные условия для извлечения полифенолов из морских бурых водорослей Undaria pinnatifida и Ascophyllum nodosum с использованием ферментолиза. Для ферментных препаратов («бета-глюканаза» и «целлюлаза») содержание полифенолов в ферментолизатах морских бурых водорослей достигает максимума примерно через 24 ч гидролиза. Дальнейшее увеличение времени гидролиза приводит к снижению содержания полифенолов, что может быть связано с их деградацией или другими химическими процессами.
Оптимальными условиями для проведения ферментолиза с использованием ферментного препарата «бета-глюканаза» являются: для водоросли Undaria pinnatifida наибольшее содержание полифенолов (0,0141 %) достигается при соотношении фермента к порошку 1 : 10 и времени гидролиза 24 ч. Для водоросли Ascophyllum nodosum максимальное содержание полифенолов (0,0052 %) также наблюдается через 24 ч гидролиза при соотношении 1 : 5.
Оптимальными условиями для проведения ферментолиза с использованием ферментного препарата «целлюлаза» являются: для Undaria pinnatifida наибольшее содержание поли- фенолов (0,0172 %) достигается при соотношении фермента к порошку 1 : 5 и времени гидролиза 24 ч. Для Ascophyllum nodosum оптимальным является соотношение 1 : 5 и время гидролиза около 18 ч, так как при увеличении продолжительности ферментолиза содержание полифенолов уменьшается.
Оптимальные условия зависят от типа ферментного препарата и вида водоросли. Однако в большинстве случаев время гидролиза около 24 ч является наиболее эффективным для извлечения полифенолов. Увеличение соотношения фермента к порошку не всегда приводит к повышению содержания полифенолов. Например, при соотношении 1 : 10 наблюдается снижение содержания полифенолов после определенного времени гидролиза, что может быть связано с деградацией полифенолов. Различные ферментные препараты демонстрируют разные динамики высвобождения полифенолов, что необходимо учитывать при выборе условий для ферментативного гидролиза. Важно отметить, что увеличение количества фермента не всегда приводит к увеличению содержания полифенолов, что подчеркивает значимость точного подбора условий для каждого конкретного случая.


