Ферментурия как маркер повреждения мочевого пузыря при острой задержке мочи
Автор: Кирпатовский В.И., Мудрая И.С., Федяков Р.П., Голованов С.А., Дрожжева В.В., Черников Д.Ю., Елисеев Д.Э., Надточий О.Н., Сыромятникова Е.В.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 1, 2012 года.
Бесплатный доступ
Доброкачественная гиперплазия предстательной железы, дисфункция мочевого пузыря, острая задержка мочи, ферментурия
Короткий адрес: https://sciup.org/142188283
IDR: 142188283
Текст статьи Ферментурия как маркер повреждения мочевого пузыря при острой задержке мочи
In experiment on 20 rats we studied the effect of a 4-hour acute urinary retention (AUR) on the functional state of the bladder and the change in activity of some enzymes (AST and ALT transaminases, lactate dehydrogenase – LDH, alkaline phosphatase – ALP, γ-glutamyltranspeptidase-GGTP, N-acetyl -β-glycosidase – NAG and cholinesterase – CE) in the urine and the bladder wall, comparing them with the changes after 2-hour total ischemia of the bladder caused by pelvic clamping of the aorta. Along with the deterioration of functional parameters we registered significant increase of activity of all studied enzymes in the experiments with AUR, mostly cytoplasmic enzymes (AST, ALT, LDH). In the experiments with ischemia also increase in activity of cytoplasmic enzymes in the urine was registered, whereas the activity of membrane enzymes increased insignificantly. In the bladder wall after AUR as well as after ischemia the activity of all enzymes decreased significantly, except for CE in the experiments with ischemia. Renal function, assessed by creatinine clearance and sodium reabsorption, in all the experiments were not significantly different from the normal values. Reduced enzymatic activity of the bladder wall and the lack of data for renal tubular damage suggests that the source of increased enzymuria after AUR is a damaged wall of the bladder. The similarity of changes in enzyme activity in experiments with AUR and ischemia may indicate an important role of ischemic damage factor of the bladder in AUR.
В.И. Кирпатовский, И.С. Мудрая, Р.П. Федяков,
С.А. Голованов, В.В. Дрожжева, Д.Ю. Черников, Д.Э. Елисеев, О.Н. Надточий, Е.В. Сыромятникова
НИИ урологии Минздравсоцразвития РФ, Москва
О страя задержка мочи (ОЗМ) является частым осложнением доброкачественной гиперплазии предстательной железы (ДГПЖ), сопровождающимся значительным перерастяжением мочевого пузыря. Данные литературы последних лет свидетельствуют, что повышение внутрипузырного давления сопровождается ухудшением кровоснабжения стенки мочевого пузыря, а при длительной обструкции это приводит к хронической гипоксии и выраженным метаболическим и функциональным расстройствам [1-5]. После деблокирования мочевого пузыря самостоятельное мочеиспускание часто не восстанавливается вследствие развившихся за период ОЗМ метаболических и функциональных нарушений. Предположительно они могут быть следствием транзиторной ишемии мочевого пузыря, вызванной длительным повышением внутрипузырного давления.
Данное исследование посвящено сопоставлению выраженности функциональных и метаболических нарушений в мочевом пузыре, оцененных по параметрам сократимости детрузора и изменению активности ряда мембраносвязанных и цитоплазматических ферментов в моче и в стенке мочевого пузыря, вызванных ОЗМ и кратковременной ишемией мочевого пузыря.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проведены на 30 белых беспородных крысах-самках массой
280-340 г. Для получения исходных данных всех крыс предварительно высаживали в обменные клетки на 1 сутки для сбора мочи, в которой определяли активность трансаминаз (АЛТ, АСТ), ЛДГ, щелочной фосфатазы, γ-глутамилтранспептидазы (ГГТП), N-ацетилгликозидазы (НАГ) и холинэстеразы (ХЭ). Для исключения влияния различий в диурезе рассчитывали активность ферментов в пересчете на 1 ммоль креатинина мочи. На следующие сутки под эфирным наркозом у этих крыс в 1-й серии моделировали ОЗМ путем предварительного наполнения мочевого пузыря до максимальной емкости физиологическим раствором через катетер, введенный по уретре и последующего пережатия предпу-зырного отдела мочеиспускательного канала мягким микрососудистым зажимом на 4 часа (7 крыс). Во 2-й серии вызывали ишемию мочевого пузыря пережатием тазового отдела аорты на 2 часа (7 крыс). После снятия обструкции мочевых путей или зажима с аорты крыс вновь помещали в обменные клетки на одни сутки для повторного сбора мочи и определения в ней ферментативной активности. В конце эксперимента удаляли мочевой пузырь и готовили из него гомогенат, в котором также определяли активность изучаемых ферментов в пересчете на 1 мг белка гомогената. В качестве нормальных значений использовали активность ферментов в гомогенате интактного мочевого пузыря (6 опытов). Для ис-
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №1 2012 ключения влияния возможного повреждения почек при ОЗМ и ишемии и почечного происхождения фермен-турии определяли также концентрацию креатинина и натрия в крови и моче, из которых рассчитывали показатели клубочковой фильтрации и канальцевой реабсорбции натрия.
Исследование активности ферментов, электролитов, белка и креатинина проводили с помощью стандартных наборов реактивов на автоматическом анализаторе «ADVIA-2000».
Функциональную полноценность детрузора после ОЗМ определяли путем исследования сократительной активности полосок, выкроенных из тела интактного и обструктивного мочевого пузыря, в экспериментальной стендовой установке в изометрическом режиме. Полоски помещали в термостатируемую камеру (37oС) с протекающим оксигенированным раствором Рингера. После периода адаптации регистрировали величину тонического напряжения, спонтанную сократительную активность, а также ее изменение в ответ на электростимуляцию (прямоугольные импульсы напряжением на 10-20% выше порогового с частотой 6 в минуту и длительностью 100-500 мсек.) и действие высокой концентрации калия в омывающем растворе [6].
Статистическую достоверность разницы результатов оценивали по парному критерию Стьюдента и критерию Вилкоксона-Манна с использованием компьютерной программы «Statistica 6.0».
РЕЗУЛЬТАТЫИ ОБСУЖДЕНИЕ
Исследуя влияние ОЗМ на функциональную полноценность мочевого пузыря в стендовой установке через сутки после 4-часовой задержки мочи мы выявили усиление спонтанной сократительной активности исследуемых полосок детрузора. Если в норме при отсутствии электростимуляции спонтанные сокращения выявлялись в 20% случаев и были низкоамплитудными, то в опытах с ОЗМ спонтанные сокращения обна-
Таблица 1. Изменение функциональных показателей состояния детрузора через сутки после 4-часовой ОЗМ
|
Тонус (мг) |
Амплитуда сокращений (мг/мм2) |
К+/- контрактура (мг/мм2) |
|
|
Норма |
222 ± 13 |
42,7 ± 3,8 |
430 ± 56 |
|
ОЗМ |
462 ± 76* |
48,8 ± 5,5 |
157 ± 54* |
Таблица 2. Ферментный спектр стенки мочевого пузыря и мочи интактных крыс
|
Активность ферментов |
Стенка мочевого пузыря (МЕ/мг белка) |
Моча (МЕ/ммоль креатинина) |
|
АСТ |
312 ± 12 |
1,5 ± 0,3 |
|
АЛТ |
35,7 ± 0,8 |
1,1 ± 0,4 |
|
ЛДГ |
1687 ± 76 |
4,9 ± 1,3 |
|
ЩФ |
371 ± 98 |
25,1 ± 5,3 |
|
ГГТП |
12,3±3,2 |
72,7±14,2 |
|
НАГ |
397 ± 73 |
32,5 ± 4,2 |
|
ХЭ |
47,1 ± 4,8 |
11,9 ± 3,0 |
ружены в 80% и имели более высокую амплитуду, иногда сопоставимую с амплитудой сокращений, вызванных электрическими импульсами (рисунок 1). В интактном детрузоре первое сокращение после включения электростимуляции имело значительно большую амплитуду (эффект потенциации покоя), что связано с более значительным выбросом кальция из депо, накопленного за период покоя, в ответ на первое раздражение. В опытах с полосками мочевого пузыря, перенесшего ОЗМ, этого эффекта практически не выявлялось. Это различие указывает на снижение резервных возможностей усиления сокращений мочевого пузыря после ОЗМ.
В опытах с ОЗМ выявляли также достоверно более высокие значения тонуса детрузора (таблица 1), что может указывать на более высокую концентрацию кальция в цитоплазме миоцитов, то есть, на снижение мощности механизма закачки кальция из цитоплазмы в депо (саркоплазматический ретикулум, митохондрии). После включения электростимуляции амплитуда активных сокращений в опытной и контрольной группах достоверно не различались. Функциональный резерв сократительной активности исследуемых полосок детрузора, выявляемый по амплитуде повышения их тонуса в ответ на замену стандартного раствора Кребса на раствор, в котором ионы натрия были заменены на ионы калия, что вызывает сокращение всех функционально активных мышечных элементов (ка-
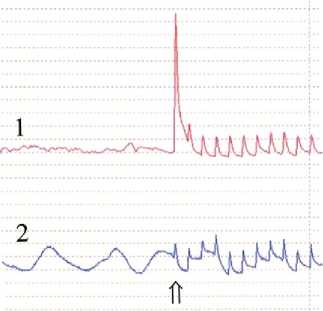
Рисунок 1. Спонтанная сократительная активность полосок интактного (1) и обструктивного (2) мочевого пузыря (стрелкой указан момент включения электростимуляции).
лиевая контрактура), в опытах с ОЗМ уменьшался более чем в 2,5 раза.
Эти данные свидетельствуют о существенном нарушении функционального состояния мочевого пузыря после 4-часовой ОЗМ.
Для выявления, насколько функциональные нарушения связаны с метаболическими расстройствами в стенке мочевого пузыря, определяли изменения спектра ферментативной активности в моче и в стенке органа после ОЗМ, а для уточнения значимости фактора нарушения кровоснабжения мочевого пузыря при этом патологическом состоянии аналогичные исследования проводили при ишемии этого органа.
Анализ спектра активности исследуемых ферментов в стенке интактного мочевого пузыря и моче показал, что в стенке пузыря из цитоплазматических ферментов наибольшая активность выявляется в отношении a
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ
№1 2012
Таблица 3. Выраженность ферментурии у крыс после ОЗМ и ишемии мочевого пузыря (МЕ/ммоль креатинина)
Ферментурия Контроль ОЗМ Контроль Ишемия
|
АСТ |
1,1 ± 0,3 |
5,8 ± 1,6*** |
1,9 ± 0,4 |
3,5 ± 0,9* |
|
АЛТ |
1,3 ± 0,4 |
3,5 ± 1,1* |
0,8 ± 0,3 |
1,7 ± 0,4* |
|
ЛДГ |
3,3 ± 1,1 |
54,3 ± 12,1*** |
6,7 ± 1,6 |
19,7 ± 4,3** |
|
ЩФ |
12,6 ± 7,3 |
42,3 ± 16,8* |
36,4 ± 6,1 |
46,3 ± 5,8 |
|
ГГТП |
52,7 ± 11,6 |
79,2 ± 19,1* |
92,2 ± 26.7 |
159,1 ± 39,3 |
|
НАГ |
27,0 ± 4,4 |
104,8 ± 26,3** |
36,4 ± 4,1 |
51,1 ± 11,9 |
|
ХЭ |
13,6 ± 2,9 |
18,5 ± 7,1 |
10,3 ± 3.1 |
20,6 ± 4,2** |
Таблица 4. Показатели функционального состояния почек в опытах с ОЗМ и ишемией мочевого пузыря
|
Показатель |
Норма |
ОЗМ |
Ишемия |
|
Клубочковая фильтрация (мл/мин/100 г массы тела) |
3,19 ± 0,11 |
3,06 ± 0,14 |
3,14 ± 0,09 |
|
Реабсорбция натрия (%) |
99,2 ± 0,03 |
99,1 ± 0,03 |
99,4 ± 0,02 |
Таблица 5. Активность ферментов в гомогенате мочевого пузыря (МЕ/мг белка) крыс после ОЗМ и ишемии
Активность ферментов Контроль ОЗМ Ишемия
|
АСТ |
312 ± 12 |
121 ± 24 (38,8%)*** |
167,1 ± 29 (53,5%)** |
|
АЛТ |
35,7 ± 0,8 |
14,8 ± 2,9 (41,6%)*** |
17,9 ± 4,3 (50,1%)** |
|
ЛДГ |
1687 ± 76 |
662 ± 98 (39,2%)*** |
882 ± 122 (52,3%)** |
|
ЩФ |
371 ± 98 |
139 ± 24 (37,5%)* |
173 ± 15 (46,6%)* |
|
ГГТП |
12,3 ± 3,2 |
2,2 ± 1,1 (17,9%)* |
1,4 ± 0,7 (11,4%)** |
|
НАГ |
397 ± 73 |
281 ± 18 (70,8%)* |
181 ± 56 (45,6%)* |
|
ХЭ |
47,1 ± 4,8 |
30,3 ± 4,1 (64,3%)* |
69,9 ± 21,4 (148,4%) |
ЛДГ, что может свидетельствовать о высоких возможностях анаэробного метаболизма (таблица 2). Среди трансаминаз активность АСТ примерно в 9 раз превышает активность АЛТ. В то же время в моче активность этих ферментов была примерно одинаковой на низких значениях. Активность ЩФ, которая локализуется как в цитоплазме, так и в митохондриях, и НАГ, являющейся лизосомальным ферментом, оказалась относительно высокой как в стенке мочевого пузыря, так и в моче. В то же время мембраносвязанный фермент ГГТП в стенке пузыря выявил низкую активность, тогда как в моче его активность была наивысшей, что может быть связано с ее преимущественно почечным происхождением, так как этот фермент в высоких концнентрациях локализован в щеточной каемке проксимальных извитых почечных канальцев. Относительно неожиданной находкой явилась достаточно высокая активность ХЭ в стенке мочевого пузыря. Ее источник может быть связан с нейрорецептор-ным аппаратом мочевого пузыря.
После ОЗМ определение активности ферментов в моче выявило достоверное возрастание ферментурии у всех крыс этой серии (таблица 3). Степень возрастания активности колебалась от 1,5 (ГГТП) до 18 раз (ЛДГ). Обращает на себя внимание, что активность цитоплазматических ферментов (АСТ, ЛГД) возрастала существенно больше, чем мембраносвязанных (ГГТП, НАГ).
В опытах с ишемией мочевого пузыря активность всех ферментов в среднем по группе также возрастала, но в меньшей степени. При этом статистически достоверные изменения получены не только для цитоплазматических ферментов (АЛТ, АСТ, ЛДГ), а также для ХЭ. Эти данные свидетельствуют, что при 4-часовой ОЗМ выраженность повреждения мочевого пузыря оказалась больше, чем после 2-часовой ишемии. Достоверное повышение активности мембраносвязанных ферментов в опытах с ОЗМ может косвенно указывать на деструкцию клеточных мембран (скорее всего, эпителиальной выстилки), тогда как увеличенный выход в мочу только цитоплазматических ферментов в опытах с ишемией мочевого пузыря свидетельствует о повышении проницаемости цитолеммы для белковых молекул без нарушения ее анатомической целостности.
Разница в выраженности повреждения в опытах с ОЗМ и ишемией мочевого пузыря может быть обусловлена или более выраженным действием ишемического фактора при 4-часовой ОЗМ, чем при 2-часовой ишемии мочевого пузыря, или наличием дополнительных повреждающих факторов при ОЗМ.
Возникает вопрос, не имеет ли возрастание ферментурии после ОЗМ почечную природу, учитывая возможность развития пузырно-почечного рефлюкса с повышением внутрило-ханочного давления и повреждения вследствие этого почечных канальцев. Для исключения или подтверждения этой возможности мы использовали три варианта проверки:
-
1. серия опытов с ишемией мочевого пузыря, в которой исключалось негативное влияние проводимых нами вмешательств на почку;
-
2. определение функциональной полноценности почек путем определения клиренса креатинина и канальцевой реабсорбции натрия;
-
3. определение изменений активности изучаемых ферментов в стенке мочевого пузыря.
В опытах с ишемией мочевого пузыря, как и в опытах с ОЗМ, выявлено достоверное увеличение ферментурии, но его спектр в опытах с ишемией оказался неидентичен опытам с ОЗМ.
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №1 2012
Определение клубочковой фильтрации и канальцевой реабсорбции натрия не выявило достоверных изменений как после ОЗМ, так и после ишемии по сравнению с исходными значениями (таблица 4).
При определении активности ферментов в гомогенате ткани мочевого пузыря выявили достоверное снижение активности всех изученных ферментов, как после ОЗМ, так и после ишемии мочевого пузыря, за исключением ХЭ в опытах с ишемией мочевого пузыря (таблица 5). Степень снижения составляла от 29,2 до 83,1% при ОЗМ и от 54,4 до 88,6% – при ишемии мочевого пузыря для разных ферментов. Ишемия приводила к несколько меньшему снижению ферментативной активности цитоплазматических ферментов стенки мочевого пузыря, но более значимой утрате активности мембраносвязанных ферментов.
В отличие от опытов с ОЗМ, в которых выявили снижение активности ХЭ в стенке мочевого пузыря, в опытах с ишемией активность этого фермента не снижалась и даже имела тенденцию к повышению. Возможно, это связано с повреждением интрамуральных парасимпатических нейронов, вызванных постгипоксическими метаболическими расстройствами, индуцирующих также увеличение активности ХЭ. Подобный механизм описан в публикации Mu-turaiu S. et al. при изучении влияния на нейроны высотной гипоксии [7].
В доступной литературе мы не обнаружили данных о влиянии ОЗМ на ферментативную активность стенки мочевого пузыря. Имеются данные, что при хронической инфравези-кальной обструкции, смоделированной в эксперименте, а также у больных ДГПЖ активность гликолитического фермента ЛДГ в мочевом пузыре возрастает, тогда как активность митохондриальных ферментов, участвующих в аэробном синтезе АТФ (СДГ, ИЦДГ) снижается [8, 9]. Различия в изменении активности ЛДГ при острой и хронической задержке мочи (снижение при ОЗМ и повышение при хронической обструкции) можно объяснить постепенной адаптацией компонентов стенки мочевого пузыря к развивающейся тканевой гипоксии при хронической обструкции мочевых путей, тогда как при ОЗМ повреждающий фактор (давление, ишемия) действует в короткий срок и с высокой интенсивностью, что вызывает выраженное повреждение клеточных структур, обуславливающее утечку ферментов из клеток.
ЗАКЛЮЧЕНИЕ
Список литературы Ферментурия как маркер повреждения мочевого пузыря при острой задержке мочи
- Мудрая И.С., Ибрагимов А.Р., Кирпатовский В.И., Ревенко С.В., Нестеров А.В., Гаврилов И.Ю. Оценка функционального состояния мочевого пузыря крыс методом Фурье-импедансной цистометрии//Экспериментальная и клиническая урология. 2010. № 3. С. 21-26.
- Shimizu S., Saito M., Kinoshita Y., Kazuyama E., Tamamura M., Satoh I., Satoh K. Acute urinary retention and subsequent catheterization cause lipid peroxidation and oxidative DNA damage in the bladder: preventive effect of edaravone, a free-radical scavenger//BJU Int. 2009. Vol. 104, № 5. P. 713-717.
- Bajory Z., Szabli A., Kirgyly I., Pajor L., Messmer K. Involvement of nitric oxide in micro-circulatory reactions after ischemia-reperfusion of the rat urinary bladder//Eur Surg Res. 2009. Vol. 42, № 1. P. 28-34.
- Ohmasa F., Saito M., Shimizu S., Taniguchi S., Dimitriadis F., Satoh I., Kinoshita Y., Satoh K. The role of ATP-sensitive potassium channel on acute urinary retention and subsequent catheterization in the rat//Eur J Pharmacol. 2010. Vol. 635, № 1-3. P. 194-197.
- Scheepe J.R., Amelink A., Wolffenbuttel K.P., De Jong B.W.D., Kok D.J. Changes in bladder wall perfusion in the overactive obstructed bladder//Eur Urol. 2010/Vol. 9, № 2. (Suppl). P. 114.
- Мудрая И.С., Кирпатовский В.И. Адренэргическая регуляция сократительной функции мочеточников человека и собаки//Бюл. экспер. биол. и мед. 1992. № 4. C. 363-366.
- Muthuraju S., Maiti P., Solanki P., Sharma A.K., Singh S.B., Prasad D., Ilavazhagan G. Cholinesterase inhibitors ameliorate spatial learning deficits in rats following hypobaric hypoxia//Exp Brain Res. 2010. Vol. 203, № 3. P. 583-592.
- Вишневский Е.Л., Лоран О.Б., Пушкарь Д.Ю., Петров С.Б. Обструктивная ноктурия. М. АНМИ, 2007. 162.
- Polyanska M., Arner A., Malmquist U., Uvelous B. Lactate dehydrogenase activity and isoform distribution in the rat urinary bladder: effect of outlet obstruction and its removal//J Urol. 1993. Vol. 150, № 2, Pt 1. P. 543-545


