Филлоидные опухоли молочных желёз. Особенности инструментальной диагностики и морфологической структуры
Автор: Зугумова М.Ш., Степанянц Н.Г., Завьялов А.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Литературные обзоры
Статья в выпуске: 2 (88), 2024 года.
Бесплатный доступ
К неэпителиальным злокачественным опухолям молочной железы относятся как неэпителиальные, так и фиброэпителиальные опухоли, прежде всего филлоидные опухоли (0,3-1 %) и саркомы (0,2-0,6 %) [1, 2]. Филлоидные опухоли рассматриваются в данной группе в связи с тем, что это редкие, фиброэпителиальные опухоли, которые имеют бифазную структуру и своеобразное клиническое течение [3]. В связи с малым количеством рандомизированных исследований, изучающих данную патологию, на сегодняшний день отсутствует стандартизированный подход к диагностике и малоизучена тактика их комплексного лечения [4].Актуальность. По статистическим данным международных исследований частота злокачественных вариантов филлоидных опухолей колеблется в широких пределах: от 2 % до 45 %. Злокачественный потенциал опухоли определяется малигнизацией неэпителиального компонента, которому чаще всего подвергается небольшая часть опухоли, в то время как остальная ее часть может иметь морфологические признаки доброкачественного процесса. Это является причиной сложности верификации опухолевого процесса на диагностическом этапе. Учитывая различные варианты клинического течения и морфологических особенностей, филлоидные опухоли следует рассматривать как целый комплекс опухолей фиброэпителиального происхождения.Цель исследования. Анализ и систематизация данных об особенностях инструментальной диагностики и морфологической структуры ФО молочных желёз.Материалы и методы исследования. Поиск литературных источников осуществлялся в PubMed по словарным запросам: «филлоидные опухоли», «листовидные опухоли», «саркомы молочной железы». Временной горизонт поиска распространялся на 2005-2023 гг.
Неэпителиальные злокачественные опухоли, филлодная опухоль, фиброаденома, ультразвуковое исследование молочных желёз, маммография
Короткий адрес: https://sciup.org/142241735
IDR: 142241735 | УДК: 006.617-089 | DOI: 10.17238/2072-3180-2024-2-93-100
Текст обзорной статьи Филлоидные опухоли молочных желёз. Особенности инструментальной диагностики и морфологической структуры
Впервые филлоидный тип опухоли описан ещё в 1774 году как «гигантская фиброаденома», а в 1827 году их в своих работах упоминает Chelius. Первым учёным, который использовал термин «cystosarcoma phyllodes», в связи с макроскопически схожим видом с саркомой был Johannes Muller. Однако этот термин вводит в некоторое заблуждение, поскольку эти опухоли редко бывают кистозными и не обладают таким злокачественным потенциалом, как большинство сарком [5]. До 1943 года, когда Cooper и Ackerman сообщили о злокачественном биологическом потенциале этой опухоли, она и вовсе считалась доброкачественной. В 1981 году Всемирная организация здравоохранения приняла термин «филлоидная опухоль» и классифицировала их гистологически как доброкачественные, пограничные или злокачественные в соответствии с такими признаками, как края опухоли, разрастание стромы, некроз опухоли, клеточная атипия и индекс митотической активности [6].
Филлоидные опухоли (phyllodes tumor, phyllon – «лист» и eidos – «вид») также известные как листовидные, или интрака-наликулярные фиброаденомы с клеточной стромой, являются редкой патологией, составляют от 0,3 до 0,5 % всех опухолей молочной железы [7] и имеют частоту около 2,1 на миллион [8]. В связи с низкой частотой встречаемости и, соответственно, с малым количеством рандомизированных исследований, изучающих данную патологию, на сегодняшний день отсутствует стандартизированный подход к диагностике и малоизучена тактика их комплексного лечения [4]. Название этих опухолей происходит от латинского слова «Phyllodium», что означает «листовидный», на основании грубого патологического опи- сания листовидной, объемной, кистозной и мясистой опухоли молочной железы [9]. Филлоидная опухоль может возникнуть в практически любом возрасте – от периода раннего полового созревания до старости. В литературе этот временной интервал колеблется от 10 до 90 лет, однако пик заболеваемости приходится на 45–49 лет и редко встречается у подростков и пожилых людей [3]. Описано несколько случаев обнаружения филлоидных опухолей у мужчин, и они неизменно были связаны с наличием гинекомастии [10]. Филлоидная опухоль отличается потенциальной возможностью трансформации в саркому молочной железы за счет злокачественных изменений в строме [1]. Размер опухолевых образований колеблется от 0,5 до 30 см со средним значением от 5 до 7,2 см [10].
Этиология листовидной опухоли неясна, так же, как и её патогенез [11]. Факторы риска также чётко не определены. По данным исследований генетические мутации в хромосомных областях +1q, +5p, +7, +8, -9p, -10p, –6 и –13 коррелировали с наличием пограничных и злокачественных филлоидных опухолей молочной железы [9, 23]. Женщины с синдромом Ли-Фраумени имеют повышенный риск развития филлоидных опухолей [9].
В отличие от карциномы молочной железы, которая развивается внутри протоков или долек, филлоидные опухоли имеют начало в соединительной ткани молочной железы, называемой стромой. Она включает в себя жировую ткань и связки, которые окружают протоки, дольки, а также кровеносные и лимфатические сосуды [9]. Данная группа опухолей имеет смешанную структуру, включая в себя и эпителиальные и стромальные элементы. Это затрудняет их чёткое отличие с одной стороны – от типичных фиброаденом, с другой стороны – от сарком мягких тканей. Также имеются данные о том, что большинство данных образований имеют поликлональные элементы и должны рассматриваться как гиперпластические, а не опухолевые поражения. Стоит отметить, что злокачественные филлодные опухоли имеют склонность к быстрому росту и метастатическому распространению [12]. Доброкачественные филлодные опухоли при клиническом, рентгенологическом и цитологическом исследовании являются часто неотличимы от фиброаденом [13]. Считается, что индукция стромального компонента может быть связана с факторами роста, продуцируемыми эпителием молочной железы, в частности с эндоте-лином–1, который стимулирует рост фибробластов молочной железы [10].
Усложняет тактику обследования и лечения пациента то, что независимо от морфологических особенностей данная группа опухолей обладает непредсказуемым поведением в плане возможных рецидивов. Местные рецидивы при доброкачественных очагах встречаются редко, в то время как при пограничных и злокачественных вариантах их процент довольно велик [14]. Сообщается, что местный рецидив составляет приблизительно 8 % для доброкачественных филлоидных опухолей и 21 % для пограничных случаев [5].
Доброкачественные филлоидные опухоли встречаются чаще и составляют от 35 % до 64 %, пограничные опухоли составляют от 7 % до 40 % случаев, в то время как злокачественные достигают 30 % [15].
Классификация
Согласно международной гистологической классификации, пересмотренной и принятой в 2012 г. рабочей группой в составе Международного агентства по изучению рака (International Agency for Research on Cancer, IARC), листовидные опухоли относятся к фиброэпителиальным опухолям и делятся на доброкачественные (9020/0), промежуточные (9020/1) и злокачественные (9020/3) в соответствии с такими признаками, как края опухоли, разрастание стромы, некроз опухоли, клеточная атипия и количество митозов на поле высокой мощности [16].
Доброкачественные филлоидные опухоли характеризуются повышенной стромальной клеточностью с легкой или умеренной клеточной атипией и низкой митотической активностью (менее 4 митозов в 10 полях зрения). При определении плоидности с помощью проточной цитофлуориметрии в доброкачественных филлоидных опухолях была выявлена 100 % диплоидия клеток опухоли [17].
Пограничные филлоидные опухоли имеют большую степень стромальной клеточности, более выраженный полиморфизм и атипию фибробластических клеток. Количество митозов составляет от 4 до 9 в 10 полях зрения (при ×400). Отдаленные рецидивы редки. В пограничных филлоидных опухолях с помощью проточной цитофлуориметрии при определении плоидности клеток выявлены как диплоидные, так и анеуплоидные клетки. Определяется высокий индекс пролиферативной активности
(Ki 67 – 48%). Число делящихся клеток в G2 + M фазе равно 19,8%, что близко к показателям сарком. В дальнейшем, при рецидиве через 6 месяцев, число делящихся клеток в G2 + M фазе подтверждалось [17].
При злокачественной филлоидной опухоли/периканалику-лярной стромальной опухоли низкой степени злокачественности (гистологическая классификация 2012 года) обнаруживаются обширные участки оксифильных масс, в которых замурованы многочисленные опухолевые клетки. Оксифильные массы образуют тяжи в виде ярко-малиновых нитевидных субстанций [17].
Стенфордская медицинская школа рекомендует классификацию, в основе которой стоит ряд морфологических характеристик: высокий митотического индекс, саркоматозная строма, преобладание стромального компонента и инфильтративные края. Доброкачественный вариант филлоидной опухоли не несёт в себе таких характеристик, в то время как пограничный вариант может сопровождаться сочетанием двух или трех, а злокачественный вариант – и вовсе регистрируются все эти параметры. Тем самым при дифференциальной диагностике составляет сложности пограничный вариант опухоли [10, 18].
Диагностика
Диагноз «злокачественная филлоидная опухоль» можно ставить только в том случае, если в препарате обнаружены эпителий и злокачественные мезенхимальные клетки (клетки саркомы). Способность филлоидных опухолей к рецидивирова-нию, малигнизации и развитию саркомы является их основной особенностью [17].
Кроме того, наличие эпителиального компонента не исключает развития карциномы. В литературе описана малигнизация двух компонентов одновременно с развитием карциносарко-мы, которой характерно как лимфогенное, так и гематогенное метастазирование [17].
Тройная оценка с помощью клинического, рентгенологического и гистологического исследования является фундаментальной для верификации диагноза. На дооперационном этапе провести чёткую дифференциальную диагностику между филлоидной опухолью и другими опухолями молочных желез довольно трудно [19].
Дифференциальная диагностика проводится с фиброаденомой, аденомой, гамартомой, липомой, ювенильным папилломатозом, карциномой, саркомой, метастатической опухолью [21].
Клиническая картина
Обычно филлоидная опухоль проявляются в виде быстро растущей, но клинически доброкачественной опухоли молочной железы [9]. Зачастую картина усугубляется внезапным увеличением размеров образования. Средний размер опухолей филлодов составляет около 4 см; 20 % опухолей вырастают более чем на 10 см (гигантская филлодная опухоль) [20]. Эти опухоли могут достигать размеров до 40 см в диаметре. В ряде случаев наблюдается двухфазное клиническое течение – длительный период стабилизации сменяется достаточно быстрым ростом, что свидетельствует о злокачественном варианте происхождения опухоли [10]. Чаще встречается в верхнем наружном квадранте с одинаковой склонностью к возникновению в любой груди. Кожа над большими опухолями может иметь расширенные вены и синюю окраску, но втягивание соска встречается редко. Сообщалось о фиксации к коже и грудным мышцам, но изъязвление встречается редко. Редко предлежание может быть двусторонним. Значительная часть пациентов имеет фиброаденому в анамнезе, и в меньшинстве они были множественный. Пальпируемая подмышечная лимфаденопатия может быть выявлена у 10–15% пациентов, но <1% имели патологические положительные узлы [9].
Рентгенрадиологические исследования
Маммография и ультразвуковое исследование являются основой рутинной визуализации опухолей молочной железы. Круглая или дольчатая форма, четко очерченные края, неоднородная внутренняя структура и не расширяющиеся внутренние перегородки чаще встречаются при филлодных опухолях, чем при фиброаденомах [21].
По данным ультразвукового исследования определяется дольчатая форма (в некоторых случаях круглая или овальная), хорошо очерченная, с гладкими краями, эхогенным ободком и низким уровнем однородных внутренних эхо-сигналов. Видны заполненные жидкостью расщелины в преимущественно твердой массе с хорошей проницаемостью и отсутствием микрокальцификации [2, 21].
Признаками, указывающими на злокачественное поведение при цветном допплеровском ультразвуковом исследовании, являются: выраженная гипоэхогенность, затенение заднего контура, плохо очерченные края опухоли, более высокие значения индекса сопротивления, увеличенный индекс пульсации, увеличенная систолическая пиковая скорость кровотока [10, 21].
Маммография показывает хорошо очерченную овальную или дольчатую массу с закругленными границами. Вокруг поражения может быть виден радиопрозрачный ореол из-за сжатия окружающей среды. Может присутствовать грубая кальцификация (но злокачественная микрокальцификация встречается редко). В принципе маммография редко позволяет поставить правильный диагноз, особенно при филлоидных опухолях маленьких размеров. Дифференцировать доброкачественный и злокачественный варианты при маммографии крайне сложно, даже при наличии таких характеристик как большие размеры и бурный рост, что является присущим обоим вариантам гистологического типа опухоли [7, 21].
На магнитно-резонансной томографии в основном обнаруживаются следующие особенности: круглая или дольчатая форма и четко очерченные края, неоднородная внутренняя структура/ несимметричные перегородки, проявляет гипоинтенсивные сиг- налы на T1–взвешенных изображениях, проявляет гипер / изо-интенсивные сигналы на T2–взвешенных изображениях. Схема усиления контраста позволяет провести дифференцировку: при доброкачественной филлоидной опухоли медленное начальное усиление с постоянной отсроченной фазой; при злокачественной - быстрое начальное усиление с феноменом вымывания. Роль МРТ в диагностике филлоидных опухолей (несмотря на высокую чувствительность для выявления рака молочной железы) все еще обсуждается и еще не понята, хотя некоторые авторы нашли доказательства, свидетельствующие о том, что МРТ может иметь высокую степень соответствия с гистопатологией [9].
Роль онкомаркеров в диагностике филлоидных опухолей
Повышенная экспрессия белка р53 и антигена Ki–67 была обнаружена в злокачественных филлоидных опухолях, и они могут быть полезны для дифференциации от фиброаденом. Кроме того, было показано, что в филлоидных опухолях экспрессия p53 и Ki–67 коррелирует с негативными прогностическими факторами. Филип К. У. и др. показал роль ангиогенеза и установил, что чем выше плотность микрососудов, тем выше степень злокачественности филлоидных опухолей. Гэри М. К. Цзе и др. обнаружено, что экспрессия белка CD117 стромальными клетками в филлоидных опухолях коррелирует с гистологическими параметрами, такими как степень злокачественности, что подразумевает возможную роль их использования в качестве дополнительных маркеров злокачественности в этих опухолях. В злокачественных опухолях уровень экспрессии достигает 46 %. Это дает дополнительные убедительные доказательства того, что активность тирозинкиназы, опосредованная рецептором c–kit, может быть вовлечена на ранних стадиях в патогенез филлоидных опухолей. Марик Лаэ и др. показал, что хромосомные изменения, обнаруженные с помощью сравнительной геномной гибридизации, могут быть полезны при классификации этих опухолей. В проточных цитометрических исследованиях была продемонстрирована корреляция между содержанием ДНК, пролиферацией клеток и гистологической оценкой. Некоторые исследования выявили корреляцию между этими маркерами клеточной пролиферации и клиническим исходом. Также есть данные о том, что теломераза, фермент рибонуклеопротеина, который генерирует теломеры (последовательности ДНК, важные для определения бессмертия клеток), может быть полезным прогностическим фактором при филлодных опухолях [21].
Морфологические особенности
FNAC-диагностика опухолевого процесса (тонкоигольная аспирационная биопсия) в диагностике филлоидных опухолей остаётся спорной, поскольку и филлоидные опухоли, и фиброаденомы относятся к спектру фиброэпителиальных поражений. Цитологически часто легче отличить доброкаче- ственные филлодные опухоли от злокачественных, чем отделить доброкачественные филлодные опухоли от фиброаденом. Однако эпителиальные клетки могут отсутствовать в образцах, взятых из злокачественных образований. Наличие сплоченных стромальных клеток (фрагментов филлодов), изолированных мезенхимальных клеток, скоплений гиперпластических клеток протоков, гигантских клеток инородного тела, кровеносных сосудов, пересекающих фрагменты стромы, и биполярных обнаженных ядер, а также отсутствие апокринной метаплазии наводят на мысль о филлоидной опухоли (рис. 1, 2, 3). Scolyer и соавт. сравнили цитологию филлоидных опухолей и фиброаденом и пришли к выводу, что если на FNAC видны гиперцеллюлярные фрагменты стромы, следует думать о фил-лоидной опухоли и рекомендовать удаление. Foxcroft и соавт., рассмотрев 83 случая с филлоидными опухолями, обнаружили, что цитология подтвердила предварительный диагноз только в 23 %, в то время как по данным биопсии филлоидная опухоль подтверждена в 65 % [9, 10, 21].
Трепан-биопсия ткани является выигрышной альтернативой тонкоигольной аспирационной биопсии из-за дополнительной архитектурной информации, полученной при морфологическом исследовании, её высокой чувствительностью (99 %), положительной (83 %) отрицательной (93 %) прогностической ценностью [21].
Очаги представляют собой фиброэпителиальные опухоли, характеризующиеся эпителиальной и стромальной пролиферацией. Макроскопически филлоидная опухоль имитирует фиброаденому, но на поверхности разреза видны расщелины, похожие на щели, с распределенным узловатым ростом стромы, а цвет отличается от коричневого до желтовато-серого. Кроме того, наблюдается чрезмерный рост стромы, митотическая активность и повышенная клеточность стромы. Кровоизлияние и некроз могут наблюдаться при злокачественном типе, кроме того, злокачественный тип может иметь мясистую поверхность среза, похожую на саркому, которая мягче, чем доброкачественная филлоидная опухоль или фиброаденома [12, 13, 19].
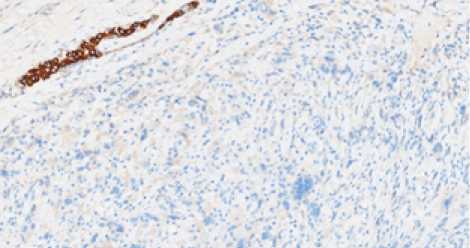
Рис. 2. Отсутствие экспрессии СK pan в клетках опухоли (положительный внутренний контроль – экспрессия в эпителии протоков молочной железы). Иммуногистохимический метод, х 200 Fig. 2. Absence of SC pan expression in tumor cells (positive internal control – expression in the epithelium of the ducts of the breast). Immunohistochemical method, x 200
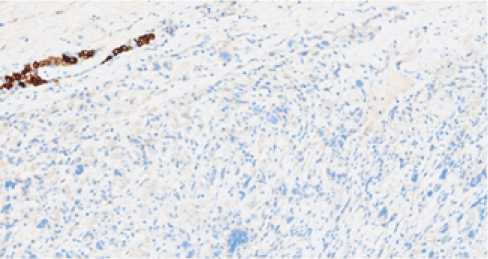
Рис. 3. Отсутствие экспрессии СK 8-18 в клетках опухоли (положительный внутренний контроль – экспрессия в эпителии протоков молочной железы). Иммуногистохимический метод, х 200
Fig. 3. Absence of expression of SC 8-18 in tumor cells (positive internal control – expression in the epithelium of the ducts of the breast). Immunohistochemical method, x 200
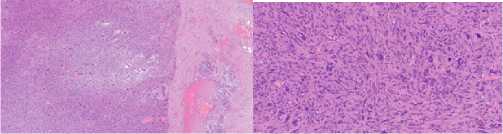
Рис. 1. Гистологическая картина низкодифференцированой (FFCCSG Grade 3) мягкотканной опухоли молочной железы: а – опухоль с относительно четкими границами и участками некроза, х40; б – солидные скопления атипичных клеток с выраженно полиморфными ядрами и многочисленными (в том числе патологическими митозами), многочисленные многоядерные клетки, х200. Окраска гематоксилином и эозином
Fig. 1. Histological picture of a low–grade (FFCCSG Grade 3) soft tissue breast tumor: a – tumor with relatively clear boundaries and areas of necrosis, x40; b - solid clusters of atypical cells with pronounced polymorphic nuclei and numerous (including pathological mitoses), numerous multinucleated cells, x200. Stained with hematoxylin and eosin
Лечение
Предоперационная диагностика и правильное лечение имеют решающее значение при филлодных опухолях из-за их склонности к рецидивам и злокачественного потенциала некоторых из этих опухолей [6].
Основным методом лечения первичных локальных форм неэпителиальных опухолей является хирургическое вмешательство. Однако из-за их неясной клинической картины, неопределенного патологического поведения и сложной предоперационной диагностики, как показывает практика, все еще существуют трудности в выборе плана лечения. В недалеком прошлом простая мастэктомия была рекомендуемым методом лечения пограничной и злокачественной филлоидной опухоли [13]. Секторальная резекция молочной железы была безопасной и адекватной даже при злокачественной филлоидной опухоли, при условии отсутствия опухоли в крае резекции. Кроме того, многочисленные клинические исследования рекомендовали широкое иссечение опухоли с чистым краем в 1 см, что может вызвать серьезные трудности в достижении хороших косметических результатов. Однако недавние исследования показывают, что нет прямой зависимости между частотой локальных рецидивов и шириной отрицательных полей. Чан и др. проанализировав 164 случая филлоидных опухолей, обнаружили, что единственным фактором, который сильно предсказывал местный рецидив, был наличие опухолевых клеток на краю резекции, в то время как ширина края резекции не коррелировала с риском локального рецидива. Онкенди и др. показали, что на безрецидивную выживаемость не влияла степень хирургической резекции у пациентов с пограничными и злокачественными филлоидными опухолями [10]. Для доброкачественных и пограничных филлоидных опухолей характерно менее агрессивное течение заболевания, а частота рецидивов низкая независимо от состояния края резекции. При определении оптимального объема оперативного вмешательства прежде всего необходимо ориентироваться на морфологический вариант опухоли, который достоверно влияет на прогноз заболевания. Другие клинические и иммуногистохимические характеристики дают дополнительную информацию о характере опухолевого процесса. В частности, при неопределенном предоперационном морфологическом заключении на основании оценки скорости роста, размеров опухоли, активности клеточной пролиферации и экспрессии ИГХ маркеров можно относительно точно судить о степени злокачественности выявленной опухоли. Применение адъювантной лучевой терапии при злокачественных филлоидных опухолях является спорным, преимущества её не доказаны [8, 9, 12, 21].
Выводы
Злокачественная филлоидная опухоль молочной железы является относительно редкой и сложной для диагностики патологией с уникальными клиническими, гистологическими и цитогенетическими характеристиками.
Маммография и ультразвуковое исследование сохраняют своё значение в визуализации филлоидных опухолей молочной железы. Однако дифференциальная диагностика затруднена.
Наиболее информативен для гистологического исследования материал удалённой опухоли. Иммуногистохимическое исследование позволяет установить правильный диагноз.
Список литературы Филлоидные опухоли молочных желёз. Особенности инструментальной диагностики и морфологической структуры
- Григорук О. Г., Богатырев В. Н., Лазарев А. Ф., Соколова В. К., Фролова Т. С., Базулина Л. М. Цитологическая диагностика листовидных опухолей и сарком молочной железы. Опухоли женской репродуктивной системы, 2005. № 1. С. 23-28.
- Зугумова М.Ш., Степанянц Н.Г., Завьялов А.А. Павлов К.А. Злокачественная филлоидная опухоль молочной железы. Московский хирургический журнал, 2023. № 2. С. 116-122.
- Confavreux C., Lurkin A., Mitton N., Blondet R., Saba C., Ranchere D. et al. Sarcomas and malignant phyllodes tumours of the breast - a retrospective study. Eur J Cancer, 2006. Vol. 42 (16), рр. 2715-2721. https://doi.org/10.1016/j.ejca.2006.05.040
- Денчик Д. А., Воротников И. К., Быкова А.В., Любченко Л.Н. Листовидные опухоли молочных желез. Злокачественные опухоли, 2012. № 1. С. 40-43.
- Жгулёва А. А., Алтынпара А. И. Современный взгляд на диагностику и лечение филлоидных опухолей молочной железы. Материалы всероссийского научного форума студентов с международным участием «Студенческая наука - 2020». Спецвыпуск, 2020. Том 3. С. 901.
- Закиряходжаев А.Д., Широких И.М., Харченко Н.В., Запиров Г.М., Сарибекян Э.К., Н. В. Аблицова Н.В. и др. Филлоидные опухоли молочных желез. Современное состояние проблемы. Исследования и практика в медицине, 2017. № 4(2). С. 13-22.
- Шаши Пракаш Мишра, Сатьендра Кумар Тивари, Манджари Мишра, Аджай Кумар Кханна, «Филлодная опухоль груди: обзорная статья». Международные научные исследования, 2013, 10 с.
- Rowell M. D., Perry R. R., Hsiu J. G., Barranco S. C. Phyllodes tumors. The American Journal of Surgery, 1993, vol. 165, № 3, pp. 376-379, https://doi.org/10.1016/s0002-9610(05)80849-9
- Bernstein L., Deapen D., Ross R. K. The descriptive epidemiology of malignant cystosarcoma phyllodes tumors of the breast. Cancer, 1993, vol. 71, № 10, pp. 3020-3024. https://doi.org/10.1002/1097-0142(19930515)71:103.0.co;2-g
- Rayzah M. Phyllodes Tumors of the Breast: A Literature Review. Cureus, № 12, рр. e10288. https://doi.org/10.7759/cureus.10288
- Jang J.H., Choi MY., Lee S.K. et al. Clinical and pathological risk factors for local recurrence of phylloid breast tumors. Ann Surg Oncol, 2012, № 19, рр. 2612-2617. https://doi.org/10.1245/s10434-012-2307-5
- Teo J.Y., Cheong C.S., Wong C.Y. Low local recurrence rates in young Asian patients with phyllodes tumours: less is more. ANZ J Surg., 2012, № 82, рр. 325-328. https://doi.org/10.1111/j.1445-2197.2012.06045.x
- Jones A.M., Mitter R., Springall R. et al. A comprehensive genetic profile of phyllodes tumours of the breast detects important mutations, intra‐tumoral genetic heterogeneity and new genetic changes on recurrence. J Pathol., 2008, № 214, рр. 533-544.
- Duman L., Gezer N.S., Balci P. et al. Differentiation between phyllodes tumors and fibroadenomas based on mammographic sonographic and MRI features. Breast Care., 2016, № 11, рр. 123-127. https://doi.org/10.1159/000444377
- Belkacémi Y., Bousquet G., Marsiglia H. et al. Phyllodes tumor of the breast. Int J Radiat Oncol Biol Phys., 2008, № 70, рр. 492-500. https://doi.org/10.1016/j.ijrobp.2007.06.059
- Strode M., Khoury T., Mangieri C., Takabe K. Update on the diagnosis and management of malignant phyllodes tumors of the breast. The Breast., 2017, № 33, рр. 91-96. https://doi.org/10.1016/j.breast.2017.03.001
- Шаши Пракаш Мишра, Сатьендра Кумар Тивари, Манджари Мишра, Аджай Кумар Кханна. Филлодная опухоль груди: обзорная статья. Международные научные исследования, 2013. 10 с.
- Родионова Л.М., Мехеда Л.В., Фомина Л.Я. Сложности цитологической диагностики фиброэпителиальных опухолей: фиброаденома и филлоидная опухоль. Клин. эксп. Морфология, 2020. № 9(1). С. 20-29. https://doi.org/10.31088/CEM2020.9.1.20-2
- Stanford Medicine. Surgical pathology criteria. Phyllodes tumor of the breast. https://doi.org/10.1111/his.12876
- Chen W.H., Cheng S.P., Tzen C.Y. et al. Surgical treatment of phyllodes tumors of the breast: retrospective review of 172 cases. J Surg Oncol., 2005, № 91, рр. 185-194. https://doi.org/10.1002/jso.20334
- Liang M.I., Ramaswami B., Patterson K.S. and others. Giant breast tumors: surgical treatment of phylloid tumors, the potential of reconstructive surgery and a literature review. World J Surg Onc, 2008, № 117. https://doi.org/10.1186/1477-7819-6-117
- Mishra S.P., Tiwary S.K., Mishra M., Khanna A.K. Phyllodes Tumor: Review Article. ISRN Surgery, 2013. https://doi.org/10.1155/2013/361469
- М.Ш. Зугумова, Н.Г. Степанянц, А.А. Завьялов, К.А. Павлов. Злокачественная филлоидная опухоль молочной железы. Московский хирургический журнал, 2023. № 2. С. 116-122.


