Физико-химическая модель натриевосиликатного расплава и термодинамика Q n-единиц
Автор: Королева Ольга Николаевна, Тупицын Алексей Альбертович, Бычинский Валерий Алексеевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 36 (295), 2012 года.
Бесплатный доступ
Сформирована физико-химическая модель натриевосиликатного расплава, основанная на представлениях о структурных единицах Q n, представляющих кремнекислородные тетраэдры с различным соотношением мостиковых и немостиковых атомов кислорода. Результаты моделирования откорректированы на основе данных высокотемпературной спектроскопии КР, что позволило ввести поправки для термодинамики Q n-единиц. Полученные результаты позволяют описать структуру и свойства расплава в области составов от чистого SiO 2 до ортосиликата натрия в диапазоне температур от 700 до 2000 К.
Физико-химическая модель, силикатные расплавы, структура расплава, корректировка термодинамических функций, минимизация термодинамических потенциалов
Короткий адрес: https://sciup.org/147160246
IDR: 147160246 | УДК: 544.3.032.4
Текст научной статьи Физико-химическая модель натриевосиликатного расплава и термодинамика Q n-единиц
Силикатные расплавы относятся к важнейшему классу высокотемпературных оксидных систем и играют важную роль, как в природе, так и в промышленности. Одним из наиболее эффективных методов изучения структуры расплавов in situ является высокотемпературная спектроскопия комбинационного рассеяния света [1]. Однако, эти экспериментальные исследования расплавов достаточно сложны и трудоемки, и, кроме того, могут быть выполнены только на относительно простых по составу модельных системах. В связи с этим актуальным является использование физико-химического моделирования для получения информации о структуре силикатных расплавов в зависимости от состава и температуры. Формирование физико-химической модели расплавов подразумевает создание базы данных силикатов и согласование термодинамических характеристик на основе экспериментальных результатов. Поэтому, основными предназначениями данной модели являются корректное описание результатов спектроскопии КР расплавов и возможность прогнозирования структурных особенностей расплавов в широком диапазоне составов и температур.
Важной особенностью силикатных расплавов, является образование неупорядоченных полимеризованных анионов, из которых формируются структурные единицы силикатных расплавов, стекол и кристаллических силикатов. В данной системе это кремнекислородные тетраэдры, состоящие из центрального атома кремния и четырех атомов кислорода, объединяющиеся в анионные группировки. Экспериментальная информация о содержании структурных единиц стекол и расплавов, получаемая методами колебательной спектроскопии и ЯМР, представляет собой распределение структурных единиц Q ” - кремнекислородных тетраэдров с различным числом мостиковых атомов кислорода n, в зависимости от состава и температуры [1-4].
Для сопоставления результатов спектроскопических исследований с данными физикохимического моделирования предполагаем, что свободные энергии образования кристаллических силикатов (A f G ° ) могут использоваться для оценки термодинамических характеристик структурных единиц Q n . В работе [5] показано, что энергетика процессов взаимодействия в силикатных системах определяется «короткодействующими» силами, следовательно, такое квазикристалли-ческое приближение может быть использовано для термодинамического описания силикатных расплавов. Поэтому в список вероятных компонентов модели включены силикаты, стехиометри-чески соответствующие структурным единицам Q n . Для оценочной калибровки адекватности физико-химической модели использованы результаты высокотемпературной спектроскопии КР [6].
Согласование данных для модели
Вследствие особенностей способов обработки результатов калориметрии и методов оценки неизвестных термодинамических свойств, в справочниках и периодической научной литературе встречаются резко отличающиеся величины термодинамических потенциалов силикатов натрия, калия и лития [7]. Исходные данные, на основе которых могут быть сконструированы формуляры термодинамических свойств силикатов щелочных металлов в конденсированном состоянии, приводится только для K2SiO3 и K2Si2O5 в фундаментальном справочном издании [8]. В справочниках [9–12] и ряде научных публикаций [13–19] приводятся отрывочные, как экспериментальные, так и расчетные сведения для K2SiO3, Li2SiO3, Na2Si2O5, Na2SiO3.
Поскольку согласование термодинамических величин следует выполнять на основе представительного количества изоструктурных веществ, расчеты проводились одновременно для силикатов калия, литии и натрия. Получены зависимости термодинамических свойств от типа структурных единиц, позволившие согласовать существенно различающиеся величины термодинамических потенциалов, а также рассчитать термодинамические свойства и оценить температуры плавления неисследованных ранее силикатов щелочных металлов методами, описанными в работе [7].
В программном комплексе «Селектор» [20] для расчета фазового состава систем, у которых температура плавления ниже температуры плавления чистых компонентов, предусмотрено раздельное описание твердого, жидкого и газообразного состояния индивидуальных веществ. Для этого используется вид представления термодинамических свойств, аналогичный применяемому в справочнике [9–10]. Принципы экстраполяции термодинамических функций вещества в жидком состоянии от температуры плавления к отсчетной температуре (298,15 К) описаны в книге [7].
Методика исследования
Подготовка исходных материалов для экспериментальных исследований выполнена согласно общепринятой методике синтеза силикатных стекол из аморфного SiO 2 и карбоната натрия [6]. Поскольку в рассматриваемой системе протекают реакции, приводящие к удалению углекислого газа и образованию силиката соответствующего стехиометрического состава, в физикохимические модели карбонаты и углекислый газ не включались:
Na2CO3 + SiO2 → Na2SiO3 + CO2↑ ;(1)
Na2CO3 + 2SiO2 → Na2Si2O5 + CO2↑;(2)
2Na2CO3 + SiO2 → Na4SiO4 + 2CO2↑;(3)
3Na2CO3 + 2SiO2 → Na6Si2O7 + 3CO2↑ .(4)
Результат обработки спектров комбинационного рассеяния представляет собой распределение структурных единиц Q n в зависимости от температуры и состава. Исходя из предположения о квазикристалличности, термодинамические функции кремнекислородных тетраэдров Q0–Q3 приняты равными термодинамическим функциям Na 2 SiO 3 , 0,5Na 2 Si 2 O 5 , Na 4 SiO 4 и 0,5Na 6 Si 2 O 7 , тогда как структурная единица Q4 характеризуется термодинамическими функциями чистого SiO 2 .
Формирование модели
К настоящему времени в физико-химическом моделировании утвердилось вполне обобщенное представление о натриевосиликатном расплаве. У разных исследователей этот образ приоб-
О 20 40 60
Na2O, мол.%
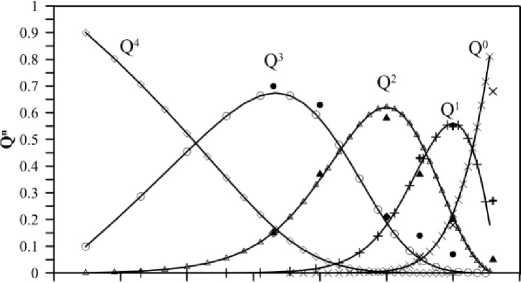
Рис. 1. Рассчитанная из стехиометрических уравнений зависимость Q n -распределения в системе Na 2 O·SiO 2 от состава температуре 1300 К
ретает индивидуальные черты, тем не менее, они легко укладываются в контуры одной общей схемы. На рис. 1 приведены расчетные данные концентрации (в мольных долях) структурных единиц Q0, Q1, Q2, Q3 и Q4 в зависимости от состава при температуре 1300 К [21]. Для расчетов авторы использовали метод стехиометрических уравнений [6]. Полученные результаты приведены в сравнении с результатами высокотемпературной спектроскопии КР.
Физико-химические свойства силикатных расплавов и стекол зависят от структуры, которая определяется составом системы. Известно, что при посте- пенном увеличении соотношения Na2O/SiO2 силикатная сетка претерпевает закономерные структурные изменения. При содержании Na2O до ≈ 23 мол. % силикатная составляющая в основном представлена структурными единицами Q4. При дальнейшем добавлении катиона-модификатора их содержание уменьшается, а содержание Q3 растет и достигает максимума при 33 мол. % Na2O, что соответствует составу дисиликата натрия. Реакцию диспропорционирования, характеризующую равновесие в натрийсиликатных расплавах в диапазоне составов от 0 до ≈ 43 мол. % Na2O, можно записать в виде:
2Q3 → Q4 + Q2. (5)
Начиная с ≈ 43 мол. % Na 2 O преобладающими структурными единицами в расплаве становятся Q2, содержание которых достигает максимума при 50 мол. % Na 2 O. Эта точка по составу соответствует метасиликату натрия. Реакцию диспропорционирования, характеризующую равновесие в натрийсиликатных расплавах в этом диапазоне составов, можно записать в виде:
2Q2 → Q1 + Q3. (6)
В условиях, когда содержание натрия составляет от ≈ 55 до ≈ 63 мол. % Na 2 O, в расплаве преобладают Q1, максимальное содержание которых достигается в при концентрации 60 мол. % Na 2 О, соответствующей пиросиликату натрия. Тогда реакцию диспропорционирования этом диапазоне составов, можно записать в виде:
2Q1 → Q0 + Q2. (7)
В области составов более 63 мол. % Na 2 O преобладают структурные единицы Q0, причем состав 67 мол. % Na 2 O соответствует ортосиликату натрия. Преобладающая реакция между структурными единицами в этом диапазоне составов можно представить в виде:
2Q0 → 2Q1 + O2–, (8) где O2– – свободные ионы кислорода, не входящие в тетраэдры SiO 4 .
На основе этих представлений была построена физико-химическая модель. База данных для силикатов щелочных металлов была создана на основе вышеописанных методов [7] и встроена в «Селектор-С» . База включает в себя термодинамические характеристики силикатов лития, натрия и калия в диапазоне температур от 298,15 до 6000 К . Для формирования моделей рассматривалось влияние исходного химического состава (соотношения SiO2/Na2O) и температуры на компонентный состав силикатного расплава. Состав расплава менялся от чистого кремнезема до ортосиликата натрия (67 мол. % Na 2 O), температурный диапазон задавался от 700 до 2000 К. В системе Na–Si–O задавался список потенциально возможных веществ в равновесии состоял из 25 зависимых компонентов, в том числе 7 газов и 15 минеральных фаз, включая NaSiO 2,5 , Na 3 SiO 3,5 , стехиометрически соответствующие единицам Q3 и Q1. Это позволило упростить согласование результатов физико-химического моделирования и результатов КР анализов, несмотря на то, что непосредственно в расчетах эти компоненты не рассматривались.
Обсуждение результатов
Рассмотрен сценарий возможного развития процессов образования расплава в рамках допущений, установленных экспериментальными данными. На первом этапе сопоставляются результаты физико-химического моделирования, полученные на основе согласованных термодинамических свойств вероятных компонентов. Сопоставление результатов моделирования распределения структурных единиц в зависимости от химического состава с экспериментальным данными (рис. 2), показывает качественное соответствие. Однако, величины количественных отклонений существенны. Эти отклонения обусловлены тем, что в модели не учитывается взаимодействие компонентов расплава. Очевидно, что хорошее воспроизведение в модели результатов экспериментальных исследований возможно только в случае корректного описания этого взаимодействия.
Обычно, при термодинамических расчетах взаимодействие компонентов расплава, влияющее на равновесие рассматриваемой системы, учитывается с помощью коэффициентов активности. Несмотря на то, что расчет коэффициентов активности для компонентов сложного силикатного расплава затруднен, в физико-химических моделях, рассчитываемых с помощью ПК «Селектор», взаимное влияние компонентов расплава можно оценить. Для этого в модель вводятся известные из экспериментальных данных ограничения на содержание индивидуальных компонентов, и на основе результатов расчетов вынужденных равновесий производится корректировка термодина- мических функций [20]. Полученные термодинамические функции компонентов расплава могут быть использованы в качестве их исходных термодинамических свойств. В результате введения поправок происходит корректировка исходной базы термодинамических данных силикатов. В этом случае результаты расчета в модели без ограничений, но с новыми термодинамическими данными, с высокой точностью описывают результаты экспериментальных исследований.
Полученное распределение структурных единиц после введения поправок на термодинамические свойства существенно отличается от первоначального результата (рис. 3). Сопоставление модельных составов со спектроскопическими данными для расплавов позволяет оценить адекватность модели как удовлетворительную, так как соблюдаются основные закономерностей изменения структуры расплава в зависимости от соотношения Na 2 O/SiO 2 .
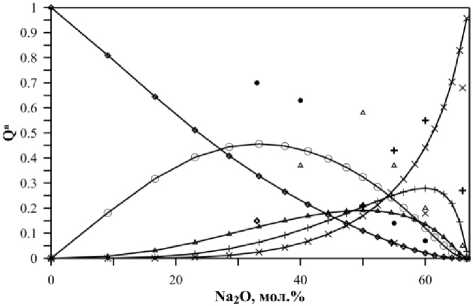
Рис. 2. Результат моделирования распределения структурных единиц в натриевосиликатном расплаве при 1336 К до введения поправок (точки – экспериментальные данные спектроскопии КР из [21])
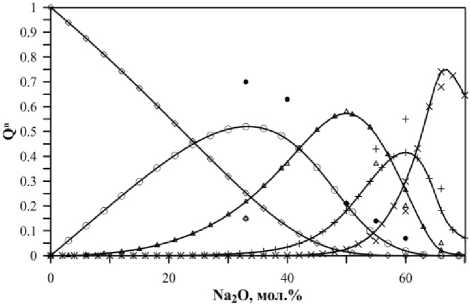
Рис. 3. Результат моделирования распределения структурных единиц в натриевосиликатном расплаве при 1336 К после введения поправок (точки – экспериментальные данные спектроскопии КР из [21])
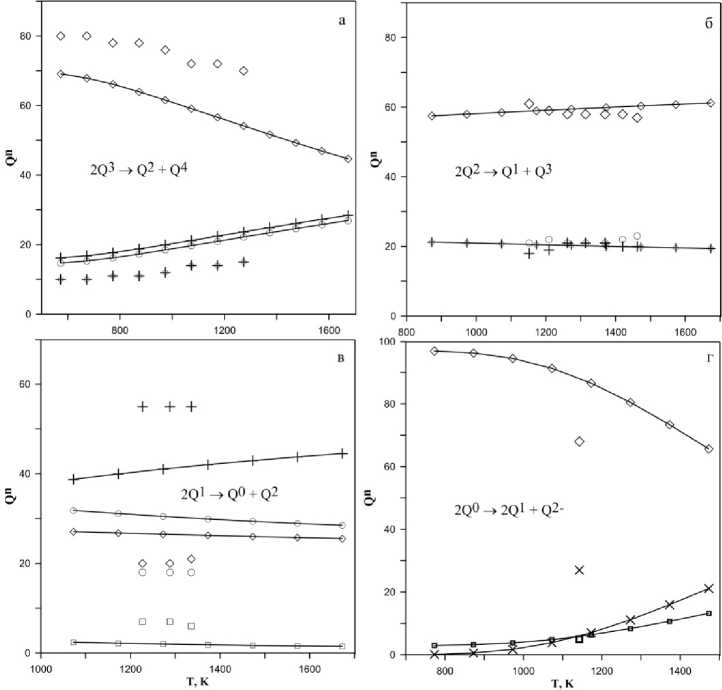
Рис. 4. Распределение структурных единиц Q n в зависимости от температуры для системы x Na 2 O·(1– x )SiO 2 , при х = 33 (a), 50 (б), 60 (в), 67 (г) мол. % (точки – экспериментальные данные спектроскопии КР [21])
На рис. 4 сопоставлено распределение структурных единиц в зависимости от температуры для системы x % Na 2 O · (1– x )% SiO 2 , при х = 33, 50, 60, 67, соответственно, с результатами спектроскопии КР для расплавов [21]. При увеличении температуры и переходе стекло-расплав наблюдается разупорядочение структуры для состава 33 мол. % (рис. 4, а), что соответствует сдвигу равновесия (5) вправо в сторону образования структурных единиц Q2 и Q4. Для состава 50 мол. % (рис. 4, б) результаты моделирования находятся в пределах погрешности экспериментального метода. Для состава 60 мол. % (рис. 4, в) экспериментальные данные представлены в узком интервале температур, тем не менее, можно говорить о качественном соответствии модели. Для состава 67 мол. % Na 2 O (рис. 4, г) экспериментальные данные ограничиваются одной точкой при температуре 1143 К, однако, в целом, результаты физико-химического моделирования и эксперимента качественно совпадают.
Выводы
Собраны базы данных силикатов натрия и структурных единиц Q n натриевосиликатного расплава. Сформирована физико-химическая модель натриевосиликатного расплава, работающая в области составов от 0 до 67 мол. % Na 2 O. Показано, что результаты моделирования процесса распределения структурных единиц расплава от его химического состава находятся в хорошем соответствии с результатами высокотемпературной спектроскопии КР. Для низкощелочных составов физико-химическая модель описывает влияние температуры на структуру расплава в пределах погрешности измерений. Для высокощелочных расплавов достигнуто качественное соответствие расчетных и экспериментально данных.
Работа выполнена при поддержке грантами РФФИ 12-05-00294-а и 12-05-90824-мол_рф_нр, гранта Президента Российской Федерации для поддержки молодых российских ученых (МК-109.2011.5) и гранта ФЦП «Научные и научно-педагогические кадры инновационной России».
Список литературы Физико-химическая модель натриевосиликатного расплава и термодинамика Q n-единиц
- Анфилогов В.Н. Силикатные расплавы/В.Н. Анфилогов, В.Н. Быков, А.А. Осипов. -М.: Наука, 2005. -361 с.
- The structural groups of alkali silicate glasses determined from 29Si MAS-NMR/H. Maekawa, T. Maekawa, K. Kamamura, T. Yokokawa//J. Non-Cryst. Solids. -1991. -Vol. 127. -P. 53-64.
- Malfait W.J. Quantitative Raman spectroscopy: High-temperature speciation of potassium silicate melts/W.J. Malfait, V.P. Zakaznova-Herzog, W.E. Halter//J. Non-Cryst. Solids. -2007. -Vol. 353. -P. 4029-4042.
- Mysen B.O. Silicate melts at magmatic temperatures: in-situ structure determination to 1651 °C and effect of temperature and bulk composition on the mixing behavior of structural units/B.O. Mysen, J.D. Frantz//Contrib Mineral Petrol. -1994. -Vol. 117. -P. 1-14.
- Hess P.C. Structure of silicate melts/P.C. Hess//Can. Mineral. -1977. -Vol. 15. -P. 162-178.
- Быков В.Н. Структура силикатных расплавов по данным спектроскопии комбинационного рассеяния и термодинамического моделирования/В.Н. Быков, О.Н. Королева, А.А. Осипов//Геохимия. -2009. -№ 11. -C. 1138-1145.
- Тупицын А. А. Подготовка термодинамических свойств индивидуальных веществ к физикохимическому моделированию высокотемпературных технологических процессов/А.А. Тупицын, А.В. Мухетдинова, В.А. Бычинский. -Иркутск: Изд-во Иркут. гос. ун-та, 2009. -303 с.
- Термодинамические свойства индивидуальных веществ: справ. изд.: в 4 т./Л.В. Гурвич [и др.]. -3-е изд., перераб. и расш. -М.: Наука, 1982. -Т. 4, кн. 1. -623 с.
- JANAF Thermochemical Tables. Part I, Al-Co/M.W. Chase [et al.]. -3th ed.//J. of Phys. and Chem. Ref. Data. -Washington, 1985. -Vol. 14. -Sup. 1. -926 p.
- JANAF Thermochemical Tables. Part II, Cr-Zr/M.W. Chase [et al.]. -3th ed.//J. of Phys. and Chem. Ref. Data. -Washington, 1985. -Vol. 14. -Sup. 1. -929 p.
- Термические константы веществ: справ./под ред. В.П. Глушко. -М.: ВИНИТИ, 1981. -Вып. 10, ч. 1. -299 с.
- Термические константы веществ: справ./под ред. В.П. Глушко. -М.: ВИНИТИ, 1981. -Вып. 10, ч. 2. -441 с.
- Téqui C. Thermodynamic Properties of Alkali Silicates: Heat Capacity of Li2SiO3 and Lithium-Bearing Melts/C. Téqui, P. Grinspan, P. Richet//J. Amer. Ceram. Soc. -1992. -Vol. 75, N 9. -P. 2601-2604.
- Kleykamp H. Enthalpy, heat capacity, second-order transitions and enthalpy of fusion of Li4SiO4 by high-temperature calorimetry/H. Kleykamp//Thermochim. acta. -1996. -Vol. 287, N 2. -P.191-201.
- Fasshauer D.W. Heat capacity of wadeite-type K2Si4O9 and the pressure-induced stable decomposition of K-feldspar/D.W. Fasshauer, B. Wunder, N.D. Chatterjee//Contrib. Min. Petrol. -1998. -Vol. 131. -P. 210-218.
- Бабушкин В.И. Термодинамика силикатов/В.И. Бабушкин, Г.М. Матвеев, О.П. Мчедлов-Петросян; под общ. ред. О.П. Мчедлова-Петросяна. -3-е изд., перераб. и доп. -М.: Изд-во лит. по строительству, 1972. -351 с.
- Heat capacities and derived thermodynamic properties of lithium, sodium, and potassium disilicates from T = (5 to 350) K in both vitreous and crystalline states/A. Labban, R. Berg, J. Zhou et al.//J. Chem. Thermodynamics. -2007. -№ 39 (7). -Р. 991-1000.
- Naylor B.F. High-temperature heat contents of sodium metasilicate and sodium disilicate/B.F. Naylor//J. Amer. Chem. Soc. -1945. -Vol. 67. -P. 466-467.
- Richet P. Heat capacity of sodium silicate liquids/P. Richet, Y. Bottinga, C. Téqui//Comm. Amer. Ceram. Soc. -1984. -P. C-6-C-8.
- Минимизация энергии Гиббса в геохимических системах методом выпуклого программирования/И.К. Карпов, К.В. Чудненко, Д.А. Кулик и др.//Геохимия. -2001. -№ 11. -С. 1207-1219.
- Королева О.Н. Термодинамическое моделирование и спектроскопия комбинационного рассеяния силикатных расплавов: дис. канд. хим. наук/О.Н. Королева. -Екатеринбург, 2009. -154 с.


